Zusammensetzung
Wirkstoffe
Lebrikizumab.
Lebrikizumab wird mittels rekombinanter DNA-Technologie in Ovarialzellen des chinesischen Hamsters (CHO-Zellen) hergestellt.
Hilfsstoffe
Histidin, Essigsäure 99%, Saccharose, Polysorbat 20, Wasser für Injektionszwecke.
Indikationen/Anwendungsmöglichkeiten
Ebglyss ist angezeigt für die Behandlung von mittelschwerer bis schwerer atopischer Dermatitis bei Erwachsenen und Jugendlichen ab 12 Jahren mit einem Körpergewicht von mindestens 40 kg, wenn eine Therapie mit topischen Arzneimitteln keine angemessene Krankheitskontrolle ermöglicht oder medizinisch nicht empfohlen wird.
Dosierung/Anwendung
Die Behandlung sollte von einem Arzt eingeleitet werden, der in der Diagnose und Behandlung der atopischen Dermatitis erfahren ist.
Übliche Dosierung
Die empfohlene Lebrikizumab-Dosis ist 500 mg (zwei 250-mg-Injektionen) jeweils in Woche 0 und Woche 2, gefolgt von 250 mg, die alle zwei Wochen bis Woche 16 subkutan verabreicht werden.
Bei Patienten, die nach 16 Wochen Behandlung kein klinisches Ansprechen gezeigt haben, sollte ein Abbruch der Behandlung in Betracht gezogen werden.
Sobald ein klinisches Ansprechen erreicht ist, beträgt die empfohlene Erhaltungsdosis von Lebrikizumab 250 mg alle vier Wochen.
Lebrikizumab kann mit oder ohne topische Kortikosteroide (TCS) angewendet werden. Topische Calcineurin-Inhibitoren (TCI) können angewendet werden, sollten aber nur auf Problemzonen wie Gesicht, Hals, intertriginöse Bereiche und Genitalbereich beschränkt bleiben.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Verspätete Dosisgabe
Wenn eine Dosis vergessen wurde, sollte die Dosis so bald wie möglich nachgeholt werden. Danach sollte die Dosisgabe zum nächsten geplanten Zeitpunkt wieder aufgenommen werden.
Spezielle Dosierungsanweisungen
Patienten mit Leber- oder Nierenfunktionsstörungen
Bei Patienten mit eingeschränkter Leber- oder Nierenfunktion ist keine Dosisanpassung erforderlich (siehe «Pharmakokinetik»).
Körpergewicht
Eine Dosisanpassung für das Körpergewicht ist nicht erforderlich (siehe «Pharmakokinetik»).
Ältere Patienten (≥65 Jahre)
Bei älteren Patienten ist keine Dosisanpassung erforderlich (siehe «Pharmakokinetik»).
Kinder unter 12 Jahren
Die Sicherheit und Wirksamkeit von Lebrikizumab bei Kindern unter 12 Jahren oder Jugendlichen im Alter von 12 bis 17 Jahren und mit einem Körpergewicht von weniger als 40 kg ist bisher noch nicht untersucht. Es sind keine Daten verfügbar.
Art der Anwendung
Subkutane Anwendung.
Lebrikizumab wird als subkutane Injektion in den Oberschenkel oder Bauch verabreicht ausserhalb eines 5 cm grossen Bereiches um den Bauchnabel. Wenn eine andere Person die Injektion verabreicht, kann die Injektion auch in den Oberarm erfolgen.
Für die anfängliche 500-mg-Dosis werden zwei 250-mg-Injektionen nacheinander an verschiedenen Injektionsstellen verabreicht.
Es wird empfohlen, die Injektionsstelle bei jeder Injektion zu wechseln. Lebrikizumab sollte nicht in Hautbereiche injiziert werden, die empfindlich oder geschädigt sind bzw. blaue Flecken oder Narben aufweisen.
Ein Patient kann sich Lebrikizumab selbst injizieren oder die Pflegeperson des Patienten kann Lebrikizumab verabreichen, wenn der behandelnde Arzt dies für angemessen hält. Patienten und/oder Pflegepersonen sind vor der Verabreichung von Lebrikizumab entsprechend zu unterweisen. Ausführliche Anweisungen zur Verabreichung sind am Ende der Patienteninformation angegeben.
Kontraindikationen
Überempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe (siehe «Zusammensetzung»).
Warnhinweise und Vorsichtsmassnahmen
Überempfindlichkeit
Wenn eine systemische Überempfindlichkeitsreaktion (unmittelbar oder verzögert) auftritt, muss Lebrikizumab abgesetzt und eine geeignete Therapie eingeleitet werden.
Konjunktivitis
Bei Patienten, die mit Lebrikizumab behandelt werden und eine Konjunktivitis entwickeln, die nach der Standardbehandlung nicht abklingt, ist eine ophthalmologische Abklärung erforderlich (siehe «Unerwünschte Wirkungen»).
Die Patienten müssen ihrem Arzt alle neu auftretenden oder sich verschlimmernden Augensymptome mitteilen.
Impfungen
Vor Beginn der Therapie mit Lebrikizumab sollte die Durchführung aller altersgemässen Impfungen gemäss den aktuellen Impfrichtlinien erwogen werden. Lebendimpfstoffe und attenuierte Lebendimpfstoffe sollten nicht gleichzeitig mit Lebrikizumab verabreicht werden, da die klinische Sicherheit und Wirksamkeit nicht nachgewiesen sind. Die Immunantwort auf Totimpfstoffe wurde bei einem Diphtherie-Tetanus-Pertussis(azellulär)-Kombinationsimpfstoff (TdaP) und einem Meningokokken-Polysaccharid-Impfstoff untersucht (siehe «Interaktionen»).
Helminthose
Patienten mit einer bekannten Helminthose wurden von den klinischen Studien ausgeschlossen. Patienten mit einer vorbestehenden Helminthose sind zu behandeln, bevor die Behandlung mit Lebrikizumab eingeleitet wird. Wenn der Patient sich während der Behandlung mit Lebrikizumab infiziert und nicht auf eine Behandlung gegen Helminthose anspricht, muss die Behandlung mit Lebrikizumab ausgesetzt werden, bis die Infektion abgeklungen ist.
Interaktionen
Lebendimpfstoffe
Die Sicherheit und Wirksamkeit der gleichzeitigen Anwendung von Lebrikizumab mit Lebendimpfstoffen und attenuierten Lebendimpfstoffen wurde nicht untersucht. Lebendimpfstoffe und attenuierte Lebendimpfstoffe sollten nicht gleichzeitig mit Lebrikizumab verabreicht werden (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Totimpfstoffe
Die Immunantworten auf Totimpfstoffe wurden in einer Studie untersucht, in der erwachsene Patienten mit atopischer Dermatitis mit 500 mg Lebrikizumab in Woche 0 und 2 gefolgt von 250 mg Lebrikizumab alle zwei Wochen bis Woche 16 behandelt wurden. Nach 12-wöchiger Verabreichung von Lebrikizumab wurden die Patienten mit einem Diphtherie-Tetanus-Pertussis(azellulär)-Kombinationsimpfstoff (TdaP) (T-Zell-abhängig) und einem Meningokokken-Polysaccharid-Impfstoff (T-Zell-unabhängig), geimpft. Die Immunantworten auf das Tetanustoxoid und den Polysaccharid-Impfstoff gegen Meningokokken der Serogruppe C wurden 4 Wochen später untersucht. Die Antikörperantworten auf beide Totimpfstoffe waren nicht durch die gleichzeitige Behandlung mit Lebrikizumab negativ beeinflusst. In der Studie wurden keine unerwünschten Wechselwirkungen zwischen den Totimpfstoffen und Lebrikizumab festgestellt.
Begleittherapien
Es wurden keine Studien zur Erfassung von pharmakokinetischen Arzneimittelwechselwirkungen durchgeführt.
Das Risiko, dass Lebrikizumab in Patienten mit atopischer Dermatitis, Zytokin-vermittelte Interaktionen an CYP Enzymen verursacht, wird als gering eingeschätzt.
Schwangerschaft, Stillzeit
Schwangerschaft
Bisher liegen nur begrenzte Erfahrungen mit der Anwendung von Ebglyss bei Schwangeren vor. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität (siehe «Präklinische Daten»). Lebrikizumab darf während der Schwangerschaft nicht angewendet werden, es sei denn der potentielle Nutzen übersteigt das potentielle Risiko für den Fötus.
Stillzeit
Es ist nicht bekannt, ob Lebrikizumab in die Muttermilch ausgeschieden oder nach Aufnahme systemisch absorbiert wird. Es ist bekannt, dass mütterliches IgG in der Muttermilch vorhanden ist. Ein Risiko für das Neugeborene/gestillte Kind kann nicht ausgeschlossen werden. Es muss eine Entscheidung getroffen werden, ob das Stillen oder die Behandlung mit Ebglyss unterbrochen werden soll. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Mutter abzuwägen.
Fertilität
Die Wirkung von Ebglyss auf die Fertilität beim Menschen wurde nicht untersucht. Tierexperimentelle Studien haben keine Beeinträchtigung der Fertilität gezeigt (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Die häufigsten unerwünschten Wirkungen sind Konjunktivitis (6,9%), Reaktionen an der Injektionsstelle (2,6%), allergische Konjunktivitis (1,8%) und trockene Augen (1,4%).
Tabellarische Auflistung der unerwünschten Wirkungen
In allen klinischen Studien zu atopischer Dermatitis wurde insgesamt 1720 Patienten Lebrikizumab verabreicht, von denen 891 Patienten mindestens ein Jahr lang Lebrikizumab erhielten. Soweit nicht anders angegeben, basieren die Häufigkeiten auf den gepoolten Daten von 4 randomisierten, doppelblinden Studien an Patienten mit mittelschwerer bis schwerer atopischer Dermatitis in denen 783 Patienten während des placebokontrollierten Zeitraums (die ersten 16 Behandlungswochen) subkutan mit Lebrikizumab behandelt wurden.
In Tabelle 1 sind die in klinischen Studien beobachteten unerwünschten Wirkungen nach Systemorganklasse und Häufigkeit aufgeführt, unter Verwendung folgender Kategorien: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1 000, <1/100); selten (≥1/10 000, <1/1 000); sehr selten (<1/10 000).
Tabelle 1. Auflistung der unerwünschten Wirkungen
|
MedDRA Systemorganklasse |
Häufigkeit |
Unerwünschte Wirkung |
|
Infektionen und parasitäre Erkrankungen |
Häufig |
Konjunktivitis |
|
|
Gelegentlich |
Herpes zoster |
|
Erkrankungen des Blutes und des Lymphsystems |
Gelegentlich |
Eosinophilie |
|
Augenerkrankungen |
Häufig |
Allergische Konjunktivitis |
|
|
Gelegentlich |
Keratitis |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Häufig |
Reaktion an der Injektionsstelle |
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Konjunktivitis und verwandte Ereignisse
Während der ersten 16 Behandlungswochen wurden Konjunktivitis, allergische Konjunktivitis, Blepharitis und Keratitis häufiger bei Patienten berichtet, die mit Lebrikizumab behandelt wurden (6,9%, 1,8%, 0,8% bzw. 0,6%), als unter Placebo (1,8%, 0,7%, 0,2% bzw. 0,3%). Die meisten Fälle von Konjunktivitis, allergischer Konjunktivitis, Blepharitis und Keratitis waren leicht oder moderat ausgeprägt, besserten sich oder klangen ohne Unterbrechung oder Absetzen der Behandlung ab.
Eosinophilie
Bei Patienten, die mit Lebrikizumab behandelt wurden, war der durchschnitlliche Anstieg der Eosinophilenzahl gegenüber Baseline grösser als bei Patienten, die mit Placebo behandelt wurden. Im Allgemeinen war der Anstieg gegenüber Baseline bei den mit Lebrikizumab behandelten Patienten nur vorübergehend.
Eosinophilie (>5000 Zellen/µl) wurde bei 0,4% der mit Lebrikizumab und bei keinem der mit Placebo behandelten Patienten beobachtet. Die Eosinophilie führte nicht zum Behandlungsabbruch und es wurden keine mit Eosinophilen zusammenhängenden Erkrankungen gemeldet.
Infektionen
Über alle klinischen Studien bei atopischer Dermatitis hinweg wurden schwerwiegende Infektionen während der ersten 16 Wochen bei 0,4% der mit Lebrikizumab behandelten Patienten und bei 0,5% der Patienten in der Placebo-Gruppe berichtet.
Reaktion an der Injektionsstelle
Reaktionen an der Injektionsstelle (einschliesslich Schmerzen, Erythem und Ausschlag) wurden häufiger bei Patienten berichtet, die Lebrikizumab (2,6%) erhielten, als unter Placebo (1,5%). Die Mehrzahl (95%) der Reaktionen an der Injektionsstelle war leicht oder moderat, und nur wenige Patienten (<0,5%) brachen die Lebrikizumab-Behandlung ab.
Herpes zoster
Herpes zoster wurde bei 0,6% der mit Lebrikizumab behandelten Patienten und bei keinem der Patienten in der Placebo-Gruppe berichtet. Alle berichteten Herpes-zoster-Ereignisse waren leicht oder moderat und keines führte zu einem dauerhaften Abbruch der Behandlung.
Immunogenität
Wie bei allen therapeutischen Proteinen besteht bei Lebrikizumab die Möglichkeit einer Immunogenität. Die Inzidenz von Anti-Drug-Antikörpern (ADAs) hängt in hohem Mass von der Empfindlichkeit und Spezifität des Tests ab. Darüber hinaus kann die beobachtete Inzidenz der Antikörperpositivität (einschliesslich neutralisierender Antikörper) in einem Test von mehreren Faktoren beeinflusst werden, beispielsweise von der Testmethodik, der Probenhandhabung, dem Zeitpunkt der Probengewinnung, den Begleitmedikamenten und der Grundkrankheit. Aus diesem Grund kann der Vergleich der Inzidenz von Antikörpern gegen Lebrikizumab mit der Inzidenz von Antikörpern gegen andere Arzneimittel irreführend sein.
Nach 12 Behandlungsmonaten entwickelten bis zu 2,8% der mit 250 mg Lebrikizumab behandelten Patienten gegen den Wirkstoff gerichtete Antikörper (ADAs). Diese waren meist neutralisierend, die Titer niedrig.
Langzeitsicherheit
Die Langzeitsicherheit von Lebrikizumab wurde in 5 klinischen Studien bewertet: In den beiden Monotherapie-Studien (ADvocate-1, ADvocate-2) für bis zu 52 Wochen, und in der TCS-Kombinationstherapie-Studie (ADhere) mit einer Langzeit-Verlängerungsstudie (ADjoin) über insgesamt 56 Wochen sowie in der Monotherapie-Studie ADore bei Jugendlichen ebenfalls über bis zu 52 Wochen. Das Sicherheitsprofil von Lebrikizumab als Monotherapie bis einschliesslich Woche 52 oder in Kombination mit TCS bis einschliesslich Woche 56 stimmt mit dem Sicherheitsprofil überein, das bis (einschliesslich) Woche 16 beobachtet wurde.
Pädiatrische Population
Jugendliche im Alter von 12 bis 17 Jahren
Die Sicherheit von Lebrikizumab wurde bei 372 Patienten im Alter von 12 bis 17 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis untersucht, darunter 270 Patienten, die mindestens ein Jahr lang Lebrikizumab erhielten. Das Sicherheitsprofil von Lebrikizumab bei diesen Patienten war vergleichbar dem Sicherheitsprofil bei Erwachsenen mit atopischer Dermatitis.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
In klinischen Studien wurden intravenöse Einzeldosen von bis zu 10 mg/kg und subkutane Mehrfachdosen von bis zu 500 mg ohne dosislimitierende Toxizität an Menschen verabreicht. Es gibt keine spezifische Behandlung für eine Lebrikizumab-Überdosierung. Im Falle einer Überdosierung ist der Patient auf Anzeichen oder Symptome von Nebenwirkungen zu überwachen und sofort eine geeignete symptomatische Behandlung einzuleiten.
Eigenschaften/Wirkungen
ATC-Code
D11AH10
Wirkungsmechanismus
Lebrikizumab ist ein monoklonaler Immunglobulin(IgG4)-Antikörper, der mit hoher Affinität an Interleukin(IL)-13 bindet und selektiv die IL-13-Signalübertragung über den IL-4-Rezeptor-alpha(IL-4Rα)/IL-13-Rezeptor-alpha-1(IL-13Rα1)-Heterodimer hemmt, wodurch die nachgelagerten Wirkungen von IL-13 inhibiert werden. Es wird erwartet, dass die Inhibition der IL-13-Signaltransduktion bei Krankheiten von Nutzen sein wird, bei denen IL-13 wesentlich zur Pathogenese der Krankheit beiträgt. Lebrikizumab verhindert nicht die Bindung von IL-13 an den IL-13-Rezeptor alpha 2 (IL-13Rα2 oder Decoy-Rezeptor), was die Internalisierung von IL-13 in die Zelle ermöglicht.
Pharmakodynamik
In klinischen Studien zu Lebrikizumab reduzierte Lebrikizumab die Konzentrationen von Periostin im Serum, Gesamt-Immunglobulin E (IgE), CC-Chemokin-Ligand(CCL)17 [thymus and activation-regulated chemokine (TARC)], CCL18 [[pulmonary and activation-regulated chemokine (PARC)] und CCL13 [monocyte chemotactic protein-4 (MCP-4)]. Die Abnahme der Typ-2-Entzündungsmediatoren liefert indirekte Hinweise auf eine Hemmung des IL-13-Signalwegs durch Lebrikizumab.
Klinische Wirksamkeit
Erwachsene und Jugendliche mit atopischer Dermatitis
Die Wirksamkeit und Sicherheit von Lebrikizumab als Monotherapie (ADvocate-1, ADvocate-2) und mit begleitenden TCS (ADhere) wurden in drei randomisierten, doppelblinden, placebokontrollierten pivotalen Studien bei 1062 Erwachsenen und Jugendlichen (im Alter von 12 bis 17 Jahren und mit einem Gewicht von ≥40 kg) mit mittelschwerer bis schwerer atopischer Dermatitis, definiert als Eczema Area and Severity Index (EASI) ≥16, Investigator's Global Assessment (IGA) ≥3 und betroffener Körperoberfläche (BSA) ≥10 %, untersucht. Patienten, die in die drei Studien aufgenommen wurden, hatten zuvor ein unzureichendes Ansprechen auf topische Medikamente oder topische Behandlungen kamen aus medizinischen Gründen nicht in Frage (letzteres Kriterium galt nicht für die Studie ADhere).
In allen drei Studien erhielten die Patienten eine Anfangsdosis von 500 mg Lebrikizumab (zwei 250mg-Injektionen) in Woche 0 und 2, gefolgt von 250 mg alle zwei Wochen (Q2W) bis Woche 16 oder entsprechend Placebo im Verhältnis 2:1. In ADhere erhielten die Studienpatienten auch begleitend TCS mit niedriger bis mittlerer Wirkstärke oder TCI auf aktive Läsionen. Die Patienten durften nach Ermessen des Prüfarztes eine Rescue-Therapie zur Behandlung unzumutbarer Symptome der atopischen Dermatitis erhalten. Bei Patienten, die eine systemische Rescue-Therapie benötigten, wurde die Behandlung abgesetzt.
Patienten, die IGA 0 oder 1 oder eine mindestens 75%ige Reduktion des EASI (EASI 75) ohne Erhalt einer Rescue-Therapie erreichten, wurden erneut randomisiert, um verblindet bis zu 52 Wochen (i) Lebrikizumab 250 mg alle zwei Wochen (Q2W), (ii) Lebrikizumab 250 mg alle 4 Wochen (Q4W) oder (iii) entsprechend Placebo zu erhalten.
In ADvocate-1 und ADvocate-2 wurde den Patienten nach Abschluss der 52-wöchigen Studie bzw. nach Abschluss der 16-wöchigen Studie in ADhere die Möglichkeit angeboten, die Behandlung in einer separaten Langzeit-Verlängerungsstudie (ADjoin) fortzusetzen.
Endpunkte
In allen drei Studien waren die co-primären Endpunkte der Anteil der Patienten mit IGA 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Reduktion um ≥2 Punkte gegenüber Baseline und der Anteil der Patienten, der eine Reduktion des EASI-Werts um mindestens 75% (EASI 75) von Baseline bis Woche 16 erreichten. Zu den wichtigsten sekundären Endpunkten gehörte der Prozentsatz der Patienten, der eine Reduktion des EASI-Werts um mindestens 90% (EASI 90), der Prozentsatz der Patienten mit einer Verbesserung um mindestens 4 Punkte gegenüber Baseline auf der numerischen Pruritus-Bewertungsskala (Pruritus-NRS), der Prozentsatz der Patienten mit einer Verbesserung um mindestens 4 Punkte gegenüber Baseline im Dermatology Life Quality Index (DLQI) erreichte und Beeinträchtigung des Schlafes durch Juckreiz (Schlafverlust-Skala). Ein zusätzlicher sekundärer Endpunkt war die Veränderung des POEM-Wertes (Patient Oriented Eczema Measure) gegenüber Baseline.
Patienten
Baseline-Merkmale
Die demografischen Merkmale und Ausgangsdaten der Patienten aus den Studien ADvocate-1, ADvocate-2 und ADhere sind in Tabelle 2 dargestellt.
Tabelle 2. Demografische Daten und Baseline-Merkmale nach Studie
|
|
ADvocate-1 N = 424 |
ADvocate-2 N = 427 |
ADhere N = 211 |
|
Alter (Mittelwert, Jahre) |
35,5 |
36,2 |
37,2 |
|
Jugendliche (12 bis 17 Jahre) (%) |
13,0 |
11,0 |
21,8 |
|
Ältere Patienten (≥65 Jahre) (%) |
7,3 |
7,7 |
9,5 |
|
Gewicht (Mittelwert, kg) |
77,7 |
76,5 |
76,2 |
|
Weiblich (%) |
50,5 |
49,4 |
48,8 |
|
Ethnische Zugehörigkeit |
|
|
|
|
Weiss (%) |
68,2 |
59,3 |
61,6 |
|
Asiatisch (%) |
16,5 |
28,6 |
14,7 |
|
Schwarz (%) |
11,6 |
8,2 |
13,3 |
|
IGA 3 (mittelschwere AD) (%) |
59,7 |
63,2 |
69,2 |
|
IGA 4 (schwere AD) (%) |
40,3 |
36,8 |
30,8 |
|
Vorherige systemische Behandlung (%)* |
54,0 |
55,5 |
47,4 |
|
EASI (Mittelwert) |
29,6 |
29,7 |
27,3 |
|
Pruritus-NRS (Mittelwert) |
7,3 |
7,1 |
7,1 |
|
DLQI (Mittelwert) |
15,4 |
15,5 |
14,4 |
|
Schlafverlust-Skala (Mittelwert) |
2,3 |
2,2 |
2,0 |
|
POEM (Mittelwert) |
20,8 |
20,8 |
19,5 |
*Kortikosteroide, Cyclosporine, Phototherapie und Dupilumab (nur ADhere)
Klinisches Ansprechen
Monotherapiestudien (ADvocate-1 und ADvocate-2) – Induktionsphase, Woche 0-16
In ADvocate-1 und ADvocate-2 erreichten in Woche 16 unter Lebrikizumab 250 mg Q2W signifikant mehr Patienten IGA 0 oder 1 mit einer Verbesserung um ≥2 Punkte gegenüber Baseline, EASI 75, EASI 90 und eine Verbesserung um ≥4 Punkte auf der Pruritus-NRS im Vergleich zu Placebo (siehe Tabelle 3).
Tabelle 3. Ergebnisse zur Wirksamkeit der Lebrikizumab-Monotherapie in ADvocate-1 und ADvocate-2 in Woche 16
|
|
ADvocate-1 |
ADvocate-2 | ||
|
|
Woche 16 | |||
|
|
Placebo |
LEB 250 mg Q2W |
Placebo |
LEB |
|
IGA 0 oder 1, %a |
12,7 |
43,1* |
10,8 |
33,2* |
|
EASI 75, %b |
16,2 |
58,8* |
18,1 |
52,1* |
|
EASI 90, %b |
9,0 |
38,3* |
9,5 |
30,7* |
|
Pruritus-NRS (Verbesserung um ≥4 Punkte), %c |
13,0 |
45,9* |
11,5 |
39,8* |
LEB = Lebrikizumab; N = Anzahl an Patienten
a Patienten mit einem IGA von 0 oder 1 («erscheinungsfrei» oder «beinahe erscheinungsfrei») mit einer Reduktion um >2 Punkte gegenüber Baseline auf einer IGA-Skala von 0-4
b Patienten mit einer Reduktion des EASI um 75% oder 90% von Baseline to Week 16.
c Der Prozentsatz wird relativ zur Anzahl der Patienten mit einer Baseline-Pruritus-NRS ≥4 berechnet.
* p<0,001 vs. Placebo
In den beiden Studien benötigten weniger Patienten, die auf Lebrikizumab randomisiert wurden, eine Rescue-Therapie (topische Kortikosteroide, systemische Kortikosteroide, Immunsuppressiva) als Patienten, die nach Randomisierung Placebo erhielten (14,7% bzw. 36,6% in beiden Studien).
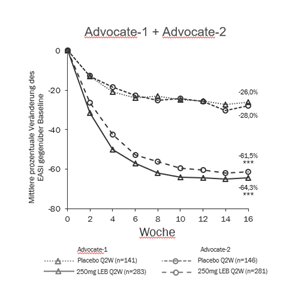
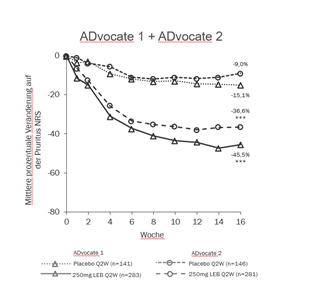
Abbildung 1 und Abbildung 2 zeigen die mittlere prozentuale Veränderung in EASI und Pruritus-NRS von Baseline bis Woche 16.
|
Abbildung 1. Mittlere prozentuale EASI-Veränderung von Baseline bis Woche 16 in ADvocate 1 und 2 |
Abbildung 2. Mittlere prozentuale Veränderung auf der Pruritus-NRS von Baseline bis Woche 16 in ADvocate 1 und 2 | ||
|
|
|
|
|
***p<0,001 vs. Placebo
Die Behandlungseffekte in Untergruppen (Gewicht, Alter, Geschlecht, ethnische Zugehörigkeit, Schweregrad der Erkrankung und vorherige Anwendung von systemischen Therapien) in ADvocate-1 und ADvocate-2 stimmten mit den Ergebnissen in der gesamten Studienpopulation während der Induktionsphase überein.
Monotherapiestudien (ADvocate-1 und ADvocate-2) – Erhaltungszeitraum, Wochen 16-52
Zur Beurteilung der Aufrechterhaltung des Ansprechens wurden 157 Patienten aus ADvocate-1 und 134 Patienten aus ADvocate-2, die mit Lebrikizumab 250 mg Q2W behandelt wurden und in Woche 16 IGA 0 oder 1 bzw. EASI 75 ohne topische oder systemische Rescue-Therapie erreichten, erneut verblindet im Verhältnis 2:2:1 randomisiert. Die Patienten erhielten über weitere 36 Wochen verblindet entweder (i) Lebrikizumab 250 mg Q2W, (ii) Lebrikizumab 250 mg Q4W oder (iii) Placebo. Die Gesamtdauer der Studie betrug 52 Wochen (siehe Tabelle 4).
Tabelle 4. Ergebnisse zur Wirksamkeit der Lebrikizumab-Monotherapie in ADvocate-1 und ADvocate-2 in Woche 52 bei Patienten, die in ADvocate-1 und ADvovate-2 in Woche 16 auf die Behandlung ansprachen (gepoolte Analyse)
|
|
ADvocate-1 und ADvocate-2 (gepoolt) | ||
|
|
Woche 52 | ||
|
|
Placebod |
LEB 250 mg |
LEB 250 mg |
|
IGA 0 oder 1, %a |
47,9 |
71,2* |
76,9** |
|
EASI 75, %b |
66,4 |
78,4 |
81,7* |
|
EASI 90, %b |
41,9 |
64,0* |
66,4** |
|
Pruritus-NRS (Verbesserung um ≥4 Punkte), %c |
66,3 |
84,6 |
84,7 |
a Patienten mit IGA 0/1 mit einer Verbesserung um ≥2 Punkte gegenüber Baseline in Woche 16, die in Woche 52 weiterhin IGA 0/1 mit einer Verbesserung um ≥2 Punkte aufwiesen.
b Patienten, die in Woche 16 EASI 75 erreichten und in Woche 52 weiterhin EASI 75 aufwiesen oder Patienten, die in Woche 16 EASI 75 erreichten und in Woche 52 EASI 90 aufwiesen.
c Der Prozentsatz wird relativ zur Anzahl der Patienten mit einer Baseline-Pruritus-NRS ≥4 berechnet.
d Patienten, die in Woche 16 auf Lebrikizumab 250 mg Q2W ansprachen (IGA 0 oder 1 oder EASI 75) und dann auf Placebo randomisiert wurden.
*p<0.05; ** p<0.01 versus placebo.
Begleitende TCS-Studie (ADhere)
In ADhere erreichte von Baseline bis Woche 16 ein signifikant grösserer Anteil der Patienten, die nach Randomisierung Lebrikizumab 250 mg Q2W + TCS erhielten, IGA 0 oder 1, EASI 75 und Verbesserungen um ≥4 Punkte in der Pruritus-NRS als unter Placebo + TCS (siehe Tabelle 5).
Tabelle 5. Ergebnisse zur Wirksamkeit der Lebrikizumab-Kombinationstherapie mit TCS in Woche 16 in ADhere
|
|
ADhere | |
|
|
Woche 16 | |
|
|
Placebo + TCS |
LEB |
|
IGA 0 oder 1, %a |
22,1 |
41,2* |
|
EASI 75, %b |
42,2 |
69,5** |
|
EASI 90, %b |
21,7 |
41,2** |
|
Pruritus-NRS (Verbesserung um ≥4 Punkte), %c |
31,9 |
50,6* |
a Patienten mit einem IGA von 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Reduktion um ≥2 Punkte gegenüber Baseline auf einer IGA-Skala von 0-4
b Patienten mit einer Reduktion des EASI um 75% oder 90% von Baseline bis Woche 16.
c Der Prozentsatz wird relativ zur Anzahl der Patienten mit einem Baseline-Pruritus NRS ≥4 berechnet.
*p<0,05; **p<0,001 vs. Placebo
In ADhere wendeten Patienten, die von Woche 0 bis 16 Lebrikizumab 250 mg Q2W+TCS erhielten, seltener TCS an, als Patienten, die Placebo + TCS erhielten (1,4% bzw. 4,5%).
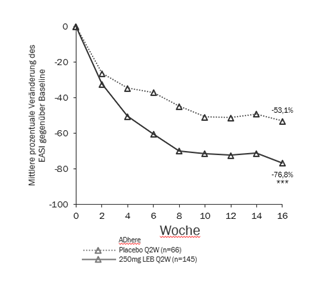
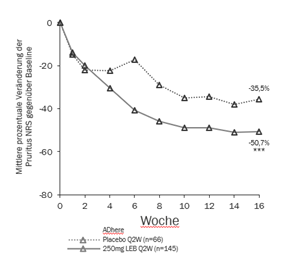
Abbildung 3 und Abbildung 4 zeigen die mittlere prozentuale Veränderung des EASI gegenüber Baseline und die mittlere prozentuale Veränderung auf der Pruritus NRS im Vergleich zur Baseline bis Woche 16.
|
Abbildung 3. Mittelwert der prozentualen Veränderung der Least squares (kleinsten Quadrate) des EASI gegenüber Baseline aus der ADhere |
Abbildung 4. Mittelwert der prozentualen Veränderung der Least squares (kleinsten Quadrate) der Pruritus NRS gegenüber Baseline aus der ADhere | ||
|
|
|
|
|
***p<0.001 vs Placebo ***p<0.001 vs Placebo
In ADhere stimmten die Behandlungseffekte in Untergruppen (Gewicht, Alter, Geschlecht, ethnische Zugehörigkeit, Schweregrad der Erkrankung und vorherige Anwendung von systemischen Therapien) mit den Ergebnissen in der gesamten Studienpopulation überein.
Bei Patienten, die in ADhere in Woche 16 ansprachen und in ADjoin eintraten und entweder mit Lebrikizumab 250 mg Q2W oder Q4W behandelt wurden, blieb das Ansprechen bis zu 56 Wochen erhalten (75,4% bzw. 86,8% für IGA 0 oder 1 sowie 85,6% bzw. 81,2% für EASI 75).
Patient-reported outcome und gesundheitsbezogene Lebensqualität
In beiden Monotherapiestudien (ADvocate-1 und ADvocate-2) verbesserte Lebrikizumab 250 mg Q2W signifikant die von den Patienten subjektiv angegebenen Ergebnisse in Bezug auf den Schweregrad der Erkrankung (POEM), die Beeinträchtigung des Schlafs durch Juckreiz (Schlafverlust-Skala) und die gesundheitsbezogene Lebensqualität (DLQI) in Woche 16 im Vergleich zu Placebo. Ein signifikant grösserer Anteil der mit Lebrikizumab behandelten Patienten erzielte klinisch bedeutsame Verbesserungen im DLQI (definiert als ≥4-Punkte-Reduktion gegenüber Baseline), POEM und der Schlafverlust-Skala von Baseline bis Woche 16 im Vergleich zur Placebogruppe (siehe Tabelle 6).
In der TCS-Studie (ADhere) verbesserte Lebrikizumab 250 mg Q2W + TCS die Beeinträchtigung des Schlafes durch Juckreiz (Schlafverlust-Skala), den vom Patienten angegebenen Schweregrad der Erkrankung (POEM) und die gesundheitsbezogene Lebensqualität (DLQI) in Woche 16 gegenüber Placebo + TCS (siehe Tabelle 6).
Tabelle 6. Patient-reported outcomes (gesundheitsbezogene Lebensqualitätsergebnisse) der Lebrikizumab-Monotherapie in Woche 16 in ADvocate-1 und ADvocate-2 oder mit begleitender TCS-Therapie in Woche 16 in ADhere
|
|
ADvocate-1 |
ADvocate-2 |
ADhere | |||
|
|
Woche 16 | |||||
|
|
Placebo |
LEB 250 mg Q2W |
Placebo |
LEB 250 mg Q2W |
Placebo + TCS |
LEB 250 mg Q2W + TCS |
|
DLQI (Erwachsene) (Verbesserung um ≥4 Punkte), %a |
33,8 |
75,6** |
33,6 |
66,3** |
58,7 |
77,4* |
|
Schlafverlust-Skala (Sleep-Loss-Scale) (Verbesserung um ≥2 Punkte), %b |
4,7 |
39.0** |
8,2 |
28,0** |
18,4 |
34,5* |
|
POEM; Veränderung des LS-Mittelwerts gegenüber Baseline (± SE) |
-3,9 |
-11,3** |
-3,5 |
-9,5** |
-6,24 |
-10,23** |
LS = least squares (mittlere Quadrate), SE = Standardfehler
a Teilnehmer mit DLQI ≥4 Punkten bei Baseline
b Teilnehmer mit ≥2 Punkten in der Schlafverlust-Skala bei Baseline
*p<0,05; **p<0,001 vs. Placebo
Jugendliche (von 12 bis 17 Jahren)
In den Monotherapiestudien ADvocate-1 und ADvocate-2 lag das Durchschnittsalter der jugendlichen Patienten bei 14,6 Jahren, das Durchschnittsgewicht bei 68,2 kg, und 56,9% waren weiblich. In diesen Studien hatten 63,7% einen IGA-Ausgangswert von 3 (mittelschwere atopische Dermatitis ), 36,3% hatten einen IGA-Ausgangswert (Baseline) von 4 (schwere atopische Dermatitis) und 47,1% hatten zuvor eine systemische Behandlung erhalten. In der begleitenden Studie mit TCS (ADhere) lag das Durchschnittsalter der jugendlichen Patienten bei 14,6 Jahren, das Durchschnittsgewicht bei 62,2 kg, und 50,0% waren weiblich. In dieser Studie hatten 76,1% einen IGA-Ausgangswert von 3 (mittelschwere atopische Dermatitis), 23,9% einen IGA-Ausgangswert von 4 (schwere atopische Dermatitis), und 23,9% hatten zuvor eine systemische Behandlung erhalten.
Die Ergebnisse zur Wirksamkeit in Woche 16 bei jugendlichen Patienten sind in Tabelle 7 dargestellt.
Tabelle 7. Ergebnisse zur Wirksamkeit der Lebrikizumab-Monotherapie in ADvocate-1, ADvocate-2 und der Lebrikizumab-Kombinationstherapie mit TCS in ADhere der jugendlichen Patienten in Woche 16
|
|
ADvocate-1 |
ADvocate-2 |
ADhere | |||
|
|
Woche 16 | |||||
|
|
Placebo |
LEB |
Placebo |
LEB |
Placebo + TCS |
LEB |
|
IGA 0 oder 1, %a |
22.2 |
48.6 |
5.9 |
44.1** |
28.6 |
57.3 |
|
EASI 75, %a |
22.2 |
62.2** |
12.0 |
61.7** |
57.1 |
88.0* |
|
EASI 90, %a |
16.7 |
45.9* |
6.1 |
34.3* |
28.6 |
55.1 |
|
Pruritus NRS (Verbesserung um ≥4-Punkte), %b |
22.8 |
54.3* |
0.3 |
42.1 |
13.8 |
45.8 |
|
a
In Woche 16, Patienten mit einem IGA von 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Reduktion um ≥2 Punkte gegenüber Baseline auf einer IGA-Skala von 0-4 oder Reduktion des EASI um 75% oder 90% von Baseline bis Woche 16. | ||||||
Bei jugendlichen Patienten, die mit Lebrikizumab bzw. Lebrikizumab + TCS behandelt wurden, wurden klinisch bedeutsame Verbesserungen des Schweregrads der Erkrankung erzielt und das Ansprechen blieb bis Woche 52 erhalten. Zusätzliche Daten aus der einarmigen ADore-Studie mit Lebrikizumab bei 206 Jugendlichen untermauern die Wirksamkeit von Lebrikizumab bei jugendlichen Patienten bis zu 52 Behandlungswochen.
Pharmakokinetik
Absorption
Nach einer subkutanen Dosis von 250 mg Lebrikizumab wurden die maximalen Serumkonzentrationen etwa 7 bis 8 Tage nach der Dosis erreicht.
Nach den Aufsättigungsdosen von 500 mg in Woche 0 und Woche 2 wurden mit der ersten Dosis von 250 mg Q2W in Woche 4 Steady-State-Serumkonzentrationen erreicht.
Basierend auf einer Populations-pharmakokinetischen (PK)-Analyse betrugen die vorhergesagten Steady-State-Talkonzentrationen (CTal,ss) nach der subkutanen Gabe von Lebrikizumab 250 mg Q2W und Q4W bei Patienten mit atopischer Dermatitis (Median und 5.-95. Perzentil) 87 (46-159) µg/ml bzw. 36 (18-68) µg/ml.
Basierend auf einer Populations-PK-Analyse wurde die absolute Bioverfügbarkeit auf 86% geschätzt. Die Injektionsstelle hatte keinen relevanten Einfluss auf die Resorption von Lebrikizumab.
Distribution
Basierend auf einer Populations-PK-Analyse betrug das Gesamtverteilungsvolumen im Steady-State 5,14 l.
Metabolismus
Da Lebrikizumab ein Protein ist, wurden keine Metabolisierungsstudien durchgeführt. Es wird erwartet, dass Lebrikizumab über katabole Prozesse auf die gleiche Weise wie endogenes IgG zu kleinen Peptiden und einzelnen Aminosäuren abgebaut wird.
Elimination
In der Populations-PK-Analyse betrug die Clearance 0,154 l/Tag und war unabhängig von der Dosis. Die mittlere Eliminationshalbwertszeit betrug etwa 24,5 Tage.
Linearität/Nicht-Linearität
Lebrikizumab zeigte eine lineare Pharmakokinetik mit dosisproportionalem Anstieg der Exposition über einen Dosisbereich von 37,5 bis 500 mg bei Verabreichung als subkutane Injektion an AD-Patienten oder gesunde Freiwillige.
Kinetik spezieller Patientengruppen
Geschlecht, Alter und ethnische Zugehörigkeit
Geschlecht, Alter (zwischen 12 und 93 Jahren) und ethnische Zugehörigkeit (64% Kaukasier, 15% Schwarze/Afroamerikaner, 16% Asiaten und 6% Andere) hatten keinen signifikanten Einfluss auf die Pharmakokinetik von Lebrikizumab.
Leber- und Nierenfunktionsstörungen
Es wurden keine spezifischen klinisch-pharmakologischen Studien zur Beurteilung der Auswirkungen einer eingeschränkten Leber- oder Nierenfunktion auf die Pharmakokinetik von Lebrikizumab durchgeführt. Es wird nicht erwartet, dass Lebrikizumab als monoklonaler Antikörper in nennenswertem Umfang über die Leber oder die Nieren eliminiert wird. In die Populations-PK-Analysen wurden 54 (3%) Probanden mit erhöhten Leberenzymen ALT oder AST ≥1.5 x ULN bei Studienbeginn, und 347 (22%) Probanden mit eingeschränkter Nierenfunktion (glomeruläre Filtrationsrate zwischen 30 und 89 ml/min) bei Studienbeginn mit einbezogen. Die Populations-PK-Analysen zeigen, dass Marker der Leber- oder Nierenfunktion die Pharmakokinetik von Lebrikizumab nicht beeinflussten.
Körpergewicht
Die Exposition gegenüber Lebrikizumab war bei den 10% Patienten mit höherem Körpergewicht (>100 kg) niedriger.
Kinder und Jugendliche
Basierend auf der Populations-PK-Analyse wiesen Jugendliche im Alter von 12 bis 17 Jahren mit atopischer Dermatitis geringfügig höhere Lebrikizumab-Serum-Talkonzentrationen auf als Erwachsene, was mit ihrem geringeren Körpergewicht zusammenhing.
Präklinische Daten
Basierend auf den konventionellen Studien zur Toxizität bei wiederholter Gabe (einschliesslich sicherheitspharmakologischer Endpunkte) und Reproduktions- und Entwicklungstoxizität, lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Genotoxizität
Das mutagene Potenzial von Lebrikizumab wurde nicht untersucht; es ist jedoch nicht zu erwarten, dass monoklonale Antikörper die DNA oder Chromosomen verändern.
Kanzerogenität
Mit Lebrikizumab wurden keine Studien zur Kanzerogenität durchgeführt. Die Auswertung der verfügbaren Erkenntnisse in Bezug auf IL-13-Hemmung und der tierexperimentellen Toxikologiedaten zu Lebrikizumab deutet nicht auf ein kanzerogenes Potenzial für Lebrikizumab hin.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank lagern (2-8 °C).
Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Nach der Entnahme aus dem Kühlschrank Ebglyss nicht über 30°C lagern und innerhalb von 7 Tagen verwenden oder entsorgen. Nach der Lagerung ausserhalb des Kühlschranks nicht wieder in den Kühlschrank geben.
Hinweise für die Handhabung
Die Anweisungen für die Vorbereitung und Verabreichung von Ebglyss in einer Fertigspritze oder in einem Fertigpen sind am Ende der Packungsbeilage aufgeführt.
Die Lösung sollte eine klare bis schillernde, farblose bis leicht gelbliche oder leicht bräunliche Lösung und frei von sichtbaren Partikeln sein. Wenn die Lösung trüb oder verfärbt ist oder sichtbare Partikel enthält, darf sie nicht verwendet werden.
Vor der Injektion von Ebglyss die 250-mg-Fertigspritze oder den Fertigpen aus dem Kühlschrank nehmen und 45 Minuten lang Raumtemperatur annehmen lassen.
Die Fertigspritze oder den Fertigpen vor hohen Temperaturen und direktem Sonnenlicht schützen. Nicht schütteln.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Zulassungsnummer
69344, 69460 (Swissmedic)
Packungen
Ebglyss, Injektionslösung in einer Fertigspritze
1 Fertigspritze [B]
2 Fertigspritzen [B]
Ebglyss, Injektionslösung im Fertigpen
1 Fertigpen [B]
2 Fertigpens [B]
Zulassungsinhaberin
Almirall AG, 8304 Wallisellen
Stand der Information
April 2024