ZusammensetzungWirkstoffe
Diphtherie-Toxoid; Tetanus-Toxoid; Pertussis-Toxoid (PT); filamentöses Hämagglutinin (FHA) von Bordetella pertussis; Pertactin (PRN) von Bordetella pertussis; inaktiviertes Poliovirus Typ 1 (Mahoney-Stamm); inaktiviertes Poliovirus Typ 2 (MEF-1-Stamm); inaktiviertes Poliovirus Typ 3 (Saukett-Stamm).
Hilfsstoffe
Wasserhaltiges Aluminiumhydroxid, Natriumchlorid corresp. Natrium 1,8 mg, Medium 199, Wasser für Injektionszwecke q.s. ad 0,5 mL.
Rückstände
Neomycinsulfat, Polymyxin B-Sulfat, Polysorbat 80, Formaldehyd.
Indikationen/AnwendungsmöglichkeitenGrundimmunisierung
Infanrix DTPa-IPV ist indiziert für die aktive Immunisierung gegen Diphtherie, Tetanus, Pertussis und Poliomyelitis bei Kindern ab 2 Monaten.
Auffrischimpfungen
Infanrix DTPa-IPV ist für die 4. Dosis (1. Auffrischimpfung = 1. Booster) bei Kindern im 2. Lebensjahr geeignet, die vorgängig mit einem DTP- und Polio-Impfstoff grundimmunisiert worden sind.
Infanrix DTPa-IPV ist indiziert für die 5. Dosis (= 2. Booster) bei Kindern zwischen 4 und 7 Jahren (gemäss Schweiz. Impfplan).
Infanrix DTPa-IPV sollte gemäss den offiziellen Impfempfehlungen angewendet werden.
Dosierung/AnwendungÜbliche Dosierung
Es muss die empfohlene, volle Dosis von 0,5 mL verabreicht werden.
Grundimmunisierung
Sie besteht aus drei Impfungen im Abstand von 2 Monaten.
1. Dosis im Alter von 2 Monaten.
2. Dosis im Alter von 4 Monaten.
3. Dosis im Alter von 6 Monaten.
Auffrischimpfungen
Die 4. Dosis wird im 2. Lebensjahr (vorzugsweise im Alter von 15 bis 18 Monaten), die 5. Dosis im Alter von 4 – 7 Jahren verabreicht.
Art der Anwendung
Infanrix DTPa-IPV soll tief intramuskulär injiziert werden. Bei Säuglingen ist die bevorzugte Injektionsstelle der anterolaterale Bereich des Oberschenkels. Bei älteren Kindern sollte die Injektion in den Deltoideus erfolgen.
Aufeinander folgende Impfungen sollten vorzugsweise in gegenüberliegende Gliedmassen verabreicht werden.
Infanrix DTPa-IPV sollte bei Kindern mit einer leichtgradigen Blutgerinnungsstörung mit Vorsicht angewendet werden, weil bei diesen Personen nach einer intramuskulären Injektion eine Blutung auftreten kann. Für mindestens 2 Minuten sollte beständiger Druck (ohne Reiben) auf die Injektionsstelle ausgeübt werden. Kinder, die an einer substitutionspflichtigen Blutgerinnungsstörung z.B. Hämophilie leiden, sollen die intramuskuläre Impfung zusammen mit bzw. direkt nach der Substitution mit dem entsprechenden Blutgerinnungsfaktor erhalten. Schwerwiegende Thrombozytopenien ≤50000/µL stellen eine Kontraindikation für intramuskuläre Impfungen dar. In diesen Fällen soll Infanrix DTPa-IPV subkutan verabreicht werden.
KontraindikationenInfanrix DTPa-IPV darf nicht angewendet werden bei Kindern mit einer bekannten Überempfindlichkeit auf eine Komponente des Impfstoffes (inkl. bekannte Überempfindlichkeit gegen Neomycin und Polymyxin) oder bei Kindern, die Zeichen einer Überempfindlichkeit nach einer früheren Anwendung von Diphtherie-, Tetanus-, Pertussis- oder Polio-Impfstoffen zeigten.
Eine Impfung mit Infanrix DTPa-IPV sollte ebenfalls unterbleiben, wenn in der Impfanamnese eine Enzephalopathie unbekannter Genese innerhalb einer Woche nach Impfung mit einem Pertussis-Impfstoff aufgetreten ist.
Wie bei anderen Impfstoffen soll die Impfung mit Infanrix DTPa-IPV bei Personen, die an akuter, schwerwiegender und fieberhafter Erkrankung leiden, verschoben werden.
Eine leichte Infektion stellt keine Kontraindikation dar.
Warnhinweise und VorsichtsmassnahmenInfanrix DTPa-IPV darf unter keinen Umständen intravaskulär injiziert werden!
Der Impfung soll eine Überprüfung der Krankengeschichte (vorwiegend bezüglich früherer Impfungen und möglicher Nebenwirkungen) und eine klinische Untersuchung vorangehen.
Bei untenstehenden Erscheinungen, die in zeitlichem Bezug zu einer DTP-Impfung stehen, sollte die Verabreichung von weiteren Dosen, die Pertussis-Komponenten enthalten, sorgfältig erwogen werden:
·Temperatur von ≥ 40,0°C innerhalb von 48 Stunden, die nicht auf eine andere Ursache zurückzuführen ist;
·Kollaps oder schockähnlicher Zustand (hypotonisch-hyporesponsive Episode) innerhalb von 48 Stunden;
·Anhaltendes, untröstliches Weinen, das mehr als 3 Stunden anhält und innerhalb von 48 Stunden nach der Impfung eintritt;
·Konvulsionen mit oder ohne Fieber, die innerhalb von 3 Tagen auftreten.
Wenn bei einem Säugling oder Kind eine ernsthafte neurologische Erkrankung zum ersten Mal auftritt oder eine progrediente schwerwiegende neurologische Erkrankung vorliegt, sollte – wie bei jeder Impfung – Nutzen und Risiko einer Immunisierung mit Infanrix DTPa-IPV gegenüber einem Aufschub dieser Impfung sorgfältig abgewogen werden.
Unter gewissen Umständen, z.B. hoher Keuchhusten-Inzidenz, können die potentiellen Vorteile der Impfung die möglichen Risiken überwiegen, vor allem wenn diese Ereignisse nicht mit einer bleibenden Folge verbunden sind.
Febrile Konvulsionen in der Vergangenheit und Krampfanfälle oder plötzlicher Kindstod (SIDS) in der Familienanamnese sind keine Kontraindikation zur Impfung mit Infanrix DTPa-IPV.
Bei Kindern unter immunosuppressiver Behandlung (Kortikosteroidbehandlung, antimitotische Chemotherapie, usw.) soll die Impfung mit Infanrix DTPa-IPV bis zum Abschluss der Behandlung verschoben werden.
Eine HIV-Infektion stellt keine Kontraindikation für die Infanrix DTPa-IPV-Impfung dar. Möglicherweise kann bei diesen Patienten keine adäquate Immunantwort nach der Impfung mit DTPa-IPV erzielt werden.
Wie bei allen injizierbaren Impfstoffen sollte für den Fall einer anaphylaktischen Reaktion nach der Impfung immer eine angemessene medizinische Behandlung zur Verfügung stehen.
Infanrix DTPa-IPV sollte bei Kindern mit Thrombozytopenie oder einer Blutgerinnungsstörung mit Vorsicht angewendet werden, da bei diesen Kindern nach einer intramuskulären Injektion eine Blutung auftreten kann.
Das potentielle Risiko von Apnoen und die Notwendigkeit einer Überwachung der Atmung über 48 – 72 Stunden sollte im Rahmen der Grundimmunisierung von sehr unreifen Frühgeborenen (geboren vor der vollendeten 28. Schwangerschaftswoche) in Betracht gezogen werden. Dies gilt insbesondere für diejenigen, die in der Vorgeschichte Zeichen einer Lungenunreife gezeigt haben. Da der Nutzen der Impfung für diese Säuglingsgruppe hoch ist, sollte sie ihnen weder vorenthalten noch verschoben werden.
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Impfdosis, d.h. es ist nahezu «natriumfrei».
InteraktionenInfanrix DTPa-IPV ist in klinischen Studien gleichzeitig mit Masern-Mumps-Röteln- oder Hib-Impfstoff angewendet worden. Die verfügbaren Daten deuten auf keine klinisch relevante Interferenz in der Antikörper-Antwort auf jedes einzelne Antigen hin.
Interaktionsstudien mit anderen Impfstoffen, biologischen Produkten oder Arzneimitteln sind nicht durchgeführt worden. Da Infanrix DTPa-IPV ein inaktiviertes Produkt ist, und in Übereinstimmung mit den allgemein gültigen Immunisierungs-Richtlinien, gibt es keinen theoretischen Grund, warum Infanrix DTPa-IPV nicht gleichzeitig mit anderen Impfstoffen oder Immunglobulinen an verschiedenen Orten verabreicht werden soll.
Wie bei anderen Impfstoffen kann bei Patienten, die eine immunsuppressive Therapie erhalten, oder bei Patienten, die eine Immundefizienz aufweisen, eine adäquate Immunantwort ausbleiben.
Bei Kinderimpfungen ist es üblich, gleichzeitig mehrere Impfungen vorzunehmen. In diesem Falle sollen immer verschiedene Injektionsstellen gewählt werden.
Schwangerschaft, StillzeitDa Infanrix DTPa-IPV nicht zur Anwendung bei Erwachsenen bestimmt ist, sind keine Daten zur Sicherheit des Impfstoffes während der Schwangerschaft und der Stillzeit verfügbar.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wird damit gerechnet, dass Infanrix DTPa-IPV nur selten Personen verabreicht wird, die fahren oder Maschinen bedienen. Dennoch ist häufig über Schläfrigkeit nach einer Impfung berichtet worden. Dies mag vorübergehend die Fähigkeit, zu fahren oder Maschinen zu bedienen, beeinträchtigen.
Unerwünschte WirkungenKlinische Studien
Das folgende Sicherheitsprofil basiert auf Daten von mehr als 2'200 Personen.
Die ermittelten Häufigkeiten werden wie folgt angegeben: «Sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1'000, <1/100), «selten» (≥1/10'000, <1/1'000), «sehr selten» (< 1/10'000).
Wie für die DTPa- und DTPa-enthaltenden Impfstoffe beobachtet, wurde nach der Boosterimpfung über eine Erhöhung der lokalen Reaktogenität und Fieber berichtet, im Vergleich zur Grundimmunisierung.
Erkrankungen des Blutes und des Lymphsystems
Selten: Lymphadenopathie1.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Appetitverlust (nach Grundimmunisierung: 10,8%; nach Booster:14,8%).
Psychiatrische Erkrankungen
Sehr häufig: Reizbarkeit (Grundimmunisierung: 46,9%; Booster: 20,1%), Unruhe (Grundimmunisierung: 26,7%; Booster: 21,5%), ungewöhnliches Schreien (Grundimmunisierung: 14,1%; Booster: 12,6%).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen1 (6 – 13 Jahre alte Kinder; nach Booster: 25,0%), Somnolenz (Grundimmunisierung: 32,7%; Booster: 22,1%).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Bronchitis2, Husten2.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit1, Erbrechen, Durchfall.
Gelegentlich: Bauchschmerzen.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: allergische Dermatitis, Hautausschlag2,3.
Selten: Urticaria, Juckreiz.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schmerzen (Grundimmunisierung: 15,2%; Booster: 46,4%), Rötung (Grundimmunisierung: 40,1%; Booster: 49,0%), lokale Schwellung um die Einstichstelle (≤ 50 mm, Grundimmunisierung: 23,7%; Booster: 39,8%), Fieber (≥38,0°C, Grundimmunisierung: 10,3%; Booster: 21,5%).
Häufig: Unwohlsein1, Schwellung der gesamten Gliedmasse um die Injektionsstelle (> 50 mm)4, Asthenie, Reaktionen an der Einstichstelle, inkl. Verhärtung, diffuse Schwellung der Gliedmasse, wo die Injektion vorgenommen wurde, manchmal unter Mitbeteiligung des benachbarten Gelenks4, Fieber5 (> 39,5°C).
Unerwünschte Wirkungen aus der Postmarketingphase
Erkrankungen des Blutes und des Lymphsystems
Thrombozytopenie6.
Erkrankungen des Immunsystems
Allergische Reaktionen, einschliesslich anaphylaktische2 und anaphylaktoide Reaktionen.
Erkrankungen des Nervensystems
Kollaps oder schockähnliche Zustände (hypotone hyporesponsive Episode), Konvulsionen mit oder ohne Fieber innerhalb von 2-3 Tagen nach der Impfung.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Apnoe2.
Erkrankungen der Haut und des Unterhautgewebes
Pruritus, angioneurotisches Ödem2.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Schwellung der gesamten betroffenen Gliedmasse4, an der die Injektion vorgenommen wurde, Bläschen an der Einstichstelle.
1 nur nach der Boosterimpfung berichtet.
2 mit DTPa-enthaltenden Impfstoffen von GlaxoSmithKline berichtet.
3 gelegentlich berichtet nach Boosterimpfung.
4 Kinder, denen zur Grundimmunisierung Impfstoffe mit azellulärer Pertussiskomponente verabreicht worden sind, haben im Vergleich zu Kindern, die mit Ganzzell-Pertussisimpfstoff grundimmunisiert wurden, eine höhere Wahrscheinlichkeit, nach der Auffrischimpfung eine Schwellung zu entwickeln. Eine lokale Schwellung an der Injektionsstelle (> 50 mm) und diffuse Schwellung können öfters vorkommen (sehr häufig und häufig), wenn die Boosterdosis zwischen 4 und 6 Jahren angewendet wird.Informationen zu diffusen Schwellungen der gesamten Gliedmasse um die Einstichstelle nach Impfung mit Infanrix DTPa-IPV (definiert als Schwellung mit Durchmesser > 50 mm mit erkennbarer diffuser Schwellung oder erkennbarer Zunahme des Umfangs der Gliedmasse), wurden in zwei klinischen Studien ermittelt: Wenn bei Kindern von 4 – 6 Jahren Infanrix DTPa-IPV entweder als 4. oder 5. DTPa-Dosis geimpft wurde, trat eine massive Schwellung (> 50 mm) an der Injektionsstelle bei 13% resp. bei 25% der Impflinge auf. Am häufigsten zeigten sich diese Reaktionen in Form massiver, lokaler Schwellungen (Durchmesser > 50 mm) an der Einstichstelle. 3% resp. 6% der Impflinge zeigten diffuse Schwellungen der gesamten beimpften Gliedmasse, manchmal unter Mitbeteiligung der benachbarten Gelenke. Generell begannen diese Reaktionen innerhalb von 48 Stunden nach der Impfung und klangen innerhalb von 4 Tagen ohne Folgen wieder ab.
5 häufig nach der Boosterimpfung berichtet.
6 nach Diphtherie- und Tetanus-Impfstoffen berichtet.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungWährend der Marktüberwachung wurde über Fälle von Überdosierung berichtet. Unerwünschte Wirkungen, wenn berichtet, waren nicht spezieller Natur, aber ähnlich derjenigen, die mit der normalen Anwendung eines Impfstoffes berichtet wurden.
Eigenschaften/WirkungenATC-Code
J07CA02 (kombinierter Bakterien- und Virenimpfstoff)
Infanrix DTPa-IPV enthält das Diphtherie-Toxoid, das Tetanus-Toxoid und drei gereinigte Antigene von Bordetella pertussis [Pertussis-Toxoid (PT), filamentöses Hämagglutinin (FHA) und Pertactin (das 69 Kilodalton (kDa) schwere äussere Membran-Protein PRN)], die an Aluminiumhydroxid adsorbiert sind. Es enthält ebenfalls drei Typen des inaktivierten Poliomyelitisvirus (Typ 1: Mahoney; Typ 2: MEF-1; Typ 3: Saukett).
Die Diphtherie- und Tetanus-Toxine werden aus Kulturen von Corynebacterium diphtheriae und Clostridium tetani gewonnen, dann werden die Toxine detoxifiziert und gereinigt. Die azellulären Pertussis-Impfstoff-Komponenten (PT, FHA und PRN) werden aus Bordetella pertussis-Bakterien gewonnen, aus denen die Antigene PT, FHA und PRN extrahiert, gereinigt und irreversibel detoxifiziert werden.
Die drei Typen des Poliomyelitisvirus werden in einer kontinuierlichen VERO-Zelllinie kultiviert, mit Formaldehyd gereinigt und inaktiviert.
Die Diphtherie- und Tetanus-Toxoide und die Komponenten des azellulären Pertussis-Impfstoffes werden an Aluminiumhydroxid adsorbiert. Der fertige Impfstoff liegt in einer NaCl-Lösung vor.
Infanrix DTPa-IPV erfüllt die WHO-Bestimmungen für die Herstellung von biologischen Produkten, von Diphtherie-, Tetanus-, Pertussis- und von inaktivierten Poliomyelitis-Impfstoffen.
Wirkungsmechanismus
Nicht zutreffend.
Pharmakodynamik
Immunantwort der DTPa-Komponente nach Grundimmunisierung und 1. Auffrischimpfung (= 4. Dosis) im 2. Lebensjahr
Einen Monat nach einer Grundimmunisierung mit drei Dosen von Infanrix DTPa-IPV (im Lebensalter von 2, 4 und 6 Monaten) wiesen mehr als 99% der Kinder Antikörpertiter ≥ 0,1 IU/mL gegen Diphtherie und Tetanus auf. Nach Verabreichung einer 1. Auffrischimpfung erhöhte sich die Anzahl der Kinder auf 99,5%.
100% der Kinder waren nach 3 Dosen seropositiv für die drei Pertussis-Komponenten (PT, FHA, PRN) und die Immunantworten für die drei Komponenten lagen bei 98,4% (PT), 97,7% (FHA) und 97,3% (PRN).
Nach der 1. Auffrischimpfung wurden Immunantworten bei 97,6%, 99% und 98,5% der Impflinge für die Pertussis-Antigene beobachtet. Einen Monat nach der 4. Dosis waren alle seropositiv.
Immunantwort der DTPa-Komponente nach 2. Auffrischimpfung
Einen Monat nach einer Auffrischimpfung mit einer Dosis Infanrix DTPa-IPV bei Kindern zwischen 5 und 6 Jahren wiesen 100% der Kinder schützende Antikörper ≥ 0,1 IU/mL gegen Diphtherie und Tetanus auf. Die Immunantworten für die drei Pertussis-Komponenten lagen bei 95,4% (PT), 100% (FHA) und 100% (PRN).
Immunantwort der IPV-Komponente nach Grundimmunisierung und 1. Auffrischimpfung (= 4. Dosis) im 2. Lebensjahr
Einen Monat nach einer Grundimmunisierung mit drei Dosen Infanrix DTPa-IPV (im Lebensalter von 2, 4 und 6 Monaten) waren mehr als 99,5% der Kinder für die drei Serotypen (1, 2 und 3) seropositiv.
Nach Anwendung einer Boosterimpfung im zweiten Lebensjahr (13 - 24 Monate) waren alle Kinder, die zuvor grundimmunisiert wurden, für die drei Typen seropositiv.
Immunantwort der IPV-Komponente nach 2. Auffrischimpfung
Einen Monat nach einer Auffrischimpfung mit einer Dosis von Infanrix DTPa-IPV bei Kindern zwischen 5 und 6 Jahren lag die Immunantwort bei 95,8% (Serotyp 1), 95,7% (Serotyp 2) und 91,3% (Serotyp 3).
Für die Pertussis-Antigene sind keine serologischen Korrelate bezüglich der Wirkung definiert worden. Die Antikörper-Titer der drei Pertussis-Komponenten waren in allen Fällen höher als diejenigen, die nach Grundimmunisierung mit dem azellulären Pertussis-Kombinations-Impfstoff für Kinder (DTPa, Infanrix) beobachtet worden sind. Dessen Wirksamkeit ist in einer Haushaltkontaktstudie nachgewiesen worden. Basierend auf diesen Vergleichen kann angenommen werden, dass Infanrix DTPa-IPV einen Schutz gegen Pertussis bildet, obgleich der Grad und die Dauer der Wirkung durch den Impfstoff unbestimmt sind.
Klinische Wirksamkeit
Siehe unter «Pharmakodynamik».
PharmakokinetikEine Beurteilung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische DatenNicht zutreffend.
Sonstige HinweiseInkompatibilitäten
Infanrix DTPa-IPV darf nicht mit anderen Impfstoffen in derselben Spritze gemischt werden, mit Ausnahme von Hiberix.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren.
Nicht einfrieren! Einmal gefrorener Impfstoff ist zu verwerfen.
Nach Lagerung können ein weisser Niederschlag und ein klarer Überstand beobachtet werden.
Hinweise für die Handhabung
Der Impfstoff soll vor Gebrauch gut geschüttelt werden, um eine homogene, weisslich-trübe Suspension zu erhalten. Zudem soll er vor Gebrauch visuell auf Fremdpartikel und/oder Veränderungen im Aussehen kontrolliert werden. Im Falle einer Veränderung ist der Impfstoff zu verwerfen.
Gebrauchsanweisung für die Fertigspritze:
|
|
|
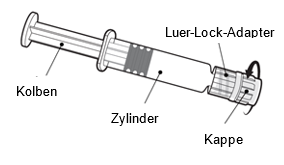
Halten Sie die Spritze am Zylinder, nicht am Kolben.
Schrauben Sie die Spritzenkappe ab, indem Sie sie gegen den Uhrzeigersinn drehen.
| |
|
|
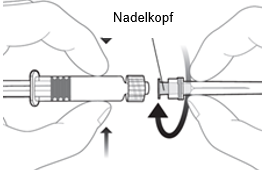
Um die Nadel an der Spritze anzubringen, verbinden Sie den Nadelkopf mit dem Luer-Lock-Adapter und drehen Sie die Nadel eine Vierteldrehung im Uhrzeigersinn, bis Sie spüren, dass sie einrastet.
Ziehen Sie den Spritzenkolben nicht aus dem Zylinder heraus. Sollte dies geschehen, verabreichen Sie den Impfstoff nicht.
|
Nicht verwendeter Impfstoff und Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer00638 (Swissmedic)
PackungenPackung mit einer Fertigspritze und separat beigelegter Nadel [B].
ZulassungsinhaberinGlaxoSmithKline AG, 3053 Münchenbuchsee
Stand der InformationJuli 2023
|


