Eigenschaften/WirkungenATC-Code
A10BJ02
Wirkungsmechanismus
Liraglutide ist ein Analogon des humanen Glucagon-ähnlichen Peptids 1 (GLP-1) mit 97-prozentiger Homologie zu humanem GLP-1, das an den GLP-1-Rezeptor bindet und diesen aktiviert. Der GLP-1-Rezeptor ist der Zielrezeptor des nativen GLP-1, eines endogenen Inkretinhormons, das die glucoseabhängige Insulinsekretion aus den Betazellen des Pankreas verstärkt. Im Gegensatz zu nativem GLP-1 besitzt Liraglutide beim Menschen ein pharmakokinetisches und pharmakodynamisches Profil, das sich für eine einmal tägliche Verabreichung eignet. Die protrahierte Wirkung nach subkutaner Applikation beruht auf drei Mechanismen: Selbstassoziation, die mit verlangsamter Resorption einhergeht, Albuminbindung und enzymatische Stabilität gegenüber den Enzymen DPP-IV und NEP, die eine lange Halbwertszeit im Plasma zur Folge hat.
Die Wirkung von Liraglutide wird durch eine spezifische Interaktion mit GLP-1-Rezeptoren vermittelt, die zu einem Anstieg der cAMP-Konzentration führt. Liraglutide stimuliert die Insulinsekretion glucoseabhängig. Gleichzeitig dämpft Liraglutide ebenfalls glucoseabhängig eine überhöhte Glucagonsekretion. Bei hohem Blutzuckerspiegel wird demnach die Insulinsekretion stimuliert und die Glucagonsekretion vermindert. Umgekehrt reduziert Liraglutide bei Hypoglykämie die Insulinsekretion und lässt die Glucagonsekretion unbeeinträchtigt. Der Mechanismus der Blutzuckersenkung beinhaltet ausserdem eine geringe Verzögerung der Magenentleerung. Liraglutide führt über Mechanismen, die eine Verminderung des Hungergefühls und der Energieaufnahme umfassen, zu einer Abnahme des Körpergewichts und der Körperfettmasse.
GLP-1 ist ein physiologischer Regulator von Appetit und Nahrungsaufnahme. GLP-1-Rezeptoren (GLP-1R) kommen in verschiedenen Hirnregionen vor, die an der Appetitregulation beteiligt sind. Tierexperimentelle Studien zeigten, dass Liraglutide nach peripherer Verabreichung in Hirnregionen aufgenommen wird, die an der Regulation des Appetits beteiligt sind, wie z.B. den Hypothalamus. Die Aktivierung von GLP-1-Rezeptoren in diesen Hirnarealen verstärkte die Sättigung, verringerte Hungersignale und induzierte letztlich eine Abnahme des Körpergewichts.
GLP-1-Rezeptoren kommen auch an spezifischen Stellen im Herz, im Gefässsystem, im Immunsystem und in den Nieren vor. Humane und tierexperimentelle Studien haben aufgezeigt, dass eine Aktivierung dieser Rezeptoren mit Liraglutide kardiovaskuläre und mikrovaskuläre Wirkungen haben kann, einschliesslich einer Entzündungsminderung. In tierexperimentellen Studien hemmte Liraglutide die Entwicklung der Atherosklerose. Im Zielgewebe (Aorta) konnten keine GLP-1R festgestellt werden. Aus diesem Grund ist von einer indirekten Wirkung von Liraglutide auszugehen.
Pharmakodynamik
Liraglutide verfügt über eine Wirkdauer von 24 Stunden. Es verbessert durch eine Senkung des postprandialen und Nüchternblutzuckers die Blutzuckerkontrolle bei Patienten mit Diabetes mellitus Typ 2.
Klinische Wirksamkeit
Im Rahmen von 5 zur Beurteilung der Wirkungen von Victoza auf die Blutzuckerkontrolle durchgeführten doppelblinden, kontrollierten klinischen Sicherheits- und Wirksamkeitsstudien wurden 3'992 Patienten mit Typ 2 Diabetes mellitus randomisiert. Die Behandlung mit Liraglutide führte zu klinisch und statistisch signifikanten Verbesserungen des HbA1c, der Nüchternplasmaglucose (NPG) und der postprandialen Glucose (PPG) gegenüber Placebo.
An diesen Studien nahmen 3'978 exponierte Probanden teil (davon wurden 2'501 mit Liraglutide behandelt), 53.7 % waren männlich und 46.3 % weiblich. 797 Patienten waren ≥65 Jahre alt (davon wurden 508 mit Victoza behandelt); 113 Patienten waren ≥75 Jahre alt (davon wurden 66 mit Victoza behandelt).
Ausserdem wurde eine grosse Studie zu kardiovaskulären Endpunkten (LEADER Studie) mit Liraglutide bei 9'340 Patienten mit Diabetes mellitus Typ 2 und hohem kardiovaskulärem Risiko durchgeführt.
Blutzuckerkontrolle
Monotherapie
Patienten, die zuvor entweder mit Diät und Bewegung oder OAD-Monotherapie in submaximaler Dosis behandelt wurden, zeigten bei einer 52-wöchigen Monotherapie mit Liraglutide 1.2 mg bzw. 1.8 mg eine stärkere Senkung des HbA1c-Werts als bei Monotherapie mit Glimepiride 8 mg (mittlere Differenz [95 % CI] für 1.2 mg -0.33 [-0.53, -0.13] und für 1.8 mg -0.62 [-0.83, -0.42]).
Tabelle 2: Liraglutide klinische Phase 3a Studien in Monotherapie (52 Wochen) und in Kombination mit oralen Antidiabetika (26 Wochen)
|
|
N
|
Mitterer HbA1c (%) bei Baseline
|
Mittlere Veränderung des HbA1c seit Baseline (%)
|
Patienten (%), die
HbA1c <7 % erreichten
|
Mittleres Gewicht bei Baseline (kg)
|
Mittlere Veränderung des Gewichts seit Baseline (kg)
| |
Monotherapie
| |
Liraglutide 1.2
|
251
|
8.18
|
-0.84
|
42.806
58.38
|
92.1
|
-2.05
| |
Liraglutide 1.8
|
246
|
8.19
|
-1.14
|
50.96
62.08
|
92.6
|
-2.45
| |
Glimepiride1
|
248
|
8.23
|
-0.51
|
27.86
30.88
|
93.3
|
1.12
| |
Add-on zu Metformin2
| |
Liraglutide 1.2
|
240
|
8.3
|
-0.97
|
35.36
52.87
|
88.5
|
-2.58
| |
Liraglutide 1.8
|
242
|
8.4
|
-1.00
|
42.46
66.37
|
88.0
|
-2.79
| |
Placebo
|
121
|
8.4
|
0.09
|
10.86
22.57
|
91.0
|
-1.51
| |
Glimepiride3
|
242
|
8.4
|
-0.98
|
36.36
56.07
|
89.0
|
0.95
| |
Add-on zu Glimepiride3
| |
Liraglutide 1.2
|
228
|
8.5
|
-1.08
|
34.56
57.47
|
80.0
|
0.32
| |
Liraglutide 1.8
|
234
|
8.5
|
-1.13
|
41.66
55.97
|
83.0
|
-0.23
| |
Placebo
|
114
|
8.4
|
0.23
|
7.56
11.87
|
81.9
|
-0.10
| |
Rosiglitazone4
|
231
|
8.4
|
-0.44
|
21.96
36.17
|
80.6
|
2.11
| |
Add-on zu Metformin2+Rosiglitazone5
| |
Liraglutide 1.2
|
177
|
8.48
|
-1.48
|
57.56
|
95.3
|
-1.02
| |
Liraglutide 1.8
|
178
|
8.56
|
-1.48
|
53.76
|
94.9
|
-2.02
| |
Placebo
|
175
|
8.42
|
-0.54
|
28.16
|
98.5
|
0.60
| |
Add-on zu Metformin2+Glimepiride3
| |
Liraglutide 1.8
|
230
|
8.3
|
-1.33
|
53.16
|
85.8
|
-1.81
| |
Placebo
|
114
|
8.3
|
-0.24
|
15.36
|
85.4
|
-0.42
| |
Insulin Glargine9
|
232
|
8.1
|
-1.09
|
45.86
|
85.2
|
1.62
| |
Add-on zu SGLT2i10 ± Metformin (≥1500 mg/Tag)
| |
Liraglutide 1.8
|
203
|
8.00
|
-1.02
|
54.8
|
91.0
|
-2.92
| |
Placebo
|
100
|
7.96
|
-0.28
|
13.9
|
91.4
|
-2.06
|
1 Glimepiride 8 mg/Tag;
2 Metformin 2'000 mg/Tag;
3 Glimepiride 4 mg/Tag;
4 Rosiglitazone 4 mg/Tag,
5 Rosiglitazone 4 mg zweimal pro Tag
6 alle Patienten;
7 vorangegangene Behandlung mit OAD-Monotherapie;
8Patienten, die vorab mit Diät behandelt wurden
10Victoza wurde als add-on zu SGLT2i in allen genehmigten Dosierungen untersucht
9 die Dosierung von Insulin Glargine erfolgte unverblindet und gemäss der Richtlinie zur Titration von Insulin Glargine. Die Dosistitration von Insulin Glargine wurde vom Patienten nach Anweisung des Prüfarztes durchgeführt:
Richtlinie zur Titration von Insulin Glargine
|
Selbst gemessene Nüchtern-Plasma-Glucose
|
Erhöhung der Dosis von Insulin Glargine (I.E.)
| |
≤5.5 mmol/l (≤100 mg/dl) Zielwert
|
Keine Anpassung
| |
≥5.5 und <6.7 mmol/l (>100 und <120 mg/dl)
|
0–2 I.E.a
| |
≥6.7 mmol/l (≥120 mg/dl)
|
2 I.E.
|
a Entsprechend der individuellen Empfehlung des Studienarztes beim vorangegangenen Besuch, beispielsweise abhängig davon, ob der Proband eine Hypoglykämie hatte.
Eine 26-wöchige Kombinationstherapie mit Victoza und Metformin, einem Sulfonylharnstoff oder Metformin und einem Thiazolidindion oder SGLT2i ± Metformin bewirkte gegenüber Placebo eine statistisch signifikante und anhaltende HbA1c-Senkung (p <0.0001).
Die Wirksamkeit von Victoza 0.6 mg wurde ausserdem in Kombination mit einem Sulfonylharnstoff oder Metformin geprüft und erwies sich als überlegen im Vergleich zu Placebo, jedoch geringer als die anderen Victoza-Dosisstärken von 1.2 mg und 1.8 mg.
In Patienten, bei denen keine ausreichende Blutzuckerkontrolle mit Victoza und Metformin erreicht wurde, resultierte die Zugabe von Insulin Detemir in einer verbesserten Wirksamkeit verglichen mit Victoza und Metformin alleine nach einer 26-wöchigen Behandlung (geschätzte Behandlungsdifferenz von -0.52 % bezüglich HbA1c (Tabelle 3)).
Tabelle 3: Resultate einer 12 + 26-wöchigen Studie, bei der Insulin Detemir zu Liraglutide und Metformin hinzugegeben wurde in Patienten, die keine ausreichende Blutzuckerkontrolle (HbA1c <7.0 %) nach einer 12-wöchigen Run-in-Phase mit Liraglutide erreichten.
Die Studie schloss anfänglich 988 Patienten in der Run-in-Phase ein. Die Patienten, die zuvor mit Metformin und Sulfonylharnstoff behandelt wurden, wurden angewiesen die Sulfonylharnstoffbehandlung abzubrechen, aber alle Patienten setzten ihre bisherige Metforminbehandlung fort. Nach der Run-in-Phase erreichten 498 Patienten (61 % der Absolventen 988 Patienten) einen HbA1c Zielwert von <7 % mit Liraglutide und Metformin und diese setzten daher die Behandlung in einem «nicht-randomisierten» Arm fort, während die übrigen 323 Patienten (39 %) mit einem HbA1c ≥7 % randomisiert wurden, um entweder die Therapie unverändert mit Liraglutide 1.8 mg und Metformin als Kontrolle (n = 161) fortzusetzen oder eine zusätzliche Intensivierung mit Insulin Detemir als Zusatztherapie (n = 162) zu erhalten.
|
Insulin Detemir als Zusatztherapie
| |
|
Patienten, die einen HbA1c Zielwert1 nach 12 Wochen Therapie mit Liraglutide und Metformin erreichen
|
Patienten, die den HbA1c Zielwert1 nach 12 Wochen Therapie mit Liraglutide und Metformin nicht erreichen
| |
Nicht-randomisierte kontinuierliche Therapie
|
Randomisiert + Insulin Detemir
|
Randomisierte Kontrollgruppe
| |
N (exponiert)
|
498
|
162
|
161
| |
HbA1c (%)
| |
Woche -12 (Mittelwert)
|
7.72
|
8.2
|
8.3
| |
Run-in-Beginn2
Woche 0 (Mittelwert)
|
6.4
|
7.6
|
7.6
| |
Veränderung vom HbA1c von Woche 0 zur Woche 26
(randomisierte Phase)
|
+0.2
|
-0.53
|
-0.13
| |
Patienten, bei denen ein HbA1c-Wert <7 % erreicht wurde
| |
Insulin Dosis (Mittelwert in Woche 38)
|
|
39 E
|
| |
Körpergewicht (kg)
| |
Woche -12 (Mittelwert)
|
99.0 kg
|
99.5 kg
|
98.8 kg
| |
Run-in-Beginn2
Woche 0 (Mittelwert)
|
94.65 kg
|
95.97 kg
|
95.34 kg
| |
Veränderung vom Körpergewicht von Woche 0 zur Woche 26
(randomisierte Phase)
|
-0.45 kg
|
-0.5 kg3
|
-1.24 kg3
|
1 HbA1c <7 %
2 (Bei Eintritt in die Run-in-Phase wurden alle Patienten von Metformin + Sulfonylharnstoff + Liraglutide 1.8 mg umgestellt oder erhielten Liraglutide 1.8 mg als Zusatztherapie zu Metformin für 12 Wochen. Bei beiden Szenarien blieb die Metforminbehandlung unverändert ≥1'500 mg/Tag.)
3 Die Schätzungen sind von einem ANCOVA-Modell mit einer Behandlung, früherer OAD und Land als fixer Effekt und den Ausgangswert als Kovariate
Anteil der Patienten, bei denen eine adäquate HbA1c-Senkung erreicht wurde
Unter Liraglutide allein erreichte ein statistisch signifikant höherer Anteil der Patienten (1.8 mg p <0.0001, 1.2 mg p = 0.0007) nach 52 Wochen einen HbA1c-Wert von ≤7 %, als dies bei mit Glimepiride behandelten Patienten der Fall war.
Eine Kombinationstherapie mit Victoza und Metformin, einem Sulfonylharnstoff, einem Thiazolidindion oder SGLT2i ± Metformin führte nach 26 Wochen im Vergleich zur monotherapeutischen Anwendung dieser Arzneimittel bei einem statistisch signifikant höheren Anteil der Patienten zum Erreichen eines HbA1c ≤6.5 % (p ≤0.0001).
Bei Patienten, die keine adäquate Blutzuckerkontrolle mit Victoza + Metformin erreichten, war der Anteil derer, die einen HbA1c Zielwerte von <7 % und ≤6.5 % erreichten, statistisch signifikant höher bei einer Behandlung mit Insulin Detemir + Liraglutide 1.8 mg + Metformin als bei einer Behandlung mit Liraglutide 1.8 mg + Metformin, (p ≤0.0001/p = 0.0016).
Nüchternplasmaglucose
Die Behandlung mit Victoza als Monotherapie und in Kombination mit einem oder zwei oralen Antidiabetika bewirkte eine Senkung der Nüchternplasmaglucose um 0.72–2.42 mmol/l (13–43.5 mg/dl) bereits innerhalb der ersten beiden Behandlungswochen.
Postprandiale Glucose
Victoza reduziert die postprandialen Glucosespiegel nach allen drei Hauptmahlzeiten um 1.68–2.71 mmol/l (31–49 mg/dl).
Betazellfunktion
Klinische Studien mit Victoza weisen auf eine verbesserte Betazellfunktion hin. Dabei wurden Messungen wie das homeostasis model assessment for beta-cell function (HOMA-B) und das Verhältnis von Proinsulin zu Insulin zugrunde gelegt. Nach 52-wöchiger Behandlung mit Victoza wurde bei einer Subgruppe von Patienten mit Diabetes mellitus Typ 2 (n = 29) eine Verbesserung von erster und zweiter Phase der Insulinausschüttung nachgewiesen.
Körpergewicht
Victoza alleine und in Kombination mit Metformin, Metformin und einem Sulfonylharnstoff oder Metformin und einem Thiazolidindion war über die Dauer der Studien mit einer nachhaltigen Gewichtsabnahme von 1.0 bis 2.8 kg verbunden.
Die Gewichtsreduktion fiel umso stärker aus, je höher der Body-Mass-Index (BMI) bei Studienbeginn war.
Der Gewichtsverlust, der in Patienten beobachtet wurde, die mit Liraglutide in Kombination mit Metformin behandelt wurden, blieb nach Hinzugabe von Insulin Detemir erhalten.
Kardiovaskuläres Risiko
Die LEADER (Liraglutide Effect and Action in Diabetes Evaluation of Cardiovascular Outcome Results) Studie ist eine randomisierte, multizentrische, doppelblinde klinische Studie, in welcher 9'340 Patienten mit Liraglutide (4'668) oder Placebo (4'672) zusätzlich zur vorbestehenden Therapie zur Senkung des Blutzuckers und kardiovaskulärer (CV) Risikofaktoren behandelt wurden. Die antihyperglykämische Behandlung und weitere kardiovaskuläre Begleitmedikationen konnten während der gesamten Studie gemäss Behandlungsstandard angepasst werden. Ausgeschlossen davon war der Einsatz alternativer Inkretin-basierter Therapien. Eingeschlossen wurden Patienten mit Typ 2 Diabetes mellitus, die 50 Jahre oder älter waren und eine manifeste kardiovaskuläre Erkrankung aufwiesen sowie Patienten ohne kardiovaskuläre Vorerkrankung, wenn diese 60 Jahre oder älter waren und mindestens einen kardiovaskulären Risikofaktor aufwiesen. Patienten mit einem akuten koronaren oder zerebrovaskulären Ereignis in den letzten 14 Tagen waren von der Studie ausgeschlossen. Die Beobachtungsdauer betrug mindestens 3.5 Jahre (maximal 5 Jahre). Die Studienpopulation umfasste Patienten mit leichter (n=3'907), moderater (n=1'934) oder schwerer (n=224) Nierenfunktionsstörung. Das mittlere Alter betrug 64 Jahre (4'329 Patienten ≥65 Jahren, 836 Patienten ≥75 Jahre), der mittlere BMI 32.5 kg/m² und die mittlere Dauer des Diabetes 12.8 Jahre.
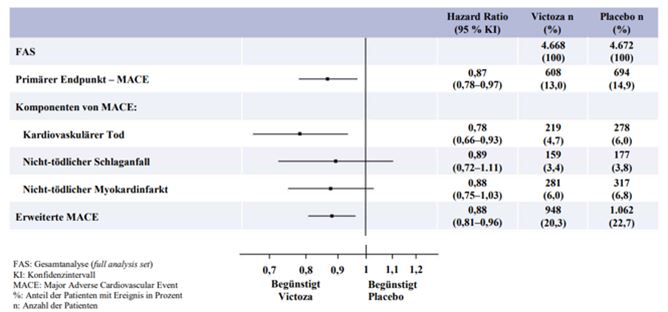
Der primäre Endpunkt war die Zeit von der Randomisierung bis zum ersten Auftreten eines zusammengesetzten kardiovaskulären Endpunkts (3-Punkt MACE) bestehend aus kardiovaskulärem Tod, nicht-tödlichem Myokardinfarkt und nicht-tödlichem Schlaganfall. Liraglutide reduzierte im Vergleich zu Placebo das Risiko für das Auftreten des MACE signifikant (Abbildung 1). Diese Risikoreduktion war konsistent für alle Komponenten des Primärendpunkts (Abbildung 2). Liraglutide verlängerte auch die Zeit bis zum Auftreten eines erweiterten MACE, welcher zusätzlich Fälle einer koronaren Revaskularisation, einer Hospitalisierung aufgrund von instabiler Angina pectoris oder Herzinsuffizienz einschloss.
Abbildung 1: Kaplan-Meier-Plot der Zeit bis zum ersten schwerwiegenden unerwünschten kardiovaskulären Ereignis (MACE) – FAS-Population
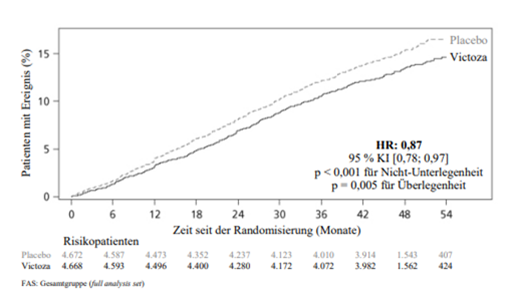
Abbildung 2: Forest Plot der Analysen einzelner Arten kardiovaskulärer Ereignisse – FAS-Population

Ungeachtet einer Therapie gemäss Behandlungsstandard in beiden Armen zeigten Patienten im Liraglutide-Arm im Vergleich zu Placebo bis einschliesslich Monat 36 eine überlegene glykämische Kontrolle (geschätzte Therapiedifferenz [ETD] -0.40 % [-0.45; -0.34]) und bessere Reduktion des Körpergewichts (ETD -2.26 [-2.54; -1.99]). Post hoc Cox-Regressionsanalysen weisen darauf hin, dass diese Unterschiede allein nicht für die Reduktion des kardiovaskulären Risikos verantwortlich waren. Die Notwendigkeit einer Initiierung der Insulinbehandlung wurde unter Liraglutide bei Patienten, die zu Studienbeginn Insulin-naiv waren, im Vergleich zu Placebo um 48 % vermindert (HR 0.52 [0.48; 0.57]).
Blutdruck und Herzfrequenz
Im Verlauf der Phase-3a-Studien verminderte Liraglutide den systolischen Blutdruck ab der Baseline im Durchschnitt um 2.3 bis 6.7 mmHg, gegenüber dem Vergleichsprodukt betrug die Verminderung 1.9 bis 4.5 mmHg. In der LEADER Studie wurde nach 36 Monaten der systolische Blutdruck mit Liraglutide im Vergleich zu Placebo reduziert (-1.4 mmHg vs. -0.2 mmHg; ETD: -1.29 mmHg [-1.92; -0.48]), während der diastolische Blutdruck unter Liraglutide im Vergleich zu Placebo weniger stark vermindert wurde (-0.8 mmHg vs. -1.4 mmHg, ETD: 0.59 [0.19; 0.99]). Ein mittlerer Anstieg der Herzfrequenz im Vergleich zur Baseline von 2 bis 3 Schlägen pro Minute wurde mit Liraglutide in langfristigen klinischen Studien, einschliesslich LEADER, beobachtet. In der LEADER Studie wurde keine langfristige Auswirkung der erhöhten Herzfrequenz auf das Risiko kardiovaskulärer Ereignisse beobachtet.
Mikrovaskuläre Beurteilung
In der LEADER Studie umfassten mikrovaskuläre Ereignisse die Nephropathie und Retinopathie. Die Analyse der Zeit bis zum ersten mikrovaskulären Ereignis unter Liraglutide im Vergleich zum Placebo wies eine HR von 0.84 [0.73, 0.97] auf. Die HR für Liraglutide vs. Placebo betrug 0.78 [0.67, 0.92] hinsichtlich der Zeit bis zum ersten Auftreten der Nephropathie und 1.15 [0.87, 1.52] bis zum ersten Auftreten der Retinopathie.
Die geschätzte Therapiedifferenz für die Veränderung der Albumin/Kreatinin-Ausscheidung mit dem Urin von der Baseline bis Monat 36 betrug 0.81 [0.76, 0.86].
Pädiatrische Population
In einer doppelblinden Studie mit Jugendlichen und Kindern ab 10 Jahren mit Typ-2-Diabetes, die die Wirksamkeit und Sicherheit von Victoza 1.8 mg im Vergleich zu Placebo als Zusatz zu Metformin ± Insulin verglich, war Victoza der Behandlung mit Placebo hinsichtlich der Senkung des HbA1c nach 26 Wochen überlegen (-1.06, [-1.65, -0.46]). Die Behandlungsdifferenz hinsichtlich des HbA1c betrug 1.3 % nach einer unverblindeten Verlängerung von zusätzlich 26 Wochen und bestätigte die anhaltende glykämische Kontrolle von Victoza.
Das Wirksamkeits- und Sicherheitsprofil von Victoza war vergleichbar mit dem, welches bei mit Victoza behandelten Erwachsenen beobachtet wurde. Basierend auf einer adäquaten glykämischen Kontrolle oder Verträglichkeit verblieben 30 % der Probanden bei einer Dosis von 0.6 mg, 17 % steigerten die Dosis auf 1.2 mg und 53 % steigerten die Dosis auf 1.8 mg.
Weitere klinische Daten
Victoza verbesserte die mittels HOMA-IR gemessene Insulinsensitivität im Vergleich zu einer Sulfonylharnstoff-Therapie über einen Zeitraum von 52 Wochen.
Entsprechend den potentiell immunogenen Eigenschaften von protein- und peptidhaltigen Arzneimitteln können Patienten während der Behandlung mit Victoza gegen Liraglutide gerichtete Antikörper bilden. Im Durchschnitt bildeten 8.6 % der Patienten Antikörper. Die Antikörperbildung ist nicht mit einer Minderung der Wirksamkeit von Victoza verbunden.
Patienten mit Nierenfunktionsstörungen
In einer doppelblinden Studie, in der die Wirksamkeit und Sicherheit von Liraglutide 1.8 mg, zusätzlich zu Insulin und/oder oralen Antidiabetika (OAD) gegeben, bei Patienten mit Typ 2 Diabetes und moderater Nierenfunktionsstörung gegen Placebo verglichen wurde, war Liraglutide der Placebo-Behandlung hinsichtlich der Reduktion des HbA1c-Wertes nach 26 Wochen (-1.05 % vs. -0.38 %, p <0.0001) überlegen. Das Risiko für hypoglykämische Episoden war in den beiden Behandlungsgruppen vergleichbar. Das Sicherheitsprofil von Liraglutide war im Allgemeinen vergleichbar mit demjenigen, das in anderen Studien mit Liraglutide beobachtet wurde.
|



