Eigenschaften/WirkungenATC-Code
A10AE06
Wirkungsmechanismus
Insulin degludec bindet spezifisch an den Humaninsulin-Rezeptor und hat die gleiche pharmakologische Wirkung wie Humaninsulin.
Die blutzuckersenkende Wirkung von Insulin degludec beruht auf der verbesserten Aufnahme von Glukose nach der Bindung des Insulins an die Insulin-Rezeptoren auf Muskel- und Fettzellen und der gleichzeitigen Hemmung der Freisetzung von Glukose aus der Leber.
Pharmakodynamik
Tresiba ist ein Basalinsulin, das nach subkutaner Injektion lösliche Multihexamere bildet, die ein Depot bilden, aus dem kontinuierlich und langsam Insulin degludec in den Blutkreislauf abgegeben wird. Dies führt zu einer flachen und stabilen blutzuckersenkenden Wirkung von Insulin degludec (siehe Abbildung 1). Während eines Zeitraums von 24 Stunden bei einmal täglicher Verabreichung war die blutzuckersenkende Wirkung von Tresiba gleichmässig zwischen dem ersten und dem zweiten 12-Stunden-Intervall verteilt (AUCGIR,0-12h,SS /AUCGIR,total,SS = 0.5).
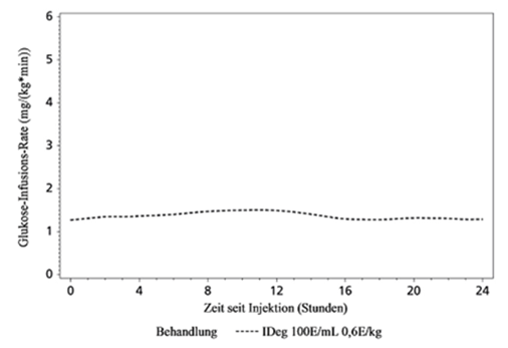
Abbildung 1: Mittlere Glukose-Infusions-Rate (GIR) – Insulin degludec im Steady-State bei Typ 2 Diabetes mellitus.
Die Wirkdauer von Tresiba beträgt innerhalb des therapeutischen Dosisbereichs über 42 Stunden (Glukose-Clamp-Studie).
Der Steady-State wird 2-3 Tage nach erster Dosisverabreichung erreicht.
Die blutzuckersenkende Wirkung von Insulin degludec im Steady-State zeigt eine niedrigere Tag-zu-Tag-Variabilität in Bezug auf die Variationskoeffizienten (VK) für die blutzuckersenkende Wirkung während eines Dosierungsintervalls mit CV% für AUCGIR,τ,SS von 20% für Insulin degludec und 82% für Insulin glargin.
Die blutzuckersenkende Wirkung von Tresiba nimmt mit zunehmender Dosierung linear zu.
Die blutzuckersenkende Wirkung von Tresiba 100 E/ml und 200 E/ml bei Verabreichung der gleichen Dosis sind vergleichbar.
Es gibt keine klinisch relevanten Unterschiede in der Pharmakodynamik von Tresiba zwischen älteren und jüngeren erwachsenen Probanden.
Klinische Wirksamkeit
Es wurden neun 26-wöchige bzw. 52-wöchige multinationale, klinische, offen kontrollierte, randomisierte, parallele Treat-to-target-Studien mit Tresiba einmal täglich mit 3815 Patienten durchgeführt (1102 mit Typ 1 Diabetes mellitus und 2713 mit Typ 2 Diabetes mellitus).
Tresiba wurde bei Patienten mit Typ 1 Diabetes mellitus (Tabelle 3), bei Insulin-naïven Patienten (Insulininitiierung bei Typ 2 Diabetes mellitus, Tabelle 4) und früheren Insulinanwendern (Insulinintensivierung bei Typ 2 Diabetes mellitus, Tabelle 5) getestet. Die Nichtunterlegenheit (non-inferiority) bei der Senkung des HbA1c vom Studienbeginn bis zum Studienende wurde in allen Studien gegenüber allen Vergleichsinsulinen bestätigt. In einer prospektiv geplanten Metaanalyse mit Patienten mit Typ 1 und Typ 2 Diabetes mellitus war Tresiba hinsichtlich der geringeren Anzahl von therapiebedingten bestätigten hypoglykämischen Episoden (aufgrund eines Vorteils bei Typ 2 Diabetes mellitus, siehe Tabelle 2) und bestätigter nächtlicher hypoglykämischer Episoden überlegen.
Tabelle 2: Hypoglykämien, Ergebnisse der Metaanalyse
|
Geschätztes Risikoverhältnis (Insulin degludec/Insulin glargin (100 E/ml))
|
Bestätigte
Hypoglykämiena
| |
Gesamt
|
Nächtlich
| |
Typ 1 + Typ 2 Diabetes mellitus (pooled)
|
0.91*
|
0.74*
| |
Erhaltungsphaseb
|
0.84*
|
0.68*
| |
Ältere Patienten ≥65 Jahre
|
0.82
|
0.65*
| |
Typ 1 Diabetes mellitus
|
1.10
|
0.83
| |
Erhaltungsphaseb
|
1.02
|
0.75*
| |
Typ 2 Diabetes mellitus
|
0.83*
|
0.68*
| |
Erhaltungsphaseb
|
0.75*
|
0.62*
| |
Alleinige Basaltherapie bei vorher Insulin-naïven Patienten
|
0.83*
|
0.64*
|
* Statistisch signifikant.
a Bestätigte Hypoglykämien wurden als Episoden definiert, die durch einen Plasmaglukosewert von <3.1 mmol/l oder dadurch bestätigt wurden, dass der Patient Fremdhilfe benötigte. Bestätigte nächtliche Hypoglykämien wurden als Episoden zwischen Mitternacht und 06:00 Uhr definiert.
b Episoden ab 16. Woche.
Tabelle 3: Ergebnisse aus offenen Typ 1 Diabetes mellitus Studien
|
|
52wöchige
Behandlung
|
26wöchige
Behandlung
| |
Tresiba1
|
Insulin glargin
(100 E/ml)1
|
Tresiba1
|
Insulin detemir1
| |
N
|
472
|
157
|
302
|
153
| |
HbA1c (%)
| |
Studienende
|
7.3
|
7.3
|
7.3
|
7.3
| |
Änderung im Mittel
|
-0.40
|
-0.39
|
-0.73
|
-0.65
| |
|
Unterschied: -0.01
[-0.14; 0.11]
|
Unterschied: -0.09
[-0.23; 0.05]
| |
Nüchternplasmaglukose (mmol/l)
| |
Studienende
|
7.8
|
8.3
|
7.3
|
8.9
| |
Änderung im Mittel
|
-1.27
|
-1.39
|
-2.60
|
-0.62
| |
|
Unterschied: -0.33
[-1.03; 0.36]
|
Unterschied: -1.66
[-2.37; -0.95]
| |
Hypoglykämie-Rate (pro Patientenjahr Expositionszeit)
| |
Schwer
|
0.21
|
0.16
|
0.31
|
0.39
| |
Bestätigt2
|
42.54
|
40.18
|
45.83
|
45.69
| |
|
Verhältnis: 1.07
[0.89; 1.28]
|
Verhältnis: 0.98
[0.80; 1.20]
| |
Bestätigt nächtlich2
|
4.41
|
5.86
|
4.14
|
5.93
| |
|
Verhältnis: 0.75
[0.59; 0.96]
|
Verhältnis: 0.66
[0.49; 0.88]
| |
Mittlere tägliche Insulindosis bei Studienende (Einheiten: Einheiten/kg)
|
61.4:0.7
|
66.2:0.8
|
60.6:0.9
|
68.9:1.0
|
1 Einmal tägliche Gabe + Insulin aspart zur Abdeckung des mahlzeitenbezogenen Insulinbedarfs.
2 Bestätigte Hypoglykämien wurden als Episoden definiert, die durch einen Plasmaglukosewert von <3.1 mmol/l oder dadurch bestätigt wurden, dass der Patient Fremdhilfe benötigte. Bestätigte nächtliche Hypoglykämien wurden als Episoden zwischen Mitternacht und 06:00 Uhr definiert.
Tabelle 4: Ergebnisse aus Typ 2 Diabetes mellitus Studien mit Insulin-naïven Patienten (Ersttherapie mit Insulin)
|
|
52wöchige
Behandlung
|
26wöchige
Behandlung
| |
Tresiba1
|
Insulin glargin
(100 E/ml)1
|
Tresiba1
|
Insulin glargin
(100 E/ml)1
| |
N
|
773
|
257
|
228
|
229
| |
HbA1c (%)
| |
Studienende
|
7.1
|
7.0
|
7.0
|
6.9
| |
Änderung im Mittel
|
-1.06
|
-1.19
|
-1.30
|
-1.32
| |
|
Unterschied: 0.09
[-0.04; 0.22]
|
Unterschied: 0.04
[-0.11; 0.19]
| |
Nüchternplasmaglukose (mmol/l)
| |
Studienende
|
5.9
|
6.4
|
5.9
|
6.3
| |
Änderung im Mittel
|
-3.76
|
-3.30
|
-3.70
|
-3.38
| |
|
Unterschied: -0.43
[-0.74; -0.13]
|
Unterschied: -0.42
[-0.78; -0.06]
| |
Hypoglykämie-Rate (pro Patientenjahr Expositionszeit)
| |
Schwer
|
0
|
0.02
|
0
|
0
| |
Bestätigt2
|
1.52
|
1.85
|
1.22
|
1.42
| |
|
Verhältnis: 0.82
[0.64; 1.04]
|
Verhältnis: 0.86
[0.58; 1.28]
| |
Bestätigt nächtlich2
|
0.25
|
0.39
|
0.18
|
0.28
| |
|
Verhältnis: 0.64
[0.42; 0.98]
|
Verhältnis: 0.64
[0.30; 1.37]
| |
Mittlere tägliche Insulindosis bei Studienende (Einheiten: Einheiten/kg)
|
56.0:0.6
|
57.8:0.6
|
59.5:0.6
|
62.7:0.7
|
1 Einmal tägliche Gabe + Metformin ± DPP-4-Inhibitor.
2 Bestätigte Hypoglykämien wurden als Episoden definiert, die durch einen Plasmaglukosewert von <3.1 mmol/l oder dadurch bestätigt wurden, dass der Patient Fremdhilfe benötigte. Bestätigte nächtliche Hypoglykämien wurden als Episoden zwischen Mitternacht und 06:00 Uhr definiert.
Tabelle 5: Ergebnisse aus Typ 2 Diabetes mellitus Studien – frühere Basalinsulin-Anwender
|
|
52wöchige Behandlung
| |
Tresiba1
|
Insulin glargin
(100 E/ml)1
| |
N
|
744
|
248
| |
HbA1c (%)
| |
Studienende
|
7.1
|
7.1
| |
Änderung im Mittel
|
-1.17
|
-1.29
| |
|
Unterschied: 0.08 [-0.05; 0.21]
| |
Nüchternplasmaglucose (mmol/l)
| |
Studienende
|
6.8
|
7.1
| |
Änderung im Mittel
|
-2.44
|
-2.14
| |
|
Unterschied: -0.29 [-0.65; 0.06]
| |
Hypoglykämie-Rate (pro Patientenjahr Expositionszeit)
| |
Schwere Hypoglykämie
|
0.06
|
0.05
| |
Bestätigt2
|
11.09
|
13.63
| |
|
Verhältnis: 0.82 [0.69; 0.99]
| |
Bestätigt nächtlich2
|
1.39
|
1.84
| |
|
Verhältnis: 0.75 [0.58; 0.99]
| |
Mittlere tägliche Insulindosis bei Studienende (Einheiten: Einheiten/kg)
|
143.1:1.5
|
139.0:1.4
|
1 Einmal tägliche Gabe + Insulin aspart zur Abdeckung des mahlzeitenbezogenen Insulinbedarfs ± Metformin ± Pioglitazon
2 Bestätigte Hypoglykämien wurden als Episoden definiert, die durch einen Plasmaglukosewert von <3.1 mmol/l oder dadurch bestätigt wurden, dass der Patient Fremdhilfe benötigte. Bestätigte nächtliche Hypoglykämien wurden als Episoden zwischen Mitternacht und 06:00 Uhr definiert.
Ausserdem wurden zwei 64-wöchige kontrollierte, doppelt-verblindete, randomisierte, Cross-over-, Treat-to-Target-Studien mit Patienten mit mindestens einem Risikofaktor für Hypoglykämien und mit Typ 1 Diabetes mellitus (501 Patienten) oder Typ 2 Diabetes mellitus (721 Patienten) durchgeführt.
Die Patienten wurden entweder für Tresiba oder Insulin glargin (100 Einheiten/ml) mit anschliessendem Cross-over randomisiert. Die Studien werteten die Rate an Hypoglykämien nach Behandlung mit Tresiba im Vergleich zu Insulin glargin (100 Einheiten/ml) aus (siehe Tabelle 6).
Tabelle 6: Ergebnisse aus doppelt-verblindeten, Cross-over-, klinischen Studien mit Patienten mit Diabetes mellitus Typ 1 und Diabetes mellitus Typ 2
|
|
Diabetes mellitus Typ 1
|
Diabetes mellitus Typ 2
| |
Tresiba1
|
Insulin glargin
(100 E/ml)1
|
Tresiba2
|
Insulin glargin
(100 E/ml)2
| |
N
|
501
|
721
| |
HbA1c (%)
| |
Ausgangswert
|
7.6
|
7.6
| |
Behandlungsende
|
6.9
|
6.9
|
7.1
|
7.0
| |
Nüchternplasmaglucose (mmol/l)
| |
Ausgangswert
|
9.4
|
7.6
| |
Behandlungsende
|
7.5
|
8.4
|
6.0
|
6.1
| |
Rate schwerer Hypoglykämien3
| |
Erhaltungsphase4
|
0.69
|
0.92
|
0.05
|
0.09
| |
Ratio: 0.65 [0.48; 0.89]
|
Ratio: 0.54 [0.21; 1.42]
| |
Rate schwerer oder BZ bestätigter symptomatischer Hypoglykämien3,5
| |
Erhaltungsphase4
|
22.01
|
24.63
|
1.86
|
2.65
| |
Verhältnis: 0.89 [0.85; 0.94]
|
Verhältnis: 0.70 [0.61; 0.80]
| |
Rate schwerer oder BZ bestätigter symptomatischer nächtlicher Hypoglykämien 3,5
| |
Erhaltungsphase4
|
2.77
|
4.29
|
0.55
|
0.94
| |
|
Verhältnis: 0.64 [0.56; 0.73]
|
Verhältnis: 0.58 [0.46; 0.74]
|
1 Einmal tägliche Gabe + Insulin aspart zur Abdeckung des mahlzeitenbezogenen Insulinbedarfs
2 Einmal tägliche Gabe ± OADs (jegliche Kombination von Metformin, Dipeptidylpeptidase-4-Inhibitor, Alpha-Glucosidase- Inhibitor, Thiazolidindione und Natrium/Glucose-Cotransporter-2-Inhibitor)
3 Pro Patientenjahr Expositionszeit
4 Episoden ab Woche 16 in jedem Behandlungszeitraum
5 Blutzucker (BZ) bestätigte symptomatische Hypoglykämien wurden als Episoden definiert, die durch einen Plasmaglucosewert von <3.1 mmol/l, mit Symptomen von Hypoglykämien, bestätigt wurden. Nächtliche bestätigte Hypoglykämien wurden als Episoden zwischen Mitternacht und 06:00 Uhr definiert.
Kardiovaskuläre Beurteilung
Bei DEVOTE handelte es sich um eine randomisierte, doppelblinde klinische Studie, bei der die kardiovaskuläre Sicherheit von Insulin degludec mit derjenigen von Insulin glargin (100 Einheiten/ml) bei 7'637 Patienten mit Typ 2 Diabetes mellitus und hohem Risiko für kardiovaskuläre Ereignisse verglichen wurde. Die Dauer der Studie war «ereignisgesteuert», d.h., bis ≥633 Ereignisse erreicht waren. Die Behandlungsdauer betrug im Median 1.83 Jahre, die Beobachtungszeit im Median 1.99 Jahre.
Die Primäranalyse umfasste den Zeitraum von der Randomisierung bis zum ersten Auftreten eines schweren unerwünschten kardiovaskulären Ereignisses (MACE, major adverse cardiovascular event). MACE umfasste drei Komponenten: «kardiovaskulärer Tod», «nicht tödlicher Herzinfarkt» oder «nicht tödlicher Schlaganfall».
Um einen Anstieg des relativen kardiovaskulären Risikos um mehr als 30% auszuschliessen, wurde die Studie als non-inferiority-Studie konzipiert. Die Obergrenze des 95%-Konfidenzintervalls (KI) für die MACE-HR lag unter dieser vordefinierten Schwelle von 1.3, womit die kardiovaskuläre Sicherheit von Insulin degludec im Vergleich zu Insulin glargin (Abbildung 2) belegt wurde.

N: Anzahl von Probanden mit einem ersten EAC-bestätigten Ereignis während der Studie.
%: Prozentualer Anteil von Probanden mit erstem EAC-bestätigten Ereignis im Vergleich zur Anzahl der randomisierten Probanden.
EAC: Event Adjudication Committee.
CI: Konfidenzintervall.
Abbildung 2: Forest plot der Analyse des kombinierten 3-Komponenten-MACE und der einzelnen kardiovaskulären Endpunkte in DEVOTE
Die Verbesserungen des HbA1c, die mit Insulin degludec und Insulin glargin erreicht wurden, waren ebenso vergleichbar (Tabelle 7).
Die Behandlung mit Tresiba resultierte im Vergleich zur Behandlung mit Insulin glargin in einer Verringerung der Rate schwerer hypoglykämischer Ereignisse und des Anteils an Patienten mit mindestens einer schweren Hypoglykämie (Tabelle 7).
Tabelle 7: Ergebnisse aus DEVOTE
|
|
Insulin degludec1
|
Insulin glargin
(100 Einheiten/ml)1
| |
N
|
3'818
|
3'819
| |
Mittlerer HbA1c (%)
| |
Ausgangswert
|
8.44
|
8.41
| |
2 Jahre der Behandlung
|
7.50
|
7.47
| |
|
Differenz: 0.008 [-0.05; 0.07] 95% KI
| |
Hypoglykämierate (pro 100 Patientenjahre Beobachtung)
| |
Schwer
|
3.70
|
6.25
| |
|
Hazard-Ratio 0.60 [0.48; 0.76]95% KI
| |
Anteil der Patienten mit Hypoglykämie (Prozentualer Anteil der Patienten)
| |
Schwer
|
4.9
|
6.6
| |
|
Hazard-Ratio: 0.73 [0.60; 0.89] 95% KI
|
1 Zusätzlich zur Standardbehandlung gegen Diabetes und kardiovaskuläre Erkrankung.
Pädiatrische Population
Die Wirksamkeit und Sicherheit von Tresiba wurde in einer 1:1 randomisierten, kontrollierten klinischen Studie bei Kindern und Jugendlichen mit Typ-1-Diabetes mellitus für eine Zeitdauer von 26 Wochen (n = 350), mit einer anschliessenden Verlängerung von 26 Wochen (n = 280) untersucht. Der Tresiba-Arm umfasste 43 Kinder im Alter zwischen 1 und 5 Jahren, 70 Kinder im Alter zwischen 6 und 11 Jahren und 61 Jugendliche im Alter zwischen 12 und 17 Jahren. Die einmal tägliche Verabreichung von Tresiba zeigte eine ähnliche Senkung des HbA1c-Werts zum Zeitpunkt Woche 52 und eine grössere Senkung des NBZ-Werts (im Vergleich zur Ausgangssituation) gegenüber der Vergleichsmedikation Insulin detemir, das ein- oder zweimal täglich verabreicht wurde. Dies wurde mit einer 30% niedrigeren Tagesdosis an Tresiba im Vergleich zu Insulin detemir erreicht. Die Raten (Ereignisse pro Patientenjahr der Exposition) schwerer Hypoglykämien (ISPAD-Definition; 0.51 versus 0.33), bestätigter Hypoglykämien (57.71 versus 54.05) und nächtlicher bestätigter Hypoglykämien (6.03 versus 7.60) waren unter Tresiba und Insulin detemir vergleichbar. In beiden Behandlungsgruppen wiesen Kinder im Alter von 6-11 Jahren eine zahlenmässig höhere Rate bestätigter Hypoglykämien als in den anderen Altersgruppen auf. Eine zahlenmässig höhere Rate schwerer Hypoglykämien wurde bei Kindern im Alter von 6-11 Jahren im Tresiba-Studienarm beobachtet.
Die Rate hyperglykämischer Episoden mit Ketose war unter Tresiba niedriger als unter Insulin detemir, mit jeweils 0.68 versus 1.09. Unter Tresiba wurden keine Sicherheitsbedenken hinsichtlich unerwünschter Ereignisse und standardisierter Sicherheitsparameter festgestellt. Die Entwicklung von Antikörpern war geringfügig und hatte keine klinische Auswirkung.
Tierexperimentelle Untersuchungen zur Fortpflanzung unter Insulin degludec haben keinerlei nachteilige Auswirkungen auf die Fruchtbarkeit gezeigt.
Schwangerschaft
Eine offene, randomisierte klinische Studie (EXPECT) verglich die beiden Basalinsuline, Insulin degludec (92 Frauen) und Insulin detemir (96 Frauen), hinsichtlich ihrer Wirksamkeit und Sicherheit bei Patientinnen mit Diabetes mellitus Typ 1, welche eine Schwangerschaft planten bzw. bereits schwanger waren. Alle Studienteilnehmerinnen erhielten im Rahmen eines Basal-Bolus-Behandlungsschemas zusätzlich Insulin Aspart.
Insulin degludec war Insulin detemir in der blutzuckersenkenden Wirkung nicht unterlegen (siehe Tabelle 8).
Tabelle 8: Ergebnisse der offenen, randomisierten, aktiv kontrollierten klinischen Studie bei schwangeren Frauen mit Diabetes mellitus Typ 1
|
|
Tresiba®
|
Insulin detemir
| |
Vollständiges Analyseset für schwangere Frauen (N)
|
92
|
96
| |
HbA1c (%) als Ausgangswert zu Behandlungsbeginn
| |
N
|
87
|
90
| |
Mittelwert (SD)
|
6.73 (0.65)
|
6.56 (0.77)
| |
HbA1c (%) bei der letzten geplanten Visite vor der Entbindung
| |
N
|
84
|
84
| |
Mittelwert (SD)
|
6.30 (0.70)
|
6.26 (0.73)
| |
Geschätzter Behandlungsunterschied
|
–0.11 Prozentpunkte [–0.31; 0.08] 95 %-KI; p < 0.0001
| |
HbA1c ≤6.0 % – im Schwangerschaftsabschnitt während der Studienteilnahme – Ausgangswert zu Behandlungsbeginn
| |
N
|
87
|
90
| |
Prozentsatz der Teilnehmerinnen
|
12.6
|
28.9
| |
HbA1c ≤6.0 % – im Schwangerschaftsabschnitt während der Studienteilnahme – bei der letzten geplanten Visite vor der Entbindung
| |
N
|
84
|
84
| |
Prozentsatz der Teilnehmerinnen
|
42.9
|
36.9
| |
Geschätzte Odds Ratio
|
1.95 [0.92; 4.17] 95 %-KI, p = 0.0832
| |
HbA1c ≤6.5 % – im Schwangerschaftsabschnitt während der Studienteilnahme – Ausgangswert zu Behandlungsbeginn
| |
N
|
87
|
90
| |
Prozentsatz der Teilnehmerinnen
|
39.1
|
45.6
| |
HbA1c ≤6.5 % – im Schwangerschaftsabschnitt während der Studienteilnahme – bei der letzten geplanten Visite vor der Entbindung
| |
N
|
84
|
84
| |
Prozentsatz der Teilnehmerinnen
|
69.0
|
63.1
| |
Geschätzte Odds Ratio
|
2.05 [0.97; 4.33] 95 %-KI, p = 0.0617
|
Die EXPECT Studie zeigte hinsichtlich der maternalen Sicherheitsendpunkte (Hypoglykämie, Frühgeburt, Präeklampsie, ungeplanter Kaiserschnitt und unerwünschte Ereignisse während der Schwangerschaft) keine gravierenden Unterschiede zwischen Insulin degludec und Insulin detemir. Eine Präeklampsie trat bei 12 (13.2%) bzw. 7 (7.4%) Personen auf, die mit Insulin degludec bzw. mit Insulin detemir behandelt wurden. Zu einem nicht geplanten Kaiserschnitt kam es bei 23 (25.3%) bzw. 15 (16.0%) Patientinnen, die mit Insulin degludec bzw. mit Insulin detemir behandelt wurden. Eine endgültige Bewertung dieser Unterschiede ist aufgrund des geringen Umfangs der Studienpopulation schwierig. Die Mehrzahl der in beiden Gruppen gemeldeten unerwünschten Ereignisse war nicht schwerwiegend und stand wahrscheinlich nicht im Zusammenhang mit dem Prüfpräparat.
Es wurde kein perinataler oder neonataler Tod berichtet. Hinsichtlich der Schwangerschaftsendpunkte (früher Tod des Fetus, Vorhandensein grösserer Anomalien, neonatale Hypoglykämie, perinatale Mortalität, neonatale Mortalität, Makrosomie des Fetus, Grosswuchs bezogen auf das Gestationsalter und unerwünschte Ereignisse beim Säugling in den ersten 30 Tagen nach der Geburt) wurden keine klinisch relevanten Unterschiede zwischen Insulin degludec und Insulin detemir festgestellt.
Die Anwendung von Tresiba wurde in einer prospektiven, nicht-interventionellen Nachzulassungssicherheitsstudie (EVOLVE) bei einer kleinen Untergruppe von schwangeren Frauen (n=41) untersucht. Die Ergebnisse dieser Studie stützen den Einsatz von Tresiba bei schwangeren Diabetikerinnen, da während der Studie keine Sicherheitsrisiken beobachtet wurden.
| 

