ZusammensetzungWirkstoffe
Insulin Degludec*/Insulin Aspart* (70% lösliches Insulin Degludec und 30% lösliches Insulin Aspart), das entspricht 2.56 mg salz- und wasserfreiem Insulin Degludec und 1.05 mg salz- und wasserfreiem Insulin Aspart.
* gentechnisch hergestellt aus rekombinanter DNS in Saccharomyces cerevisiae
Hilfsstoffe
Glycerol, Natriumchlorid, Zinkacetat, Wasser für Injektionszwecke. Conserv.: Metacresol 1.72 mg/ml, Phenol 1.50 mg/ml
Indikationen/AnwendungsmöglichkeitenDiabetes mellitus Typ 1 bei Erwachsenen, Jugendlichen und Kindern ab dem Alter von 2 Jahren.
Diabetes mellitus Typ 2 bei Erwachsenen sofern eine Insulinbehandlung notwendig ist.
Dosierung/AnwendungRyzodeg ist ein lösliches Insulinpräparat, bestehend aus dem lang wirkenden Basalinsulin Degludec und dem rasch wirkenden Mahlzeiteninsulin Aspart.
Ryzodeg wird ein- oder zweimal täglich subkutan zu den Hauptmahlzeiten verabreicht.
Die Wirksamkeit von Insulinanaloga, einschliesslich Ryzodeg, wird in Einheiten (E) angegeben. Eine Einheit IDegAsp entspricht einer Internationalen Einheit (IE) Humaninsulin und einer Einheit aller anderen Insulinanaloga.
Bei Patienten mit Typ 2 Diabetes mellitus kann Ryzodeg sowohl alleine als auch in Kombination mit oralen Antidiabetika (OAD), die zur Anwendung mit Insulin zugelassen sind und zusammen mit Bolus-Insulin verabreicht werden (siehe unter «Eigenschaften/Wirkungen»).
Bei Patienten mit Typ 1 Diabetes mellitus wird Ryzodeg mit kurz/rasch wirkendem Insulin zu den verbleibenden Mahlzeiten kombiniert.
Dosisanpassung
Ryzodeg wird gemäss dem individuellen Bedarf des Patienten dosiert. Es wird empfohlen, Dosisanpassungen in erster Linie anhand des Nüchternblutzuckers vorzunehmen.
Wie bei allen Insulinpräparaten kann eine Dosisanpassung bei erhöhter körperlicher Aktivität, Änderung der Ernährungsgewohnheiten oder Begleiterkrankungen notwendig sein.
Wenn Ryzodeg einmal täglich angewendet wird, sollte eine Umstellung auf eine zweimal tägliche Gabe in Betracht gezogen werden, sobald höhere Dosen erforderlich sind, um z.B. Hypoglykämien zu vermeiden. Die Dosis sollte basierend auf dem individuellen Bedarf des Patienten aufgeteilt und zu Hauptmahlzeiten angewendet werden.
Therapieeinleitung
Bei Patienten mit Typ 2 Diabetes mellitus beträgt die empfohlene Anfangsdosis von Ryzodeg 10 Einheiten pro Tag zu der Mahlzeit/zu den Mahlzeiten, gefolgt von einer individuellen Dosisanpassung.
Bei Patienten mit Typ 1 Diabetes mellitus wird Ryzodeg einmal täglich zum Essen verabreicht und mit einem kurz/rasch wirkenden Insulin zu den verbleibenden Mahlzeiten kombiniert. Die empfohlene Anfangsdosis von Ryzodeg beträgt 60-70% der täglich benötigten Gesamtinsulindosis. Eine individuelle Dosisanpassung ist erforderlich.
Patienten mit Typ 2 Diabetes mellitus
Patienten, die von einer einmal täglichen Basal- oder Mischinsulintherapie umstellen, können 1:1 auf einmal oder zweimal täglich Ryzodeg mit der gleichen Gesamtinsulindosis, wie bei ihrer vorherigen Therapie, umgestellt werden.
Patienten, die von einer mehr als einmal täglichen Basal- oder Mischinsulintherapie umstellen, können 1:1 auf einmal oder zweimal täglich Ryzodeg mit der gleichen Gesamtinsulindosis, wie bei ihrer vorherigen Therapie, umgestellt werden.
Patienten, die von einer Basal-Bolus-Insulintherapie zu Ryzodeg umstellen, müssen die Dosis aufgrund ihres individuellen Bedarfs anpassen. Im Allgemeinen beginnen die Patienten mit den gleichen Anzahl Einheiten des Basalinsulins.
Dosis und Einnahmezeit von antidiabetischen Begleitmedikationen ist gegebenenfalls anzupassen.
Patienten mit Typ 1 Diabetes mellitus
Bei Patienten mit Typ 1 Diabetes mellitus beträgt die empfohlene Anfangsdosis für Ryzodeg 60–70% des gesamten Tagesinsulinbedarfs in Kombination mit einem kurz/rasch wirkenden Insulin zu den verbleibenden Mahlzeiten, gefolgt von individueller Dosisanpassung.
Die Dosis und Verabreichungszeit gleichzeitig verwendeter kurz/rasch wirkender Insulinpräparate ist gegebenenfalls anzupassen.
Verabreichungszeit
Ryzodeg wird einmal oder zweimal täglich subkutan mit der (den) Hauptmahlzeit(en) verabreicht. Insulin Degludec hat eine langsame, gleichmässige Absorptionsrate, was zu einer geringen Variabilität der blutzuckersenkenden Wirkung führt. Deshalb kann in Fällen, wo eine Dosis vergessen wurde oder wo der übliche Zeitpunkt der Injektion nicht eingehalten werden kann, die Dosis mit einer Hauptmahlzeit zu einem anderen Zeitpunkt am selben Tag verabreicht werden.
Danach soll wieder in den üblichen, einmal oder zweimal täglichen Verabreichungsplan gewechselt werden.
Umstellung von einem anderen Insulin-Präparaten auf Ryzodeg
Wie bei allen Insulinpräparaten wird während der Umstellung und in den Wochen danach eine sorgfältige Kontrolle der Blutzuckerwerte empfohlen.
Spezielle Dosierungsanweisungen
Patienten mit Nieren- und Leberfunktionsstörungen
Ryzodeg kann bei Patienten mit Nieren- und Leberfunktionsstörungen angewendet werden. Wie bei allen Insulinpräparaten sollte die Blutzuckerkontrolle intensiviert werden. Die Insulindosis ist individuell anzupassen (siehe unter «Pharmakokinetik»).
Ältere Patienten
Ryzodeg kann bei älteren Patienten angewendet werden. Wie bei allen Insulinpräparaten sollte die Blutzuckerkontrolle intensiviert werden. Die Insulindosis ist individuell anzupassen (siehe unter «Pharmakokinetik»).
Kinder und Jugendliche
Das Mischinsulin Ryzodeg (70% Insulin Degludec und 30% Insulin Aspart) kann mit der Hauptmahlzeit bei Jugendlichen und Kindern ab dem Alter von 2 Jahren mit Diabetes Typ 1 angewendet werden (siehe unter «Pharmakodynamik»), wenn eine intensivierte Insulintherapie nach dem klassischen Basal-Bolus-System nicht möglich oder gewünscht ist. Wenn von einer anderen Insulintherapie auf Ryzodeg umgestellt wird, muss eine Dosisreduktion der Gesamtinsulindosis auf individueller Basis in Betracht gezogen werden, um das Risiko einer Hypoglykämie zu minimieren (siehe unter «Warnhinweise und Vorsichtsmassnahmen»).
Ryzodeg sollte bei Kindern und Jugendlichen mit besonderer Vorsicht angewendet werden, da die Rate schwerer Hypoglykämien in einer klinischen Studie in dieser Population gegenüber dem Vergleichsarm numerisch erhöht war (siehe unter «Klinische Wirksamkeit», «Pharmakodynamik», «Unerwünschte Wirkungen» und «Warnhinweise und Vorsichtsmassnahmen»).
Art der Anwendung
Ryzodeg ist ausschliesslich zur subkutanen Anwendung bestimmt.
Ryzodeg darf nicht intravenös verabreicht werden, da dies zu schweren Hypoglykämien führen kann.
Ryzodeg darf nicht intramuskulär verabreicht werden, da dies die Resorption verändern kann.
Ryzodeg darf nicht in Insulin-Infusionspumpen verwendet werden.
Ryzodeg wird subkutan in die Bauchdecke, den Oberarm oder in den Oberschenkel injiziert. Die Einstichstelle ist bei jeder Injektion innerhalb derselben Körperregion zu wechseln, um das Risiko einer Lipodystrophie und einer kutanen Amyloidose zu reduzieren.
Ryzodeg FlexTouch® ist ein Fertigpen zur Anwendung mit NovoFine®- oder NovoTwist®-Injektionsnadeln. Ryzodeg FlexTouch® liefert 1 bis 80 Einheiten in Schritten von 1 Einheit.
Ryzodeg Penfill® ist zur Anwendung mit Insulininjektionsgeräten von Novo Nordisk und NovoFine®- oder NovoTwist®-Injektionsnadeln konzipiert.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenHypoglykämie
Beim insulinbehandelten Diabetiker besteht grundsätzlich das Risiko leichter oder schwerer Hypoglykämien. Dies kann die Aufmerksamkeit und insbesondere die Sicherheit beim Autofahren oder beim Bedienen von Maschinen beeinträchtigen. Dies gilt besonders zu Beginn der Behandlung, bei Präparatewechsel oder unregelmässiger Nahrungsaufnahme sowie allgemein bei nicht optimaler Stoffwechseleinstellung, wo es zu starken Blutzuckerschwankungen, unter anderem auch zu Hypoglykämien kommen kann. Es muss darauf aufmerksam gemacht werden, dass Alkoholeinnahme diese Gefährdung zusätzlich erhöht (Hemmung der hepatischen Glukoneogenese). Ebenso ist bei früher durchgemachten schweren Hypoglykämien das Risiko grösser, dass sich solche wiederholen. Um einer Hypoglykämie frühzeitig begegnen zu können, ist der Patient zu instruieren, immer Traubenzucker, Würfelzucker o.ä. mit sich zu führen. Er soll auch seinen Diabetikerausweis bei sich haben.
Wie bei anderen Basalinsulinen kann die verlängerte Wirkung die Erholung von einer Hypoglykämie verzögern.
Begleiterkrankungen, insbesondere Infektionen und Fieber, erhöhen in der Regel den Insulinbedarf. Begleiterkrankungen der Nieren, der Leber oder Krankheiten, die die Nebennieren, die Hypophyse oder die Schilddrüse in Mitleidenschaft ziehen, können Veränderungen der Insulindosis erforderlich machen.
Bei Patienten mit deutlich gebesserter Stoffwechsellage (z.B. aufgrund einer intensivierten Insulintherapie) oder nach Umstellung von tierischem auf humanes Insulin, sowie auch sonst gelegentlich bei Präparatewechsel, können unter Umständen einige oder sämtliche Warnsymptome entfallen, mit denen sich eine Hypoglykämie ankündigt. Diese Patienten sind entsprechend vorzuwarnen (siehe auch unter «Unerwünschte Wirkungen»).
Bei schon lange von Diabetes betroffenen Patienten verschwinden möglicherweise die üblichen Warnsymptome.
β-Blocker können die üblichen Hypoglykämie-Warnsymptome abschwächen, bzw. maskieren. Marihuana-Konsum kann möglicherweise eine Verschlechterung der Glukosetoleranz bewirken. (Andere illegale Substanzen wurden nicht getestet.) (Andere Interaktionen s. Rubrik «Interaktionen».)
Bei Kindern sollte die Anwendung des Mischinsulins Ryzodeg nur nach sorgfältiger Abwägung gegenüber anderen Therapiealternativen in Betracht gezogen werden. Es ist dabei besonders darauf zu achten, dass die Insulindosis gut mit der Nahrungsaufnahme und den körperlichen Aktivitäten abgestimmt ist, um das Risiko einer Hypoglykämie zu minimieren. Ryzodeg war in einer Studie bei Kindern und Jugendlichen im Vergleich zur Basal-Bolus-Therapie mit einem numerischen Anstieg schwerer Hypoglykämien assoziiert (siehe unter «Pharmakodynamik»).
Hyperglykämisches/Ketoazidotisches Koma
Bei schweren Hyperglykämien wird die Verabreichung von schnell wirkenden Insulinen empfohlen. Eine nicht ausreichende Dosierung oder Unterbrechung der Behandlung kann bei Patienten, die Insulin benötigen, zu Hyperglykämie und möglicherweise zu diabetischer Ketoazidose führen. Darüber hinaus können auch Begleiterkrankungen, insbesondere Infektionen, zu Hyperglykämie führen und dadurch einen erhöhten Insulinbedarf bewirken.
Die ersten Symptome einer Hyperglykämie entwickeln sich gewöhnlich langsam über Stunden bzw. Tage. Dazu gehören Durst, grosse Urinmengen, Appetitlosigkeit, Müdigkeit, Benommenheit, Übelkeit, Erbrechen, Mundtrockenheit, gerötete, trockene Haut sowie nach Aceton riechender Atem. Als weitere Ursachen kommen in Frage: Diätfehler, Auslassen resp. Verringern von Insulininjektionen. Der Patient soll angewiesen werden, bei den ersten Anzeichen einer Überzuckerung sofort den Arzt aufzusuchen. Unbehandelte hyperglykämische Reaktionen können zu Bewusstlosigkeit, Koma oder Tod führen.
Erkrankung der Haut und des Unterhautzellgewebes
Patienten müssen angewiesen werden, die Injektionsstelle regelmässig zu wechseln, um das Risiko einer Lipodystrophie und einer kutanen Amyloidose zu reduzieren. Es besteht das potenzielle Risiko einer verzögerten Insulinresorption und einer schlechteren Blutzuckerkontrolle nach Insulininjektionen an Stellen mit diesen Reaktionen. Bei einem plötzlichen Wechsel der Injektionsstelle zu einem nicht betroffenen Bereich wurde darüber berichtet, dass dies zu Hypoglykämie führte. Nach einem Wechsel des Injektionsbereichs wird eine Überwachung des Blutzuckers empfohlen und eine Dosisanpassung der Antidiabetika kann in Erwägung gezogen werden.
Patientenschulung betreffend Diabetes mellitus
Die Insulintherapie erfordert grundsätzlich eine entsprechende Fähigkeit des Patienten zum selbständigen Umgang mit der Diabeteserkrankung, wie Überwachung des Blutzuckerspiegels, Erlernen der richtigen Injektionstechnik und angemessenes Verhalten bei hypo- und hyperglykämischen Stoffwechselsituationen. Die Patienten müssen für diese selbständig durchzuführenden Massnahmen geschult werden. Sie müssen ausserdem über das richtige Verhalten in Ausnahmesituationen aufgeklärt werden, wie sie durch unzureichende oder ausgelassene Insulingaben oder durch versehentlich zu hohe Insulindosen, unzureichende Nahrungsaufnahme oder ausgelassene Mahlzeiten entstehen können (siehe auch unter «Verabreichungszeitpunkt»).
Die Behandlung mit Insulin erfordert ständige Aufmerksamkeit gegenüber möglichen Hyper- oder Hypoglykämien. Patienten und ihre Angehörigen müssen wissen, welche korrigierenden Massnahmen ergriffen werden müssen, wenn eine Hyper- oder Hypoglykämie auftritt oder vermutet wird, und wann ein Arzt zu informieren ist.
Bei ungenügender Stoffwechseleinstellung oder Neigung zu Hyper- oder Hypoglykämien müssen die Einhaltung des Therapieschemas durch den Patienten, die gewählten Injektionsstellen und die Injektionstechnik, die Handhabung des FlexTouch und des Penfills sowie alle anderen relevanten Faktoren überprüft werden, bevor eine Dosisanpassung in Erwägung gezogen wird.
Umstellung von einem anderen Insulin-Präparat
Die Umstellung eines Patienten, der bisher ein Insulin von einem anderen Typ, einer anderen Marke oder einem anderen Hersteller verwendet hat, muss unter ärztlicher Aufsicht erfolgen und kann eine Veränderung der Dosierung erforderlich machen (siehe auch Rubrik «Dosierung/Anwendung»).
Kombination von Pioglitazon und Insulinpräparaten
Im Zusammenhang mit der Kombination von Pioglitazon und Insulin sind Fälle von Herzinsuffizienz berichtet worden, insbesondere bei Patienten mit Risikofaktoren für die Entwicklung einer Herzinsuffizienz. Dies sollte im Auge behalten werden, wenn eine kombinierte Behandlung mit Pioglitazon und Insulinpräparaten erwogen wird. Wenn eine kombinierte Behandlung angewendet wird, sollten die Patienten auf Anzeichen und Symptome von Herzinsuffizienz, Gewichtszunahme und Ödemen kontrolliert werden. Pioglitazon ist abzusetzen, wenn Anzeichen für eine Verschlechterung der Herzfunktion auftreten.
Vermeidung von Medikationsfehlern
Die Patienten müssen die eingestellten Einheiten auf der Dosisanzeige des Pens visuell überprüfen. Voraussetzung für eine Selbstinjektion durch den Patienten ist daher, dass dieser die Dosisanzeige auf dem Pen ablesen kann. Blinde oder sehbehinderte Patienten müssen aufgefordert werden, sich immer von einer gut sehenden Person helfen zu lassen, die im Umgang mit dem Insulininjektionsgerät geschult wurde.
Die Anwendung von Insulin kann die Bildung von Insulinantikörpern verursachen. In seltenen Fällen kann das Vorhandensein von solchen Insulinantikörpern eine Anpassung der Insulindosis erforderlich machen.
InteraktionenDer Glukosestoffwechsel wird von einigen Arzneimitteln beeinflusst.
1. Der Insulinbedarf kann vermindert sein in Gegenwart von Substanzen, welche die Insulinwirkung verbessern (Insulinsensitivität erhöhen), die Insulinsekretion steigern, die hepatische Gluconeogenese hemmen oder die intestinale Glukoseaufnahme beeinflussen. Bei gleichbleibender Insulinmenge besteht somit erhöhte Hypoglykämie-Gefahr durch gleichzeitige Einnahme/Anwendung von:
oralen Antidiabetika; GLP-1 Rezeptor-Agonisten; ACE-Hemmern (z.B. Captopril und Enalapril); antiarrhythmischen Substanzen wie Disopyramid; β-Blockern und Clonidin; SSRI; Fenfluramine; MAO-Hemmern; trizyklischen Antidepressiva; Salicylaten und (selten) anderen NSAIDs; Fibraten; Tetracyclinen; Pentamidin (Hypoglykämie; gelegentlich mit nachfolgender Hyperglykämie); Anti-Malariamitteln (Chinin, Chloroquin, Mefloquin); Sulfonamiden (z.B. Cotrimoxazol); Cimetidin und Ranitidin.
2. Der Insulinbedarf kann erhöht sein bei gleichzeitiger Einnahme/Anwendung der folgenden Substanzen bzw. Substanzgruppen:
Orale Kontrazeptiva und andere Oestrogen- oder Progestagen-Präparate, Korticosteroide und ACTH; GH (Somatotropin); Danazol; Schilddrüsenhormone; Sympathikomimetika (vor allem β2-Sympathikomimetika wie Ritodrin, Salbutamol, Terbutalin, aber auch α-selektive Sympathikomimetika, sowie nicht selektive wie Epinephrin); Diazoxid; Nikotinsäure und -derivate; Chlorpromazin (vor allem in hohen Dosen) und andere Phenothiazin-Derivate; Diuretika (z.B. Thiazid-Diuretika, Indapamid und Furosemid); anti-retrovirale Substanzen; Immunsuppressive Substanzen (Ciclosporin, Tacrolimus, Sirolimus), atypische Antipsychotika.
3. Bei Anwendung der folgenden Substanzen kann die Insulinwirkung je nach Dosis verstärkt bzw. abgeschwächt werden:
·Lanreotid, Octreotid-, Salicylsäure-Derivate, Lithium-Salze (selten)
·β-Blocker können zu einer Verstärkung der Insulinresistenz aber auch, in gewissen Fällen, zu einer Hypoglykämie führen. Ausserdem können die Hypoglykämie-Warnsymptome abgeschwächt bzw. maskiert werden.
·Alkohol kann die blutzuckersenkende Wirkung von Insulin verstärken oder vermindern.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen keine klinischen Erfahrungen mit Ryzodeg bei schwangeren Frauen vor. Ryzodeg sollte deshalb bei schwangeren Frauen nicht angewendet werden.
Fortpflanzungsstudien an Tieren haben keine Unterschiede zwischen Insulin Degludec und Humaninsulin hinsichtlich Embryotoxizität und Teratogenität gezeigt.
Generell sind eine intensivierte Blutzuckerkontrolle und eine sorgfältige Überwachung von schwangeren Frauen mit Diabetes während der Schwangerschaft und bei der Erwägung einer Schwangerschaft zu empfehlen. Gewöhnlich fällt der Insulinbedarf im ersten Trimenon ab, steigt aber anschliessend im Verlauf des zweiten und dritten Trimenon wieder an. Nach der Entbindung pendelt sich der Insulinbedarf normalerweise schnell wieder auf die Werte von vor der Schwangerschaft ein.
Stillzeit
Es gibt keine klinische Erfahrung mit Ryzodeg bei stillenden Frauen. Bei Ratten wurde IDegAsp in der Muttermilch nachgewiesen, allerdings in niedrigerer Konzentration als im Plasma.
Es ist unbekannt, ob IDegAsp in die menschliche Muttermilch übertritt. Ryzodeg sollte deshalb bei stillenden Müttern nicht verwendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDie Konzentrations- und Reaktionsfähigkeit der Patienten können als Folge einer Hypoglykämie beeinträchtigt sein. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z.B. beim Autofahren oder Bedienen von Maschinen), ein Risiko darstellen.
Die Patienten sind dahingehend aufzuklären, dass sie in der Lage sind, Massnahmen zu ergreifen, um eine Hypoglykämie während des Fahrens zu vermeiden. Dies ist besonders wichtig bei Patienten mit verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnzeichen oder häufigen Hypoglykämie-Episoden.
Unerwünschte WirkungenIns klinische Entwicklungsprogramm von Ryzodeg wurden mehr als 2'000 Patienten eingeschlossen. Die am häufigste berichtete Nebenwirkung während der Behandlung ist die Hypoglykämie.
Die unten aufgeführten Nebenwirkungen basieren auf Daten aus klinischen Studien und sind nach MedDRA-Organklassen zusammengefasst. Die Häufigkeitsklassen sind wie folgt definiert: Sehr häufig (≥1/10), häufig (≥1/100 bis <1/10), gelegentlich (≥1/1'000 bis <1/100), selten (≥1/10'000 bis <1/1'000), sehr selten (<1/10'000).
|
Erkrankungen des Immunsystems
|
Selten - Überempfindlichkeit
| |
Selten - Urtikaria
| |
Stoffwechsel- und Ernährungsstörungen
|
Sehr häufig - Hypoglykämie
| |
Erkrankungen der Haut und des Unterhautzellgewebes
|
Nicht bekannt – Lipodystrophie
Nicht bekannt – Kutane Amyloidose
| |
Allgemeine Erkrankungen und Beschwerden an der Injektionsstelle
|
Häufig - Reaktionen an der Injektionsstelle
| |
Gelegentlich - Periphere Ödeme
|
Beschreibung ausgewählter Nebenwirkungen
Erkrankungen des Immunsystems
Selten - Allergische Reaktionen, Urtikaria
Bei Insulin-Präparaten können allergische Reaktionen auftreten. Allergische Reaktionen vom Soforttyp entweder auf das Insulin selbst oder auf einen der Hilfsstoffe sind potenziell lebensbedrohlich.
Überempfindlichkeit (die sich in einer Schwellung der Zunge und Lippen, Durchfall, Übelkeit, Müdigkeit und Juckreiz zeigen kann) und Urtikaria wurden selten im Zusammenhang mit Ryzodeg berichtet.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig – Hypoglykämie (95% bei Patienten mit Typ 1 Diabetes mellitus, 44.2-57.7% bei Patienten mit Typ 2 Diabetes mellitus bei 1x täglicher Anwendung von Ryzodeg, 61.2-73.5% bei Patienten mit Typ 2 Diabetes mellitus bei 2x täglicher Anwendung von Ryzodeg)
Eine Hypoglykämie kann auftreten, wenn die Insulindosis im Verhältnis zum Insulinbedarf zu hoch ist. Schwere Hypoglykämien können zu Bewusstlosigkeit und/oder Krampfanfällen führen und vorübergehende oder dauerhafte Störungen der Gehirnfunktion oder sogar den Tod nach sich ziehen. Die Symptome einer Hypoglykämie treten gewöhnlich plötzlich auf. Diese Symptome sind kalter Schweiss, kalte blasse Haut, Müdigkeit, Nervosität oder Zittern, Angstgefühle, ungewöhnliche Müdigkeit oder Schwäche, Verwirrung, Konzentrationsstörungen, Benommenheit, grosser Hunger, Sehstörungen, Kopfschmerzen, Übelkeit und Herzklopfen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig - Reaktionen an der Injektionsstelle
Bei Patienten, die mit Ryzodeg behandelt wurden, traten Reaktionen an der Injektionsstelle (einschliesslich Hämatomen an der Injektionsstelle, Schmerzen, Blutungen, Rötungen, Knötchen, Schwellungen, Verfärbungen, Juckreiz und Wärme) auf. Diese Reaktionen sind in der Regel schwach und vorübergehend und verschwinden normalerweise im Laufe der Behandlung.
Erkrankungen der Haut und des Unterhautzellgewebes
Lipodystrophie (einschliesslich Lipohypertrophie, Lipoatrophie) und kutane Amyloidose können an der Injektionsstelle auftreten und die lokale Insulinresorption verzögern. Durch einen regelmässigen Wechsel der Injektionsstelle innerhalb des jeweiligen Injektionsbereichs können diese Reaktionen reduziert oder verhindert werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Besondere Patientengruppen
Die Ergebnisse aus klinischen Studien zeigten keine Unterschiede betreffend Häufigkeit, Art und Schwere der Nebenwirkungen zwischen älteren Patienten und Patienten mit eingeschränkter Nieren- oder Leberfunktion und der allgemeinen Bevölkerung.
Ryzodeg wurde bei Kindern und Jugendlichen im Alter von bis zu 18 Jahren angewendet, um die pharmakokinetischen Eigenschaften zu untersuchen (siehe unter «Pharmakokinetik»). Die Sicherheit und Wirksamkeit wurden in einer Studie bei Kindern im Alter von 2 bis unter 18 Jahren gezeigt. In dieser Studie wurde bei Gabe von Ryzodeg zur Hauptmahlzeit im Vergleich zur Standard Basal-Bolus-Behandlung ein numerisch höheres Auftreten für schwere Hypoglykämien beobachtet (siehe unter «Dosierung/Anwendung», «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»). Ansonsten waren Häufigkeit, Art und Schwere der Nebenwirkungen bei Kindern und Jugendlichen mit denen bei Erwachsenen vergleichbar.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs kann keine spezifische Überdosierung für Insulin definiert werden. Wenn die Dosis jedoch im Vergleich zum Bedarf des Patienten zu hoch ist (wenn der Patient somit mehr Insulin erhält als er benötigt) kann sich stufenweise eine Hypoglykämie entwickeln, (siehe unter «Warnhinweise und Vorsichtsmassnahmen»).
Milde Hypoglykämien können durch die orale Gabe von Glukose oder anderen zuckerhaltigen Lebensmitteln behandelt werden. Es wird daher empfohlen, dass der Diabetiker stets glukosehaltige Produkte auf sich trägt.
Schwere Hypoglykämien, bei denen der Patient nicht in der Lage ist, sich selbst zu behandeln, können mit von einer geschulten Person intramuskulär oder subkutan verabreichtem Glukagon (0.5 bis 1 mg) oder mit von medizinischem Fachpersonal intravenös verabreichter Glukose behandelt werden. Wenn der Patient nicht innerhalb von 10 bis 15 Minuten auf Glukagon anspricht, ist Glukose intravenös zu verabreichen. Sobald der Patient wieder bei Bewusstsein ist, wird die orale Gabe von Kohlenhydraten empfohlen, um einen Rückfall zu verhindern.
Eigenschaften/WirkungenATC-Code
A10AD06
Wirkungsmechanismus
Insulin Degludec und Insulin Aspart bindet spezifisch an den Humaninsulin-Rezeptor und hat die gleiche pharmakologische Wirkung wie Humaninsulin.
Die blutzuckersenkende Wirkung von Insulin beruht auf der verbesserten Aufnahme von Glukose nach der Bindung des Insulins an die Insulin-Rezeptoren auf Muskel- und Fettzellen und der gleichzeitigen Hemmung der Freisetzung von Glukose aus der Leber.
Pharmakodynamik
Die pharmakodynamische Wirkung der beiden Komponenten in Ryzodeg ist deutlich separiert (siehe Abbildung 1) und das daraus resultierende Wirkprofil spiegelt die einzelnen Komponenten, das rasch wirkende Insulin Aspart und die basale Komponente Insulin Degludec deutlich wider.
Die lang wirkende basale Komponente von Ryzodeg (Insulin Degludec) bildet nach subkutaner Injektion lösliche Multihexamere, die ein Depot bilden, aus dem kontinuierlich und langsam Insulin Degludec in den Blutkreislauf abgegeben wird, was zu einer flachen und stabilen blutzuckersenkenden Wirkung führt. Diese Wirkung bleibt in der Kombination mit Insulin Aspart erhalten und interferiert nicht mit den rasch wirkenden Insulin Aspart Monomeren.
Nach Verabreichung von Ryzodeg erfolgt der Wirkungseintritt sehr rasch und deckt die Mahlzeiten ab. Die basale Komponente weist ein flaches, stabiles und lang wirkendes Profil auf, was zu einer kontinuierlichen Abdeckung des Insulin Basalbedarfs führt. Die Wirkdauer einer Einzeldosis Ryzodeg beträgt mehr als 24 Stunden.
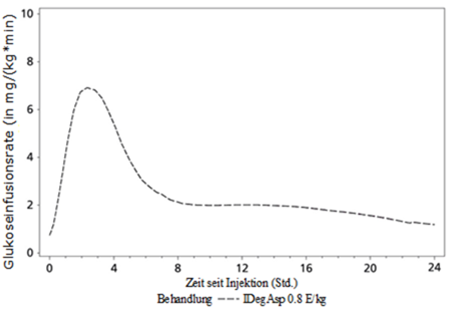
Abbildung 1: durchschnittliche Glukoseinfusionsrate von Ryzodeg nach Verabreichung einer Einzeldosis von 0,8 E/kg bei Typ 1 Diabetikern
Die Gesamt- und die maximale blutzuckersenkende Wirkung von Ryzodeg nimmt mit zunehmender Dosierung linear zu. Das Steady-State wird 2-3 Tage nach erster Verabreichung erreicht.
Die pharmakodynamische Wirkung von Ryzodeg unterscheidet sich zwischen älteren und jüngeren Patienten nicht.
Klinische Wirksamkeit
Es wurden sieben multinationale, randomisierte, kontrollierte, nicht verblindete klinische Treat-to-Target-Studien mit einer Dauer zwischen 26 bis 52 Wochen durchgeführt. Hierbei wurden insgesamt 1'761 Patienten mit Diabetes mellitus (1 Studie mit 362 Patienten mit Diabetes mellitus Typ 1 und 6 Studien mit 1'399 Patienten mit Diabetes mellitus Typ 2) mit Ryzodeg behandelt.
Die Anwendung von einmal täglich Ryzodeg wurde mit Insulin glargin (IGlar) (einmal täglich) in zwei Studien zu Typ 2 Diabetes mellitus verglichen (Tabelle 1).
In zwei Studien zu Typ 2 Diabetes mellitus wurde Ryzodeg zweimal täglich mit biphasischem Insulin Aspart 30 (BIAsp 30) zweimal täglich sowie in einer Studie zu Typ 2 Diabetes mellitus mit Insulin degludec (IDeg) einmal täglich plus 2-4 mal täglich Insulin aspart (IAsp) verglichen (Tabelle 2).
In einer Studie zu Typ 2 Diabetes mellitus wurde Ryzodeg einmal täglich mit Insulin glargin (IGlar) einmal täglich plus IAsp einmal täglich verglichen. Nach 26 Behandlungswochen konnte die Ryzodeg Dosis in eine zweimal tägliche Dosierung aufgeteilt werden (Tabelle 3). In allen Studien zu Typ 2 Diabetes mellitus waren orale Antidiabetika (OADs) erlaubt.
Ryzodeg einmal täglich plus Insulin Aspart (IAsp) wurde ebenfalls mit einmal täglich oder zweimal täglich Insulin Detemir (IDet) plus IAsp bei Diabetes mellitus Typ 1 verglichen (Tabelle 4).
Die Nichtunterlegenheit hinsichtlich der Veränderung des HbA1c-Ausgangswert bis zum Studienende wurde in 6 von 7 Studien gegenüber allen Vergleichspräparaten gemäss dem Treat-to-Target-Prinzip bestätigt, während die Nichtunterlegenheit in einer Studie (Vergleich von Ryzodeg zweimal täglich mit IDeg einmal täglich plus 2-4 mal IAsp täglich) mit Diabetes mellitus Typ 2 Patienten nicht bestätigt wurde (Tabelle 2).
In Kombination mit OAD zeigt Ryzodeg einmal täglich sowohl bei Insulin naïven als auch bei mit Insulin vorbehandelten Typ 2 Diabetikern eine vergleichbare Blutzuckerkontrolle wie Insulin Glargin. Ryzodeg wies eine verbesserte prandiale Blutzuckerkontrolle mit einer niedrigeren Rate nächtlicher Hypoglykämien (definiert als Episoden zwischen Mitternacht und 6 Uhr morgens mit einem bestätigten Plasmaglukosewerte von <3,1 mmol/l oder wenn der Patient auf fremde Hilfe angewiesen war) (Tabelle 1) im Vergleich zu Insulin Glargin auf.
Ryzodeg zweimal täglich verabreicht zeigte eine vergleichbare Blutzuckerkontrolle (HbA1c) wie BIAsp 30 zweimal täglich. Mit Ryzodeg wurde ein besserer Nüchternblutzuckerwert erreicht und die Patienten erreichten den Plasmaglukosezielwert von 5 mmol/l rascher als mit BIAsp 30. Ryzodeg zeigte eine geringere Gesamtrate an Hypoglykämien sowie nächtlicher Hypoglykämien (Tabelle 2).
Ryzodeg zweimal täglich wurde bei Patienten mit Typ-2-Diabetes mellitus, die mit Basalinsulin behandelt werden und eine Therapieintensivierung mit einem prandialen Insulin benötigen, mit IDeg einmal täglich plus IAsp (2-4 Injektionen pro Tag) verglichen. Beide Behandlungen haben die glykämische Kontrolle verbessert, jedoch hat die Behandlung mit Ryzodeg die vordefinierte Nichtunterlegenheitsgrenze von 0.4% gegenüber IDeg plus IAsp für den primären Endpunkt der Veränderung des HbA1c-Ausgangswerts bis zur Woche 26 nicht erreicht (Tabelle 2). Es gab keine statistisch signifikanten Unterschiede zwischen den beiden Behandlungsgruppen.
In einer Studie mit Patienten mit Typ 2 Diabetes mellitus, die mit Basalinsulin behandelt wurden und eine Therapieintensivierung mit einem prandialen Insulin benötigten, wurde Ryzodeg einmal täglich mit IGlar einmal täglich plus IAsp einmal täglich über 26 Wochen verglichen. Nach 26 Wochen konnte die Ryzodeg Dosis im Ryzodeg-Arm in eine zweimal tägliche Dosierung aufgeteilt werden. Im IGlar-Arm konnten zusätzliche Dosen IAsp während der anderen Mahlzeiten (bis zu dreimal täglich) verabreicht werden. Ryzodeg einmal täglich erreichte im Vergleich zu IGlar einmal täglich plus IAsp einmal täglich nach 26 Wochen eine ähnliche glykämische Kontrolle (HbA1c). Ryzodeg einmal täglich oder zweimal täglich erreichte im Vergleich zu IGlar einmal täglich plus IAsp ein- bis dreimal täglich nach 38 Wochen eine ähnliche glykämische Kontrolle (HbA1c). Ryzodeg zeigte während der 26 und der 38 Wochen eine niedrigere Rate der nächtlichen Hypoglykämien (Tabelle 3).
Bei Typ 1 Diabetikern zeigte die Behandlung mit Ryzodeg einmal täglich plus Insulin Aspart zu den verbleibenden Mahlzeiten eine vergleichbare Blutzuckerkontrolle (HbA1c und Nüchternplasmaglukose) bei einer geringeren Rate nächtlicher Hypoglykämien im Vergleich zu einer Basis-Bolus-Behandlung mit Insulin Detemir plus Insulin Aspart zu allen Mahlzeiten (Tabelle 4).
Tabelle 1: Resultat von zwei 26-wöchigen Studien mit Typ 2 Diabetikern
|
|
Ryzodeg
(einmal täglich)1
Insulin naïv
|
IGlar
(einmal täglich)1
Insulin naïv
|
Ryzodeg
(einmal täglich)2
Insulin-Anwender
|
IGlar
(einmal täglich)2
Insulin-Anwender
| |
N
|
266
|
263
|
230
|
233
| |
Mittlerer HbA1c-Wert (%)
| |
Studienende
Änderung im Mittel
|
7,2
-1,65
|
7,2
-1,72
|
7,3
-0,98
|
7,4
-1,00
| |
|
Unterschied:
0,03 [-0,14; 0,20]
|
Unterschied:
-0,03 [-0,20; 0,14]
| |
Nüchternplasmaglukose (mmol/l)
| |
Studienende
Änderung im Mittel
|
6,8
-3,32
|
6,3
-4,02
|
6,3
-1,68
|
6,0
-1,88
| |
|
Unterschied:
0,51 [0,09; 0,93]
|
Unterschied:
0,33 [-0,11; 0,77]
| |
Blutzucker (Plasma) 90 Minuten nach den Mahlzeiten am Studienende (in mmol/l)
| |
nach dem Frühstück
Änderung im Mittel
|
1,9
-1,5
|
3,4
-0,3
|
|
| |
nach dem Abendessen
Änderung im Mittel
|
|
|
1,2
-1,5
|
2,6
-0,6
| |
Hypoglykämie-Rate (pro Patientenjahr Expositionszeit)
| |
Schwer
|
0,01
|
0,01
|
0,00
|
0,04
| |
Bestätigt3
|
4,23
|
1,85
|
4,31
|
3,20
| |
|
Verhältnis:
2,17 [1,59; 2,94]
|
Verhältnis: 1,43
[1,07; 1,92]
| |
Bestätigt nächtlich3
|
0,19
|
0,46
|
0,82
|
1,01
| |
|
Verhältnis:
0,29 [0,13;0,65]
|
Verhältnis:
0,80 [0,49;1,30]
|
1 Einmal tägliche Gabe + Metformin
2 Einmal tägliche Gabe + Metformin ± Pioglitazon ± DPP-4-Inhibitor
3 Bestätigte Hyperglykämien wurden als Episoden definiert, die durch einen Plasmaglukosewert von <3,1 mmol/l oder dadurch bestätigt wurden, dass der Patient Fremdhilfe benötigte. Bestätigte nächtliche Hypoglykämien wurden als Episoden zwischen Mitternacht und 06:00 Uhr definiert.
IGlar = Insulin Glargin
Tabelle 2: Resultat von drei 26-wöchigen Studien mit Typ 2 Diabetikern
|
|
Ryzodeg
(zweimal täglich)1
Insulin-Anwender
|
BIAsp 30
(zweimal täglich)1
Insulin-Anwender
|
Ryzodeg
(zweimal täglich)2
Insulin-Anwender
|
BIAsp 30
(zweimal täglich)2
Insulin-Anwender
|
Ryzodeg (zweimal täglich)3
Insulin-Anwender
|
IDeg (einmal täglich) + IAsp4
Insulin-Anwender
| |
N
|
224
|
222
|
280
|
142
|
138
|
136
| |
Mittlerer HbA1c-Wert (%)
| |
Studienende
Änderung im Mittel
|
7,1
-1,28
|
7,1
-1,30
|
7,1
-1,38
|
7,0
-1,42
|
7,0
-1,31
|
6,8
-1,50
| |
|
Unterschied:
-0,03 [-0,18; 0,13]
|
Unterschied:
0,05 [-0,10; 0,20]
|
Unterschied:
0,18 [-0,04; 0,41]
| |
Nüchternplasmaglukose (mmol/l)
| |
Studienende
Änderung im Mittel
|
5,8
-3,09
|
6,8
-1,76
|
5,4
-2,55
|
6,5
-1,47
|
6,8
-2,25
|
7,1
-1,78
| |
|
Unterschied:
-1,14 [-1,53; -0,76]
|
Unterschied:
-1,06 [-1,43; -0,70]
|
Unterschied:
-0,31 [-0,97; 0,34]
| |
Hypoglykämie Rate (pro Patientenjahr Expositionszeit)
| |
Schwer
|
0,09
|
0,25
|
0,05
|
0,03
|
0,47
|
0,24
| |
Bestätigt5
|
9,72
|
13,96
|
9,56
|
9,52
|
11,55
|
13,62
| |
|
Verhältnis:
0,68 [0,52; 0,89]
|
Verhältnis:
1,00 [0,76; 1,32]
|
Verhältnis:
0,81 [0,61; 1,07]
| |
Bestätigt nächtlich5
|
0,74
|
2,53
|
1,11
|
1,55
|
1,23
|
1,55
| |
|
Verhältnis:
0,27 [0,18; 0,41]
|
Verhältnis:
0,67 [0,43; 1,06]
|
Verhältnis:
0,80 [0,50; 1,29]
| |
Totale Insulin Dosis (Einheiten)
| |
Studienende
|
|
106,7
|
130,6
| |
Verhältnis: 0,81
[0,69; 0,95]
|
1 Zweimal tägliche Gabe ± Metformin ± Pioglitazon ± DPP-4-Inhibitor
2 Zweimal tägliche Gabe ± Metformin
3 Zweimal tägliche Gabe ± Metformin ± Insulin Sekretagoge ± DPP-4 Inhibitor ± α-Glucosidase-Inhibitor
4 Einmal täglich Gabe + Insulin Aspart 2-4 mal täglich als prandiales Insulin ± Metformin ± Insulin Sekretagoge ± DPP-4 Inhibitor ± α-Glucosidase-Inhibitor
5 Bestätigte Hypoglykämien wurden als Episoden definiert, die durch einen Plasmaglukosewert von <3,1 mmol/l oder dadurch bestätigt wurden, dass der Patient Fremdhilfe benötigte. Bestätigte nächtliche Hypoglykämien wurden als Episoden zwischen Mitternacht und 06:00 Uhr definiert.
Tabelle 3: Resultat einer 38-wöchigen Studie mit Typ 2 Diabetikern
|
|
Ryzodeg
(einmal täglich)1
26 Wochen
|
IGlar (einmal täglich) +
IAsp (einmal täglich)1
26 Wochen
|
Ryzodeg
(einmal täglich/
zweimal täglich)2
38 Wochen
|
IGlar (einmal täglich) +
IAsp (1-3 mal täglich)3
38 Wochen
| |
N
|
267
|
265
|
267
|
265
| |
Mittlerer HbA1c-Wert (%)
|
|
| |
Studienende
Änderung im Mittel
|
7,1
-1,1
|
7,1
-1,1
|
7,0
-1,2
|
6,9
-1,2
| |
|
Unterschied:
0,07 [-0,06; 0,21]
|
Unterschied:
0,09 [-0,04; 0,22]
| |
Nüchternplasmaglukose (mmol/l)
|
|
| |
Studienende
Änderung im Mittel
|
6,7
-2.3
|
6.5
-2,3
|
6,3
-2,7
|
6,5
-2,3
| |
|
Unterschied:
0,04 [-0,34; 0,42]
|
Unterschied:
-0,24 [-0,60; 0,13]
| |
Hypoglykämierate (pro Patientenjahr Expositionszeit)
|
|
| |
Schwer oder Plasmaglukose bestätigt4
|
2,58
|
2,96
|
2,87
|
3,43
| |
|
Verhältnis:
0,90 [0,67; 1,22]
|
Verhältnis:
0,86 [0,65; 1,14]
| |
Schwer nächtlich oder Plasmaglukose bestätigt4
|
0,48
|
0,93
|
0,60
|
1,01
| |
|
Verhältnis:
0,55 [0,34; 0,90]
|
Verhältnis:
0,61 [0,40; 0,93]
| |
Totale Insulin Dosis (Einheiten)
| |
Studienende
|
70,9
|
79,4
|
83,4
|
89,3
| |
|
Verhältnis:
0,88 [0,81; 0,95]
|
Verhältnis:
0,91 [0,83; 0,99]
|
1 Einmal tägliche Gabe ± OADs
2 Einmal oder Zweimal tägliche Gabe ± OADs
3 Einmal täglich Insulin glargin + Insulin aspart 1-3 mal täglich ± OADs
4 Schwere oder Plasmaglukose bestätigte symptomatische Hypoglykämie wurde als Episode definiert, die bestätigt wurde durch einen Plasmaglukosewert von <3,1 mmol/l mit Symptomen, welche mit einer Hypoglykämie übereinstimmen. Bestätigte nächtliche Hypoglykämien wurden als Episoden zwischen Mitternacht und 06:00 definiert.
Bemerkung: OADs können jede beliebige Kombination von Metformin, DPP-4-Inhibitoren, α-Glukosidase-Inhibitoren oder SGLT2-Inhibitoren beinhalten.
Tabelle 4: Resultat einer 26-wöchigen Studie mit Typ 1 Diabetikern
|
|
Ryzodeg
(einmal täglich)1
|
IDet
(einmal/zweimal täglich)2
| |
N
|
366
|
182
| |
Mittlerer HbA1c-Wert (%)
| |
Studienende
Änderung im Mittel
|
7,6
-0,73
|
7,6
-0,68
| |
|
Unterschied:
-0,05 [-0,18; 0,08]
| |
Nüchternplasmaglukose (mmol/l)
| |
Studienende
Änderung im Mittel
|
8,7
-1,61
|
8,6
-2,41
| |
|
Unterschied:
0,23 [-0,46; 0,91]
| |
Hypoglykämierate (pro Patientenjahr Expositionszeit)
| |
Schwer
|
0,33
|
0,42
| |
Bestätigt3
|
39,2
|
44,3
| |
|
Verhältnis:
0,91 [0,76; 1,09]
| |
Bestätigt nächtlich3
|
3,71
|
5,72
| |
|
Verhältnis:
0,63 [0,49; 0,81]
|
1 Einmal tägliche Gabe + Insulin aspart zur Abdeckung des mahlzeitenbezogenen Insulinbedarfs
2 Einmal oder zweimal tägliche Gabe + Insulin aspart zur Abdeckung des mahlzeitenbezogenen Insulinbedarfs
3 Bestätigte Hypoglykämien wurden als Episoden definiert, die durch einen Plasmaglukosewert von <3,1 mmol/l oder dadurch bestätigt wurden, dass der Patient Fremdhilfe benötigte. Bestätigte nächtliche Hypoglykämien wurden als Episoden zwischen Mitternacht und 06:00 definiert.
Kardiovaskuläre Beurteilung
Bei DEVOTE handelt es sich um eine randomisierte, doppelblinde klinische Studie, bei der die kardiovaskuläre Sicherheit von Insulin degludec mit derjenigen von Insulin glargin (100 Einheiten/ml) bei 7'637 Patienten mit Typ 2 Diabetes mellitus und hohem Risiko für kardiovaskuläre Ereignisse verglichen wurde. Die Dauer der Studie war «ereignisgesteuert», d.h., bis ≥633 Ereignisse erreicht waren. Die Behandlungsdauer betrug im Median 1.83 Jahre, die Beobachtungszeit im Median 1.99 Jahre.
Die Primäranalyse umfasste den Zeitraum von der Randomisierung bis zum ersten Auftreten eines schweren unerwünschten, kardiovaskulären Ereignisses (MACE, major adverse cardiovaskulare event). MACE umfasste drei Komponenten: «kardiovaskulärer Tod», «nicht tödlicher Herzinfarkt» oder «nicht tödlicher Schlaganfall».
Um einen Anstieg des relativen kardiovaskulären Risikos um mehr als 30% auszuschliessen, wurde die Studie als non-inferiority-Studie konzipiert. Die Obergrenze des 95.%-Konfidenzintervalls (KI) für die MACE-HR lag unter dieser vordefinierten Schwelle von 1.3, womit die kardiovaskuläre Sicherheit von Insulin degludec im Vergleich zu Insulin glargin (Abbildung 2) belegt wurde.
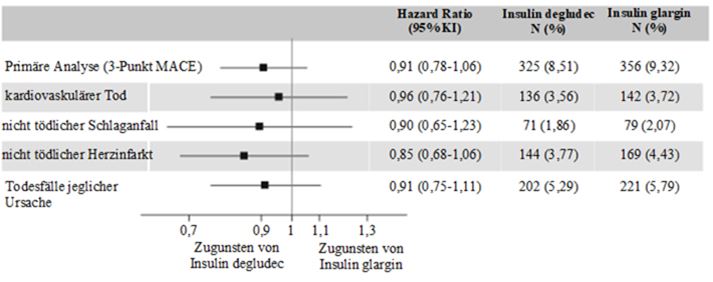
N: Anzahl von Probanden mit einem ersten EAC-bestätigten Ereignis während der Studie.
%: Prozentualer Anteil von Probanden mit erstem EAC-bestätigten Ereignis im Vergleich zur Anzahl der randomisierten Probanden.
EAC: Event Adjudication Commitee.
KI: Konfidenzintervall
Abbildung 2: Forest plot der Analyse des kombinierten 3-Komponenten-MACE und der einzelnen kardiovaskulären Endpunkte in DEVOTE.
Die Verbesserung des HbA1c, die mit Insulin degludec und Insulin glargin erreicht wurden, waren ebenso vergleichbar (Tabelle 5).
Die Behandlung mit Insulin degludec resultierte im Vergleich zur Behandlung mit Insulin glargin in einer Verringerung der Rate schwerer hypoglykämischer Ereignisse und des Anteils an Patienten mit mindestens einer schweren Hypoglykämie (Tabelle 4).
Tabelle 5: Ergebnisse aus DEVOTE
|
|
Insulin degludec1
|
Insulin glargin1
| |
N
|
3'818
|
3'819
| |
Mittlerer HbA1c (%)
| |
Ausgangswert
|
8.44
|
8.41
| |
2 Jahre der Behandlung
|
7.50
|
7.47
| |
|
Differenz:
0.008 [-0.05; 0.07]95%KI
| |
Hypoglykämie (pro 100 Patientenjahre Beobachtung)
| |
Schwer
|
3.70
|
6.25
| |
|
Hazard-Ratio:
0.60 [0.48; 0.76]95%KI
| |
Anteil der Patienten mit Hypoglykämie (Prozentualer Anteil der Patienten)
| |
Schwer
|
4.9
|
6.6
| |
|
Hazard-Ratio:
0.73 [0.60; 0.89]95%KI
|
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Die Wirksamkeit und Sicherheit von Ryzodeg wurden bei Kindern und Jugendlichen mit Diabetes mellitus Typ 1 in einer randomisierten, kontrollierten klinischen Studie über einen Zeitraum von 16 Wochen (n=362) untersucht. Patienten im Ryzodeg Studienarm waren 40 Kinder im Alter von 2-5 Jahren, 61 Kinder im Alter von 6-11 Jahren und 80 Jugendliche im Alter von 12-17 Jahren. Die einmal tägliche Gabe von Ryzodeg zusammen mit der Hauptmahlzeit zuzüglich der Gabe von Insulin Aspart zusammen mit den übrigen Mahlzeiten zeigte eine ähnliche Senkung des HbA1c-Werts zum Zeitpunkt Woche 16 und keine Unterschiede des Nüchternplasmaglucose- sowie des selbstgemessenen Plasmaglucosewerts gegenüber dem Vergleichspräparat Insulin Detemir, das einmal oder zweimal täglich gegeben wurde, zuzüglich der mahlzeitenbezogenen Gabe von Insulin Aspart. Zum Zeitpunkt Woche 16 betrug die mittlere tägliche Gesamtinsulindosis 0,88 gegenüber 1,01 Einheiten/kg im Ryzodeg bzw. Insulin Detemir Studienarm. Die Raten (Ereignisse pro Patientenjahr der Exposition) bestätigter Hypoglykämien (ISPAD [Internationale Gesellschaft für Kinder- und Jugenddiabetologie]-Definition 2009: 46,23 gegenüber 49,55) und nächtlicher bestätigter Hypoglykämien (5,77 gegenüber 5,40) waren bei Ryzodeg und Insulin Detemir vergleichbar. Jedoch war die Rate schwerer Hypoglykämien (0,26 gegenüber 0,07) im Ryzodeg numerisch höher (HR 3.2 [0.88; 11.66]95% KI).
Langzeitdaten
Es gibt keine klinisch relevante Entwicklung von Insulin-Antikörpern nach einer Langzeit-Behandlung mit Ryzodeg.
Weitere Informationen
Fruchtbarkeit
In Fortpflanzungsstudien mit Insulin Degludec bei Tieren wurden keinerlei nachteilige Auswirkungen auf die Fruchtbarkeit nachgewiesen.
PharmakokinetikAbsorption
Ryzodeg ist eine Mischung des Basalinsulins Degludec und des rasch wirkenden Insulins Aspart, bei der die Fähigkeit des Insulins Degludec zur Bildung von Multihexameren an der Injektionsstelle nach der subkutanen Injektion bewahrt bleibt. Insulin Degludec bildet ein Depot von Multihexameren im Unterhautgewebe aus dem sich die Insulin-Degludec-Monomere sukzessive lösen, was in einer langsamen und kontinuierlichen Abgabe von Insulin Degludec in den Blutkreislauf resultiert. Steady-State-Serum-Konzentrationen der basalen Komponente (Insulin Degludec) werden 2-3 Tagen nach der Dosisverabreichung von Ryzodeg erreicht.
Die rasche Resorption-Eigenschaft des etablierten Insulin Asparts bleibt bei Ryzodeg erhalten. Insulin Aspart erscheint 14 Minuten nach der Injektion im Blutkreislauf und die maximale Konzentration wird nach 72 Minuten erreicht.
Distribution
Die Affinität von Insulin Degludec zu Serumalbumin entspricht einer Plasmaproteinbindung von >99% in menschlichem Plasma. Insulin Aspart verfügt über eine geringfügige Bindung an Plasmaproteine (<10%), vergleichbar mit der von löslichem Humaninsulin.
Metabolismus
Der Abbau von Insulin Degludec und Insulin Aspart ist ähnlich dem von Humaninsulin; alle gebildeten Metaboliten sind inaktiv.
Elimination
Die Halbwertszeit nach subkutaner Injektion von Ryzodeg wird durch die Resorptionsrate aus dem subkutanen Gewebe bestimmt. Die Halbwertszeit der basalen Komponente (Insulin Degludec) beträgt im Steady-State unabhängig von der Dosis ca. 25 Stunden.
Linearität
Die totale Exposition mit Ryzodeg erhöht sich proportional zur steigenden Dosis der Basalkomponente (Insulin Degludec) und der mahlzeitenbezogenen Komponente (Insulin Aspart) bei Diabetes mellitus Typ 1 und Typ 2.
Kinetik spezieller Patientengruppen
Geschlecht
Es gibt keine klinisch relevanten Unterschiede der pharmakokinetischen Eigenschaften von Ryzodeg zwischen den Geschlechtern.
Ältere Patienten und Patienten mit eingeschränkter Nieren- und Leberfunktion
Es gibt keinen klinisch relevanten Unterschied der Pharmakokinetik von IDegAsp zwischen älteren und jüngeren Patienten oder zwischen gesunden Menschen und Patienten mit eingeschränkter Nieren- oder Leberfunktion.
Kinder und Jugendliche
Die pharmakokinetischen Eigenschaften von Ryzodeg bei Patienten mit Diabetes mellitus Typ 1 wurden nach der Anwendung einer Einzeldosis bei Kindern (6-11 Jahre) und Jugendlichen (12-18 Jahre) untersucht und mit den Ergebnissen von Erwachsenen verglichen.
Die pharmakokinetischen Eigenschaften der Insulin degludec Komponente von Ryzodeg im Steady State wurden in einer pharmakokinetischen Populationsanalyse bei Kindern ab dem Alter von 1 Jahr untersucht.
Die totale Exposition und die Maximalkonzentration von Insulin Aspart waren bei Kindern höher als bei Erwachsenen und bei Jugendlichen ähnlich wie bei Erwachsenen.
Die pharmakokinetischen Eigenschaften von Insulin degludec bei Kindern (1-11 Jahre) und Jugendlichen (12-18 Jahre) waren im Steady State vergleichbar mit denen, die bei Erwachsenen mit Diabetes mellitus Typ 1 beobachtet wurden. Die Gesamtexposition von Insulin degludec nach der Anwendung einer Einzeldosis war bei Kindern und Jugendlichen jedoch höher als bei Erwachsenen mit Diabetes mellitus Typ 1.
Präklinische DatenPräklinische Daten auf der Grundlage von Studien zur pharmakologischen Sicherheit, Toxizität bei wiederholter Gabe, Kanzerogenität und Reproduktionstoxizität ergaben keine Sicherheitsbedenken für Menschen.
Das Verhältnis von mitogener zu metabolischer Wirkung von Insulin Degludec entspricht dem von Humaninsulin.
Sonstige HinweiseInkompatibilitäten
Das Hinzufügen von Substanzen zu Ryzodeg kann zur Degradierung von Insulin Degludec und/oder Insulin Aspart führen.
Ryzodeg darf nicht zu Infusionslösungen hinzugefügt werden.
Dieses Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch oder als Ersatz mitgeführt
Ryzodeg Penfill: Nicht über 30 °C lagern. Ryzodeg Penfill nicht im Kühlschrank lagern. Innerhalb von 4 Wochen verbrauchen. Bewahren Sie die Ryzodeg Penfill Patronen in der Faltschachtel auf, um sie vor Licht zu schützen.
Ryzodeg Flextouch: Nicht über 30 °C lagern. Ryzodeg FlexTouch kann im Kühlschrank (2-8 °C) gelagert werden. Innerhalb von 4 Wochen verbrauchen.
Die Verschlusskappe aufgesetzt lassen, wenn Ryzodeg FlexTouchnicht in Gebrauch ist, um den Inhalt vor Licht zu schützen.
Alle Reste sind zu entsorgen.
Besondere Lagerungshinweise
Vorrat:
Im Kühlschrank (2-8 °C) lagern, jedoch nicht in der Nähe des Gefrierelementes.
Nicht einfrieren.
In der Originalverpackung aufbewahren.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Der Fertigpen Ryzodeg FlexTouch ist für die Anwendung mit NovoFine/NovoTwist-Einwegnadeln konzipiert.
Ryzodeg FlexTouch liefert 1 bis 80 Einheiten in Schritten von 1 Einheit. Die dem Fertigpen beiliegenden detaillierten Anweisungen sind zu befolgen.
RyzodegPenfill Patronen sind zur Anwendung mit Novo Nordisk Injektionsgeräten (Geräte für die wiederholte Verwendung) und NovoFine/NovoTwist-Einwegnadeln bestimmt.
Ryzodeg FlexTouch und Ryzodeg Penfill dürfen nur von einer einzigen Person verwendet werden. Die Patrone darf nicht wieder aufgefüllt werden.
Ryzodeg darf nicht verwendet werden, wenn die Lösung nicht klar und farblos aussieht.
Einmal gefrorenes Ryzodeg darf nicht mehr verwendet werden.
Die Injektionsnadeln sind nach jeder Injektion zu entsorgen.
Zulassungsnummer62627, 62648 (Swissmedic)
PackungenRyzodeg Penfill
Patronen 100 E/ml zu 3 ml (300 E pro Patrone): 5 (B)
Ryzodeg FlexTouch
Fertigpen 100 E/ml zu 3 ml (300 E pro Fertigpen): 5 (B)
ZulassungsinhaberinNovo Nordisk Pharma AG, Kloten
Domizil: Zürich
Stand der InformationNovember 2020
|


