Eigenschaften/WirkungenATC-Code: L04AC11
Wirkungsmechanismus
Siltuximab ist ein Mensch/Maus chimärer monoklonaler Antikörper, der mit löslichen bioaktiven Formen humanen Interleukins-6 (IL-6) stabile Komplexe mit hoher Affinität bildet. Siltuximab verhindert die Bindung von humanem IL-6 an lösliche und membrangebundene IL-6-Rezeptoren (IL-6R) und hemmt somit die Bildung des hexameren Signalkomplexes mit gp130 auf der Zelloberfläche. IL-6 ist ein proinflammatorisches Zytokin, das von einer Vielfalt von Zelltypen produziert wird, u.a. von T- und B-Zellen, Lymphozyten, Monozyten, Makrophagen und Fibroblasten sowie malignen Zellen. IL-6 ist nachweislich an verschiedenen normalen physiologischen Prozessen wie der Einleitung der Immunglobulinsekretion, der Einleitung der hepatischen Synthese von Akut-Phasen-Proteinen und der Stimulation der hämatopoetischen Vorläuferzellproliferation und -differenzierung beteiligt. Die Überproduktion von IL-6 bei chronisch-entzündlichen Erkrankungen und Malignitäten wurde mit Anämie und Kachexie in Verbindung gebracht und es wird angenommen, dass sie eine zentrale Rolle beim Ankurbeln der Plasmazellproliferation und systemischen Manifestationen bei Patienten mit multizentrischer Castleman-Krankheit spielt.
Pharmakodynamik
In-vitro hemmte Siltuximab dosisabhängig das Wachstum einer IL-6abhängigen murinen Plasmozytomzelllinie in Reaktion auf humanes IL-6. In Kulturen humaner Hepatomzellen wurde die IL-6-stimulierte Produktion des Akutphaseproteins Serum-Amyloid A durch Siltuximab dosisabhängig gehemmt. Gleichermassen wurde in Kulturen humaner Burkitt-Lymphom-Zellen die Produktion von Immunglobulin M (IgM) in Reaktion auf IL-6 von Siltuximab dosisabhängig gehemmt.
Biomarker
IL-6 stimuliert die Akutphasen-Ausschüttung von CRP. Der Wirkmechanismus von Siltuximab besteht in der Neutralisierung der Bioaktivität von IL-6, die indirekt durch die Suppression von CRP gemessen werden kann. Die Behandlung mit Sylvant bei MCD führt zu schnellen und nachhaltigen Verringerungen der CRP-Serumkonzentrationen. Die Messung der IL-6-Konzentrationen im Serum oder Plasma während der Behandlung sollte nicht als pharmakodynamischer Marker verwendet werden, da Siltuximab-neutralisierte Antikörper-IL-6-Komplexe die derzeitigen immunologisch-basierten IL-6-Quantifizierungsmethoden beeinträchtigen.
Klinische Wirksamkeit
Studie 1
Eine internationale, 2:1-randomisierte, doppelt verblindete, Placebo-kontrollierte Phase-2-Studie wurde durchgeführt, um die Wirksamkeit und Sicherheit von Sylvant (11 mg/kg alle 3 Wochen) im Vergleich zum Placebo in Kombination mit den besten supportiven Behandlungsmassnahmen bei Patienten mit MCD zu bewerten. Die Behandlung wurde bis zum Therapieversagen (definiert als Krankheitsprogression, basierend auf einer Verstärkung der Symptome, radiologischer Progression oder Verschlechterung des Leistungsstatus) oder einer inakzeptablen Toxizität fortgesetzt. Insgesamt wurden 79 Patienten mit symptomatischer MCD randomisiert und behandelt. Das durchschnittliche Alter betrug 47 Jahre (Bereich 20-74) im Sylvant-Arm und 48 Jahre (Bereich 27-78) im Placebo-Arm. Es wurden mehr männliche Patienten in den Placebo-Arm aufgenommen (85% im Placebo-Arm gegenüber 56% im Sylvant-Arm). Der ECOG-Leistungsstatus-Score (0/1/2) bei Therapiebeginn betrug 42%/45%/13% im Sylvant-Arm bzw. 39%/62%/0% im Placebo-Arm. Bei Therapiebeginn hatten 55% der Patienten im Sylvant-Arm und 65% der Patienten im Placebo-Arm zuvor systemische Therapien zur Behandlung von MCD erhalten. 30% der Patienten im Sylvant-Arm sowie 31% der Patienten im Placebo-Arm verwendeten Kortikosteroide. Der histologische Subtyp war in beiden Behandlungsarmen ähnlich mit 33% für den hyalin-vaskulären Subtyp, 23% für den plasmazytischen Subtyp und 44% für den gemischten Subtyp. Die krankheitsbezogenen Laborparameter sind in Tabelle 3 zusammengefasst. Die CRP- und Erythrozyten-Sedimentationsrate (ESR) zeigte eine breite Vielfalt über beide Behandlungsarme.
Tabelle 3: Krankheitsbezogene Laborparameter
|
|
Sylvant + BSC*
|
Placebo + BSC
| |
Patienten in der Intent-to-treat-Population
|
53
|
26
| |
Hämoglobin (g/l)-Mittelwert (Standardabweichung)
|
115,8 (24,70)
|
130,0 (25,70)
| |
Thrombozyten (109/l)-Mittelwert (Standardabweichung)
|
323,2 (156,58)
|
302,6 (123,54)
| |
Albumin (g/dl)-Mittelwert (Standardabweichung)
|
3,5 (0,76)
|
3,6 (0,46)
| |
ESR (mm/Std.)-Mittelwert (Standardabweichung)
|
68,3 (48,66)
|
34,6 (35,06)
| |
CRP (mg/l)-Mittelwert (Standardabweichung)
|
43,2 (53,63)
|
24,8 (34,53)
| |
Fibrinogen (µmol/l)-Mittelwert (Standardabweichung)
|
16,9 (7,52)
|
15,3 (7,48)
|
* Best Supportive Care (bestmögliche Begleitbehandlung).
Der primäre Endpunkt der Studie war das dauerhafte und symptomatische Ansprechen, definiert als Tumoransprechen, bewertet durch eine unabhängige Begutachtung und ein vollständiges Abklingen bzw. die Stabilisierung prospektiv erfasster MCD-Symptome für mindestens 18 Wochen ohne Therapieversagen.
Studie 1 demonstrierte eine statistisch signifikante Verbesserung der unabhängig begutachteten Tumor- und Symptomansprechrate im Sylvant-Arm, verglichen mit dem Placebo-Arm (34% vs. 0%, 95%-iges Konfidenzintervall: 11,1; 54,8; p=0,0012). Empfindlichkeitsanalysen unterstützten des Weiteren die primäre Endpunktanalyse, die eine signifikant höhere vom Prüfarzt bewertete dauerhafte Tumor- und Symptomansprechrate von 45% bei mit Sylvant behandelten Patienten verglichen mit 0% der mit Placebo behandelten Patienten zeigte (p <0,0001). Die allgemeine Tumoransprechrate wurde basierend auf den modifizierten Cheson-Kriterien sowohl durch die unabhängige Begutachtung als auch die Bewertung durch den Prüfarzt beurteilt.
Die wichtigsten Wirksamkeitsergebnisse aus Studie 1 sind in Tabelle 4 zusammengefasst.
Tabelle 4: Wirksamkeitsendpunkte aus Studie 1
|
Wirksamkeitsendpunkte:
|
Sylvant + BSC
|
Placebo + BSC
|
p-Werta
| |
Primärer Wirksamkeitsendpunkt
| |
Dauerhaftes Tumor- und symptomatisches Ansprechen (unabhängige Begutachtung)
|
18/53 (34,0%)
|
0/26 (0%)
|
0,0012
| |
Sekundäre Wirksamkeitsendpunkte
| |
Bestes Tumoransprechen (unabhängige Begutachtung)
|
20/53 (37,7%)
|
1/26 (3.8%)
|
0,0022
| |
Bestes Tumoransprechen (Begutachtung durch den Prüfarzt)
|
27/53 (50,9%)
|
0/26 (0%)
|
<0,0001
| |
Zeit bis zum Therapieversagen
|
Nicht erreicht
|
134 days
|
0,0084; HR 0,418
| |
Hämoglobinanstieg >15 g/l in Woche 13/Hämoglobinantwort-bewertbare Population
|
19/31 (61,3%)
|
0/11 (0%)
|
0,0002
| |
Dauer des Tumor- und Symptomansprechens (Tage) - unabhängige Begutachtung; Mittelwert (Minimum, Maximum)
|
340 (55, 676)b
|
Nicht zutreffendc
|
| |
Dauerhaftes komplettes Symptomansprechend
|
13/53 (24,5%)
|
0/26 (0%)
|
0,0037
| |
Dauer des dauerhaften kompletten Symptomansprechens (Tage) Mittelwert (Minimum, Maximum)
|
472 (169, 762)e
|
Nicht zutreffendc
|
|
a Angepasst für die Kortikosteroid-Verwendung bei der Randomisierung.
b Zum Zeitpunkt der primären Analyse wurden Daten für 19 von 20 Tumor- und Symptom-Respondern aufgrund eines fortlaufenden Ansprechens zensiert.
c Nichtzutreffend, es gab keine Responder im Placebo-Arm, daher ist die Dauer nicht anwendbar.
d Komplettes Symptomansprechen ist definiert als 100%ige Senkung des MCD-Gesamtsymptomscores vom Therapiebeginn, aufrechterhalten für mindestens 18 Wochen vor einem Therapieversagen.
e Daten aus 11 von 13 dauerhaften kompletten Symptom-Respondern wurden zensiert aufgrund eines fortgesetzten Ansprechens.
MCD-bezogene Anzeichen und Symptome wurden prospektiv erfasst. Ein Gesamtscore aller Symptome (bezeichnet als der MCD-bezogene Gesamtsystemscore) ist die Summe der Schweregrade (NCI-CTCAE-Grade) der MCD-bezogenen Anzeichen und Symptome [allgemeine MCD-bezogene (Ermattung, Unwohlsein, Hyperhidrose, Nachtschweiss, Fieber, Gewichtsabnahme, Anorexie, Tumorschmerzen, Atemnot und Juckreiz), Autoimmunerscheinungen, Flüssigkeitsretention, Neuropathie und Hauterkrankungen]. Die prozentuale Veränderung der MCD-bezogenen Anzeichen und Symptome und der MCD-bezogene Gesamt-Symptomscore in jedem Zyklus wurde berechnet. Ein komplettes Symptomansprechen wurde definiert als 100%ige Senkung des MCD-bezogenen Gesamtsymptomscores gegenüber dem Therapiebeginn, die für mindestens 18 Wochen aufrechterhalten wurde, bevor ein Therapieversagen eintrat.
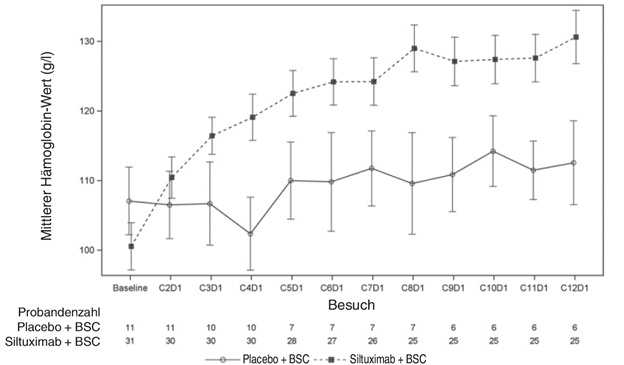
Das Hämoglobin-Ansprechen wurde definiert als Veränderung seit Therapiebeginn um ≥15 g/l in Woche 13. Der durchschnittliche Hämoglobin-Wert je Zyklus während der verblindeten Behandlungsperiode ist in Abbildung 1 dargestellt.
Abbildung 1: Durchschnittlicher Hämoglobin-Wert je Zyklus während der verblindeten Behandlungsperiode
Die einjährige Überlebensrate betrug 100% im Sylvant-Arm und 92% im Placebo-Arm.
Subgruppenanalysen:
Analysen bezüglich der primären und sekundären Endpunkte zu verschiedenen Subgruppen, einschliesslich Alter (<65 Jahre und ≥65 Jahre); ethnische Herkunft (weisshäutig oder nicht); Region (Nordamerika, EMEA und Asien-Pazifik); Kortikosteroid-Verwendung bei Therapiebeginn (ja und nein); vorangegangene Therapie (ja und nein) und MCD-Histologie (plasmatische und gemischte Histologie) zeigten übereinstimmend, dass die Therapiewirkung im Sylvant-Arm besser war, mit Ausnahme der hyalin-vaskulären Subgruppe. Eine durchgehend bessere Therapiewirkung bei mit Sylvant behandelten Patienten wurde in der hyalin-vaskulären Subgruppe über alle wichtigen sekundären Endpunkte nachgewiesen.
Studie 2
Zusätzlich zu Studie 1 sind Wirksamkeitsdaten bei Patienten mit der Castleman-Krankheit (CD) aus einer einarmigen Phase-1-Studie (Studie 2) verfügbar. In dieser Studie wurden 37 CD Patienten mit Sylvant behandelt. 35 dieser Patienten hatten MCD. Insgesamt wurden 16 Patienten mit MCD mit 11 mg/kg alle 3 Wochen behandelt. Die demografischen Patientendaten und Krankheitsmerkmale für alle 3 Wochen mit 11 mg/kg behandelte Patienten waren ähnlich denen in Studie 1. Das mittlere Alter betrug 51 Jahre (21-76) und 50% der Patienten waren Männer. Das ECOG-Leistungsstatus-Score (0/1/2) bei Therapiebeginn war 6%/69%/25%. Neunundsechzig Prozent (69%) der Patienten hatten zuvor systemische Therapien für MCD erhalten. Der histologische Subtyp betrug 44% für den hyalin-vaskulären Subtyp, 50% für den plasmazytischen Subtyp und 6% für den gemischten Subtyp. Dieser mittlere (Standardabweichung) Hämoglobin-Spiegel betrug 125 (23) g/l.
Der in Studie 1 beobachtete klinische Nutzen wurde durch Studie 2 unterstützt. Die durchschnittliche Dauer der Sylvant-Therapie betrug 1,278 Tage und die durchschnittliche Anzahl der Verabreichungen von Sylvant betrug 51 bei Sylvant-Patienten. Bei den 16 alle 3 Wochen mit 11 mg/kg behandelten MCD-Patienten betrug die allgemeine Tumoransprechrate nach unabhängiger Begutachtung 43,8% mit einem 6,3%-igen kompletten Ansprechen. Das Ansprechen sämtlicher Tumore dauerte über >18 Wochen an. Für Patienten mit einem Hämoglobin-Wert unterhalb der Untergrenze des Normalwertes betrug die Hämoglobin-Ansprechrate in Woche 13 50%. Die einjährige Überlebensrate von mit Sylvant behandelten Patienten betrug 100%.
Studie 3
In einer offenen, multizentrischen, nicht randomisierten Phase-2-Studie wurden die Sicherheit und Wirksamkeit einer verlängerten Behandlung mit Siltuximab bei 60 Patienten mit MCD beurteilt, die zuvor in Studie 1 (41 Patienten) oder Studie 2 (19 Patienten) aufgenommen worden waren. Die mediane Dauer der Behandlung mit Siltuximab betrug 5,52 Jahre (Bereich: 0,8 bis 10,8 Jahre); über 50% der Patienten wurden ≥5 Jahre lang mit Siltuximab behandelt. Nach einer medianen Nachbeobachtungsphase von 6 Jahren war keiner der 60 Patienten verstorben, und bei 58 der 60 Patienten wurde die Aufrechterhaltung der Krankheitskontrolle gezeigt.
|

