Eigenschaften/WirkungenATC-Code
L01XX51
Wirkungsmechanismus
Talimogen laherparepvec ist ein onkolytisches Virus, abgeleitet von HSV-1. Talimogen laherparepvec wurde modifiziert, sodass es sich in Tumoren repliziert und das immunstimulierende Protein humanes GM-CSF produziert. Talimogen laherparepvec führt zum Absterben von Tumorzellen sowie zur Freisetzung von Antigenen, die von Tumorzellen abstammen. Es wird angenommen, dass es zusammen mit GM-CSF eine systemische Anti-Tumor-Immunantwort und eine Effektor-T-Zell-Antwort fördert. Mäuse mit einer vollständigen Rückbildung der Primärtumoren nach der Behandlung waren resistent gegenüber einer nachfolgenden Tumor-Reexposition.
Zu den Modifikationen an Talimogen laherparepvec gegenüber HSV-1 zählen die Deletion von ICP34.5 und ICP47. Während antivirale Immunantworten normale Zellen nach einer Infektion mit Talimogen laherparepvec schützen, wurde bei Tumoren gezeigt, dass diese anfällig für Schädigungen und Zelltod durch ICP34.5-defiziente HSV-1-Viren, einschliesslich Talimogen laherparepvec, sind. Die Entfernung von ICP47 verhindert die Downregulation von antigenpräsentierenden Molekülen und erhöht die Expression des HSV-US11-Gens, was wiederum die virale Replikation in Tumorzellen fördert.
Klinische Wirksamkeit und Sicherheit
Pivotale Studie
Die Sicherheit und Wirksamkeit der IMLYGIC-Monotherapie im Vergleich zu subkutan verabreichtem GM-CSF wurden in einer multinationalen, unverblindeten, randomisierten klinischen Phase-3-Studie bei Patienten mit einem Melanom im Stadium IIIB, IIIC und IV untersucht, das als nicht chirurgisch resezierbar eingestuft wurde. Eine vorangegangene systemische Melanom-Behandlung war zulässig, aber nicht erforderlich. Patienten mit aktiven Hirnmetastasen, Knochenmetastasen, extensiver viszeraler Erkrankung, primärem Augen- oder Schleimhautmelanom, Anzeichen einer Immunsuppression oder Patienten, die eine systemische antiherpetische Behandlung erhielten, wurden aus der Studie ausgeschlossen.
Die Patienten wurden im Verhältnis 2:1 randomisiert und erhielten entweder IMLYGIC oder GM-CSF (N = 436; IMLYGIC: N = 295, GM-CSF: N = 141). IMLYGIC wurde als intraläsionale Injektion mit einer Anfangskonzentration von 106 (1 Million) PFU/ml an Tag 1 verabreicht, gefolgt von 108 (100 Millionen) PFU/ml an Tag 21 und danach alle zwei Wochen mit einer Dosis von bis zu 4 ml. GM-CSF wurde in sich wiederholenden Intervallen während 14 Tagen mit einer täglichen Dosis von 125 µg/m2 subkutan verabreicht, gefolgt von einer 14tägigen behandlungsfreien Phase.
Um eine verzögerte immunvermittelte Anti-Tumor-Wirkung zu ermöglichen, wurden die Patienten für mindestens sechs Monate lang behandelt oder bis sie keine injizierbaren Läsionen mehr zeigten. Während dieses Zeitraums wurde die Behandlung auch dann fortgesetzt, wenn sich die vorhandenen Läsionen vergrösserten und/oder sich neue Läsionen bildeten, ausser der Patient entwickelte eine nicht tolerierbare Toxizität oder der klinische Zustand des Patienten machte den Beginn einer neuen Therapie erforderlich. Nach 6 Monaten der Behandlung mussten die Patienten die Behandlung bis zu einer klinisch relevanten Krankheitsprogression fortsetzen (d.h. Krankheitsprogression im Zusammenhang mit einem Rückgang des Performance-Status und/oder es waren nach Meinung des Prüfers alternative Therapien erforderlich).
Patienten, die nach zwölf Monaten auf die Behandlung ansprachen, konnten die Behandlung für bis zu weitere sechs Monate fortsetzen. Die mittlere (SD) Behandlungsdauer der ITT-Population betrug im GM-CSF-Arm 15,76 Wochen (15,79) und im IMLYGIC-Arm 26,83 (18,39) Wochen. Der primäre Endpunkt war die dauerhafte Ansprechrate (DRR) [definiert als der prozentuale Anteil an Patienten mit einem vollständigen Ansprechen (CR) oder teilweisen Ansprechen (PR), welches für mindestens 6 Monate aufrechterhalten werden konnte] gemäss verblindeter zentraler Bewertung der ansprechenden Patienten. Die sekundären Endpunkte umfassten das Gesamtüberleben (OS), die Gesamtansprechrate (ORR) [PR+CR], die Zeit bis zum Ansprechen, die Dauer des Ansprechens und die Zeit bis zum Therapieversagen (Zeit von der Randomisierung bis zur ersten Episode einer klinisch relevanten Krankheitsprogression ohne Ansprechen nach dem Progressionsereignis, oder bis zum Tod).
Das mittlere Alter betrug 63 (Bereich: 22 bis 94) Jahre, wobei 26,5% über 65 Jahre alt und 23,3% über 74 Jahre alt waren. Die Mehrheit der Patienten waren Kaukasier (98%). 57% der Studienpopulation waren männlich und 70% der Patienten hatten zu Studienbeginn einen ECOG-Performance-Status 0. Von den eingeschlossenen Patienten hatten 22% eine Erkrankung im Stadium IVM1c und 53% der Patienten hatten zuvor neben Operation, adjuvanter Therapie oder Bestrahlung eine Melanomtherapie wie Chemotherapie und Zytokin-basierte Immuntherapie erhalten. Insgesamt waren 58% aller in die Studie eingeschlossenen Patienten zu Beginn seropositiv für Wildtyp HSV-1 und 32,6% seronegativ. Der HSV-1-Serostatus für die restlichen 9,4% war unbekannt.
Durch die Behandlung mit IMLYGIC erhöhte sich in der ITT-Population die DRR statistisch signifikant (siehe Tabelle 3).
Tabelle 3: Zusammenfassung der Ergebnisse der ITT-Population der Pivotalstudie mit IMLYGIC
|
|
Studienendpunkt
|
IMLYGIC N = 295
|
GM-CSF N = 141
| |
Dauerhafte Ansprechrate
|
primär
|
16,3% (n = 48)
(95% KI: 12,1, 20,5)
|
2,1% (n = 3)
(95% KI: 0,0, 4,5)
| |
Odds Ratio 8,9; (95% KI: 2,7, 29,2)
p < 0,0001
| |
Gesamtansprechrate
(% CR, % PR)
|
sekundär
|
26,4% (n = 78)
(95% KI: 21,4%, 31,5%)
(10,8% CR, 15,6% PR)
|
5,7% (n = 8)
(95% KI: 1,9%, 9,5%)
(0,7% CR, 5% PR)
| |
Gesamtüberleben
|
sekundär
|
Median 23,3
(95% KI: 19,5, 29,6) Monate
|
Median 18,9
(95% KI: 16,0, 23,7) Monate
| |
HR: 0,79; (95% KI: 0,62, 1,00) p = 0,051
| |
Dauer des Ansprechens (anhaltendes Ansprechen zum Zeitpunkt der letzten Tumor-Auswertung)
|
sekundär
|
Nicht erreicht
(Bereich: > 0,0 bis > 16,8 Monate)
|
Median 2,8 Monate
(Bereich: 1,2 bis > 14,9 Monate)
| |
HR: 0,46; (95% KI: 0,35, 0,60)
| |
Zeit bis zum Ansprechen (Median)
|
sekundär
|
4,1 Monate
|
3,7 Monate
| |
Zeit bis zum Therapieversagen (Median)
|
sekundär
|
8,2 Monate
(95% KI: 6,5, 9,9)
|
2,9 Monate
(95% KI: 2,8, 4,0)
| |
HR: 0,42; (95% KI: 0,32, 0,54)
|
Bei 56 der mit IMLYGIC behandelten Responder (72%) dauerte das Ansprechen zum Zeitpunkt der Primäranalyse noch an. Bei 42 der Responder (54%) nahm die Gesamtgrösse der vorhandenen Läsionen um ≥25% zu und/oder sie entwickelten eine oder mehrere neue Läsionen, bevor sie schlussendlich ein Ansprechen erreichten (Pseudoprogression).
In einer Analyse zur Untersuchung der systemischen Aktivität von IMLYGIC zeigten 27 von 79 Patienten (34,2%) eine Gesamtabnahme der nicht mit IMLYGIC injizierten nichtviszeralen Läsionen von ≥50%. Bei 8 von 71 Patienten (11,3%) lag die Gesamtabnahme der nicht mit IMLYGIC behandelten viszeralen Läsionen bei ≥50%.
Zum Zeitpunkt des medianen Follow-ups von 44,4 Monaten betrug das mediane Gesamtüberleben bei IMLYGIC 23,3 Monate (Bereich: 19,5, 29,6 Monate) und bei GM-CSF 18,9 Monate (Bereich: 16,0, 23,7 Monate) (Hazard Ratio [HR] 0,79 (95% KI: 0,62, 1.00), p = 0,051, Abbildung 4). Die Gesamtüberlebensrate war nach 1, 2, 3 und 4 Jahren bei Patienten, die dem IMLYGIC-Arm zugewiesen wurden, höher (73,7%, 49,8%, 38,6% bzw. 32,6%) als bei Patienten, die GM-CSF erhielten (69,1%, 40,3%, 30,1% bzw. 21,3%) (siehe Tabelle 4).
Es wurden insgesamt keine Unterschiede bezüglich Sicherheit oder Wirksamkeit zwischen älteren (≥65 Jahre) und jüngeren erwachsenen Patienten festgestellt.
Abbildung 4: Kaplan-Meier-Plot – Gesamtüberleben (ITT Population)
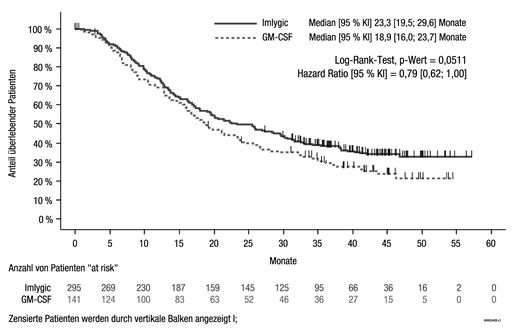
Patienten, die nicht als verstorben erfasst worden sind, sind als zensiert eingeschlossen.
Explorative Subgruppenanalysen für DRR und Gesamtüberleben nach Krankheitsstadium wurden ebenfalls durchgeführt (siehe Abbildung 5 und Tabelle 4). Obwohl die Power der Pivotalstudie nicht auf die Beurteilung der Wirksamkeit in diesen individuellen Subgruppen ausgelegt war, hatten Patienten ohne viszerale Erkrankung durch die Behandlung mit IMLYGIC einen grösseren Nutzen als jene mit einer weiter fortgeschrittenen Erkrankung.
Tabelle 4: Zusammenfassung der Ergebnisse einer explorativen Analyse der Pivotalstudie mit IMLYGIC
|
|
DRR (%)
|
ORR (%)
|
OS (Hazard Ratio)
| |
IMLYGIC
|
GM-CSF
|
IMLYGIC
|
GM-CSF
|
IMLYGIC versus GM-CSF
| |
Stadium IIIB/IIIC/ Stadium IVM1a
(IMLYGIC: n = 163; GM-CSF: n = 86)
|
25,2
|
1,2
|
40,5
|
2,3
|
0,57 (95% KI: 0,40; 0,80)
| |
Stadium IVM1b/IVM1c
(IMLYGIC: n = 131; GM-CSF: n = 55)
|
5,3
|
3,6
|
9,2
|
10,9
|
1,07 (95% KI: 0,75; 1,52)
|
Abbildung 5: Explorativer Kaplan-Meier-Plot des Gesamtüberlebens nach randomisiertem Behandlungsarm für die Krankheitsstadien IIIB, IIIC und IVM1a
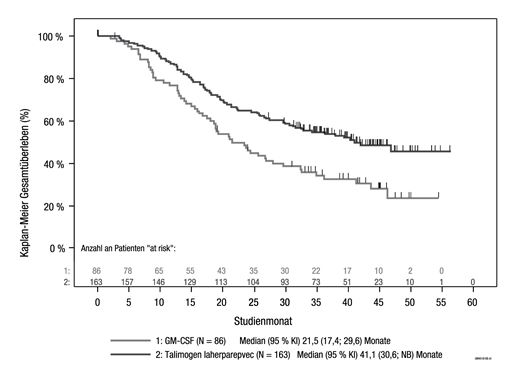
Zensierte Patienten werden durch vertikale Balken angezeigt I.
Patienten, die nicht als verstorben erfasst worden sind, sind als zensiert eingeschlossen.
Die ITT-Population umfasst alle Patienten, die zum Erhalt einer Studienbehandlung randomisiert worden sind. Die Patienten werden anhand der randomisierten Behandlung analysiert.
Ein Monat = 365,25/12 Tage. NB = nicht bestimmbar.
Aufgrund des explorativen Charakters der Analyse und basierend auf der aktuellen Datenlage ist nicht erwiesen, dass IMLYGIC mit einem Effekt auf das Gesamtüberleben assoziiert ist.
|


