ZusammensetzungWirkstoffe
Phenylephrinum (ut Phenylephrini hydrochloridum).
Hilfsstoffe
Natrii chloridum, acidum citricum monohydricum, natrii citras dihydricus, natrii hydroxidum, aqua ad injectabile.
1 Fertigspritze mit 10 ml enthält 36,8 mg Natrium.
Indikationen/Anwendungsmöglichkeiten·Behandlung der Hypotonie während der Allgemeinanästhesie und der Spinal- und Periduralanästhesie (einschliesslich Sectio caesarea);
·Präventivbehandlung der Hypotonie während der Spinalanästhesie (einschliesslich Sectio caesarea).
Dosierung/AnwendungPhenylephrin Aguettant wird intravenös (Bolus) verabreicht.
Die Dosis muss an die Pressor-Antwort angepasst werden.
Die normale Dosis beträgt 0,05-0,1 mg (1-2 ml) als Bolus und kann bis zum Erreichen der gewünschten Wirkung wiederholt werden.
Die Dosen können bei schwerer Hypotonie erhöht werden, ohne 0,1 mg (2 ml) als Bolus zu überschreiten.
Phenylephrin Aguettant darf nur von medizinischem Fachpersonal mit entsprechender Schulung und einschlägiger Erfahrung verabreicht werden. Die Fertigspritze ist nicht zur Verwendung in einer Spritzenpumpe geeignet.
Spezielle Dosierungsanweisungen
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit eingeschränkter Nierenfunktion kann eine niedrigere Dosis Phenylephrin notwendig sein.
Patienten mit Leberfunktionsstörungen
Bei Patienten mit Leberzirrhose kann eine höhere Dosis Phenylephrin notwendig sein.
Kinder und Jugendliche
Die Anwendung und Sicherheit von Phenylephrin bei Kindern und Jugendlichen ist bisher nicht geprüft worden. Die Anwendung bei Kindern und Jugendlichen wird daher nicht empfohlen.
KontraindikationenPhenylephrin darf nicht angewendet werden:
·bei Patienten mit Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung;
·bei Patienten mit schwerer Hypertonie, ventrikulärer Tachykardie, Engwinkelglaukom;
·in Kombination mit nicht-selektiven Monoaminoxidase (MAO)-Hemmern, wegen des Risikos einer paroxysmalen Hypertonie und einer Hyperthermie mit möglicherweise tödlichen Folgen;
·bei Patienten mit schwerer Hyperthyreose.
Warnhinweise und VorsichtsmassnahmenWährend der Behandlung muss der arterielle Blutdruck überwacht werden.
Phenylephrin sollte mit Vorsicht verabreicht werden an Patienten mit:
·Diabetes mellitus;
·arteriellem Bluthochdruck;
·Aneurysma,
·unkontrollierter Hyperthyreose;
·myokardialer Pathologie;
·koronaren Herzerkrankungen und chronischen Herzerkrankungen;
·Bradykardie;
·partiellem Herzblock;
·Tachykardie;
·Arrhythmie;
·Angina pectoris (Phenylephrin kann bei Patienten mit koronarer Gefässerkrankung und einer Anamnese von Angina eine Angina herbeiführen oder verschlimmern);
·leichter peripherer Durchblutungsstörung;
·schwere Arteriosklerose.
Phenylephrin kann eine Reduzierung der Herzleistung hervorrufen. Daher sollte die Verabreichung an Patienten mit Arteriosklerose, an ältere Menschen und an Patienten mit eingeschränkter zerebraler oder koronarer Durchblutung mit Vorsicht erfolgen.
Bei Patienten mit Herzinsuffizienz oder kardiogenem Schock kann Phenylephrin die Herzinsuffizienz infolge induzierter Gefässverengung (Anstieg der Nachlast) verschlimmern.
Bei Patienten mit Erkrankungen wie einer verminderten Herzleistung oder einer peripheren Arterienerkrankung sollten die Vitalfunktionen des Körpers häufig kontrolliert werden und die Untergrenze des systolischen Blutdruckes sollte als Kriterium gelten, um die Dosis zu senken oder Phenylephrin abzusetzen.
Bei der Phenylephrin-Injektion sollte ein besonderes Augenmerk darauf gelegt werden, Extravasation zu vermeiden, da diese eine Gewebsnekrose verursachen kann.
Bei Patienten mit eingeschränkter Nierenfunktion kann eine niedrigere Dosis Phenylephrin notwendig sein.
Bei Patienten mit Leberzirrhose kann eine höhere Dosis Phenylephrin notwendig sein.
Von der gleichzeitigen Verabreichung von Phenylephrin Aguettant und den folgenden Arzneimitteln wird aufgrund der Risiken für Gefässverengung und/oder für eine hypertensive Krise im Zusammenhang mit seiner indirekten sympathomimetischen Wirkung abgeraten:
·dopaminerge (Bromocriptin, Cabergolin, Lisurid, Pergolid) oder gefässverengende (Dihydroergotamin, Ergotamin oder Methysergid, Methylergometrin) Mutterkornalkaloide
·Zusammen mit Linezolid
Dies ist bei Patienten mit einer strengen natriumarmen Diät zu berücksichtigen.
Bei gleichzeitiger Verabreichung von Phenylephrin Aguettant und oxytocischen Arzneimitteln (Oxytocin, neurohypophysische Extrakte, Mutterkornalkaloide usw.) wird die sympathomimetische Wirkung verstärkt.
Natrium
Dieses Arzneimittel enthält 36,8 mg Natrium pro Fertigspritze aus 10 ml, entsprechend 1,8 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme von 2 g.
InteraktionenKontraindizierte Kombinationen:
Nicht-selektive Monoaminoxidase (MAO)-Hemmer (Iproniazid, Nialamid)
Paroxysmale Hypertonie, Hyperthermie mit möglicherweise tödlichen Folgen. Wegen der lang anhaltenden Wirkung von MAO-Hemmern, ist diese Wechselwirkung auch noch 15 Tage nach der letzten Einnahme von MAO-Hemmern möglich.
Nicht empfehlenswerte Kombinationen
Dopaminerge Ergotalkaloide (Bromocriptin, Cabergolin, Lisurid, Pergolid):
Risiko von Vasokonstriktion und/oder hypertensiver Krise.
Vasokonstriktorisch wirkende Ergotalkaloide (Dihydroergotamin, Ergotamin, Methylergometrin, Methysergid):
Risiko von Vasokonstriktion und/oder hypertensiver Krise.
Trizyklische Antidepressiva (z.B. Imipramin):
Paroxysmale Hypertonie mit möglichem Auftreten von Arrhythmien (Hemmung des Eindringens von Adrenalin oder Noradrenalin in Sympathikusfasern).
Noradrenerge-serotonerge Antidepressiva (Milnacipran, Venlafaxin):
Paroxysmale Hypertonie mit möglichem Auftreten von Arrhythmien (Hemmung des Eindringens von Adrenalin oder Noradrenalin in Sympathikusfasern).
Selektive Monoaminoxidase-A (MAO)-Hemmer (Moklobemid, Toloxaton):
Risiko von Vasokonstriktion und/oder hypertensiver Krise.
Linezolid:
Risiko von Vasokonstriktion und/oder hypertensiver Krise.
Guanethidin und verwandte Produkte:
Erheblicher Blutdruckanstieg (mit Senkung des Sympathikotonus und/oder Hemmung des Eindringens von Adrenalin oder Noradrenalin in Sympathikusfasern verbundene Hyperreaktivität).
Kann eine Kombination nicht vermieden werden, sollten niedrigere Sympathomimetika-Dosen mit Vorsicht verwendet werden.
Herzglykoside, Chinidin:
Erhöhtes Risiko von Arrhythmien.
Sibutramin:
Paroxysmale Hypertonie mit möglichem Auftreten von Arrhythmien (Hemmung des Eindringens von Adrenalin oder Noradrenalin in Sympathikusfasern).
Halogenierte flüchtige Anästhetika (Desfluran, Enfluran, Halothan, Isofluran, Methoxyfluran, Sevofluran):
Risiko perioperativer hypertensiver Krisen und Arrhythmien.
Kombinationen, bei denen Vorsichtsmassnahmen erforderlich sind:
Wehenmittel
Die Wirkung von bei Druck aktiven sympathomimetischen Aminen wird potenziert. Daher können einige Wehenmittel eine schwere persistierende Hypertonie verursachen und es können während der Nachgeburtsphase Schlaganfälle auftreten.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen keine tierexperimentellen Studien zur Auswirkung auf die Schwangerschaft, Embrionalentwicklung, Entwicklung des Föten und/oder die postnatale Entwicklung vor. Das potentielle Risiko für den Menschen ist nicht bekannt.
Während der Schwangerschaft sollte das Arzneimittel nicht verabreicht werden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Es ist nicht bekannt, ob Phenylephrin in die Muttermilch übertritt. Phenylephrin Aguettant sollte während der Stillzeit nicht verwendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt. Unter Anwendung von Phenylephrin wurde gelegentlich von Übelkeit und Kopfschmerzen als unerwünschte Wirkungen berichtet. Wenn ein Patient davon betroffen ist, sollte er keine Fahrzeuge lenken oder Maschinen bedienen.
Unerwünschte Wirkungen«Sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (<1/100, ≥1/1000), «selten» (<1/1000, ≥1/10'000), «sehr selten» (<1/10'000).
Die meisten unerwünschten Wirkungen von Phenylephrin sind dosisabhängig und entsprechen dem erwarteten pharmakodynamischen Profil.
Die am häufigsten auftretenden Nebenwirkungen von Phenylephrin sind Bradykardie, hypertensive Krisen, Übelkeit und Erbrechen. Hypertonie tritt häufiger bei hohen Dosierungen auf.
Die am häufigsten berichtete kardiovaskuläre Nebenwirkung scheint die Bradykardie zu sein, wahrscheinlich verursacht durch die Barorezeptor-vermittelte vagale Stimulation und im Einklang mit der pharmakologischen Wirkung von Phenylephrin.
Folgende Nebenwirkungen können auftreten:
Erkrankungen des Immunsystems
Hypersensitivität.
Stoffwechsel und Ernährungsstörungen
Anormaler Glukosezyklus.
Psychiatrische Erkrankungen
Erregbarkeit, Unruhe, Angst, psychotische Zustände, Verwirrung.
Erkrankungen des Nervensystems
Gelegentlich: Kopfschmerzen, Kribbeln, Schweregefühl im Kopf, Nervosität, Schlaflosigkeit, Parästhesie, Tremor.
Augenerkrankungen
Mydriasis, Verschlimmerung eines vorbestehenden Engwinkelglaukoms.
Herzerkrankungen
Gelegentlich: Reflexbradykardie, Arrhythmien, Tachykardie, Herzstillstand, Angina pectoris, Palpitationen, myokardiale Ischämie.
Gefässerkrankungen
Zerebrale Blutung, Hypertonie, Hypotonie mit Schwindelgefühl, Ohnmacht, vasomotorische Störungen, Kältegefühl auf der Haut, Blässe.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Dyspnoe, Lungenödem.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Übelkeit, übermässiger Speichelfluss, Erbrechen.
Erkrankungen der Haut und des Unterhautzellgewebes
Diaphorese, Schaudern, Schweissabsonderung, blasse Haut.
Erkrankungen der Nieren und Harnwege
Schwierigkeiten beim Wasserlassen, Harnstauung.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Nekrotische Extravasation an der Einstichstelle.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Bei Überdosierung, vor allem bei direkter i.v. Verabreichung, können Kammerextrasystolen und selbst kurze Anfälle von Kammertachykardie beobachtet werden.
Behandlung
Im Falle eines übermässigen Blutdruckanstieges kann dieser sofort mit einem α-adrenergen Blocker, z.B. Phentolamin, gemildert werden.
Eigenschaften/WirkungenATC-Code
C01CA06
Wirkungsmechanismus
Die durch Phenylephrin ausgelöste Vasokonstriktion hält 20 Minuten nach intravenöser Injektion und bis zu 50 Minuten nach subkutaner Injektion an. Phenylephrin verlangsamt die Herzfrequenz und erhöht das Schlagvolumen ohne die Herzfrequenz zu beeinflussen.
Phenylephrin ist ein postsynaptisches alpha-Rezeptor-Stimulans mit geringer Wirkung auf die Betarezeptoren des Herzens. In therapeutischen Dosen führt es zu keiner oder nur geringer Stimulation des Rückenmarks oder Grosshirns. Bei wiederholter Injektion können vergleichbare Wirkungen erzielt werden.
Pharmakodynamik
Phenylephrin wirkt vornehmlich auf das kardiovaskuläre System. Parenterale Verabreichung verursacht beim Menschen und bei anderen Spezies einen Anstieg des systolischen und diastolischen Blutdrucks. Mit der Pressor-Antwort auf Phenylephrin geht ausgeprägte Reflexbradykardie einher, die mit Atropin blockiert werden kann; nach Atropin-Verabreichung erhöhen hohe Dosen des Arzneimittels die Herzfrequenz nur geringfügig.
Beim Menschen ist das Herzminutenvolumen leicht verringert und der periphere Widerstand erheblich erhöht. Die Zirkulationszeit ist leicht verlängert und der venöse Druck leicht erhöht; es liegt keine ausgeprägte Venenkonstriktion vor. Die meisten Gefässbetten sind eingeengt; die Durchblutung von Nieren,Splanchnikus, Haut und Extremitäten ist verringert, die koronare Durchblutung ist erhöht. Die Lungengefässe sind eingeengt und der pulmonale Arteriendruck ist erhöht.
Klinische Wirksamkeit
Keine Daten verfügbar.
PharmakokinetikAbsorption
Bioverfügbarkeit bei oraler Aufnahme beträgt 38%.
Distribution
Die Distributions-Halbwertszeit beträgt 5 Minuten und das Distributions-Volumen ist grösser als 40 Liter. Nach i.v. Applikation ist die zentrale Verteilung vergleichbar mit dem Extrazellulärvolumen (ca. 40 Liter), wobei das Steady-State Distributionsvolumen bei 340 Liter liegt.
Metabolismus
Phenylephrin wird zu M-Hydroxymandelsäure und zu phenolischen Konjugaten metabolisiert. Der Abbau zu phenolischen Konjugaten tritt verstärkt bei oraler und weniger bei intravenöser Applikation auf. Die Metabolisierung findet in der Leber und in der Darmwand statt.
Elimination
Bei i.v. Applikation beträgt die Eliminations-Halbwertszeit 2-3 Stunden und die renale Exkretion liegt bei 80-86%, wobei bei der Ausscheidung im Urin 16% des Wirkstoffes unverändert ausgeschieden werden. Die Eliminations-Halbwertszeit beträgt 2 bis 3 Stunden.
Kinetik spezieller Patientengruppen
Keine Daten verfügbar.
Präklinische DatenEs gibt keine experimentellen Tierstudien zur Toxizität von Phenylephrin für die Fortpflanzung und Entwicklung.
Präklinische Daten an Ratten und Mäuse geben keinen Hinweis auf ein karzinogenes oder gentoxisches Gefährdungspotential.
Sonstige HinweiseInkompatibilitäten
Die Fertigspritzen sind gebrauchsfertig und dürfen nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Die Zubereitung enthält kein Konservierungsmittel. Aus mikrobiologischen Gründen ist die gebrauchsfertige Zubereitung unmittelbar nach Öffnung der Blisterverpackung zu verwenden.
Eventuell verbleibende Reste in der Fertigspritze sollen entsorgt werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25 °C) und ausser Reichweite von Kindern aufbewahren.
Die Blisterverpackung in der Originalverpackung, vor Licht geschützt aufbewahren.
Hinweise für die Handhabung
Die Fertigspritze ist zum einmaligen Gebrauch für einen Patienten bestimmt.
Der Inhalt einer ungeöffneten und unbeschädigten Blisterverpackung ist steril. Die Blisterverpackung soll erst unmittelbar vor dem Gebrauch geöffnet werden.
Die äussere Oberfläche der Spritze ist bis zur Öffnung der Blisterverpackung steril. Vor Gebrauch die Blisterverpackung auf Beschädigungen prüfen.
1. Nehmen Sie die Fertigspritze aus der Blisterverpackung.
2. Drücken Sie den Stempel um den Gummistopfen zu entsichern.
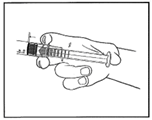
3. Entfernen Sie durch drehen die Schutzkappe.
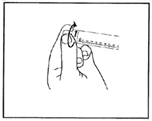
4. Überprüfen Sie, ob die Spitzendichtung der Spritze vollständig entfernt wurde.
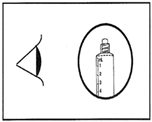
5. Entleeren Sie die Luft mit einem leichten Druck auf den Kolben.
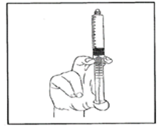
6. Verbinden Sie die Spritze mit dem intravenösen Zugang. Langsam schieben Sie den Kolben, um das gewünschte Volumen zu verabreichen.
Zulassungsnummer66317 (Swissmedic).
PackungenPhenylephrin Aguettant 0,05 mg/ml, Fertigspritze zu 10 ml: 1 [B]
Phenylephrin Aguettant 0,05 mg/ml, Fertigspritze zu 10 ml: 10 [B]
ZulassungsinhaberinAguettant Suisse SA, Thônex
Stand der InformationApril 2023
| 



