ZusammensetzungWirkstoffe
Oxodotreotid 40 μg
Hilfsstoffe
Durchstechflasche 1 (Pulver zur Herstellung einer Injektionslösung):
1,10-Phenanthrolin 5 μg
Gentisinsäure 6 μg
Mannitol 20 mg
Durchstechflasche 2 (Reaktionspuffer):
Ameisensäure 60 mg
Natriumhydroxid 56.5 mg (entspricht. 32.48 mg Natrium pro ml)
Wasser für Injektionszwecke qs 1 ml
Radioaktiv markiertes Produkt:
Nach der Rekonstitution und Radiomarkierung enthält die injizierbare Gallium-(68Ga)-Oxodotreotid-Lösung zusätzlich Chlorwasserstoffsäure aus dem Generatoreluat.
Tabelle 1: Spezifikationen des radioaktiv markierten Produkts:
|
Test
|
Akzeptanzkriterien
| |
Aussehen
|
Farblose und partikelfreie Lösung
| |
pH-Wert
|
3.2–3.8
| |
Wirksamkeit der Radiomarkierung
|
Gallium-(68Ga)-Oxodotreotid ≥95 %
Andere 68Ga-Formen ≤5 %
|
Indikationen/AnwendungsmöglichkeitenDieses Arzneimittel ist ausschliesslich für die diagnostische Anwendung bestimmt.
Nach der Radiomarkierung mit Gallium-68 ist NETSPOT für die Bildgebung durch Positronenemissionstomographie (PET) indiziert, welche zur Lokalisierung von neuroendokrinen Tumoren (NET), die zu einer Überexpression des Somatostatin-Rezeptors führen, dient.
Dosierung/AnwendungDas Arzneimittel ist ausschliesslich zur Verwendung in Institutionen bestimmt, denen der Gebrauch des Radionuklids Gallium-68 bewilligt ist (siehe «Gesetzliche Bestimmungen»).
Radiopharmazeutische Produkte dürfen nur von oder unter der Aufsicht von qualifizierten medizinischen Fachkräften verwendet werden, die eine entsprechende Ausbildung absolviert haben und die wissen, wie Radionuklide sicher zu verwenden und zu handhaben sind, und deren Erfahrung und Ausbildung von staatlichen Behörden anerkannt wurde, die zur Erteilung von Genehmigungen zur Verwendung von Radionukliden befugt sind.
Übliche Dosierung
Für erwachsene Patienten ist eine Mindestdosis von 100 MBq notwendig, um eine Bildgebung guter Qualität zu erzielen, ergänzt durch eine zusätzliche Anpassung in Abhängigkeit vom Gewicht von 2 MBq/kg ± 10 %. Die Gesamtdosis darf 200 MBq nicht überschreiten.
Patienten mit Leberfunktionsstörungen/Nierenfunktionsstörungen
Die Anwendung von Gallium-(68Ga)-Oxodotreotid bei Patienten mit verminderter Nieren-/Leberfunktion wurde in Studien nicht explizit untersucht. Bei Patienten mit Niereninsuffizienz muss von einer verlangsamten Elimination mit einem stärkeren Grundrauschen durch das Gallium-(68Ga)-Oxodotreotid ausgegangen werden. Dies kann zu einer geringeren Detektionsrate kleinerer Tumore führen.
Ältere Patienten
Es liegt keine Studie vor, die nachweist, dass Patienten im Alter von 65 Jahren und darüber anders als jüngere Patienten reagieren. Andere klinische Erfahrungsberichte haben keine Unterschiede im Ansprechen bei jüngeren und älteren Patienten ergeben.
Kinder und Jugendliche
Die Wirksamkeit der PET-Bildgebung mit Gallium-(68Ga)-Oxodotreotid bei pädiatrischen Patienten mit neuroendokrinen Tumoren leitet sich aus Studien an Erwachsenen; Studien, die die Fähigkeit von Gallium-(68Ga)-Oxodotreotid zur Bindung an Somatostatin-Rezeptoren belegen (siehe Rubrik «Eigenschaften/Wirkungen») sowie einer veröffentlichten Studie zur PET-Bildgebung mit Gallium-(68Ga)-Oxodotreotid bei pädiatrischen Patienten mit Tumoren, die die Somatostatin-Rezeptoren exprimieren, ab. Das Sicherheitsprofil von Gallium-(68Ga)-Oxodotreotid ist bei erwachsenen und pädiatrischen Patienten mit Somatostatin-Rezeptoren exprimierenden Tumoren ähnlich.
Die bei Kindern und Jugendlichen zu verabreichende Aktivität kann gemäss den Empfehlungen der Arbeitsgruppe Pädiatrie der Europäischen Gesellschaft für Nuklearmedizin (EANM) mit der nachfolgenden Formel berechnet werden: verabreichte Aktivität [MBq] = 12.8 × multiplizierender Faktor (genannt in Tabelle 2 weiter unten). Dabei ist der Mindestgrenzwert für die Aktivität von 14 MBq nicht zu unterschreiten (gemäss der Dosierungskarte der EANM für mit 68Ga markierte Peptide).
Tabelle 2: Multiplizierender Faktor, entsprechend dem Gewicht des Patienten
|
3 kg = 1.00
|
22 kg = 5.29
|
42 kg = 9.14
| |
4 kg = 1.14
|
24 kg = 5.71
|
44 kg = 9.57
| |
6 kg = 1.71
|
26 kg = 6.14
|
46 kg = 10.00
| |
8 kg = 2.14
|
28 kg = 6.43
|
48 kg = 10.29
| |
10 kg = 2.71
|
30 kg = 6.86
|
50 kg = 10.71
| |
12 kg = 3.14
|
32 kg = 7.29
|
52–54kg = 11.29
| |
14 kg = 3.57
|
34 kg = 7.72
|
56–58 kg = 12.00
| |
16 kg = 4.00
|
36 kg = 8.00
|
60–62 kg = 12.71
| |
18 kg = 4.43
|
38 kg = 8.43
|
64–66 kg = 13.43
| |
20 kg = 4.86
|
40 kg = 8.86
|
68 kg = 14.00
|
Art der Anwendung
Intravenöse Anwendung (Bolus) nach Rekonstitution mit dem Galliumchlorid-Eluat (68Ga) aus einem Germanium-68/Gallium-68-Generator und der Reaktionspufferlösung (siehe Abschnitt Hinweise für die Handhabung, Rubrik Sonstige Hinweise).
Vorbereitung des Patienten
Die Patienten müssen eine ausreichende Menge Wasser trinken, um eine angemessene Hydratation sicherzustellen, bevor das Gallium-(68Ga)-Oxodotreotid verabreicht wird.
Nach der PET-Untersuchung
Die Patienten sollten in den ersten Stunden nach der Verabreichung häufig trinken und urinieren, um die Strahlenexposition zu reduzieren.
Bildaufnahme
Bei der PET-Bildgebung mit Gallium-(68Ga)-Oxodotreotid erfolgt die Bildaufnahme durch einen Ganzkörper-Scan vom Schädel bis zur Mitte des Oberschenkels. Die Bilder können etwa 40 bis 90 Minuten nach der intravenösen Verabreichung des Gallium-(68Ga)-Oxodotreotids aufgenommen werden. Der Startzeitpunkt und die Dauer der Bildaufnahme sollten je nach verwendeter Ausstattung, Patient und den Tumormerkmalen angepasst werden, um eine optimale Qualität der Aufnahmen zu erzielen.
Interpretation der Bilder
Das Gallium-(68Ga)-Oxodotreotid bindet an die Somatostatin-Rezeptoren. Die mit dem Gallium-(68Ga)-Oxodotreotid angefertigten PET-Aufnahmen geben anhand der Signalstärke das Vorliegen von und die Dichte der Somatostatin-Rezeptoren im Gewebe wieder. Tumoren ohne Somatostatin-Rezeptoren können nicht dargestellt werden. Eine erhöhte Aufnahme in den Tumoren ist kein spezifischer Hinweis auf NETs (siehe Rubrik Warnhinweise und Vorsichtsmassnahmen).
Strahlenexposition
Die geschätzten Strahlendosen pro injizierter Aktivität, die bei erwachsenen Patienten nach einem intravenösen Bolus Gallium-(68Ga)-Oxodotreotid von Organen und Geweben absorbiert werden, sind in Tabelle 3 dargestellt. Die geschätzten effektiven Strahlendosen pro injizierter Aktivität bei erwachsenen und pädiatrischen Patienten nach einem intravenösen Bolus Gallium-(68Ga)-Oxodotreotid sind in Tabelle 4 dargestellt.
Die effektive Strahlendosis, die sich aus der Verabreichung einer Aktivität von 150 MBq (4.05 mCi) bei einem Erwachsenen mit 75 kg Körpergewicht ergibt [im für Gallium-(68Ga)-Oxodotreotid empfohlenen Injektionsdosisbereich], beträgt ca. 3,15 mSv. Bei einer verabreichten Aktivität von 150 MBq (4.05 mCi) beträgt die typischerweise an kritische Organe (d.h. Blasenwand, Milz, Nieren/Nebennieren) abgegebene Strahlung ca. 14.70, 16.35, 13.95 bzw. 12.90 mGy. Bei Patienten mit Milzproblemen (z.B. Splenektomie und/oder Splenose) können in anderen pathologischen Organen und Geweben erhöhte Aufnahmen und Strahlendosen auftreten, da die Milz eine der höchsten physiologischen Aufnahmen zeigt (siehe Rubrik Risiko der Fehlinterpretation der Bilder und Rubrik Dosierung/Anwendung).
Die durch eine Untersuchung mittels Computertomographie (CT) an den ganzen Körper abgegebene Strahlendosis beträgt maximal 4.3 mSv [50–80 mGy DLP/Niedrigdosis]. Die Gesamtdosis, die theoretisch mit einer PET-/CT-Prozedur einhergeht, wird folglich auf 7.45 mSv geschätzt.
1. Physikalische Daten
Gammakonstante: 0.67 mrem/h pro mCi auf 1 Meter [1.8E-4 mSv/h pro MBq auf 1 Meter]
Spezifische Aktivität: max. 4.1E7 Ci/g [1.51E18 Bq/g]
2. Schutz
Blei [Pb] Halbwertsschichtdicke: 6 mm (0.24 Zoll)
Zehntelwertsschichtdicke: 17 mm (0.67 Zoll)
Tabelle 3: Geschätzte absorbierte Strahlendosen pro injizierter Aktivität für ausgewählte Organe und Gewebe bei erwachsenen Patienten nach Injektion einer Dosis Gallium-(68Ga)-Oxodotreotid
|
Von ausgewählten Organen und Geweben absorbierte Dosis pro injizierter Aktivität bei Erwachsenen
|
mGy/MBq
|
mGy/150 MBq
| |
Mittelwert
|
Standardabweichung
| |
Nebennieren
|
0.086
|
0.052
|
12.90
| |
Gehirn
|
0.010
|
0.002
|
1.50
| |
Brust
|
0.010
|
0.002
|
1.50
| |
Gallenblasenwand
|
0.016
|
0.002
|
2.40
| |
Wand des unteren Dickdarms
|
0.015
|
0.002
|
2.25
| |
Dünndarm
|
0.025
|
0.004
|
3.75
| |
Magenwand
|
0.013
|
0.002
|
1.95
| |
Wand des oberen Dickdarms
|
0.021
|
0.003
|
3.15
| |
Herzwand
|
0.018
|
0.003
|
2.70
| |
Nieren
|
0.093
|
0.016
|
13.95
| |
Leber
|
0.050
|
0.015
|
7.50
| |
Lunge
|
0.006
|
0.001
|
0.90
| |
Muskel
|
0.012
|
0.002
|
1.80
| |
Eierstöcke
|
0.016
|
0.001
|
2.40
| |
Pankreas
|
0.015
|
0.002
|
2.25
| |
Rotes Knochenmark
|
0.015
|
0.003
|
2.25
| |
Osteogene Zellen
|
0.021
|
0.005
|
3.15
| |
Haut
|
0.010
|
0.002
|
1.50
| |
Milz
|
0.109
|
0.058
|
16.35
| |
Hoden
|
0.010
|
0.001
|
1.50
| |
Thymus
|
0.012
|
0.002
|
1.80
| |
Schilddrüse
|
0.011
|
0.002
|
1.65
| |
Blasenwand
|
0.098
|
0.048
|
14.70
| |
Gebärmutter
|
0.015
|
0.002
|
2.25
| |
Gesamter Organismus
|
0.014
|
0.002
|
2.10
| |
Effektive Dosis pro injizierter Aktivität
|
mSv/MBq
|
mSv/150 MBq
| |
|
0.021
|
0.003
|
3.15
|
Tabelle 4: Geschätzte effektive Strahlendosen pro injizierter Aktivität nach Injektion einer Dosis Gallium-(68Ga)-Oxodotreotid
|
Alter
|
Gewicht (kg)
|
Effektive Dosis pro injizierter Aktivität (mSv/MBq)*
| |
Erwachsener
|
73.7
|
0.021
| |
15 Jahre
|
56.8
|
0.025
| |
10 Jahre
|
33.2
|
0.040
| |
5 Jahre
|
19.8
|
0.064
| |
1 Jahr
|
9.7
|
0.13
| |
Neugeborenes
|
3.6
|
0.35
|
* Geschätzte Dosis, basierend auf der verabreichten Aktivität von 180 MBq bei einem Patienten mit einem Körpergewicht von 68 kg.
In Tabelle 3 ist dargestellt, wie sich die effektive Dosis pro injizierter Aktivität, beschrieben anhand informationstechnischer Modelle zu erwachsenen und pädiatrischen Patienten, für gewöhnlich im Organismus verhält.
KontraindikationenBei Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung oder einem der Bestandteile des markierten radiopharmazeutischen Produkts.
Bei bekannter oder vermuteter Schwangerschaft oder wenn eine Schwangerschaft nicht ausgeschlossen wurde.
Warnhinweise und VorsichtsmassnahmenMöglichkeit von Überempfindlichkeitsreaktionen oder anaphylaktischen Reaktionen
Im Falle einer Überempfindlichkeitsreaktion oder einer anaphylaktischen Reaktion muss die Verabreichung des Arzneimittels unverzüglich unterbrochen und bei Bedarf eine intravenöse Behandlung eingeleitet werden. Um im Notfall eine schnelle Behandlung zu gewährleisten, sollten die notwendigen Medikamente und Materialien, insbesondere ein Endotrachealtubus, sofort verfügbar sein.
Risiko der Fehlinterpretation der Bilder
Die Aufnahme des Gallium-(68Ga)-Oxodotreotids gibt das Niveau der Somatostatin-Rezeptor-Dichte in NETs an. Eine solche Aufnahme ist jedoch auch bei einer Vielzahl anderer Tumorarten zu beobachten (z.B. Tumoren mit Ursprung im Gewebe der Neuralleiste). Eine erhöhte Aufnahme kann zudem auch bei anderen Erkrankungen zu beobachten sein (z.B. Schilddrüsenerkrankungen oder subakute Entzündungen) oder für eine physiologisch normale Variante stehen (z.B. Hakenfortsatz des Pankreas).
Da die Milz eine der höchsten physiologischen Aufnahmen zeigt, ist das Vorliegen von Milzproblemen (z.B. Splenektomie und/oder Splenose) ein Faktor, der für die genaue Interpretation der Gallium-(68Ga)-Oxodotreotid-PET-Bilder zu berücksichtigen ist (siehe Rubrik Strahlenexposition). Die (68Ga)-Oxodotreotid-PET-Bilder müssen visuell interpretiert werden; wird eine Aufnahme beobachtet, kann dies eine Bestätigung durch histopathologische oder anderweitige Untersuchungen notwendig machen (siehe Abschnitt Interpretation der Bilder, Rubrik Dosierung/Anwendung).
Die Befunde sollten, wenn möglich, durch weitere bildgebende oder histologische und/oder andere relevante Untersuchungen bestätigt werden, um die Diagnose abzusichern.
Ein chronischer endogener Hypercortisolismus (z.B. bei Morbus Cushing) kann die Expression des Somatostatinrezeptors negativ regulieren und sich negativ auf die Ergebnisse der Gallium-(68Ga)-Oxodotreotid-PET-Bildgebung des Somatostatinrezeptors auswirken. Aus diesem Grund soll bei Patienten mit gastroenteropathischem NET oder Hypercortisolismus versucht werden, den Cortisolspiegel vor Durchführung einer PET mit Gallium-(68Ga)-Oxodotreotid zu normalisieren.
Strahlenrisiko
Gallium-(68Ga)-Oxodotreotid trägt langfristig zur kumulierten Gesamtexposition des Patienten bei. Die kumulierte Langzeitexposition gegenüber Strahlung ist mit einem erhöhten Krebsrisiko assoziiert. Es ist auf eine sichere Handhabung und ein sicheres Vorgehen bei der Rekonstitution des Präparats zu achten, um Patienten und Fachkräfte vor jeglicher unbeabsichtigter Strahlenexposition zu schützen (siehe Abschnitt Art der Anwendung, Rubrik Dosierung/Anwendung).
Es wird empfohlen, nach der Injektion 12 Stunden lang jeglichen engen Kontakt zwischen dem Patienten und kleinen Kindern zu vermeiden.
Individueller Nutzen/Rechtfertigung des Risikos
Bei allen Patienten muss die Strahlenexposition durch den zu erwartenden diagnostischen Nutzen gerechtfertigt sein. Es sollte stets die niedrigste Strahlendosis gewählt werden, mit der eine Diagnosestellung noch möglich ist.
Besondere Warnhinweise
Je nach Zeitpunkt der Vorbereitung der Spritze zur Injektion am Patienten kann der Natriumgehalt in manchen Fällen über 1 mmol liegen. Dies ist bei Patienten, die eine natriumarme Ernährung befolgen, zu berücksichtigen.
Für Vorsichtsmassnahmen in Bezug auf Risiken für die Umwelt siehe Abschnitt Hinweise für die Handhabung, Rubrik Sonstige Hinweise.
InteraktionenNicht-radioaktive Somatostatin-Analoga konkurrieren mit Gallium-(68Ga)-Oxodotreotid um die Bindung an denselben Somatostatin-Rezeptoren. Die PET-Untersuchung von Patienten mittels Gallium-(68Ga)-Oxodotreotid ist kurz vor der Verabreichung der Folgedosis von lang wirksamen Somatostatin-Analoga durchzuführen, um einen Eliminationszeitraum von mindestens 3 bis 4 Wochen zu gewährleisten. Bei Patienten mit funktionellen Störungen können Somatostatin-Analoga mit kurzer Wirkdauer bis zu 24 Stunden vor der Bildgebung mit Gallium-(68Ga)-Oxodotreotid angewendet werden.
Glucocorticoide
Es ist belegt, dass Glucocorticoide eine negative Regulierung der Somatostatinrezeptoren vom Subtyp 2 (SSTR2) induzieren können. Die wiederholte Gabe hoher Dosen von Glucocorticoiden vor der Verabreichung von Gallium-(68Ga)-Oxodotreotid kann dazu führen, dass die Expression des SSTR2-Rezeptors unzureichend ist, um Somatostatinrezeptor exprimierende NETs adäquat darstellen zu können.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter
Eine Schwangerschaft muss vor Anwendung des Produkts ausgeschlossen werden. Alle Frauen, deren Regelblutung ausgeblieben ist, müssen als schwanger angesehen werden, bis das Gegenteil bewiesen wurde. Bei Unsicherheit hinsichtlich einer möglichen Schwangerschaft (keine Regelblutung, Regelblutung unregelmässig usw.) sollten Methoden ohne ionisierende Strahlung (falls vorhanden) in Betracht gezogen werden.
Schwangerschaft
Es liegen keine Daten zur Anwendung von Gallium-(68Ga)-Oxodotreotid während der Schwangerschaft und den damit verbundenen Risiken für schwangere Frauen vor. Grundsätzlich können jedoch alle radiopharmazeutischen Produkte mit Gallium-(68Ga)-Oxodotreotid den Fötus der Strahlung aussetzen und ihm schaden. Aufgrund dessen sollten nur absolut notwendige Untersuchungen durchgeführt werden.
Es wurden keine Reproduktionsstudien zu Gallium-(68Ga)-Oxodotreotid bei Tieren durchgeführt.
Stillzeit
Es liegen keine Daten zum Übergang von Gallium-(68Ga)-Oxodotreotid in die Muttermilch, zu Auswirkungen auf das gestillte Kind oder Auswirkungen auf die Milchproduktion vor. Die Vorteile des Stillens für die Entwicklung des Kindes und seine Gesundheit sind ebenso zu berücksichtigen wie der klinische Bedarf der Mutter an einer Injektion von Gallium-(68Ga)-Oxodotreotid und die Folgen einer Injektion von Gallium-(68Ga)-Oxodotreotid für das gestillte Kind oder eine nicht erkannte Erkrankung der Mutter.
Vor jeglicher Verabreichung eines radiopharmazeutischen Produkts während der Stillzeit muss eine Rückstellung der Behandlung mit dem radiopharmazeutischen Produkt auf die Zeit nach dem Ende der Stillzeit in Betracht gezogen werden, da die Radioaktivität in die Muttermilch übergeht. Ist eine Behandlung notwendig, muss das Stillen für 12 Stunden unterbrochen und die abgepumpte Milch entsorgt werden.
Nach der Verabreichung ist enger Kontakt mit Säuglingen 12 Stunden lang zu vermeiden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien zur Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen durchgeführt.
Unerwünschte WirkungenDie Sicherheit von Gallium-(68Ga)-Oxodotreotid wurde in drei monozentrischen Studien (siehe Abschnitt Klinische Wirksamkeit und Sicherheit, Rubrik Eigenschaften/Wirkungen) und anhand einer Analyse wissenschaftlicher Literatur bewertet.
Sicherheitsbezogene Erfahrungen nach Marktzulassung:
Nach Verabreichung von NETSPOT wurden vorübergehende, nicht-schwerwiegende Übelkeit, Erbrechen und Reaktionen an der Injektionsstelle gemeldet.
Die Exposition gegenüber ionisierender Strahlung ist mit der Entwicklung von Krebs und erblichen Anomalien assoziiert. Da die effektive Dosis bei Verabreichung der empfohlenen maximalen Aktivität von 200 MBq ungefähr 4,5 mSv beträgt, ist die Wahrscheinlichkeit einer Entwicklung von Krebs und erblichen Anomalien gering (siehe Abschnitt Warnhinweise und Vorsichtsmassnahmen, Strahlenrisiko).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungIm Falle einer zu hohen Strahlenexposition kann die Elimination der Radionuklide im Organismus durch verstärkte Hydratation und durch regelmässiges Urinieren gefördert werden, um so die vom Patienten resorbierte Dosis so weit wie möglich zu reduzieren. Die Verabreichung eines Diuretikums kann ebenfalls in Betracht gezogen werden. Die dem Patienten verabreichte Dosis sollte gemessen oder zumindest geschätzt werden.
Eigenschaften/WirkungenATC-Code
Keiner
Physikalische Eigenschaften
Gallium (68Ga) zerfällt mit einer Halbwertzeit von 68 Minuten zu stabilem Zink (68Zn):
• 89 % über Positronenemission einer mittleren Energie von 836 keV, gefolgt von einer Photonenstrahlung von 511 keV (178 %),
• 10 % über Orbitalelektroneneinfang (Röntgenstrahlen oder Auger-Emissionen) und
• 3 % über 13 Gammaübergänge auf 5 Anregungsniveaus.
Tabelle 5 bis Tabelle 7 geben die wesentlichen Daten zur Strahlungsemission, zur Abschwächung der Strahlung durch Bleiabschirmung und den physischen Zerfall von 68Ga wieder.
Tabelle 5: Wesentliche Daten zur Strahlungsemission (> 1 %)
|
Strahlung/Emission
|
Zersetzung in %
|
Mittlere Energie
(MeV)
| |
Beta+
|
88 %
|
0.8360
| |
Beta+
|
1.1 %
|
0.3526
| |
Gamma
|
178 %
|
0.5110
| |
Gamma
|
3 %
|
1.0770
| |
Röntgenstrahlen
|
2.8 %
|
0.0086
| |
Röntgenstrahlen
|
1.4 %
|
0.0086
|
Tabelle 6: Abschwächung der Photonen (511 keV) durch Bleiabschirmung (Pb)
|
Dicke der Abschirmung (Pb) in mm
|
Abschwächungskoeffizient
| |
6
|
0.5
| |
12
|
0.25
| |
17
|
0.1
| |
34
|
0.01
| |
51
|
0.001
|
Tabelle 7: Radioaktiver Zerfall von Gallium (68Ga)
|
Minuten
|
Restliche Fraktion
| |
0
|
1.000
| |
15
|
0.858
| |
30
|
0.736
| |
60
|
0.541
| |
90
|
0.398
| |
120
|
0.293
| |
180
|
0.158
| |
360
|
0.025
|
Wirkungsmechanismus
Gallium-(68Ga)-Oxodotreotid bindet an die Somatostatin-Rezeptoren, mit einer erhöhten Affinität gegenüber den Rezeptoren des Subtyps 2 (SSTR2). Es bindet an Somatostatinrezeptor-exprimierende Zellen wie maligne Zellen, die die SSTR2 überexprimieren. Gallium (68Ga) ist ein Radionuklid, das Beta-plus-Strahlung emittiert, mit einem Strahlungswirkungsgrad, der eine Bildgebung über Positronen-Emissions-Tomographie (PET) ermöglicht.
Die Beziehung zwischen der Plasmakonzentration von Gallium-(68Ga)-Oxodotreotid und einer erfolgreichen Bildgebung wurde in klinischen Studien noch nicht untersucht.
Pharmakodynamik
Die Menge des Wirkstoffs (Oxodotreotid) befindet sich im Mikrogrammbereich, sodass bei den gegebenen Aktivitäten keine pharmakodynamische Wirkung im klassischen Sinne auftritt.
Klinische Wirksamkeit
Die Wirksamkeit von NETSPOT wurde im Rahmen dreier monozentrischer, offener Studien erwiesen (Studien A bis C).
In Studie A wurden bei 97 erwachsenen Patienten (Durchschnittsalter 54 Jahre, 41 Männer und 56 Frauen) mit vermuteten oder bestätigten neuroendokrinen Tumoren (NET) PET-Scans mit Gallium-(68Ga)-Oxodotreotid durchgeführt. Die mit Gallium-(68Ga)-Oxodotreotid aufgenommenen Bilder wurden von zwei unabhängigen Betrachtern ohne Kenntnis der klinischen Daten interpretiert. Die Interpretationen wurden mit den Computertomographie-(CT-)Bildern und/oder den Magnetresonanztomographie- (MRT-)Bildern sowie den Bildern verglichen, die innerhalb der letzten 3 Jahre mittels Einzelphotonen-Emissionscomputertomographie (SPECT) mit Indium-(111In)-Pentetreotid aufgenommen wurden. Bei den 74 von 78 Patienten, für die sowohl CT- und/oder MRT-Bilder als auch Bilder mit Indium-(111In)-Pentetreotid verfügbar waren, entsprachen die PET-Ergebnisse mit Gallium-(68Ga)-Oxodotreotid den CT- und MRT-Bildern. Von 50 Patienten mit durch CT und/oder MRT lokalisierten NETs lieferte Gallium-(68Ga)-Oxodotreotid bei 48 Patienten einen positiven Befund, darunter auch 13 Patienten, bei denen die Untersuchung mit Indium-(111In)-Pentetreotid einen negativen Befund erbracht hatte. Bei 26 von 28 Patienten, bei denen die CT- und/oder MRT-Bildgebung negativ ausfiel, war auch Gallium-(68Ga)-Oxodotreotid negativ.
Bei Studie B handelt es sich um eine veröffentlichte Studie mit 104 Patienten (Durchschnittsalter 58 Jahre, 52 Männer und 52 Frauen), bei denen aufgrund klinischer Symptome, erhöhter Tumormarker-Werte oder unbestimmter Tumore, die auf NET hindeuteten, ein Vorliegen von NET vermutet wurde. Die diagnostische Leistung des PET-Scans mit Gallium-(68Ga)-Oxodotreotid zur Lokalisierung der Tumorbereiche wurde retrospektiv mittels Referenzstandard: Histopathologie (n = 49) oder klinischer Überwachung über einen Zeitraum von 5 Monaten (n = 55) bewertet. Die Bilder wurden einvernehmlich von zwei Betrachtern vor Ort interpretiert, denen die klinischen Daten bekannt waren. Bei 36 Patienten wurden die NET-Bereiche mittels Referenzstandard lokalisiert (alle über Histopathologie). Unter diesen Patienten war die Untersuchung mit Gallium-(68Ga)-Oxodotreotid bei 29 Patienten positiv (d.h. korrekte Erkennung eines NET-Bereichs) und bei 7 Patienten falsch-negativ. Bei 68 Patienten ohne per Referenzstandard erkannte NETs waren die Bilder bei 61 Patienten negativ und bei 7 Patienten falsch-positiv.
Studie C war eine veröffentlichte Studie mit 63 Patienten (Durchschnittsalter 58 Jahre, 34 Männer und 29 Frauen) mit rezidivierendem NET, in der die gleichen Referenzstandards verwendet wurden wie oben in Studie B beschrieben. Die mittels Gallium-(68Ga)-Oxodotreotid erzeugten Bilder wurden von zwei Betrachtern aus voneinander unabhängigen Zentren ohne Kenntnis der klinischen Daten interpretiert. Betrachter 1 lokalisierte die NETs mit dem Referenzstandard bei 23 von 29 positiven Patienten korrekt, Betrachter 2 lokalisierte die NETs bei 22 dieser Patienten korrekt. Bei 34 Patienten ohne per Referenzstandard erkannte NETs waren die Interpretationen von Betrachter 1 bei 29 Patienten korrekt, bei Betrachter 2 bei 32 Patienten.
PharmakokinetikAbsorption
Nicht anwendbar.
Distribution
Gallium-(68Ga)-Oxodotreotid wird an alle SSTR2-exprimierenden Organe verteilt, z.B. die Hypophyse, die Schilddrüse, die Milz, die Nebennieren, die Nieren, das Pankreas, die Prostata, die Leber und die Speicheldrüsen. Es erfolgt keine Aufnahme im Cortex cerebri oder im Herzen, und die Aufnahme im Thymus und in der Lunge ist üblicherweise schwach.
Metabolismus
In-vivo-Studien zur Biodistribution/Verstoffwechselung bei Ratten mit Tumoren belegten, dass der Grossteil des peptidischen Analogons (Oxodotreotid) über das Nierensystem ausgeschieden wird, primär in intakter Form.
Die Daten einer In-vitro-Studie zum Metabolismus deuten darauf hin, dass das peptidische Analogon nicht über die Hepatozyten der Ratte, des Hundes oder des Menschen metabolisiert wird, sondern eine schnelle Metabolisierung über die Nieren-Homogenate der Ratte, des Hundes oder des Menschen erfolgt.
Die Bewertung der Fähigkeit des peptidischen Analogons, humane CYP450-Enzyme zu hemmen oder zu induzieren, hat gezeigt, dass die Verbindung im getesteten Konzentrationsspektrum, das sich im beim Menschen vorhersehbaren Plasmakonzentrationsspektrum befindet, keine hemmende oder induzierende Wirkung hat.
Studien zu P-Glykoprotein-vermittelten Interaktionen mit einer Caco-2-Zelllinie deuten darauf hin, dass das peptidische Analogon keine spezifischen Interaktionen mit dem P-Glykoprotein aufweist, weder als Substrat noch als Inhibitor.
Elimination
Insgesamt werden innerhalb der ersten Stunden nach der Injektion 12 % der injizierten Dosis über den Urin ausgeschieden.
Kinetik spezieller Patientengruppen
Die Pharmakokinetik bei Patienten mit verminderter Nieren- oder Leberfunktion ist nicht beschrieben.
In-vitro-Bewertung des Potenzials für Arzneimittelwechselwirkungen
Stoffwechsel- und transporterbasierte Wechselwirkungen
In-vitro-Metabolismusstudien zeigten keine signifikanten hemmenden oder induzierenden Wirkungen auf menschliche CYP450-Enzyme und P-Glykoprotein. Daher ist es unwahrscheinlich, dass Oxodotreotid klinisch relevante Wechselwirkungen mit anderen Arzneimitteln hervorruft
Präklinische DatenEs wurden keine Langzeitstudien an Tieren zur Fertilität, Embryologie, Mutagenität oder Karzinogenität bei Anwendung von Gallium-(68Ga)-Oxodotreotid durchgeführt. Genotoxizitätsstudien, die mit einem sehr ähnlichen Molekül (175Lu-Oxodotreotid/Oxodotreotid-Mischung) durchgeführt wurden, haben jedoch gezeigt, dass diese nicht-radioaktiven Verbindungen in vitro bei murinen L5178Y-Lymphomzellen keine Mutation am Thymidinkinase-(TK-)Lokus hervorriefen, ebenso wenig wie eine Rückmutation bei Salmonella typhimurium oder Escherichia coli (mit oder ohne metabolische S9-Aktivierung).
Sonstige HinweiseInkompatibilitäten
Dieses Arzneimittel darf nicht mit anderen pharmazeutischen Produkten gemischt werden.
Haltbarkeit
Datum und Zeitpunkt des Verfalls sind auf der Original-Umverpackung und auf den Durchstechflaschen angegeben. Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
NETSPOT in der Originalverpackung und nicht über 25 °C lagern (nicht einfrieren), um eine lange Haltbarkeit zu gewährleisten.
Gallium-(68Ga)-Oxodotreotid-Lösung nach der Rekonstitution und Radiomarkierung maximal 4 Stunden in aufrechter Position, unter Verwendung eines ausreichenden Strahlenschutzes und nicht über 25 °C lagern (nicht einfrieren). Die Lagerung des radiomarkierten Produkts muss die rechtlichen Anforderungen an die Lagerung radioaktiver Materialien erfüllen.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Für weitere Informationen zur Lagerdauer des Arzneimittels, siehe Abschnitt Haltbarkeit.
Hinweise für die Handhabung
Anweisungen für die Markierung
Vorbereitung des Arzneimittels
Das NETSPOT-Kit wird in Form von 2 Durchstechflaschen bereitgestellt (siehe Rubrik Darreichungsform und Wirkstoffmenge pro Einheit) und ermöglicht eine direkte Herstellung der Gallium-(68Ga)-Oxodotreotid-Lösung mithilfe des Eluats aus den folgenden Generatoren (spezifische Anweisungen für den Gebrauch der einzelnen Generatoren sind nachfolgend zu finden):
·Germanium 68/Gallium 68-(68Ge/68Ga)-Generator GalliaPharm von Eckert & Ziegler
·Germanium 68/Gallium 68-(68Ge/68Ga)-Generator Galli Ad von IRE ELiT (in den USA auch als Germanium 68/Gallium 68-(68Ge/68Ga)-Generator Galli Eo bezeichnet)
Der 68Ge/68Ga-Generator GalliaPharm von Eckert & Ziegler («GalliaPharm-Generator») und der Germanium 68/Gallium 68-(68Ge/68Ga)-Generator Galli Ad von IRE ELiT sind nicht im NETSPOT-Kit enthalten. Die Sicherheit und Wirksamkeit der mithilfe des NETSPOT-Kits zubereiteten Injektionslösung aus dem Gallium-(68Ga)-Oxodotreotid-Arzneimittel ist ausschliesslich bei Verwendung einer Galliumchloridlösung (68Ga) erwiesen, die aus den oben genannten Generatoren eluiert wurde.
Beim Rekonstitutionsvorgang muss Galliumchlorid-(68Ga)-Eluat aus dem Generator mit einer maximalen Nennaktivität von 1850 MBq verwendet werden, um Gallium-(68Ga)-Oxodotreotid mit einer maximalen Aktivität von 218 MBq/ml herzustellen.
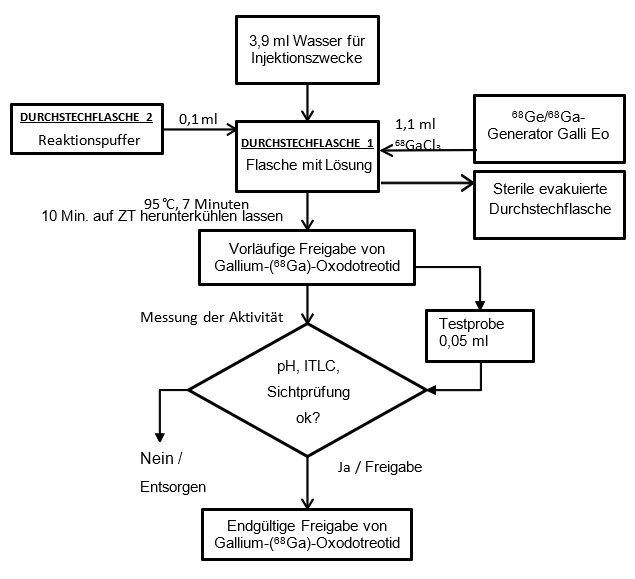
Stellen Sie die Gallium-(68Ga)-Oxodotreotid-Lösung zur intravenösen Injektion gemäss nachfolgender aseptischer Vorgehensweise her (Abbildung 1 und Abbildung 2):
Vorgehen
a. Verwenden Sie eine angemessene Abschirmung zur Abschwächung der Strahlenexposition.
b. Tragen Sie Schutzhandschuhe.
c. Kontrollieren Sie regelmässig (jede Woche) mit einer geeigneten Methode den 68Ge-Durchbruch im Galliumchlorid-(68Ga)-Eluat. Der Durchbruch von 68Ge sowie anderen Radionukliden, die Gammastrahlung aussenden, sollte unter 0.001 % liegen.
d. Stellen Sie die Temperatur des abgeschirmten Trockenbads auf 95 °C ein und warten Sie, bis die eingestellte Temperatur erreicht ist und sich stabilisiert hat.
e. Bereiten Sie die Spritzen für die Elutions- und Rekonstitutionsschritte entsprechend Tabelle 8 unten vor.
f. Die radioaktive Markierung von Trägermolekülen mit Galliumchlorid (68Ga) reagiert sehr empfindlich auf die Anwesenheit von metallischen Spurenverunreinigungen. Verwenden Sie nur Spritzen und Nadeln, bei denen metallische Spurenverunreinigungen so gering wie möglich gehalten werden können (z.B. nicht-metallische Nadeln oder Nadeln mit Silikonbeschichtung; nicht im Lieferumfang enthalten).
g. Verwenden Sie eine 1-ml-Plastikspritze mit geringem Totvolumen, um das richtige Volumen an Reaktionspuffer, das während der Herstellung zugegeben werden muss, genau abzumessen. Keine Glasspritzen verwenden.
h. Bevor Sie die Membranen der Durchstechflaschen durchstechen, entfernen Sie die Schutzkappe von der Durchstechflasche, reinigen Sie die Oberseite der Durchstechflasche mit Alkohol, um sie zu desinfizieren, und lassen Sie sie trocknen.
Tabelle 8: Lösungen für die Elution des Generators und die Radiomarkierungsreaktion
|
Lösungen zur Verwendung mit dem GalliaPharm-Generator von Eckert & Ziegler
| |
Spritze
|
Lösung
|
Verwendung
| |
Sterile 5-ml-Spritze (21G bis 23G)
|
5 ml steriles HCl 0.1 N, vom Hersteller des Generators bereitgestellt
|
Für die Elution des Generators
| |
Sterile 1-ml-Spritze (21G bis 23G)
|
Durchstechflasche 2 – Puffer
Berechnen Sie das Volumen (in ml), indem Sie das Volumen in ml des für die Generator-Elution verwendeten HCl mit seiner Molarität multiplizieren:
Reaktionspuffer-Volumen in ml = HCl-Volumen in ml x HCl-Molarität (5 ml x 0.1 N = 0.5 ml Reaktionspuffer)
|
Für die Radiomarkierungsreaktion
| |
Lösungen zur Verwendung mit dem Galli-Eo-Generator von IRE
| |
Sterile 5-ml-Spritze (21G bis 23G)
|
3.9 ml steriles Wasser für Injektionszwecke
|
Für die vorbereitende Verdünnung von Durchstechflasche 1
| |
Sterile 1-ml-Spritze (21G bis 23G)
|
Durchstechflasche 2 – Puffer
Berechnen Sie das Volumen (in ml), indem Sie das Volumen in ml des für die Generator-Elution verwendeten HCl mit seiner Molarität multiplizieren:
Reaktionspuffer-Volumen in ml = HCl-Volumen in ml x HCl-Molarität (1.1 ml x 0.1 N = 0.11 ml Reaktionspuffer)
|
Für die Radiomarkierungsreaktion
|
i. Stechen Sie mit einer sterilen, mit einem sterilen 0.22-µm-Luftfilter (nicht im Lieferumfang enthalten) versehenen Kanüle durch die Membran von Durchstechflasche 1, um während der Rekonstitution den atmosphärischen Druck im Inneren der Durchstechflasche aufrechtzuerhalten.
j. Befolgen Sie die spezifischen Rekonstitutionsanweisungen für den Generator, die nachfolgend beschrieben sind. Fahren Sie dann mit dem Inkubationsschritt h fort.
Rekonstitution mit dem GalliaPharm-Generator von Eckert & Ziegler
·Verbinden Sie den männlichen Luer-Anschluss an der Auslassleitung des GalliaPharm-Generators mit einer sterilen Kanüle.
·Verbinden Sie Durchstechflasche 1 direkt mit dem Auslass des GalliaPharm-Generators, indem Sie die Kanüle durch die Gummimembran stechen, und geben Sie die Durchstechflasche in einen durch Blei abgeschirmten Behälter.
·Eluieren Sie den Generator gemäss den Gebrauchsanweisungen für den GalliaPharm-Generator von Eckert & Ziegler direkt in Durchstechflasche 1 mit 5 ml Eluat, um das lyophilisierte Pulver zu rekonstituieren. Führen Sie die Elution entweder manuell oder mithilfe einer Pumpe durch.
·Trennen Sie nach Fertigstellung der Elution den Generator von Durchstechflasche 1, indem Sie die Kanüle aus der Gummimembran ziehen, und geben Sie unverzüglich 0,5 ml Reaktionspuffer (die Zugabe des Puffers nicht länger als 10 Minuten hinauszögern) mit einer sterilen 1-ml-Fertigspritze hinzu (21G bis 23G; die Menge des Reaktionspuffers wurde in Tabelle 8 bestimmt).
·Ziehen Sie die Spritze und den sterilen 0,2-µm-Luftfilter heraus.
Rekonstitution mit dem Galli-Eo-Generator von IRE
·Bereiten Sie den Galli-Eo-Generator gemäss den Anweisungen des Herstellers für die Elution vor. Verbinden Sie eine sterile Kanüle (21G bis 23G) mit der Auslassleitung des Generators, drehen Sie den Knopf um 90° in die Ladeposition, warten Sie 10 Sekunden und drehen Sie den Knopf dann wieder in seine Ausgangsposition zurück.
·Rekonstituieren Sie Durchstechflasche 1 mit 3.9 ml sterilem Wasser für Injektionszwecke, das wie in Tabelle 8 beschrieben vorbereitet wurde.
·Geben Sie die 0.1 ml Reaktionspuffer in Durchstechflasche 1, die wie in Tabelle 8 beschrieben vorbereitet wurde.
·Verbinden Sie Durchstechflasche 1 mit der Auslassleitung des Galli-Eo-Generators, indem Sie die Kanüle durch die Gummimembran stechen.
·Verbinden Sie einen der zwei männlichen Luer-Anschlüsse eines sterilen Verlängerungsschlauchs mit einem sterilen 0.2-µm-Luftfilter, der mit Durchstechflasche 1 verbunden wurde.
·Schliessen Sie eine sterile Kanüle an den zweiten männlichen Luer-Anschluss des sterilen Verlängerungsschlauchs an und verbinden Sie sie mit einer evakuierten sterilen Durchstechflasche (mit einem Volumen von mindestens 17 ml), indem Sie die Kanüle durch die Gummimembran stechen. Die Elution des Generators beginnt.
·Warten Sie, bis die Elution abgeschlossen ist (mindestens 3 Minuten, gemäss den Gebrauchsanweisungen des Herstellers).
·Ziehen Sie nach Fertigstellung der Elution zunächst die Kanüle aus der evakuierten Durchstechflasche, um in Durchstechflasche 1 den atmosphärischen Druck herzustellen, und trennen Sie anschliessend Durchstechflasche 1 vom Generator, indem Sie die Kanüle aus der Gummimembran ziehen und den sterilen 0.2-µm-Luftfilter aus Durchstechflasche 1 ziehen.
Inkubation
k. Platzieren Sie Durchstechflasche 1 mithilfe einer Zange in der Heizkavität des Trockenbads und erwärmen Sie die Durchstechflasche mindestens 7 Minuten bei einer Temperatur von 95 °C (bis maximal 98 °C), ohne sie zu schütteln oder zu bewegen (nicht länger als 10 Minuten der Wärme aussetzen).
l. Ziehen Sie die Durchstechflasche nach 7 Minuten aus dem Trockenbad, geben Sie sie in eine geeignete Bleiabschottung und lassen Sie sie etwa 10 Minuten auf Zimmertemperatur herunterkühlen.
m. Messen Sie mit einem kalibrierten Aktivimeter die Radioaktivität der Durchstechflasche mit der Gallium-(68Ga)-Oxodotreotid-Injektionslösung und protokollieren Sie das Ergebnis.
n Führen Sie gemäss den empfohlenen Methoden eine Qualitätskontrolle durch, um die Einhaltung der Spezifikationen sicherzustellen (siehe Rubrik Eigenschaften/Wirkungen, Qualitätskontrolle).
o. Führen Sie vor Gebrauch hinter einer Schutzscheibe (zum Strahlenschutz) eine Sichtprüfung der Lösung durch. Verwenden Sie nur klare Lösungen ohne sichtbare Partikel.
p. Lagern Sie die Durchstechflasche mit der Gallium-(68Ga)-Oxodotreotid-Injektionslösung bis zu ihrem Gebrauch in aufrechter Position in einem Strahlenschutzbehälter und unter 25 °C.
Verwenden Sie die Gallium-(68Ga)-Oxodotreotid-Injektionslösung innerhalb von 4 Stunden nach Zugabe des Galliumchlorids (68Ga) zur Reaktionsflasche. Nach der Rekonstitution dürfen keine weiteren Verdünnungen vorgenommen werden.
Abbildung 1: Rekonstitutionsvorgang mit dem GalliaPharm-Generator von Eckert & Ziegler
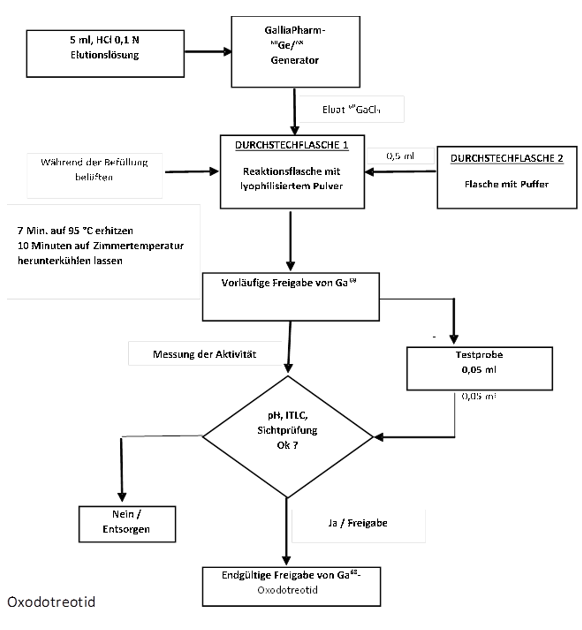
Abbildung 2: Rekonstitutionsvorgang mit dem Galli-Ad-Generator von IRE
Qualitätskontrolle
Führen Sie die Qualitätskontrollen gemäss Tabelle 9 zum Schutz vor Radioaktivität hinter einer abgeschirmten Glasscheibe durch.
Tabelle 9: Produktspezifikationen des radioaktiv markierten Gallium-(68Ga)-Oxodotreotid-Bildgebungsprodukts
|
Test
|
Akzeptanzkriterien
|
Vorgehensweise
| |
Aussehen
|
Farblos und partikelfrei
|
Sichtprüfung
| |
pH-Wert
|
3.2–3.8
|
pH-Indikator-Teststreifen
| |
Wirksamkeit der Radiomarkierung
|
Gallium-(68Ga)-Oxodotreotid ≥95 %
Andere 68Ga-Formen ≤5 %
|
Dünnschichtchromatographie (ITLC, siehe Angaben unten)
|
Feststellung der Wirksamkeit der Radiomarkierung des Gallium-(68Ga)-Oxodotreotids:
Folgendes Material muss vorhanden sein:
q. ITLC SA oder ITLC SG
r. Ammoniumacetat 1M: Methanol (1:1 V/V)
s. Entwicklungstank
t. Radiometrischer Scanner TLC
Gehen Sie wie folgt vor:
u. Füllen Sie die Lösung aus Ammoniumacetat 1M: Methanol (1:1 V/V) bis auf eine Höhe von 3 bis 4 mm in den Entwicklungstank, decken Sie den Tank ab und lassen Sie sie austarieren.
v. Geben Sie einen Tropfen der Gallium-(68Ga)-Oxodotreotid-Injektionslösung auf eine mit Bleistift gezeichnete Linie, 1 cm vom unteren Ende des ITLC-Teststreifens entfernt.
w. Geben Sie den ITLC-Teststreifen in den Entwicklungstank und lassen Sie ihn bis zu einem Abstand von 6 cm vom Applikationspunkt entwickeln (d.h. oberhalb der Bleistiftmarkierung).
x. Lesen Sie den ITLC-Teststreifen mit einem Radio-ITLC-Scanner aus.
y. Berechnen Sie die radiochemische Reinheit (RCP) durch Integration der Spitzen im Chromatogramm. Verwenden Sie das rekonstituierte Produkt nicht, wenn die RCP unter 95 % liegt.
z. Die Spezifikationen des Retentionsfaktors (Rf) sind für ITLC SA oder ITLC SG wie folgt:
ITLC SA: Nicht-komplexierte Gallium-Formen (68Ga), Rf = 0–0.1; Gallium-(68Ga)-Oxodotreotid, Rf = 0.6–0.8
ITLC SG: Nicht-komplexierte Gallium-Formen (68Ga), Rf = 0–0.1; Gallium-(68Ga)-Oxodotreotid, Rf = 0.8–1
Anwendung
Führen Sie vor Gebrauch hinter einer Schutzscheibe (zum Strahlenschutz) eine Sichtprüfung der hergestellten Gallium-(68Ga)-Oxodotreotid-Lösung durch. Verwenden Sie nur klare Lösungen ohne sichtbare Partikel. Verwenden Sie eine Einmal-Spritze mit einer sterilen Kanüle und einer Abschirmung. Ziehen Sie die hergestellte Gallium-(68Ga)-Oxodotreotid-Lösung vor der Anwendung aseptisch auf.
Prüfen Sie unmittelbar vor der Verabreichung an den Patienten die injizierte Radioaktivität, indem Sie die Radioaktivität der Durchstechflasche mit der Gallium-(68Ga)-Oxodotreotid-Lösung mit einem Aktivimeter messen. Vergewissern Sie sich, dass die injizierte Radioaktivität im Bereich von ± 10 % der empfohlenen Dosis liegt. Das Aktivimeter muss kalibriert sein und den internationalen Standards entsprechen.
Eine versehentliche Extravasation kann aufgrund des sauren pH-Werts der Gallium-(68Ga)-Oxodotreotid-Lösung zu einer lokalen Reizung führen. Im Fall einer Extravasation beenden Sie die Injektion, wechseln Sie die Injektionsstelle und spülen den betroffenen Bereich mit Natriumchloridlösung.
Handhaben und entsorgen Sie radioaktive Abfälle gemäss den geltenden Regelungen.
Handhabung des Arzneimittels
Die Handhabung der Gallium-(68Ga)-Oxodotreotid-Lösung sollte nach deren Rekonstitution und Radiomarkierung unter Einhaltung angemessener Sicherheitsmassnahmen stattfinden, um die Strahlenexposition zu minimieren. Tragen Sie bei der Herstellung und Handhabung der Gallium-(68Ga)-Oxodotreotid-Lösung Schutzhandschuhe und einen wirksamen Strahlenschutz und wenden Sie effektive Schutzmassnahmen an.
Entsorgung
Da dieses Arzneimittel keine Konservierungsstoffe enthält, müssen Lösungsreste entsorgt werden. Die Entsorgung von radioaktiven Abfällen hat gemäss den geltenden Schweizer Regelungen zu erfolgen (Strahlenschutzverordnung, StSV, SR 814.501).
Gesetzliche Bestimmungen
Die Anwendung radioaktiver Stoffe an Menschen ist in der Schweiz durch die letzte gültige Version der Verordnung über den Strahlenschutz gesetzlich geregelt. Entsprechend ist für die Anwendung von Radiopharmazeutika nur autorisiert, wer über die erforderliche Bewilligung des Bundesamtes für Gesundheit für den Umgang mit ionisierenden Strahlen verfügt. Um jede unnötige Bestrahlung von Patienten und Personal zu vermeiden, sind beim Umgang mit radioaktiven Stoffen sowie bei der Beseitigung radioaktiven Abfalls die Schutzvorkehrungen der oben erwähnten Verordnung zu beachten.
Zulassungsnummer66611 (Swissmedic)
PackungenNETSPOT wird in Form eines Mehrdosen-Kits vertrieben und dient zur Herstellung mehrerer Injektionsdosen radioaktiv markierten Gallium-(68Ga)-Oxodotreotids.
Das Kit enthält:
·Durchstechflasche 1 (10-ml-Durchstechflasche aus Ultra-inert-Glas vom Typ I Plus, hellblaue Schutzkappe): 40 μg Oxodotreotid, 5 μg 1,10-Phenanthrolin, 6 μg Gentisinsäure, 20 mg Mannitol in Pulverform zur Herstellung einer Injektionslösung.
·Durchstechflasche 2 (10-ml-Durchstechflasche aus Cyclo-Olefin-Polymer mit gelber Schutzkappe): Reaktionspuffer (Volumen ca. 1 ml), 60 mg Ameisensäure, 56.5 mg Natriumhydroxid und Wasser für Injektionszwecke.
Das Radionuklid ist nicht im Kit enthalten. Vor der Rekonstitution und Radiomarkierung mit dem Gallium (68Ga) ist der Kit-Inhalt nicht radioaktiv.
Abgabekategorie A.
ZulassungsinhaberinNovartis Pharma Schweiz AG, Risch; Domizil 6343 Rotkreuz
Stand der InformationFebruar 2024
|


