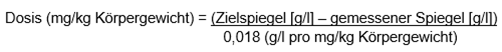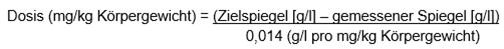ZusammensetzungWirkstoffe
Humanes Fibrinogen.
Hergestellt aus dem Plasma menschlicher Spender.
Hilfsstoffe
Pulver:
L-Argininhydrochlorid.
Glycin.
Natriumchlorid.
Natriumcitrat-Dihydrat.
Pro vitro corresp. Natrium 132 mg.
Lösungsmittel:
Wasser für Injektionszwecke 50 ml.
Indikationen/AnwendungsmöglichkeitenBehandlung und perioperative Prophylaxe von Blutungsepisoden bei Patienten mit kongenitaler Hypo- oder Afibrinogenämie mit Blutungsneigung.
Als Ergänzungstherapie bei der Behandlung von unkontrollierten schweren Blutungen bei erworbenem Fibrinogenmangel.
Dosierung/AnwendungDie Behandlung sollte unter der Überwachung eines Arztes eingeleitet werden, der über Erfahrung in der Behandlung von Blutgerinnungsstörungen verfügt.
Dosierung
Dosierung und Dauer der Substitutionstherapie hängen von der Schwere der Erkrankung, der Lokalisation und dem Umfang der Blutung sowie vom klinischen Zustand des Patienten ab.
Die individuelle Dosierung sollte auf Grundlage des (funktionalen) Fibrinogenspiegels berechnet werden. Menge und Häufigkeit der Anwendung sollten individuell für den einzelnen Patienten durch regelmässige Messung des Fibrinogenspiegels im Plasma, durch kontinuierliche Überwachung des klinischen Zustands des Patienten und durch Überwachung anderer gleichzeitig angewandter Substitutionstherapien bestimmt werden.
Bei grösseren chirurgischen Eingriffen ist eine präzise Überwachung der Substitutionstherapie durch Gerinnungstests unbedingt erforderlich.
a) Prophylaxe bei Patienten mit kongenitaler Hypo- oder Afibrinogenämie und bekannter Blutungsneigung.
Um übermässige Blutungen bei chirurgischen Eingriffen zu verhindern, wird eine prophylaktische Behandlung empfohlen, um den Fibrinogenspiegel auf 1 g/l anzuheben und auf diesem Wert zu halten, bis die Hämostase unter Kontrolle ist, und auf über 0,5 g/l zu halten, bis die Wundheilung abgeschlossen ist.
Für einen chirurgischen Eingriff oder zur Behandlung einer Blutungsepisode sollte die Dosis wie folgt berechnet werden:
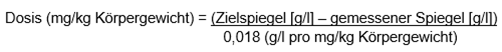
Die Berechnung mit dem gegebenen IVR (0,018 g/l pro mg/kg Körpergewicht) trifft bei Patienten, die zwischen 12 und 65 Jahre alt waren, zu.
Die nachfolgende Dosierung (Injektionsdosen und -häufigkeit) sollte auf Grundlage des klinischen Zustands des Patienten und der Laborergebnisse erfolgen.
Die biologische Halbwertszeit von Fibrinogen beträgt 3-4 Tage. Daher ist bei fehlendem Verbrauch eine wiederholte Behandlung mit humanem Fibrinogen in der Regel nicht erforderlich. Aufgrund der Akkumulation bei wiederholter Verabreichung zur Prophylaxe sollten die Dosis und Häufigkeit der Gabe auf Grundlage der therapeutischen Ziele des Arztes für den jeweiligen Patienten bestimmt werden.
Ältere Patienten
In klinischen Studien mit Fibryga waren keine Patienten ab 65 Jahren eingeschlossen, so dass keine endgültige Aussage darüber gemacht werden kann, ob diese Patienten anders auf die Behandlung ansprechen als jüngere Patienten.
Kinder und Jugendliche
Für einen chirurgischen Eingriff oder zur Behandlung einer Blutungsepisode sollte die Dosis für Jugendliche gemäss der vorstehend beschriebenen Formel für Erwachsene berechnet werden, während die Dosis für Kinder für Kinder ≥1 bis < 12 Jahre wie folgt zu berechnen ist:
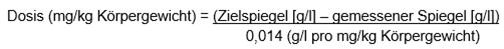
Die nachfolgende Dosierung sollte auf Grundlage des klinischen Zustands des Patienten und der Laborergebnisse erfolgen.
b) Behandlung von Blutungen
Blutungen bei Patienten mit kongenitaler Hypo- oder Afibrinogenämie
Blutungsepisoden sollten gemäss den vorstehenden Formeln für Erwachsene/Jugendliche bzw. Kinder behandelt werden, um den Fibrinogenspiegel im Plasma auf den empfohlenen Zielwert von 1 g/l anzuheben. Der Fibrinogenspiegel sollte auf diesem Wert gehalten werden, bis die Hämostase unter Kontrolle ist.
Blutungen bei Patienten mit erworbener Hypofibrinogenämie
Erwachsene
Generell werden anfänglich 1-2 g verabreicht mit nachfolgenden Infusionen nach Bedarf. Im Fall von schweren Blutungen, z.B. bei grossen chirurgischen Eingriffen, können grössere Mengen (4-8 g) Fibrinogen benötigt werden.
Kinder und Jugendliche
Die Dosierung sollte entsprechend dem Körpergewicht und den klinischen Bedürfnissen bestimmt werden und beträgt normalerweise 20-30 mg/kg.
Art der Anwendung
Intravenöse Infusion oder Injektion.
Fibryga sollte langsam intravenös verabreicht werden. Die empfohlene maximale Infusionsgeschwindigkeit beträgt 5 ml/min bei Patienten mit kongenitaler Hypo- oder Afibrinogenämie und 10 ml/min bei Patienten mit erworbenem Fibrinogenmangel.
Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung, siehe Rubrik «Sonstige Hinweise».
KontraindikationenFibryga darf nicht angewendet werden bei Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenThromboembolie
Es besteht ein Thromboserisiko, wenn Patienten mit angeborenem oder erworbenem Fibrinogenmangel mit humanem Fibrinogen behandelt werden, insbesondere bei hohen Dosen oder wiederholter Gabe. Patienten, die humanes Fibrinogen erhalten, sollten engmaschig auf Anzeichen oder Symptome einer Thrombose überwacht werden.
Bei Patienten mit koronarer Herzkrankheit oder Myokardinfarkt in der Anamnese, Patienten mit Lebererkrankung, peri- oder postoperativen Patienten, Neugeborenen oder Patienten mit einem Risiko thromboembolischer Ereignisse oder disseminierter intravaskulärer Gerinnung muss der potenzielle Nutzen einer Behandlung mit Fibrinogen aus humanem Blutplasma gegen das Risiko thromboembolischer Komplikationen abgewogen werden. Vorsicht und eine engmaschige Überwachung sind geboten.
Allergische oder anaphylaktoide Reaktionen
Wenn allergische oder anaphylaktoide Reaktionen auftreten, muss die Injektion/Infusion sofort gestoppt werden. Im Falle eines anaphylaktischen Schocks muss die standardmässige medizinische Schockbehandlung durchgeführt werden.
Natriumgehalt
Fibryga enthält bis zu 132 mg Natrium pro Flasche, entsprechend 6,6% der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g. Dies ist bei Patienten zu berücksichtigen, die eine kontrollierte natriumarme Diät einhalten müssen.
Virussicherheit
Standardmassnahmen zur Vorbeugung von Infektionen, die sich durch den Einsatz von Arzneimitteln ergeben, die aus menschlichem Blut oder Blutplasma hergestellt sind, schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie effektive Schritte zur Inaktivierung/Entfernung von Viren im Herstellungsverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln, die aus menschlichem Blut oder Blutplasma hergestellt wurden, die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu aufgetretene Viren und andere Pathogene.
Die getroffenen Massnahmen werden als wirksam angesehen für umhüllte Viren wie z.B. das humane Imundefizienzvirus (HIV), das Hepatitis B-Virus (HBV) und das Hepatitis C-Virus (HCV) sowie für das nicht umhüllte Hepatitis A-Virus (HAV). Die getroffenen Massnahmen sind bei nicht umhüllten Viren wie dem Parvovirus B19 möglicherweise von begrenztem Wert. Parvovirus-B19-Infektionen können für schwangere Frauen (fetale Infektion) und für Personen mit Immunschwäche oder verstärkter Erythropoese (z.B. hämolytische Anämie) schwerwiegende Folgen haben.
Es wird empfohlen, bei jeder Verabreichung von Fibryga an einen Patienten Name und Chargennummer des Präparates zu dokumentieren, um einen Zusammenhang zwischen Patient und Produktcharge herzustellen.
Bei Patienten, die regelmässig bzw. wiederholt mit aus humanem Plasma gewonnenen Arzneimitteln behandelt werden, sollte eine entsprechende Impfung (Hepatitis A und B) erwogen werden.
Immunogenität
Bei Substitutionstherapien mit Gerinnungsfaktoren bei anderen angeborenen Mangelkrankheiten wurden Antikörperreaktionen beobachtet. Für Fibrinogenkonzentrate liegen aber derzeit keine Daten vor.
InteraktionenEs sind keine Wechselwirkungen zwischen Produkten mit humanem Fibrinogen und anderen Arzneimitteln bekannt.
Schwangerschaft, StillzeitSchwangerschaft
Tierexperimentelle Studien zur Reproduktion wurden mit Fibryga nicht durchgeführt. Da der Wirkstoff menschlichen Ursprungs ist, wird er in der gleichen Weise wie das körpereigene Protein des Patienten abgebaut. Es ist nicht zu erwarten, dass diese physiologischen Bestandteile des menschlichen Blutes zu Reproduktionsschäden oder zu Schäden bei dem Fötus führen.
Die Sicherheit der Anwendung von menschlichem Fibrinogen während der Schwangerschaft wurde bislang nicht in kontrollierten Studien geprüft.
Die klinische Erfahrung mit Fibrinogenprodukten bei der Behandlung geburtshilflicher Komplikationen lässt keine gesundheitsschädlichen Auswirkungen während der Schwangerschaft oder auf die Gesundheit des Fötus oder Neugeborenen erwarten.
Stillzeit
Es ist nicht bekannt, ob Fibryga in die Muttermilch übergeht. Die Sicherheit der Anwendung von menschlichem Fibrinogen während der Stillzeit wurde bislang nicht in kontrollierten Studien geprüft.
Fertilität
Es liegen keine Daten zur Fertilität vor.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenFibryga hat keinen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Es liegen keine belastbaren Daten zu den Häufigkeiten von Nebenwirkungen in klinischen Studien mit diesem Arzneimittel vor.
In klinischen Studien wurden die folgenden Nebenwirkungen berichtet: Pyrexie, Arzneimittelexanthem, Phlebitis und Thrombose.
Die folgenden Nebenwirkungen wurden von Fibryga und anderen Fibrinogenkonzentraten berichtet:
|
Standardsystemorganklasse gemäss MedDRA
|
Nebenwirkungen
|
Häufigkeit
| |
Erkrankungen des Immunsystems:
|
Allergische oder anaphylaktoide Reaktionen
Hautreaktionen
|
Einzelfälle
| |
Gefässerkrankungen:
|
Thromboembolische Episoden (einschliesslich Myokardinfarkt und Lungenembolie)
Thrombophlebitis
|
Einzelfälle
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
|
Anstieg der Körpertemperatur (Pyrexie)
|
Einzelfälle
|
Hinweise zur Sicherheit hinsichtlich übertragbarer Erreger, siehe Rubrik „Warnhinweise und Vorsichtsmassnahmen“
Kinder und Jugendliche:
Es wurden 26 Patienten im Alter von 1 bis unter 18 Jahren in die Sicherheitsanalyse bei kongenitalem Fibrinogenmangel eingeschlossen: 12 Jugendliche im Alter von 12 bis unter 18 Jahren, 8 Kinder zwischen 6 und unter 12 Jahren sowie 6 Kinder im Alter von 1 bis unter 6 Jahren.
Das allgemeine Sicherheitsprofil ist bei Erwachsenen, Jugendlichen und Kindern gleich.
Es liegen keine Daten zur Anwendung von Fibryga bei pädiatrischen Patienten mit erworbenem Fibrinogenmangel vor.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs wurden keine Fälle von Überdosierung berichtet.
Zur Vermeidung von Überdosierungen sind während der Therapie regelmässige Kontrollen des Fibrinogenspiegels im Plasma angezeigt (siehe Rubrik «Dosierung/Anwendung»).
Im Falle einer Überdosierung besteht ein erhöhtes Risiko für thromboembolische Komplikationen.
Eigenschaften/WirkungenATC-Code
B02BB01.
Wirkstoffgruppe: Antihämorrhagika, humanes Fibrinogen
Wirkungsmechanismus
Die Gabe humanen Fibrinogens erhöht den Fibrinogenspiegel im Plasma und kann den Blutgerinnungsdefekt bei Patienten mit Fibrinogenmangel vorübergehend korrigieren.
Pharmakodynamik
Humanes Fibrinogen (Gerinnungsfaktor I) wird in Anwesenheit von Thrombin, aktiviertem Gerinnungsfaktor XIII (F XIIIa) und Calciumionen in ein stabiles und elastisches dreidimensionales Fibrinnetz umgewandelt.
Klinische Wirksamkeit
In einer offenen, prospektiven, randomisierten, kontrollierten, zweiarmigen pharmakokinetischen Cross-Over-Einzeldosisstudie der Phase II bei 22 Patienten mit kongenitalem Fibrinogenmangel (Afibrinogenämie) (siehe Rubrik «Pharmakokinetik») wurde ausserdem die maximale Gerinnselfestigkeit (Maximum Clot Firmness, MCF) als Surrogatmarker für die hämostatische Wirksamkeit bestimmt (FORMA-01). Die MCF wurde mittels Thrombelastometrie (ROTEM) bestimmt. Für jeden Patienten wurde der MCF-Wert vor (Ausgangswert) und eine Stunde nach Gabe einer Einzeldosis Fibryga bestimmt. Die MCF-Werte waren nach der Gabe von Fibryga im Vergleich zum Ausgangszeitpunkt signifikant höher (siehe Tabelle unten).
Tabelle 1: Maximale Gerinnselfestigkeit (MCF, in mm) (ITT-Population) n = 22
|
Zeitpunkt
|
Mittelwert ± SD
|
Median (Bereich)
| |
Vor der Infusion
|
0 ± 0
|
0 (0-0)
| |
1 Stunde nach der Infusion
|
9,7 ± 3,0
|
10,0 (4,0-16,0)
| |
Mittlere Veränderung (Primäranalyse)*
|
9,7 ± 3,0
|
10,0 (4,0-16,0)
|
MCF = Maximale Gerinnselfestigkeit (Maximum Clot Firmness); ITT = Intention-to-treat.
*p < 0,0001 (95%-Konfidenzintervall 8,37; 10,99)
Es wurde eine prospektive, offene, nicht kontrollierte, multizentrische Studie der Phase III (FORMA-02) an 25 Patienten mit kongenitalem Fibrinogenmangel (Afibrinogenämie und Hypofibrinogenämie) in einem Alter von 12 bis 54 Jahren (6 Jugendliche und 19 Erwachsene) durchgeführt. Diese umfasste die Behandlung von 89 Blutungsepisoden und 12 operativen Eingriffen. Der mittels ROTEM bestimmte MCF-Wert und der Fibrinogenspiegel im Plasma waren gegenüber dem Ausgangswert signifikant verschieden. Die mediane Dosis von Fibryga pro Infusion zur Behandlung von Blutungsepisoden betrug 57,5 mg/kg und der Median der Gesamtdosis lag bei 59,4 mg/kg. Die mediane Gesamtdosis Fibryga pro Operation betrug 85,8 mg/kg. Die allgemeine hämostatische Wirksamkeit wurde von einem unabhängigen Bewertungsgremium unter Verwendung eines objektiven Wertungssystems für 98,9 % der behandelten Blutungsepisoden und 100 % der Operationen als erfolgreich eingestuft (Wertung als gute oder ausgezeichnete Wirksamkeit).
Eine weitere prospektive, offene, nicht kontrollierte, multizentrische Phase-3-Studie (FORMA-04) wurde an 14 Kindern mit kongenitalem Fibrinogenmangel (Afibrinogenämie und Hypofibrinogenämie) in einem Alter von 1 bis 10 Jahren (6 Kinder unter 6 Jahren und 8 Kinder zwischen 6 und unter 12 Jahren) durchgeführt. Diese umfasste die Behandlung von 10 Blutungsepisoden und 3 operativen Eingriffen sowie die Untersuchung der Pharmakokinetik nach einer Einzeldosis. Der mittels ROTEM und der Fibrinogenspiegel im Plasma bestimmte MCF-Wert war gegenüber dem Ausgangswert signifikant verschieden. Die mediane Dosis von Fibryga pro Infusion zur Behandlung von Blutungsepisoden betrug 70,2 mg/kg und der Median der Gesamtdosis lag bei 73,9 mg/kg. Die mediane Gesamtdosis Fibryga pro Operation betrug 108 mg/kg. Die allgemeine hämostatische Wirksamkeit wurde von einem unabhängigen Bewertungsgremium unter Verwendung eines objektiven Wertungssystems für 100 % der behandelten Blutungsepisoden und der Operationen als erfolgreich eingestuft (Wertung als gute oder ausgezeichnete Wirksamkeit).
Die FORMA-05 Studie ist eine prospektive, randomisierte, kontrollierte Studie, die die haemostatische Wirksamkeit und Sicherheit von Fibryga im Vergleich zu Kryopräzipitat bei Patienten mit erworbenem Fibrinogenmangel während eines zytoreduktiven Eingriffs für die abdominale Tumorkrankheit Pseudomyxoma Peritonei, untersucht. 23 Patienten wurden in die Per Protokoll (PP) Interimsanalyse eingeschlossen, davon 10, die mit Fibryga und 13, die mit Kryopräzipitat behandelt wurden. Die Fibrinogen Gabe während der Operation bestand aus 4 g Fibryga oder 2 Pools mit je 5 Einheiten Kryopräzipitat, die nach Bedarf wiederholt wurde. Während der Operation (7.7 ± 1.4 Stunden) wurden 6.4 ± 2.8 g Fibryga (85 ± 36 mg/kg Körpergewicht) bzw. 3.9 ± 1.7 Pools mit je 5 Einheiten Kryopräzipitat verabreicht. In beiden Gruppen wurde im Mittel nur eine Einheit Erythrozytenkonzentrat während der Operation und 0 Einheiten Erythrozytenkonzentrat in den 24 Stunden nach der Operation verabreicht, ohne weitere Transfusionen von gefrorenem Frischplasma oder Thrombozytenkonzentraten (siehe Tabelle 2). Alle auf Fibrinogen-basierten untersuchten Behandlungen bei den 23 Operationen wurden von einem unabhängigen Bewertungsgremium unter Verwendung eines objektiven Wertungssystems als erfolgreich eingestuft (Wertung als gute oder ausgezeichnete Wirksamkeit).
Tabelle 2: Transfusion von Erythrozytenkonzentraten* [Einheiten] während der Operation und in den ersten 24 Stunden nach der Operation (PP Analyse)
|
Zeitraum
|
Fibryga Gruppe (n=10)
Median (Bereich)
|
Cryoprecipitate Gruppe (n=13)
Median (Bereich)
| |
Während der Operation
|
1 (0-2)
|
1 (0-5)
| |
Erste 24 Stunden nach der Operation
|
0 (0-2)
|
0 (0-1)
|
PP = Per Protokoll.
*Keine Transfusion von gefrorenem Frischplasma (GFP) oder Thrombozytenkonzentraten wurde verabreicht.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Bei kongenitalem Fibrinogenmangel wurde Fibryga in zwei klinischen Studien (FORMA-02 und FORMA-04) an 20 Patienten im Alter zwischen 1 und unter 18 Jahren verabreicht (6 Jugendliche zwischen 12 und unter 18 Jahren, 8 Kinder von 6 bis unter 12 Jahren und 6 Kinder zwischen 1 und unter 6 Jahren). Die hämostatische Wirksamkeit wurde von einem unabhängigen Bewertungsgremium für alle behandelten Blutungsepisoden (10 Blutungsepisoden bei Jugendlichen, 5 bei Kindern zwischen 6 und unter 12 Jahren und 5 bei Kindern von 1 bis unter 6 Jahren) als erfolgreich eingestuft. Die Prophylaxe für die 4 bei diesen Patienten durchgeführten Operationen (1 bei Jugendlichen und 3 bei Kindern zwischen 1 und unter 6 Jahren) wurde ebenfalls als erfolgreich bewertet.
PharmakokinetikHumanes Fibrinogen ist ein normaler Bestandteil des menschlichen Plasmas und verhält sich wie körpereigenes Fibrinogen. Die biologische Halbwertszeit von Fibrinogen im Plasma beträgt 3-4 Tage. Fibryga wird intravenös verabreicht und ist sofort in einer der verabreichten Dosis entsprechenden Plasmakonzentration verfügbar.
In einer offenen, prospektiven, randomisierten, kontrollierten, zweiarmigen Cross-Over-Studie der Phase II bei 22 Patienten mit kongenitalem Fibrinogenmangel (Afibrinogenämie) im Alter zwischen 12 und 53 Jahren (6 Jugendliche, 16 Erwachsene) wurden die pharmakokinetischen Eigenschaften von Fibryga nach Gabe einer Einzeldosis mit denen eines anderen auf dem Markt befindlichen Fibrinogenkonzentrats bei den gleichen Patienten verglichen (FORMA-01). Jeder Patient erhielt eine intravenöse Einzeldosis von 70 mg/kg Fibryga und dem Vergleichspräparat. Zur Bestimmung der Fibrinogenaktivität wurden vor Beginn der Infusion und bis 14 Tage nach Ende der Infusion Blutproben gesammelt. Die pharmakokinetischen Parameter von Fibryga in der Per-Protocol(PP)-Analyse (n = 21) sind in der nachstehenden Tabelle zusammengefasst.
Tabelle 3: Pharmakokinetische Parameter (n = 21) für die Fibrinogenaktivität (PP-Population*)
|
Parameter
|
Mittelwert ± SD
|
Bereich
| |
Halbwertszeit (h)
|
75,9 ± 23,8
|
40,0-157,0
| |
Cmax (mg/dl)
|
139,0 ± 36,9
|
83,0-216,0
| |
AUCnorm für Dosis von 70 mg/kg (mg*h/ml)
|
113,7 ± 31,5
|
59,7-175,5
| |
Clearance (ml/h/kg)
|
0,67 ± 0,2
|
0,4-1,2
| |
Mittlere Verweildauer (h)
|
106,3 ± 30,9
|
58,7-205,5
| |
Verteilungsvolumen im Steady State (ml/kg)
|
70,2 ± 29,9
|
36,9-149,1
|
* Ein Patient wurde von der PP-Population ausgeschlossen, weil dieser < 90 % der vorgesehenen Dosis von Fibryga und dem Vergleichspräparat erhalten hatte
Cmax = maximale Plasmakonzentration; AUCnorm = für die verabreichte Dosis normalisierte Fläche unter der Kurve; SD = Standardabweichung
Zusätzlich wurde die inkrementelle Wiederfindungsrate (In Vivo Recovery [IVR]) aus Spiegeln bis zu 4 Stunden nach der Infusion bestimmt. Die mediane inkrementelle IVR war ein Anstieg um 1,8 mg/dl (Bereich 1,08-2,62 mg/dl) pro mg/kg. Die mediane IVR besagt, dass eine Dosis von 70 mg/kg die Fibrinogenkonzentration im Plasma des Patienten um ca. 125 mg/dl erhöht.
Pharmakokinetik bei besonderen Patientengruppen
Zwischen männlichen und weiblichen Studienteilnehmern wurde hinsichtlich der Fibrinogenaktivität kein statistisch relevanter Unterschied festgestellt. In der PP-Analyse wurde bei der Halbwertszeit bei Patienten unter 18 Jahren (n = 5) mit 72,8 ± 16,5 Stunden ein geringer Unterschied gegenüber der Gruppe der Erwachsenen (n = 16, 76,9 ± 26,1 Stunden) beobachtet.
Absorption
Nicht zutreffend.
Distribution
Verteilungsvolumen im Steady State (ml/kg): siehe Tabelle 3. Das Verteilungsvolumen betrug 70,2 ± 29,9 ml/kg.
Metabolismus
Nicht bekannt.
Elimination
Clearance (ml/h/kg): siehe Tabelle 3. Die Clearance war in beiden Altersgruppen nahezu identisch und betrug 0,68 ± 0,18 ml/h/kg bzw. 0,66 ± 0,21 ml/h/kg.
Kinder und Jugendliche
Die pharmakokinetischen Eigenschaften von Fibryga wurden in der Studie FORMA-04 an 13 Kindern im Alter von 1 bis 10 Jahren mit kongenitalem Fibrinogenmangel (Afibrinogenämie) eingehender untersucht. Jeder Patient erhielt eine intravenöse Einzeldosis von 70 mg/kg Fibryga. Die pharmakokinetischen Parameter von Fibryga sind in der nachstehenden Tabelle zusammengefasst. Die mediane inkrementelle IVR war ein Anstieg um 1,4 mg/dl (Bereich 1,3-2,1 mg/dl) pro mg/kg.
Tabelle 4: Pharmakokinetische Parameter (n = 13) für die Fibrinogenaktivität
|
Parameter
|
Mittelwert ± SD
|
Bereich
| |
Halbwertszeit (h)*
|
63,3 ± 12,0
|
45,6-91,6
| |
Cmax (mg/dl)
|
107,2 ± 16,8
|
93,0-154,0
| |
AUCnorm für Dosis von 70 mg/kg (mg*h/ml)*
|
92,0 ± 20,0
|
69,7-134,2
| |
Clearance (ml/h/kg)*
|
0,8 ± 0,2
|
0,5-1,0
| |
Mittlere Verweildauer (h)*
|
88,0 ± 16,8
|
63,6-126,7
| |
Verteilungsvolumen im Steady State (ml/kg)*
|
67,6 ± 7,1
|
52,8-76,8
|
*Berechnet bei 10 von 13 Patienten aufgrund der unzureichenden Anzahl messbarer Werte bei 3 Patienten
IVR = Wiederfindungsrate (In Vivo Recovery); Cmax = maximale Plasmakonzentration; AUCnorm = für die verabreichte Dosis normalisierte Fläche unter der Kurve; SD = Standardabweichung
Präklinische DatenSicherheitspharmakologie
Basierend auf den Studien zur Sicherheitspharmakologie, lassen die präklinische Daten keine besonderen Gefahren für den Menschen erkennen.
Langzeittoxizität (bzw. Toxizität bei wiederholter Verabreichung)
Toxizitätsstudien bei wiederholter Verabreichung wurden nicht durchgeführt. Toxizitätsstudien in Tieren bei wiederholter Verabreichung von Fibryga sind aufgrund zu erwartender Interferenzen mit induzierten Antikörpern gegen das menschliche Protein nicht durchführbar.
Mutagenität
Studien zur Mutagenität wurden nicht durchgeführt. Da es sich um ein aus Plasma gewonnenes humanes Protein zur perioperativen Prophylaxe und Substitutionstherapie handelt, werden mutagene Effekte nicht erwartet.
Karzinogenität
Studien zur Kanzerogenität wurden nicht durchgeführt. Da es sich um ein aus Plasma gewonnenes humanes Protein zur perioperativen Prophylaxe und Substitutionstherapie handelt, werden kanzerogene Effekte nicht erwartet.
Reproduktionstoxizität
Studien zur Reproduktionstoxizität wurden nicht durchgeführt. Unter der beabsichtigten klinischen Indikation und Anwendung von Fibryga sind reproduktionstoxikologische Wirkungen auszuschliessen.
Weitere Daten (Lokale Toxizität, Phototoxizität, Immunotoxizität)
Die lokale Verträglichkeit wurde an Kaninchen intravenös, intraarteriell und paravenös getestet. Die makroskopische Untersuchung der Applikationsstellen nach intraarterieller Verabreichung ergab leichte Schorfbildung und Rötung. Die histopathologische Untersuchung ergab keine Anzeichen morphologische Läsionen. Fibryga zeigte eine hervorragende Verträglichkeit für die intravenöse Verabreichung, den für die klinische Anwendung vorgesehenen Verabreichungsweg.
Sonstige HinweiseInkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf Fibryga nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Fibryga darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Die chemische und physikalische Stabilität nach Rekonstitution wurde für 24 Stunden bei Raumtemperatur (max. 25 °C) gezeigt. Aus mikrobiologischer Sicht sollte das Arzneimittel sofort nach der Rekonstitution verwendet werden. Wenn die rekonstituierte Lösung nicht sofort angewendet wird, unterliegen die Aufbewahrungszeiten und -bedingungen der Verantwortung des Anwenders. Die rekonstituierte Lösung darf nicht eingefroren oder im Kühlschrank gelagert werden. Angebrochene Flaschen sind zu verwerfen.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Nicht über 25 °C lagern. Nicht einfrieren. Die Flasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels, siehe «Haltbarkeit nach Anbruch».
Hinweise für die Handhabung
Die rekonstituierte Lösung sollte nahezu farblos und leicht opaleszierend sein. Keine Lösungen verwenden, die trübe sind oder Ablagerungen aufweisen.
Fibryga ist nur zur einmaligen Verwendung bestimmt. Kein Bestandteil darf erneut verwendet werden.
Aus Gründen der mikrobiologischen Sicherheit sollte das Arzneimittel sofort nach der Rekonstitution verwendet werden. Die chemische und physikalische Stabilität nach Rekonstitution wurde für 24 Stunden bei Raumtemperatur (max. 25 °C) gezeigt. Die rekonstituierte Lösung darf nicht eingefroren oder im Kühlschrank gelagert werden.
Rekonstitution
1.Stellen Sie sicher, dass die Flasche mit dem Pulver (Fibryga) und das Fläschchen mit dem Lösungsmittel Raumtemperatur aufweisen. Diese Temperatur sollte während der Rekonstitution beibehalten werden. Wenn zum Aufwärmen ein Wasserbad benutzt wird, muss darauf geachtet werden, dass das Wasser nicht in Kontakt mit den Gummistopfen oder den Verschlusskappen der Behältnisse kommt. Die Temperatur des Wasserbads sollte +37 °C nicht überschreiten.
2.Die Verschlusskappen von der Flasche mit dem Pulver (Fibryga) und dem Fläschchen mit dem Lösungsmittel abziehen, um den zentralen Teil des Infusionsstopfens freizulegen. Die Gummistopfen mit einem Alkoholtupfer säubern und anschliessend trocknen lassen.
3.Die Packung mit dem Transfersystem (nextaro) durch Abziehen des Deckels öffnen (Abb. 1). Das Transfersystem nicht aus der durchsichtigen Blisterpackung nehmen, um die Sterilität zu gewährleisten. Nicht den Dorn berühren.
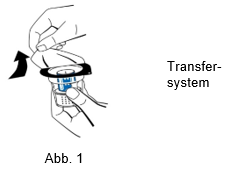
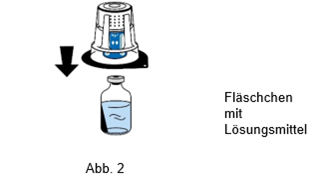
4.Das Fläschchen mit dem Lösungsmittel auf eine ebene, saubere Fläche stellen und festhalten. Ohne die Blisterpackung zu entfernen, den blauen Teil des Transfersystems auf das Fläschchen mit dem Lösungsmittel aufsetzen. Gerade und fest nach unten drücken, bis es einrastet (Abb. 2). Beim Aufsetzen nicht drehen.
Hinweis:
Das Transfersystem muss zuerst auf das Fläschchen mit dem Lösungsmittel und dann auf die Flasche mit dem lyophilisierten Pulver aufgesetzt werden. Andernfalls kommt es zu einem Verlust des Vakuums, und das Lösungsmittel kann nicht überführt werden.
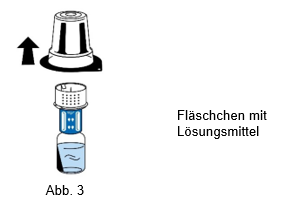
5.Das Fläschchen mit dem Lösungsmittel festhalten und die Blisterpackung vorsichtig vom Transfersystem (nextaro) entfernen, indem Sie diese senkrecht nach oben ziehen. Achten Sie darauf, dass das Transfersystem fest mit dem Fläschchen mit dem Lösungsmittel verbunden bleibt (Abb. 3).
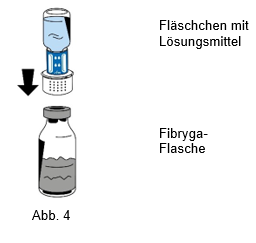
6.Die Flasche mit dem Pulver (Fibryga) auf eine ebene, saubere Fläche stellen und festhalten. Das Fläschchen mit dem Lösungsmittel und dem daran befestigten Transfersystem ergreifen und auf den Kopf drehen. Den weissen Teil des Transfersystem-Verbindungsstücks auf die Flasche mit dem Pulver (Fibryga) setzen und fest nach unten drücken, bis es einrastet (Abb. 4). Beim Aufsetzen nicht drehen. Das Lösungsmittel fliesst automatisch in die Flasche mit dem Pulver (Fibryga).
7.Die Fibryga-Flasche mit dem daran befestigten Fläschchen mit dem Lösungsmittel vorsichtig schwenken, bis das Pulver vollständig gelöst ist. Die Flasche nicht schütteln, um Schaumbildung zu vermeiden. Das Pulver sollte innerhalb von ca. 5 Minuten vollständig gelöst sein. Das Auflösen des Pulvers sollte nicht länger als 20 Minuten dauern. Wenn das Pulver nach 20 Minuten noch nicht vollständig gelöst ist, muss das Arzneimittel verworfen werden.
8.In den seltenen Fällen, in denen während der Überführung des WfI ein in der Flüssigkeit schwimmendes, nicht rekonstituiertes Pulver festgestellt wird oder die Rekonstitution unerwartet lange dauert, kann der Auflösungsprozess durch kräftigere horizontale Bewegung der Flasche unterstützt werden.
9.Nach Abschluss der Rekonstitution das Transfersystem (blauer Teil) gegen den Uhrzeigersinn in zwei Teile aufdrehen (Abb. 5). Dabei den Luer-Lock-Anschluss am weissen Teil des Transfersystems nicht berühren.
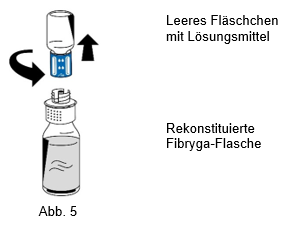
10.Das leere Lösungsmittel-Fläschchen zusammen mit dem blauen Teil des Transfersystems entsorgen.
Anwendung
1.Vorsichtig eine Spritze am Luer-Lock-Anschluss auf dem weissen Teil des Transfersystems anbringen (Abb. 6).
2.Die Fibryga-Flasche auf den Kopf drehen und die Lösung in die Spritze aufziehen (Abb. 7).
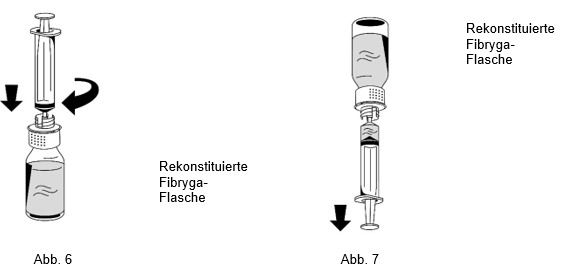
3.Nachdem die Lösung aufgezogen wurde, den Spritzenkörper festhalten (der Spritzenkolben zeigt nach unten) und die Spritze vom Transfersystem trennen (Abb. 8).
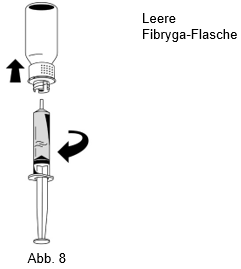
4.Den weissen Teil des Transfersystems zusammen mit der leeren Fibryga-Flasche entsorgen.
Zur intravenösen Verabreichung der rekonstituierten Lösung bei Raumtemperatur wird die Verwendung eines herkömmlichen Infusionssets empfohlen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Zulassungsnummer66836 (Swissmedic)
Packungen1 Packung Fibryga (B)
mit:
1 Durchstechflasche mit Pulver
1 Durchstechflasche mit Lösungsmittel (Wasser für Injektionszwecke)
1 nextaro-Transfersystem
Die Flasche mit Pulver ist aus farblosem Glas Typ II, verschlossen mit einem Bromobutyl-Gummistopfen und einer Verschlusskappe aus Aluminium.
Die Flasche mit Lösungsmittel ist aus farblosem Glas Typ II, verschlossen mit einem Halobutyl-Gummistopfen und einer Verschlusskappe aus Aluminium.
ZulassungsinhaberinOctapharma AG
Seidenstrasse 2
CH-8853 Lachen
Stand der InformationNovember 2023.
|