| Fachinformation zu NYXOID®: | Mundipharma Medical Company, Hamilton, Bermuda, Basel Branch | | ZusammensetzungWirkstoffe
Naloxoni hydrochloridum.
Hilfsstoffe
Tri-Natriumcitrat-Dihydrat, Natriumchlorid, Salzsäure, Natriumhydroxid, gereinigtes Wasser. Der Gesamtgehalt an Natrium beträgt maximal 0,14 mg pro Dosis à 100 µl.
Indikationen/AnwendungsmöglichkeitenNyxoid soll als Notfalltherapie bei bekannter oder vermuteter Opioid-Überdosierung, die sich als Atemdepression und/oder Depression des Zentralnervensystems manifestiert, sowohl in nicht-medizinischen als auch in medizinischen Situationen umgehend verabreicht werden.
Nyxoid wird angewendet bei Erwachsenen und Jugendlichen im Alter von 14 Jahren und älter.
Nyxoid ersetzt nicht die Behandlung durch den ärztlichen Notfalldienst.
Dosierung/AnwendungÜbliche Dosierung
Erwachsene und Jugendliche ab 14 Jahren
Die empfohlene Dosis beträgt 1,8 mg und wird in ein Nasenloch verabreicht (ein Nasenspray).
In bestimmten Fällen können weitere Dosen notwendig sein. Die angemessene Höchstdosis von Nyxoid ist situationsabhängig. Wenn der Patient nicht anspricht, sollte die zweite Dosis nach 2–3 Minuten verabreicht werden. Wenn der Patient auf die erste Verabreichung anspricht, dann jedoch wieder in eine Atemdepression verfällt, sollte die zweite Dosis umgehend verabreicht werden. Weitere Dosen (falls vorhanden) sollten abwechselnd in das linke und das rechte Nasenloch verabreicht werden und der Patient sollte während der Wartezeit bis zum Eintreffen des ärztlichen Notfalldiensts überwacht werden. Der ärztliche Notfalldienst kann entsprechend den örtlichen Richtlinien weitere Dosen verabreichen.
Spezielle Dosierungsanweisungen
Kinder und Jugendliche unter 14 Jahren
Die Sicherheit und Wirksamkeit von Nyxoid bei Patienten unter 14 Jahren ist nicht gezeigt. Es liegen keine Daten vor.
Art der Anwendung
Nasale Anwendung.
Nyxoid muss so bald wie möglich verabreicht werden, um eine Schädigung des zentralen Nervensystems oder den Tod zu verhindern.
Nyxoid enthält nur eine Dosis und daher darf vor der Anwendung kein Probestoss abgegeben werden und es darf nicht getestet werden.
Anweisungen für die Verabreichung von Nyxoid Nasenspray:
1.Überprüfen Sie die Person auf Symptome und darauf, ob sie ansprechbar ist.
·Prüfen Sie, ob die Person ansprechbar ist, um herauszufinden, ob sie bei Bewusstsein ist. Sie können den Namen der Person rufen, sanft ihre Schulter rütteln, laut in ihr Ohr sprechen, ihr Brustbein (Sternum) reiben oder ihr ins Ohr oder das Nagelbett kneifen.
·Überprüfen Sie die Atemwege und die Atmung. Entfernen Sie alle Blockaden aus dem Mund und der Nase. Prüfen Sie die Atmung 10 Sekunden lang – bewegt sich der Brustkorb? Können Sie Atemgeräusche hören? Können Sie den Atem auf der Wange spüren?
·Überprüfen Sie auf Anzeichen einer Überdosierung, wie z. B.: keine Reaktion auf Berührung oder Geräusche, langsame, ungleichmässige Atmung oder keine Atmung, Schnarchen, nach Luft schnappen oder Schlucken, blaue oder lila Fingernägel oder Lippen.
·Wenn eine Überdosierung vermutet wird, sollte Nyxoid gegeben werden.

2.Rufen Sie den ärztlichen Notfalldienst. Nyxoid ersetzt nicht die Behandlung durch den ärztlichen Notfalldienst.
3.Ziehen Sie die Folie auf der Rückseite der Blisterpackung von der Ecke aus ab, um den Nasenspray herauszunehmen. Legen Sie den Nasenspray griffbereit hin.
4.Legen Sie den Patienten auf den Rücken, stützen Sie seinen Nacken und neigen Sie seinen Kopf nach hinten. Entfernen Sie alles, was die Nase des Patienten blockiert.
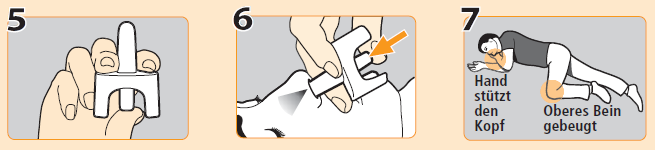
5.Halten Sie die Düse des Nasensprays zwischen Mittel- und Zeigefinger und legen Sie Ihren Daumen auf den Kolben. Geben Sie keinen Probestoss des Nyxoid-Nasensprays ab und testen Sie es nicht vor der Anwendung, da es nur eine Dosis Naloxon enthält und nicht wiederverwendet werden kann.
6.Führen Sie die Düse vorsichtig in ein Nasenloch des Patienten ein. Drücken Sie kräftig auf den Kolben, bis es klickt, um die Dosis zu verabreichen. Nach der Verabreichung ziehen Sie die Düse aus dem Nasenloch.
7.Bringen Sie den Patienten in die stabile Seitenlage. Der Mund muss geöffnet sein und Richtung Boden zeigen. Bleiben Sie beim Patienten, bis der ärztliche Notfalldienst eintrifft. Achten Sie darauf, ob sich Atmung, Wachheit und Ansprechen auf Geräusche und Berührung bessern.
8.Wenn es dem Patienten nicht innerhalb von 2 bis 3 Minuten besser geht, kann eine zweite Dosis verabreicht werden. Seien Sie sich bitte bewusst, dass der Patient aufwachen, aber darauf wieder das Bewusstsein verlieren und aufhören kann zu atmen. Wenn dies geschieht, kann eine zweite Dosis umgehend verabreicht werden. Wiederholen Sie die Schritte 3 bis 6 mit einem neuen Nyxoid-Nasenspray im anderen Nasenloch. Sie können dies tun, während der Patient sich in der stabilen Seitenlage befindet.
9.Wenn der Patient auf zwei Dosen nicht anspricht, können weitere Dosen verabreicht werden (falls vorhanden). Bleiben Sie beim Patienten und halten Sie weiterhin nach einer Verbesserung Ausschau, bis der ärztliche Notfalldienst eintrifft, der den Patienten weiterbehandeln wird.
Wenn der Patient nicht bei Bewusstsein ist oder nicht normal atmet, sollten nach Möglichkeit zusätzliche lebensrettende Massnahmen eingeleitet werden.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenUnterweisung von Patienten/Anwendern in die ordnungsgemässe Anwendung von Nyxoid
Nyxoid sollte erst dann ausgehändigt werden, nachdem die Eignung und Kompetenz der Person festgestellt wurden, Naloxon unter den angemessenen Umständen zu verabreichen. Patienten oder andere Personen, die Nyxoid eventuell einem Patienten verabreichen müssen, sind in den Symptomen zur Erkennung einer anzunehmenden Atemdepression und/oder Depression des Zentralnervensystems, in der ordnungsgemässen Anwendung von Nyxoid und in der Wichtigkeit der Benachrichtigung des ärztlichen Notfalldiensts zu unterweisen.
Nyxoid ersetzt nicht die Behandlung durch den ärztlichen Notfalldienst.
Nyxoid kann statt einer intravenösen (i.v.) Injektion verabreicht werden, wenn ein i.v. Zugang nicht sofort verfügbar ist.
Nyxoid soll als Teil der Wiederbelebungsmassnahmen bei Verdacht auf eine Überdosierung mit möglicher Beteiligung von Opioid-Medikamenten angewendet werden, z. B. in einem nichtmedizinischen Umfeld.
Reaktion des Patienten überwachen
Patienten, die zufriedenstellend auf Nyxoid ansprechen, müssen strikt überwacht werden. Die Wirkung einiger Opioide kann länger andauern als die Wirkung von Naloxon, was dazu führen kann, dass eine Atemdepression erneut auftritt und eine weitere Dosis Naloxon erforderlich ist.
Opioid-Entzugssyndrom
Die Verabreichung von Nyxoid kann eine schnelle Umkehrung der Opioid-Wirkung auslösen und zu einem akuten Entzugssyndrom führen (siehe «Unerwünschte Wirkungen»). Patienten, die Opioide zur Linderung chronischer Schmerzen bekommen, verspüren nach der Verabreichung von Nyxoid möglicherweise Schmerzen und Opioid-Entzugserscheinungen.
Wirksamkeit von Naloxon
Die Aufhebung einer durch Buprenorphin vermittelten Atemdepression ist möglicherweise nicht vollständig möglich. Wenn nur ein unvollständiges Ansprechen erreicht wird, sollte die Atmung mechanisch unterstützt werden.
Die intranasale Resorption und Wirksamkeit von Naloxon kann bei Patienten mit verletzter Nasenschleimhaut und Septumdefekten verändert sein.
Kinder und Jugendliche unter 14 Jahren
Opioid-Entzug kann bei Neugeborenen lebensbedrohlich sein, wenn er nicht erkannt und entsprechend behandelt wird. Es können folgende Zeichen und Symptome auftreten: Krämpfe, übermässiges Weinen und hyperaktive Reflexe.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis à 100 µl, d.h. es ist nahezu „natriumfrei“.
InteraktionenNaloxon führt aufgrund der Interaktion mit Opioiden und Opioid-Agonisten zu einem pharmakologischen Ansprechen. Wenn es opioidabhängigen Personen verabreicht wird, kann Naloxon bei manchen Personen akute Entzugssymptome auslösen. Hypertonie, Herzrhythmusstörungen, Lungenödeme und Herzstillstand wurden berichtet, normalerweise bei der postoperativen Anwendung von Naloxon (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»).
Die Anwendung von Nyxoid kann die analgetischen Wirkungen von Opioiden, die primär zur Schmerzlinderung angewendet werden, aufgrund seiner antagonistischen Eigenschaften verringern (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Wenn Naloxon Patienten verabreicht wird, die Buprenorphin als Analgetikum erhalten haben, kann eine vollständige Analgesie möglicherweise wiederhergestellt werden. Man geht davon aus, dass diese Wirkung ein Ergebnis der bogenförmigen Dosis-Wirkungs-Kurve von Buprenorphin mit abnehmender Analgesie im Fall von hohen Dosen ist. Die Umkehrung einer durch Buprenorphin ausgelösten Atemdepression ist jedoch begrenzt.
Schwangerschaft, StillzeitSchwangerschaft
Es gibt keine ausreichenden Daten zur Anwendung von Naloxon bei schwangeren Frauen. Tierexperimentelle Studien haben eine Reproduktionstoxizität nur bei maternal toxischen Dosen gezeigt (siehe «Präklinische Daten»). Das potenzielle Risiko für den Menschen ist unbekannt. Nyxoid sollte während der Schwangerschaft nicht angewendet werden, es sei denn, der klinische Zustand der Frau erfordert die Behandlung mit Naloxon.
Bei schwangeren Frauen, die mit Nyxoid behandelt wurden, sollte der Fötus auf Anzeichen für Stress beobachtet werden.
Bei schwangeren, opioidabhängigen Frauen kann die Naloxon-Verabreichung zu Entzugserscheinungen beim Neugeborenen führen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Stillzeit
Es ist nicht bekannt, ob Naloxon in die Muttermilch übergeht. Es wurde nicht erforscht, ob sich Naloxon auf gestillte Neugeborene/Kinder auswirkt. Allerdings ist Naloxon fast nicht oral bioverfügbar und somit ist das Auswirkungspotenzial auf gestillte Neugeborene/Kinder vernachlässigbar.
Bei der Verabreichung von Naloxon an eine stillende Mutter ist Vorsicht geboten, aber es besteht keine Notwendigkeit, das Stillen abzubrechen.
Gestillte Kinder von Müttern, die mit Nyxoid behandelt wurden, sollten überwacht werden, um sie auf eine Sedierung oder Reizbarkeit zu prüfen.
Fertilität
Es gibt keine klinischen Daten über die Auswirkungen von Naloxon auf die Fruchtbarkeit, aber Daten aus Studien mit Ratten (siehe «Präklinische Daten») zeigten keine Auswirkungen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenPatienten, die Naloxon zur Umkehr der Opioid-Wirkung bekommen haben, dürfen mindestens 24 h lang nicht Auto fahren, Maschinen bedienen oder andere körperlich oder mental anstrengende Aktivitäten ausführen, da die Wirkung der Opioide sonst zurückkehren kann.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die häufigste unerwünschte Arzneimittelwirkung unter Naloxon ist Übelkeit (sehr häufig). Bei Verabreichung von Naloxon ist ein typisches Opioidentzugssyndrom zu erwarten, was durch den abrupten Opioidentzug bei körperlich abhängigen Personen auftreten kann.
Liste der unerwünschten Wirkungen
Folgende unerwünschte Wirkungen wurden unter Nyxoid und/oder anderen naloxonhaltigen medizinischen Präparaten während klinischer Studien und nach der Marktzulassung gemeldet. Die Häufigkeitskategorien sind den unerwünschten Wirkungen zugewiesen, die zumindest möglicherweise in einem kausalen Zusammenhang mit Naloxon stehen könnten. Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
„sehr häufig“ (≥1/10)
„häufig“ (≥1/100, <1/10),
„gelegentlich“ (≥1/1‘000, <1/100)
„selten“ (≥1/10‘000, <1/1‘000)
„sehr selten“ (<1/10‘000)
Erkrankungen des Immunsystems
Sehr selten: Überempfindlichkeit, anaphylaktischer Schock.
Erkrankungen des Nervensystems
Häufig: Schwindel, Kopfschmerz.
Gelegentlich: Tremor.
Herzerkrankungen
Häufig: Tachykardie.
Gelegentlich: Arrhythmie, Bradykardie.
Sehr selten: Herzflimmern, Herzstillstand.
Gefässerkrankungen
Häufig: Hypotonie, Hypertonie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Hyperventilation.
Sehr selten: Lungenödem.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Übelkeit.
Häufig: Erbrechen.
Gelegentlich: Durchfall, Mundtrockenheit.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Hyperhidrose.
Sehr selten: Erythema multiforme.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Arzneimittelentzugssyndrom (bei Patienten, die von Opioiden abhängig sind).
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Arzneimittelentzugssyndrom
Zu den Zeichen und Symptomen eines Arzneimittelentzugssyndroms gehören Ruhelosigkeit, Reizbarkeit, Hyperästhesie, Übelkeit, Erbrechen, Schmerzen im Magen-Darm-Trakt, Muskelkrämpfe, Dysphorie, Schlafstörungen, Angstzustände, Hyperhidrose, Piloerektion, Tachykardie, erhöhter Blutdruck, Gähnen, Pyrexie. Verhaltensänderungen, einschliesslich gewalttätiges Verhalten, Nervosität und Aufregungszustände, können ebenfalls beobachtet werden.
Gefässerkrankungen
In Berichten über intravenöses/intramuskuläres Naloxon: Hypotonie, Hypertonie, Herzrhythmusstörung (einschliesslich ventrikulärer Tachykardie und Vorhofflimmern) und Lungenödem traten bei postoperativer Verwendung von Naloxon auf. Unerwünschte kardiovaskuläre Wirkungen traten häufiger bei postoperativen Patienten mit einer vorbestehenden kardiovaskulären Erkrankung auf oder bei Patienten, die andere Medikamente mit ähnlichen unerwünschten kardiovaskulären Wirkungen bekamen.
Pädiatrische Population
Nyxoid ist indiziert bei Erwachsenen und Jugendlichen im Alter von 14 Jahren und älter. Es ist zu erwarten, dass Häufigkeit, Art und Schwere von Nebenwirkungen bei Jugendlichen die gleichen sind wie bei Erwachsenen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAngesichts der Indikation und des breiten therapeutischen Bereichs ist keine Überdosierung zu erwarten.
Eigenschaften/WirkungenATC-Code
V03AB15
Wirkungsmechanismus
Naloxon, ein halbsynthetisches Morphinderivat (N-Allylnoroxymorphon), ist ein spezifischer Opioid-Antagonist, der kompetitiv an Opioid-Rezeptoren bindet. Er zeigt eine sehr hohe Affinität für Opioid-Rezeptoren und verdrängt dadurch sowohl Opioid-Agonisten als auch partielle Antagonisten.
Pharmakodynamik
Naloxon hat keine der „agonistischen” oder morphinähnlichen Eigenschaften anderer Opioid-Antagonisten. Wenn keine Opioide oder agonistische Wirkungen anderer Opioid-Antagonisten vorhanden sind, hat es praktisch keine pharmakologische Wirkung. Für Naloxon konnte kein Gewöhnungseffekt oder die Entwicklung einer körperlichen oder mentalen Abhängigkeit gezeigt werden.
Klinische Wirksamkeit
Da die Wirkungsdauer mancher Opioid-Agonisten länger sein kann als die von Naloxon, können die Wirkungen dieser Opioid-Agonisten erneut auftreten, wenn die Wirkung von Naloxon nachlässt. Deswegen können weitere Dosen Naloxon erforderlich sein – allerdings ist die Notwendigkeit wiederholter Naloxon-Dosen von Menge, Art und Verabreichungsweg des behandelten Opioid-Agonisten abhängig.
Pädiatrie
Kinder und Jugendliche unter 14 Jahren
Es liegen keine Daten vor.
PharmakokinetikAbsorption
Naloxon wird bei intranasaler Verabreichung sehr schnell resorbiert, was durch den sehr frühen Nachweis (bereits 1 Minute nach Verabreichung) des Wirkstoffs im systemischen Kreislauf gesichert ist.
Eine Studie zur Untersuchung von intranasalem Naloxon in Dosierungen von 1, 2 und 4 mg (MR903-1501) zeigte, dass der mediane (Bereich) tmax bei intranasaler Verabreichung von 1 mg Naloxon bei 15 (10-60) min. liegt. Bei intranasalen Dosen von 2 mg wird die Spitzenkonzentration nach 30 (8-60) min. erreicht und bei intranasalen Dosen von 4 mg nach 15 (10-60) min. Es wird davon ausgegangen, dass der Wirkungseintritt nach intranasaler Verabreichung bei jedem Patienten bereits vor Erreichen des tmax erfolgt.
Die Halbwertsdauer (Plasmakonzentrationen ≥ 50% Cmax) bei intranasaler Verabreichung war länger als bei i.m. Verabreichung (intranasal 2 mg: 1,27 h, i.m. 0,4 mg: 1,09 h). Daraus lässt sich schliessen, dass intranasal verabreichtes Naloxon eine längere Wirkungsdauer hat als i.m. verabreichtes Naloxon. Wenn die Wirkungsdauer des Opioid-Agonisten länger ist als die von intranasalem Naloxon, können die Auswirkungen des Opioid-Agonisten erneut auftreten und eine zweite intranasale Verabreichung von Naloxon erforderlich machen.
Eine Studie zeigte eine mittlere absolute Bioverfügbarkeit von 47% und eine mittlere Halbwertszeit von 1,4 h nach intranasalen Dosen von 2 mg.
Distribution
Keine Angaben.
Metabolismus
Naloxon wird schnell in der Leber metabolisiert und über den Urin ausgeschieden. Die umfassende Verstoffwechselung in der Leber erfolgt vor allem durch Glucuronid-Konjugation. Die wichtigsten Metaboliten sind Naloxon-3glucuronid, 6-beta-naloxol und sein Glucuronid.
Elimination
Über die Ausscheidung von Naloxon nach intranasaler Verabreichung gibt es keine Daten, aber die Disposition von markiertem Naloxon nach i.v. Verabreichung wurde an gesunden Freiwilligen und opioidabhängigen Patienten untersucht. Nach einer i.v. Dosis von 125 µg wurden bei gesunden Freiwilligen innerhalb von 6 h 38% der Dosis im Urin wiedergefunden, während es bei opioidabhängigen Patienten im gleichen Zeitraum nur 25% der Dosis waren. Nach 72 h wurden bei gesunden Freiwilligen 65% der Dosis im Urin wiedergefunden, während es bei opioidabhängigen Patienten 68% der Dosis waren.
Kinetik spezieller Patientengruppen
Kinder und Jugendliche
Es liegen keine Daten vor.
Präklinische DatenBasierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Gentoxizität, Kanzerogenität und Reproduktionstoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Adverse Effekte wurden in präklinischen Studien nur bei Expositionen beobachtet, die als ausreichend über der maximalen Exposition des Menschen liegend angesehen wurden, was auf eine geringe Relevanz für die klinische Anwendung hinweist.
Es sind keine für die Anwendung sicherheitsrelevanten Präparat-spezifischen Daten bekannt.
Genotoxizität
Naloxon erwies sich im Ames-Test als nicht mutagen, war aber positiv im Maus-Lymphom-Test und klastogen in vitro, wobei Naloxon in vivo nicht klastogen ist. Insgesamt deutet die Evidenz darauf hin, dass Naloxon, wenn überhaupt, nur ein minimales genotoxisches Risiko für Menschen darstellt.
Kanzerogenität
In einem 2-jährigen Tierversuch an Ratten und in einem 26wöchigen Experiment an Tg-rasH2-Mäusen erwies sich Naloxon nach oraler Verabreichung als nicht karzinogen. Insgesamt deutet die Evidenz darauf hin, dass Naloxon, wenn überhaupt, nur ein minimales karzinogenes Risiko für Menschen darstellt.
Reproduktionstoxizität
Naloxon hatte keine Auswirkung auf die Fruchtbarkeit und Reproduktion von Ratten oder auf die frühembryonale Entwicklung bei Ratten und Kaninchen. In peri-postnatalen Studien an Ratten erhöhte Naloxon in hohen Dosen, die auch signifikante Toxizität bei der Mutter auslösten (z. B. Verlust von Körpergewicht, Krämpfe), die Sterblichkeit der Nachkommen direkt nach der Geburt. Naloxon hatte keinen Einfluss auf die Entwicklung oder das Verhalten der überlebenden Nachkommen. Naloxon ist daher bei Ratten oder Kaninchen nicht teratogen.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit „EXP“ bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 25°C lagern.
Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer66930 (Swissmedic).
PackungenPackungen mit 2 Einzeldosis-Nasensprays [B].
ZulassungsinhaberinMundipharma Medical Company, Hamilton/Bermuda, Zweigniederlassung Basel
Stand der InformationFebruar 2018.
|
|


