Eigenschaften/WirkungenATC-Code
R03AC19
Wirkungsmechanismus
Pharmakodynamik
Olodaterol hat eine starke Affinität und eine hohe Selektivität für den menschlichen Beta2-Adrenozeptor.
In-vitro-Studien belegen, dass die agonistische Aktivität von Olodaterol an den Beta2-Adrenozeptoren mehr als 219-mal grösser als an den Beta1-Adrenozeptoren und 1622-mal grösser als an den Beta3-Adrenozeptoren ist.
Nach topischer Verabreichung mittels Inhalation übt die Substanz ihre pharmakologischen Wirkungen aus, indem sie an Beta2-Adrenozeptoren bindet und diese aktiviert.
Die Aktivierung dieser Rezeptoren in den Atemwegen führt zur Stimulation des intrazellulären Enzyms Adenylzyklase, das die Synthese von zyklischem 3',5'-Adenosinmonophosphat (cAMP) vermittelt. Erhöhte cAMP-Spiegel induzieren eine Bronchodilatation, da sie die glatten Muskelzellen in den Atemwegen relaxieren.
In präklinischen Studien zeigte Olodaterol das Profil eines selektiven langwirkenden Beta2-Agonisten (LABA) mit schnellem Wirkungseintritt und einer Wirkdauer von mindestens 24 Stunden.
Die Beta-Adrenozeptoren werden in drei Subtypen unterteilt: Beta1-Adrenozeptoren werden vorwiegend auf den glatten Herzmuskelzellen, Beta2-Adrenozeptoren vorwiegend auf den Muskelzellen der Atemwege und Beta3-Adrenozeptoren vorwiegend auf Fettgewebszellen exprimiert. Die Beta2-Agonisten bewirken eine Bronchodilatation. Zwar stellen die Beta2-Adrenozeptoren den vorherrschenden Adrenozeptortyp in der glatten Muskulatur der Atemwege dar, doch findet sich dieser Typ auch auf der Oberfläche verschiedener anderer Zellen, darunter die Epithel- und Endothelzellen der Lungen und Zellen im Herzen. Die genaue Funktion der Beta2-Rezeptoren im Herzen ist nicht bekannt, doch bedeutet die Tatsache, dass sie dort vorhanden sind, dass selbst hochgradig selektive beta2-adrenerge Agonisten Wirkungen am Herzen haben können.
Klinische Wirksamkeit
Wirkungen auf die Elektrophysiologie des Herzens
In einer randomisierten, placebo- und aktiv- (Moxifloxacin) kontrollierten Studie wurde bei 24 gesunden männlichen und weiblichen Probanden untersucht, wie sich Olodaterol auf das QT/QTc-Intervall im EKG auswirkt. Es wurde nachgewiesen, dass sich das QT-Intervall in den ersten 20 Minuten bis 2 Stunden nach Verabreichung einer Einmaldosis Olodaterol (10, 20, 30 und 50 mcg) im Mittel um 1,6 Millisekunden (unter 10 mcg Olodaterol) bis 6,5 Millisekunden (unter 50 mcg Olodaterol) stärker gegenüber dem Ausgangswert verändert als unter Placebo; diese Wirkung ist dosisabhängig, wobei die obere Grenze des zweiseitigen 90%-Konfidenzintervalls für alle Dosierungsstufen unter 10 Millisekunden lag.
In den 48-wöchigen, placebokontrollierten Phase-3-Studien wurde bei einer Untergruppe von 772 Patienten die Wirkung von 5 mcg und 10 mcg Striverdi Respimat auf Herzfrequenz und Herzrhythmus mittels kontinuierlichem 24-Stunden-EKG (Holter-Monitoring) untersucht. Dabei wurden keine dosis- oder zeitabhängigen Trends oder Muster bezüglich der Grössenordnungen der mittleren Veränderungen hinsichtlich Herzfrequenz oder Auftreten von Extrasystolen beobachtet. Die Veränderungen zwischen Baseline und Behandlungsende hinsichtlich Extrasystolen liessen keine bedeutsamen Unterschiede zwischen Olodaterol 5 mcg, Olodaterol 10 mcg und Placebo erkennen.
Das klinische Entwicklungsprogramm der Phase III zu Striverdi Respimat bestand aus acht randomisierten, placebokontrollierten Doppelblindstudien. von denen jeweils zwei ein identisches Design hatten. Von den insgesamt 3533 Teilnehmern mit COPD erhielten 1281 die Dosis von 5 mcg und 1284 die Dosis von 10 mcg.
Durchgeführt wurden:
1.zwei identisch angelegte, placebokontrollierte, 48-wöchige Studien mit parallelen Gruppen [Studien 1 und 2]
2.zwei identisch angelegte, placebo- und aktiv-kontrollierte, 48-wöchige Studien mit parallelen Gruppen und Formoterol 12 mcg zweimal täglich als aktive Vergleichstherapie [Studien 3 und 4]
3.zwei identisch angelegte, placebo- und aktiv-kontrollierte, 6-wöchige Studien mit Crossover-Design und Formoterol 12 mcg zweimal täglich als aktive Vergleichstherapie [Studien 5 und 6]
4.zwei identisch angelegte, placebo- und aktiv-kontrollierte, 6-wöchige Studien mit Crossover-Design und Tiotropium HandiHaler 18 mcg einmal täglich als aktive Vergleichstherapie [Studien 7 und 8].
In allen Studien wurde die Lungenfunktion (forciertes exspiratorisches Volumen in einer Sekunde, FEV1), in den 48-wöchigen Studien ausserdem das Ansprechen der Lungenfunktion in der Peak-Phase (AUC0-3) und in der Talphase gemessen. Die 6-wöchigen Studien hingegen beinhalteten die kontinuierliche Ermittlung des Lungenfunktionsprofils während eines Dosierungsintervalls von 24 Stunden. In den beiden identisch angelegten placebo- und aktiv-kontrollierten, 48-wöchigen Studien wurden auch der Transition Dyspnea Index (TDI) zur Bewertung der Dyspnoe und der St. George's Respiratory Questionnaire (SGRQ) zur Bewertung der gesundheitsbezogenen Lebensqualität eingesetzt.
An dem Entwicklungsprogramm der Phase III nahmen Patienten im Alter von 40 Jahren oder älter mit der klinischen Diagnose einer COPD, einer Raucheranamnese von mindestens 10 Packungsjahren und einer mittelgradigen bis sehr schweren Einschränkung der Lungenfunktion (FEV1 nach Anwendung eines Bronchodilatators <80% des Normwertes [GOLD-Stadium II-IV]; FEV1/FVC-Quotient nach Anwendung eines Bronchodilatators <70%) teil.
Merkmale der Patienten
Die 3104 Patienten, die für die weltweiten, 48-wöchigen Studien [Studien 1 und 2, Studien 3 und 4] rekrutiert wurden, waren überwiegend männlich (77%) und europäischstämmig (66%) bzw. Asiaten (32%) mit einem Durchschnittsalter von 64 Jahren. Das mittlere FEV1 nach Anwendung eines Bronchodilatators betrug 1,38 Liter (GOLD II [50%], GOLD III [40%], GOLD IV [10%]). Im Mittel führte die Gabe eines Beta2-Agonisten zu einer Veränderung um 15% des Ausgangsbefundes (0,160 Liter). Mit Ausnahme anderer langwirkender Beta2-Agonisten waren als Begleittherapie alle Lungenmedikamente erlaubt (so z.B. Tiotropium [24%], Ipratropium [25%], inhalative Steroide [45%], Xanthine [16%]). Die Aufnahme der Patienten erfolgte stratifiziert nach der Anwendung von Tiotropium. In allen vier Studien wurden die folgenden primären Wirksamkeitsendpunkte zur Beurteilung der Wirkung auf die Lungenfunktion erfasst: Veränderung des forcierten Einsekundenvolumens im Zeitraum 0-3 Stunden (FEV1 AUC0-3h) und in der Talphase (vor der nächsten Dosis), jeweils gegenüber dem Ausgangswert vor Behandlungsbeginn (nach 12 Wochen in den Studien 1 und 2; nach 24 Wochen in den Studien 3 und 4).
Die 6-wöchigen Studien [Studien 5 und 6, Studien 7 und 8] wurden in Europa und Nordamerika durchgeführt. Für die Studien 5 und 6 wurden 199 Patienten – mehrheitlich Männer (53%) und Europäischstämmige (93%) – mit einem Durchschnittsalter von 63 Jahren rekrutiert. Der mittlere FEV1-Wert nach Anwendung eines Bronchodilatators betrug 1,43 Liter (GOLD II [54%], GOLD III [39%], GOLD IV [7%]). Die durch die Gabe eines Beta2-Agonisten erzielte Veränderung betrug im Mittel 17% des Ausgangswertes (0,187 Liter). Mit Ausnahme anderer langwirkender Beta2-Agonisten waren als Begleittherapie alle Lungenmedikamente erlaubt (so z.B. Tiotropium [24%], Ipratropium [16%], inhalative Steroide [31%], Xanthine [0,5%]). Tiotropium musste allerdings jeweils 48 h vor den Messungen spirometrischer Endpunkte pausiert werden. Die 230 für die Studien 7 und 8 rekrutierten Patienten waren ebenfalls mehrheitlich männlich (69%) und europäischstämmig (99,6%); das Durchschnittsalter betrug bei diesen Studien 62 Jahre. Der mittlere FEV1-Wert nach Anwendung eines Bronchodilatators betrug 1,55 Liter (GOLD II [57%], GOLD III [35%], GOLD IV [7%]), die mittlere Veränderung durch die Gabe eines Beta2-Agonisten 18% des Ausgangswertes (0,203 Liter). Mit Ausnahme anderer langwirkender Beta2-Agonisten und Anticholinergika waren als Begleittherapie alle Lungenmedikamente erlaubt (z.B. inhalative Steroide [49%], Xanthine [7%]).
Lungenfunktion
In den 48-wöchigen Studien führte die Verabreichung von 5 mcg Striverdi Respimat einmal täglich morgens innerhalb von 5 Minuten nach der ersten Dosis zu einer signifikanten (p<0,0001) Verbesserung der Lungenfunktion (mittlere Zunahme des FEV1 0,130 Liter bei einem Ausgangswert von 1,18 Litern vor der Behandlung). Die signifikante Verbesserung der Lungenfunktion hielt 24 Stunden an (mittlere Zunahme des FEV1 AUC0-3h 0,162 Liter versus Placebo, p<0,0001; mittlere Zunahme des FEV1-Talwertes nach 24 Stunden 0,071 Liter versus Placebo, p<0,0001); die Verbesserung der Lungenfunktionswerte war sowohl bei Anwendern als auch bei Nichtanwendern von Tiotropium evident. Die Verbesserung von FEV1 AUC0-3h und FEV1-Talwert war mit den Ergebnissen unter Formoterol zweimal täglich vergleichbar. Die bronchodilatatorischen Wirkungen von Striverdi Respimat hielten bis zum Ende der 48-wöchigen Behandlung an. Striverdi Respimat verbesserte auch die morgendlichen und abendlichen PEFR-Werte (maximale exspiratorische Atemflussrate) im Vergleich zu Placebo, was anhand der täglichen Aufzeichnungen der Patienten ermittelt wurde.
In den 6-wöchigen Studien sprachen die FEV1-Werte der mit Striverdi Respimat behandelten Patienten während des gesamten 24-stündigen Dosierungsintervalls signifikant stärker auf die Behandlung an als die Werte der Patienten unter Placebo (p<0,0001) (Abbildung 1, Abbildung 2, Tabelle 1).
Abbildung 1: FEV1-Profil unter Striverdi Respimat 5 mcg und unter Placebo, kontinuierlich gemessen während des gesamten 24-stündigen Dosierungsintervalls (Studien 5 und 6; kombiniertes Datenmaterial; Anticholinergika als Begleitbehandlung waren erlaubt)
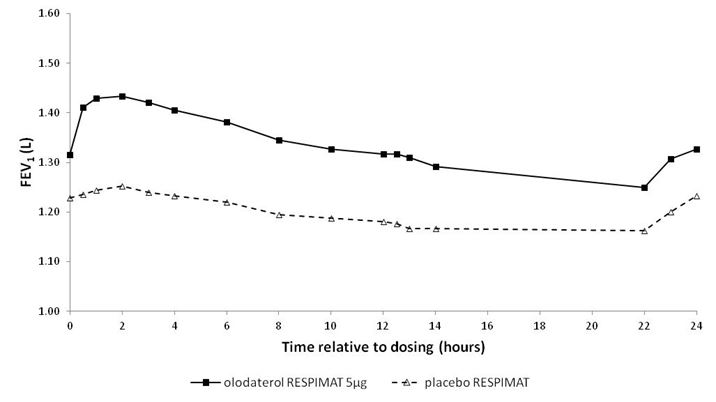
Abbildung 2: FEV1-Profil unter Striverdi Respimat 5 mcg und unter Placebo, kontinuierlich gemessen während des gesamten 24-stündigen Dosierungsintervalls (Studien 7 und 8; kombiniertes Datenmaterial; Anticholinergika als Begleitbehandlung waren nicht erlaubt)

Tabelle 1: Differenzen zwischen den FEV1-Werten unter Striverdi Respimat 5 mcg und unter Placebo bei kontinuierlicher Messung während eines 24-stündigen Dosierungsintervalls nach 6-wöchiger Behandlung in den Studien 5 und 6 (kombinierte Daten) und den Studien 7 und 8 (kombinierte Daten)
|
|
FEV1: Differenz vs. Placebo (Liter)1
| |
|
Durchschnitt nach 3 Std.
|
Durchschnitt nach 12 Std.
|
Durchschnitt nach 24 Std.
|
Talwert
| |
Studien 5 und 6
|
0,175
|
0,160
|
0,137
|
0,102
| |
Studien 7 und 8
|
0,211
|
0,193
|
0,168
|
0,134
|
1 Ausgangswerte vor Behandlungsbeginn: FEV1 = 1,26 Liter (Studien 5 und 6) bzw. 1,33 Liter (Studien 7 und 8)
Der Transition Dyspnea Index (TDI) und der St. George's Respiratory Questionnaire (SGRQ) wurden auch im Rahmen der placebo- und aktiv kontrollierten, 48-wöchigen Wiederholungsstudien [Studien 1 und 2] eingesetzt.
Nach 24 Wochen wurde bei der primären Analyse in der Placebo-Gruppe in einer Studie (Tabelle 1) kein signifikanter Unterschied zwischen Striverdi Respimat, Formoterol und Placebo in Bezug auf den Punktwert des TDI nachgewiesen; in einer post-hoc-Analyse, in der die Studienabbrüche von Patienten berücksichtigt wurden, wies der Unterschied zwischen Striverdi Respimat und Placebo einen p-Wert von 0,027 auf.
Tabelle 2: Punktwert des TDI nach 24 Behandlungswochen
|
|
|
Mittelwert der Behandlung
|
Unterschied zu Placebo
Mittelwert (p-Wert)
| |
Primäre Analyse
|
Placebo
|
1,5 (0,2)
|
| |
|
Olodaterol 5 μg einmal täglich
|
1,9 (0,2)
|
0,3 (p=0,1704)
| |
|
Formoterol 12 μg zweimal täglich
|
1,8 (0,2)
|
0,2 (p=0,3718)
| |
Post-hoc-Analyse
|
Placebo
|
1,5 (0,2)
|
| |
|
Olodaterol 5 μg einmal täglich
|
2,0 (0,2)
|
0,5 (p=0,0270)
| |
|
Formoterol 12 μg zweimal täglich
|
1,8 (0,2)
|
0,4 (p=0,1166)
|
Exazerbationen, Lebensqualität, Bedarf an Notfallmedikamenten, PGR-Skala.
In den identisch angelegten, placebo- und aktiv-kontrollierten, 48-wöchigen Studien [Studien 3 und 4] wurden als sekundäre Endpunkte Exazerbationen und mithilfe des SGRQ-Fragebogens (St. George's Respiratory Questionnaire) auch die gesundheitsbezogene Lebensqualität erfasst.
Betreffend Exazerbationshäufigkeit zeigte weder Olodaterol noch Formoterol konsistente Unterschiede gegenüber Placebo. Nach 24 Wochen waren die mittleren SGRQ-Gesamtscores der Patienten, die mit Striverdi Respimat behandelt wurden, signifikant besser als die der Patienten unter Placebo (Tabelle 2); eine Verbesserung war in allen 3 SGRQ-Domänen (Beschwerden, Tätigkeiten, Auswirkungen) zu beobachten. Verglichen mit Placebo zeigten mehr Patienten unter Striverdi Respimat eine Verbesserung des SGRQ-Gesamtscores über der minimalen klinisch bedeutsamen Differenz (MCID: 4 Punkte) (50,2% vs. 36,4%, p<0,0001).
Tabelle 3: SGRQ-Gesamtscores und Einzelscores für die Domänen nach 24-wöchiger Therapie
|
|
|
Mittelwert der Behandlung
(Veränderung vs. Baseline)
|
Differenz vs. Placebo
Mittelwert (p-Wert)
| |
Gesamtscore
|
Baseline
|
44,4
|
| |
|
Placebo
|
41,6 (-2,8)
|
| |
|
Olodaterol 5 μg 1x täglich
|
38,8 (-5,6)
|
-2,8 (p=0,0034)
| |
|
Formoterol 12 μg 2x täglich
|
40,4 (-4,0)
|
-1,2 (p=0,2009)
| |
Beschwerden
|
Placebo
|
46,0
|
| |
|
Olodaterol 5 μg 1x täglich
|
41,1
|
-4,8 (p=0,0004)
| |
|
Formoterol 12 μg 2x täglich
|
43,7
|
-2,3 (p=0,0924)
| |
Tätigkeiten
|
Placebo
|
55,3
|
| |
|
Olodaterol 5 μg 1x täglich
|
52,9
|
-2,4 (p=0,0455)
| |
|
Formoterol 12 μg 2x täglich
|
55,0
|
-0,3 (p=0,7797)
| |
Auswirkungen
|
Placebo
|
32,3
|
| |
|
Olodaterol 5 μg 1x täglich
|
29,7
|
-2,6 (p=0,0157)
| |
|
Formoterol 12 μg 2x täglich
|
30,8
|
-1,5 (p=0,1605)
|
Die Patienten, die mit Striverdi Respimat behandelt wurden, benötigten tagsüber ebenso wie nachts weniger Salbutamol als Notfallmedikament als die Patienten, die Placebo erhielten.
In jeder der 48-wöchigen Studien erzielten die Patienten, die mit Striverdi Respimat behandelt wurden, eine stärkere Verbesserung ihrer Atemfunktion als die Patienten der Placebogruppe. Gemessen wurde dies mithilfe einer PGR-Skala (Patient's Global Rating Scale); dieses Ergebnis ist ein weiterer Beleg für die positive Wirkung auf die Symptome.
Belastungstoleranz
Die Wirkung von Striverdi Respimat auf die durch das Auftreten von Symptomen limitierte Belastungstoleranz bei COPD-Patienten wurde in zwei identischen, randomisierten, placebokontrollierten, 6-wöchigen Doppelblindstudien mit Crossover-Design untersucht. In diesen Studien verbesserte Striverdi Respimat die tolerierte Belastungsdauer signifikant um 14,0% (p=0,0002) bzw. 11,8% (p=0,0018) versus Placebo. Striverdi Respimat reduzierte auch die Überblähung der Lungen (verminderte funktionelle Residualkapazität, FRC) mit dem Ergebnis, dass die inspiratorische Kapazität in Ruhe und bei Belastung im Vergleich zu Placebo zunahm.
|


