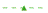Eigenschaften/WirkungenATC-Code
M09AX09
Wirkungsmechanismus
Onasemnogen abeparvovec ist eine Gentherapie, die darauf abzielt, eine funktionsfähige Kopie des Survival-Motoneuron-Gens (SMN1) in die transduzierten Zellen einzubringen, um die monogenetische Grundursache der Erkrankung zu behandeln. Durch das Bereitstellen einer alternativen Quelle der SMN-Proteinexpression in Motoneuronen wird voraussichtlich das Überleben und die Funktion der transduzierten Motoneuronen gefördert.
Onasemnogen abeparvovec ist ein nicht-replizierender rekombinanter AAV9-Vektor, der ein AAV9-Kapsid verwendet, um ein stabiles, voll funktionsfähiges menschliches SMN-Transgen bereitzustellen. Die Fähigkeit des AAV9-Kapsids, die Blut-Hirn-Schranke zu überwinden, und Motoneuronen zu transduzieren konnte nachgewiesen werden. Das in Onasemnogen abeparvovec vorhandene SMN1-Gen ist so konzipiert, dass es als episomale DNS im Kern der transduzierten Zellen liegt und in postmitotischen Zellen voraussichtlich über einen längeren Zeitraum stabil exprimiert wird. Es besteht die Möglichkeit, dass rekombinante AAV Vektoren mit geringer Häufigkeit zufällig in die menschliche DNA integrieren. (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Es ist nicht bekannt, dass das AAV9-Virus beim Menschen Krankheiten verursacht. Das Transgen wird als selbst-komplementäres doppelsträngiges Molekül in die Zielzellen eingebracht. Die Expression des Transgens wird durch einen konstitutiven Promotor (Hybrid aus Cytomegalievirus-Enhancer und Hühner-β-Aktin Promotor) ermöglicht, der zu einer kontinuierlichen, anhaltenden SMN-Proteinexpression führt. Der Nachweis des Wirkmechanismus wird durch präklinische Studien und durch Daten zur Biodistribution am Menschen gestützt.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
Phase-3-Studie AVXS-101-CL-303 bei Patienten mit Typ-1-SMA
AVXS-101-CL-303 (Studie CL-303) ist eine offene, einarmige Phase-3-Einzeldosisstudie, in der Onasemnogen-Abeparvovoec in der therapeutischen Dosis (1,1 × 1014 vg/kg) intravenös angewendet wird. Es wurden 22 Patienten mit Typ-1-SMA und zwei SMN2-Kopien aufgenommen. Vor der Behandlung mit Onasemnogen abeparvovec benötigte keiner der 22 Patienten die Unterstützung durch nicht-invasive Beatmung (NIV), und alle Patienten konnten ausschliesslich oral ernährt werden (d.h. es bestand keine Notwendigkeit für eine nicht-orale Ernährung). Der durchschnittliche CHOP-INTEND-(Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders-)Score bei Baseline lag bei 32,0 (Bereich 18 bis 52). Das Alter der 22 Patienten zum Zeitpunkt der Behandlung betrug im Durchschnitt 3,7 Monate (Bereich 0,5 bis 5,9 Monaten).
Von den 22 in die Studie aufgenommenen Patienten überlebten 21 Patienten bis ≥10,5 Monate ohne Dauerbeatmung (dies wird als ereignisfreies Überleben bezeichnet), 20 Patienten überlebten bis ≥14 Monate ereignisfrei (co-primärer Wirksamkeitsendpunkt) und 20 Patienten bis 18 Monate.
Drei Patienten brachen die Studie ab. Bei zwei von ihnen trat ein Ereignis (Tod oder Dauerbeatmung) auf, was zu 90,9 % (95 % KI: 79,7 %, 100,0 %) ereignisfreiem Überleben (ohne Dauerbeatmung am Leben) im Alter von 14 Monaten führte, siehe Abbildung 1.
Abbildung 1: Zeit (in Monaten) bis zum Tod oder dauerhafter Beatmung, zusammengefasst aus den Onasemnogen abeparvovec i.v.-Studien (CL-101, CL-302, CL-303, CL-304 2-Kopien-Kohorte)
PNCR = Pediatric Neuromuscular Clinical Research, Kohorte im natürlichen, interventionslosen Verlauf (Natural History).
NeuroNext = Exzellenz-Netzwerk für klinische Studien in den Neurowissenschaften, Kohorte im natürlichen Verlauf (Natural History)
Bei den 14 Patienten der Studie CL-303, die den Meilenstein «unabhängiges Sitzen über mindestens 30 Sekunden» zu einem beliebigen Termin während der Studie erreicht haben, betrug das mediane Alter beim erstmaligen Nachweis dieses Meilensteins 12,6 Monate (Bereich 9,2 bis 18,6 Monate).
Bei 13 Patienten (59,1 %) bestätigte sich der Meilenstein «unabhängiges Sitzen über mindestens 30 Sekunden» bei der 18-Monats-Visite (co-primärer Endpunkt, p < 0,0001). Ein Patient erreichte den Meilenstein «unabhängiges Sitzen über 30 Sekunden» im Alter von 16 Monaten, der jedoch bei der 18-Monats-Visite nicht bestätigt werden konnte. Die videobestätigten Entwicklungsmeilensteine für die Patienten in der Studie CL-303 sind in Tabelle 4 zusammengefasst. Drei Patienten erreichten keinen Motorik- Meilenstein (13,6 %) und weitere drei Patienten (13,6 %) erreichten vor dem letzten Studienbesuch im Alter von 18 Monaten eine Kopfkontrolle als maximalen Motorik-Meilenstein.
Tabelle 4: Mediane Zeit bis zum videodokumentierten Erreichen von Motorik-Meilensteinen, Studie CL-303
|
Videodokumentierter Meilenstein
|
Anzahl Patienten, die den Meilenstein erreichten
n/N (%)
|
Medianes Alter bis Erreichen des Meilensteins
(Monate)
|
95 %-Konfidenzintervall
| |
Kopfkontrolle
|
17/20* (85.0)
|
6,8
|
(4,77, 7,57)
| |
Rollt sich vom Rücken auf die Seiten
|
13/22 (59.1)
|
11,5
|
(7,77, 14,53)
| |
Sitzt ohne Unterstützung über 30 Sekunden (Bayley)
|
14/22 (63.6)
|
12,5
|
(10,17, 15,20)
| |
Unterstützungsfreies Sitzen über mindestens 10 Sekunden (WHO)
|
14/22 (63.6)
|
13,9
|
(11,00, 16,17)
|
* 2 Patienten zeigten laut klinischer Beurteilung zu Therapiebeginn eine Kopfkontrolle.
Ein Patient (4,5 %) konnte nach 12,9 Monaten ebenfalls mit Unterstützung gehen. Aufgrund des natürlichen Verlaufs der Erkrankung wurde nicht erwartet, dass Patienten, die die Einschlusskriterien der Studie erfüllten, die Fähigkeit zum Sitzen ohne Unterstützung erlangten. Darüber hinaus waren 18 der 22 Patienten im Alter von 18 Monaten von der Beatmungsunterstützung unabhängig.
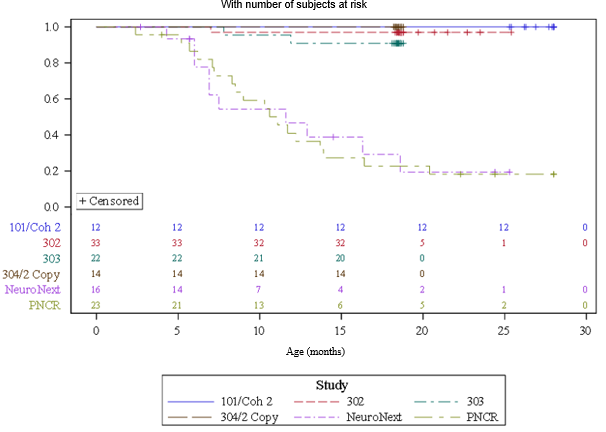
Eine Verbesserung der motorischen Entwicklung wurde auch beobachtet; dabei basierten die Messungen auf dem CHOP INTEND-Test, siehe Abbildung 2. Einundzwanzig Patienten (95,5 %) erreichten einen CHOP-INTEND-Wert ≥40, 14 Patienten (63,6 %) hatten einen CHOP-INTEND-Wert ≥50 und 9 Patienten (40,9 %) hatten einen CHOP-INTEND-Wert ≥58 erreicht. Patienten mit unbehandelter Typ-1-SMA erreichen fast nie einen CHOP-INTEND-Wert ≥40. Trotz eines konstanten Niveaus bei CHOP-INTEND wurden bei einigen Patienten Motorik-Meilensteine erreicht. Es wurde keine klare Korrelation zwischen den CHOP-INTEND-Werten und dem Erreichen von Motorik-Meilensteinen beobachtet.
Abbildung 2: Scores der motorischen Entwicklung nach CHOP-INTEND, Studie CL-303 (n=22)
Phase-3-Studie AVXS-101-CL-302 bei Patienten mit SMA
AVXS-101-CL-302 (Studie CL-302) ist eine offene, einarmige Phase-3-Einzeldosisstudie, in der onasemnogene abeparvovec in der therapeutischen Dosis (1,1 × 1014 vg/kg) intravenös verabreicht wurde. Es wurden 33 Patienten mit Typ-1-SMA und 2 SMN2-Kopien in die Studie eingeschlossen. Vor der Behandlung mit onasemnogene abeparvovec benötigten 9 Patienten (27,3 %) unterstützende Beatmung und 9 Patienten (27,3 %) Sondenernährung. Der mittlere CHOP-INTEND-Wert der 33 Patienten bei Baseline betrug 27,9 (Bereich: 14 bis 55). Das Durchschnittsalter der 33 Patienten betrug zum Zeitpunkt der Behandlung 4,1 Monate (Bereich: 1,8 bis 6,0 Monate).
Von den 33 eingeschlossenen Patienten («Efficacy Completers Population») befand sich ein Patient (3 %), der eine Dosis erhalten hatte, ausserhalb des Altersbereichs gemäss Protokoll und wurde daher nicht in die Intent-to-treat-Population (ITT) aufgenommen. Von den 32 Patienten in der ITT-Population starb ein Patient (3 %) während der Studie aufgrund eines Fortschreitens der Krankheit.
Von den 32 Patienten in der ITT-Population erreichten 14 Patienten (43,8 %) den Meilenstein «Sitzen ohne Unterstützung für mindestens 10 Sekunden» bei irgendeinem Studientermin bis einschliesslich zum Studientermin nach 18 Monaten (primärer Wirksamkeitsendpunkt). Das mediane Alter, bei dem dieser Meilenstein erstmalig erreicht wurde, lag bei 15,9 Monaten (Bereich: 7,7 bis 18,6 Monate). 31 Patienten (96,9 %) in der ITT-Population überlebten ohne dauerhafte Beatmung (d.h. ereignisfreies Überleben) bis zum Alter von ≥14 Monaten (sekundärer Wirksamkeitsendpunkt).
Die zusätzlichen videobestätigten Entwicklungsmeilensteine für Patienten in der «Efficacy Completers Population» der Studie CL-302 bei irgendeinem Studientermin bis zum Studientermin nach 18 Monaten (einschliesslich) sind in Tabelle 5 zusammengefasst.
Tabelle 5: Mediane Zeit bis zum videodokumentierten Erreichen von Motorik-Meilensteinen in der Studie CL-302 («Efficacy Completers Population»)
|
Videodokumentierter Meilenstein
|
Anzahl der Patienten, die den Meilenstein erreichten
n/N (%)
|
Medianes Alter bis zum Erreichen des Meilensteins
(Monate)
|
95-%-Konfidenzintervall
| |
Kopfkontrolle
|
23/30* (76,7)
|
8,0
|
(5,8; 9,2)
| |
Rollt sich vom Rücken auf die Seiten
|
19/33 (57,6)
|
15,3
|
(12,5; 17,4)
| |
Sitzt mehr als 30 Sekunden ohne Unterstützung
|
16/33 (48,5)
|
14,3
|
(8,3; 18,3)
|
*3 Patienten zeigten laut klinischer Beurteilung bei Baseline eine Kopfkontrolle.
Ein Patient (3 %) erreichte die Motorik-Meilensteine Krabbeln, Stehen mit Unterstützung, alleine Stehen, Gehen mit Unterstützung und alleine Gehen bis zum Alter von 18 Monaten.
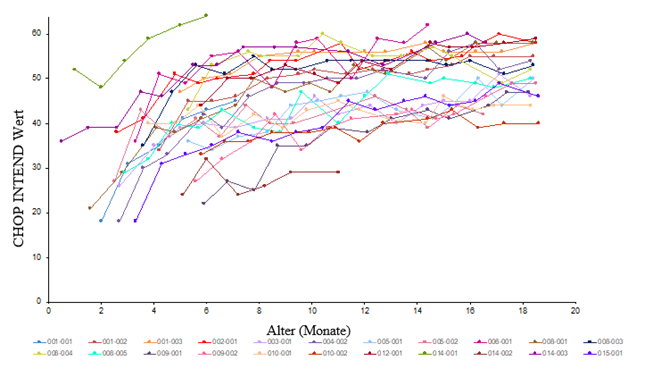
Von den 33 eingeschlossenen Patienten erreichten 24 Patienten (72,7 %) einen CHOP-INTEND-Wert von ≥40, 14 Patienten (42,4 %) erreichten einen CHOP-INTEND-Wert von ≥50 und 3 Patienten (9,1 %) erreichten einen CHOP-INTEND-Wert von ≥58 (siehe Abbildung 3). Patienten mit unbehandelter Typ-1-SMA erreichen fast nie einen CHOP-INTEND-Wert von ≥40.
Abbildung 3; Werte der motorischen Entwicklung nach CHOP-INTEND in der Studie CL-302 («Efficacy Completers Population»; N=33)*
*Hinweis: Der programmgesteuert berechnete Gesamtwert für einen Patienten (
) in Monat 7 (Gesamtwert=3) wird als ungültig betrachtet. Es wurden nicht alle Elemente bewertet und der Gesamtwert hätte auf «fehlend» (d.h. nicht berechnet) gesetzt werden müssen.
Phase-1-Studie AVXS-101-CL-101 bei Patienten mit Typ-1-SMA
Die Ergebnisse aus der Studie CL-303 werden gestützt durch die Studie AVXS-101-CL-101 (Studie CL-101) eine Phase-1-Studie mit Typ-1-SMA Patienten, in der Onasemnogen abeparvovec als einzelne intravenöse Infusion bei 12 Patienten mit einem Körpergewicht von 3,6 kg bis 8,4 kg (Alter 0,9 Monate bis 7,9 Monate) angewendet wurde. Im Alter von 14 Monaten waren alle behandelten Patienten ereignisfrei, d.h. sie überlebten ohne dauerhafte Beatmung, verglichen mit 25 % in der Kohorte im natürlichen Verlauf (Natural History). Am Ende der Studie (24 Monate nach der Verabreichung) waren alle behandelten Patienten ereignisfrei, verglichen mit weniger als 8% in der Natural History, siehe Abbildung 1.
Nach 24 Monaten posttherapeutischer Nachbeobachtung konnten 10 von 12 Patienten ≥10 Sekunden lang ohne Unterstützung sitzen, 9 Patienten konnten ≥30 Sekunden lang ohne Unterstützung sitzen und 2 Patienten konnten ohne Hilfe stehen und gehen. Bei einem von 12 Patienten wurde die Kopfkontrolle als maximaler Motorik-Meilenstein nicht vor dem Alter von 24 Monaten erreicht. Zehn von 12 Patienten aus der Studie CL-101 werden in einer Langzeitstudie (bis zu 7.5 Jahre nach der Verabreichung) weiter beobachtet und alle 10 Patienten waren am 23. Mai 2022 am Leben und benötigten keine dauerhafte Beatmung. Alle der 10 Patienten haben entweder die zuvor erreichten Meilensteine beibehalten oder neue Meilensteine erreicht, darunter Sitzen mit Unterstützung, Stehen mit Hilfe und allein Gehen. Sechs der 10 Patienten erhielten während der Langzeitstudie zu einem Zeitpunkt eine begleitende Nusinersen- oder Risdiplam Behandlung. Das Aufrechterhalten der Wirksamkeit und das Erreichen von Meilensteinen kann daher nicht bei allen Patienten allein auf Onasemnogen abeparvovec zurückgeführt werden. Der Meilenstein «Stehen mit Hilfe» wurde von zwei Patienten, die kein Nusinersen oder Risdiplam erhielten, neu erreicht.
Phase-3-Studie AVXS-101-CL-304 bei Patienten mit präsymptomatischer SMA
Die Studie CL-304 ist eine, globale, offene, einarmige, multizentrische Phase-3-Einzeldosis-Studie mit AVXS-101 i.v. bei präsymptomatischen neugeborenen Patienten bis zu einem Alter von 6 Wochen mit 2 (Kohorte 1, n = 14) oder 3 (Kohorte 2, n = 15) SMN2-Kopien.
Kohorte 1
Die 14 behandelten Patienten mit 2 SMN2-Kopien wurden bis zum Alter von 18 Monaten beobachtet. Alle Patienten überlebten ereignisfrei bis zu einem Alter von mindestens 14 Monaten ohne dauerhafte Beatmung. Alle 14 Patienten erreichten bei irgendeinem Studientermin bis zum Alter von 18 Monaten (primärer Wirksamkeitsendpunkt) den Meilenstein «Sitzen ohne Unterstützung für mindestens 30 Sekunden», und zwar in einem Alter von 5,7 bis 11,8 Monaten. 11 der 14 Patienten erreichten den Meilenstein «Sitzen ohne Unterstützung» im Alter von 279 Tagen oder früher, dem 99. Perzentil für die Entwicklung dieses Meilensteins. Neun Patienten erreichten den Meilenstein «alleine Gehen» (64,3 %). Alle 14 Patienten haben bis zum Alter von 18 Monaten bei irgendeinem Studientermin einen CHOP-INTEND-Wert von ≥58 erreicht. Keiner der Patienten benötigte während der Studie unterstützende Beatmung oder Sondenernährung.
Kohorte 2
Die 15 behandelten Patienten mit 3 SMN2-Kopien wurden bis zum Alter von 24 Monaten beobachtet. Alle Patienten überlebten ereignisfrei bis zum Alter von 24 Monaten ohne dauerhafte Beatmung.
Alle 15 Patienten waren im Alter von 9,5 bis 18,3 Monaten in der Lage, mindestens 3 Sekunden lang ohne Unterstützung allein zu stehen (primärer Wirksamkeitsendpunkt). 14 der 15 Patienten erreichten den Meilenstein «alleine Stehen» im Alter von 514 Tagen oder früher, was dem 99. Perzentil für die Entwicklung dieses Meilensteins entspricht. Vierzehn Patienten (93,3 %) waren in der Lage, mindestens fünf Schritte selbstständig zu gehen. Alle 15 Patienten erreichten in den Bayley-III-Untertests für Grob- und Feinmotorik bei jeder Nachuntersuchung bis zum Alter von 24 Monaten einen Wert von ≥4 innerhalb von 2 Standardabweichungen vom Altersmittelwert. Keiner der Patienten benötigte während der Studie unterstützende Beatmung oder Sondenernährung.
Phase-3-Studie OAV101A12306 bei Patienten mit SMA mit einem Gewicht von ≥8,5 kg bis ≤21 kg
Die Studie OAV101A12306 ist eine abgeschlossene, offene, einarmige, multizentrische Phase-3-Studie zur intravenösen Verabreichung von Zolgensma in der therapeutischen Dosis (1,1 × 1014 vg/kg) bei 24 pädiatrischen Patienten mit SMA mit einem Gewicht von ≥8,5 kg bis ≤21 kg (Mediangewicht: 15,8 kg). Das Alter der Patienten warzum Zeitpunkt der Verabreichung zwischen 1,5 und 9 Jahren. 1 der 24 Patienten war zum Zeitpunkt der Verabreichung noch keine 2 Jahre alt (Median: 4,9 Jahre). Die Patienten hatten 2 bis 4 Kopien von SMN2. Vor der Behandlung mit Zolgensma setzten 21 Patienten ihre vorherige Behandlung mit Nusinersen oder Risdiplam ab.
In Woche 52 betrug die mittlere Veränderung des Gesamtscores der Hammersmith Functional Motor Scale - Expanded (HFMSE) gegenüber dem Ausgangswert 3,7 (18/24 Patienten), was aufgrund der Daten zum natürlichen Verlauf der SMA klinisch bedeutsam ist. Der mittlere Anstieg des Gesamtscores des Revised Upper Limb Module (RULM) lag in Woche 52 bei 2,0 (17/24 Patienten).
In den klinischen Prüfungen ist Onasemnogen abeparvovec bei Patienten mit einer biallelischen Mutation im SMN1-Gen und nur einer SMN2-Kopie nicht untersucht worden.
|