Eigenschaften/WirkungenATC-Code
L01XL07
Wirkungsmechanismus
Abecma ist eine chimäre Antigenrezeptor-positive T-Zelltherapie (CAR-positive T-Zelltherapie), die auf das B-Zell-Reifungsantigen abzielt, das auf der Oberfläche von normalen und malignen Plasmazellen exprimiert wird. Das CAR-Konstrukt enthält eine Anti-BCMA-scFv-Zieldomäne für die Antigenspezifität, eine Transmembrandomäne, eine CD3-Zeta-T-Zell-Aktivierungsdomäne und eine 4-1BB kostimulatorische Domäne. Die antigenspezifische Aktivierung von Abecma führt zu CAR-positiver T-Zellproliferation, Zytokinsekretion und anschliessender zytolytischer Abtötung von BCMA-exprimierenden Zellen.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
KarMMa-3
KarMMa-3 ist eine offene, multizentrische, randomisierte, kontrollierte klinische Studie zur Untersuchung der Wirksamkeit und Sicherheit von Abecma im Vergleich zu Standardtherapie-Regimen bei erwachsenen Patienten mit rezidiviertem und refraktärem multiplen Myelom, die zwei bis vier vorangegangene Therapielinien zur Behandlung des multiplen Myeloms erhalten haben, darunter ein immunmodulatorischer Wirkstoff, ein Proteasom-Inhibitor und Daratumumab. Die Patienten waren auf ihre letzte Myelombehandlung refraktär. Jedem Patienten wurde vor der Randomisierung ein Standard-Regime zugewiesen, das sich nach seiner letzten Myelomtherapie richtete. Die Standard-Regimen bestanden aus Daratumumab, Pomalidomid, Dexamethason (DPd); Daratumumab, Bortezomib, Dexamethason (DVd); Ixazomib, Lenalidomid, Dexamethason (IRd); Carfilzomib, Dexamethason (Kd) oder Elotuzumab, Pomalidomid, Dexamethason (EPd). Falls klinisch angezeigt, wurde bei den zum Abecma-Arm randomisierten Patienten das zugewiesene Standard-Regime als Überbrückungstherapie verwendet.
Die Studie schloss Patienten ein, die auf mindestens 1 vorangegangenes Therapie-Regime angesprochen hatten (geringes Ansprechen oder besser) und einen Eastern Cooperative Oncology Group (ECOG) Performance Status von 0 oder 1 aufwiesen. Ausgeschlossen von der Studie waren Patienten mit einer Serumkreatinin-Clearance < 45 ml/min, Serum-Aspartat-Aminotransferase (AST)- oder Serum-Alanin-Aminotransferase (ALT)-Werten > 2,5-fach des oberen Normalwerts und einer linksventrikulären Auswurffraktion (LVEF) < 45 %. Ebenfalls ausgeschlossen waren Patienten mit einer absoluten Neutrophilenzahl < 1000/µl und einer Thrombozytenzahl < 75.000/μl, bei denen < 50 % der kernhaltigen Zellen im Knochenmark Plasmazellen waren, und Patienten mit einer Thrombozytenzahl < 50.000/μl, bei denen ≥50 % der kernhaltigen Zellen im Knochenmark Plasmazellen waren.
Das Durchschnittsalter der Studienpopulation betrug 63 Jahre (Bereich: 30 bis 83 Jahre); 40,9 % waren 65 Jahre oder älter und 60,9 % waren Männer. Der ECOG Performance Status war bei Studienbeginn 0 bei 48,2 %, 1 bei 50,5 % und 2 bei 0,8 % der Patienten.
Neunzig Prozent der Patienten waren refraktär gegenüber eine immunmodulatorischen Medikament (IMiD), 74 % waren refraktär gegenüber einem Proteasom-Inhibitor (PI), und 95 % waren refraktär gegenüber einem monoklonalen Anti-CD38-Antikörper. Sechsundsechzig Prozent waren dreifach refraktär gegenüber den Klassen (refraktär gegenüber einem PI; einem IMiD und einem monoklonalen Anti-CD38 Antikörper).
Die Patienten wurden im Verhältnis 2:1 zu einer Behandlung mit entweder Abecma (n = 254) oder zu Standard-Regime (n = 132) für das rezidivierte und refraktäre multiple Myelom randomisiert. Die Randomisierung erfolgte stratifiziert nach Alter, Anzahl der vorangegangenen Myelomtherapien und zytogenetischen Anomalien mit hohem Risiko. Patienten, die das Standard-Regime erhielten, durften mit Abecma behandelt werden, wenn eine bestätigte Krankheitsprogression vorlag.
Patienten, die zu Abecma randomisiert wurden, sollten eine lymphodepletierende Chemotherapie bestehend aus Cyclophosphamid (300 mg/m2 als i.v.-Infusion täglich über 3 Tage) und Fludarabin (30 mg/m2 als i.v. Infusion täglich über 3 Tage) erhalten, welche 5 Tage vor dem Zieldatum der Infusion von Abecma beginnen sollte. Zwischen der Apherese und bis 14 Tage vor dem Beginn der lymphodepletierenden Chemotherapie war bis zu 1 Zyklus einer Krebstherapie mit DPd, DVd, IRd, Kd oder EPd (Überbrückungstherapie) zur Kontrolle der Erkrankung erlaubt.
Von den 254 zu Abecma randomisierten Patienten unterzogen sich 249 (98 %) einer Leukapherese, und 225 (88,6 %) Patienten erhielten Abecma. Von den 225 Patienten erhielten 192 (85,3 %) Patienten eine Überbrückungstherapie. Bei 29 Patienten wurde aufgrund von Tod (n = 4), unerwünschten Ereignissen (n = 5), Rücktritt (n = 2), Entscheidung des Arztes (n = 7), Nichterfüllung der Kriterien für eine lymphodepletierende Chemotherapie (n = 8) oder Herstellungsausfall (n = 3) kein Abecma angewendet.
Der erlaubte Dosisbereich lag bei 150 bis 540 x 106 CAR-positiven T-Zellen. Die tatsächlich erhaltene mediane Dosis betrug 445,3 x 106 CAR-positive T-Zellen (Bereich: 174,9 bis 529,0 x 106 CAR-positive T-Zellen). Die mediane Zeit von der Leukapherese bis zur Verfügbarkeit des Präparats betrug 35 Tage (Bereich: 24 bis 102 Tage) und die mediane Zeit von der Leukapherese bis zur Infusion betrug 49 Tage (Bereich: 34 bis 117 Tage).
Von den zu den Standard-Regimen randomisierten 132 Patienten erhielten 126 (95,5 %) eine Behandlung. Sechs Patienten brachen die Studie wegen Krankheitsprogression (n = 1), Rücktritt (n = 3) oder Entscheidung des Arztes (n = 2) ab, ohne eine Behandlung erhalten zu haben. Patienten, die ein Standard-Regime erhielten, durften auf Verlangen des Prüfarztes Abecma erhalten, wenn die unabhängige Prüfungskommission (IRC) auf der Grundlage der Kriterien der International Myeloma Working Group (IMWG) eine Krankheitsprogression bestätigte und die Eignung für die Studie bestätigt war. Von den in Frage kommenden Patienten unterzogen sich 69 (54,8 %) einer Leukapherese und 60 (47,6 %) erhielten Abecma.
Der primäre Endpunkt zur Beurteilung der Wirksamkeit war das progressionsfreie Überleben (PFS), definiert nach IMWG Uniform Response Criteria for Mulitple Myeloma und evaluiert durch die IRC.. Weitere Wirksamkeitsendpunkte waren die Gesamtansprechrate (ORR), das Gesamtüberleben (OS) und die von den patient reported outcome (PRO). In der -Zielpopulation (Intent-to-Treat, ITT) betrug die mediane Nachbeobachtungsdauer von der Randomisierung bis zum Stichtag der Datenerhebung 18,6 Monate. Eine Zusammenfassung der Interimsanalyse der Wirksamkeitsergebnisse ist in der Tabelle 3 dargestellt.
Im Abecma-Arm betrug die mediane Ansprechdauer (DOR) bei Patienten mit partiellem Ansprechen (partial response, PR) oder besser 13,9 Monate (KI-95%: 11,2; 17,8). Bei Patienten, die ein vollständiges Ansprechen (complete response, CR) oder besser erreichten, betrug die mediane Dauer des Ansprechens (duration of response, DOR) 20 Monate (KI-95%: 15,8; 24,3).
Tabelle 3: Zusammenfassung der Wirksamkeitsergebnisse basierend auf der KarMMa-3 (Intent-to-Treat-Population)
|
|
Abecma-Arm
(n = 254)
|
Standard-Regime- Arm (n = 132)
| |
Progressionsfreies Überleben (PFS)
| |
Anzahl Ereignisse, n (%)
|
149 (58,7)
|
93 (70,5)
| |
Median, Monate [KI-95%]a
|
13,3 [11,8; 16,1]
|
4,4 [3,4; 5,9]
| |
Hazard ratio [KI-95%]]b
|
0,49 [0,38; 0,65]
| |
Einseitiger p-Wertc
|
< 0,0001
| |
Gesamtansprechrate (ORR)
| |
n (%)
|
181 (71,3)
|
55 (41,7)
| |
KI-95 (%)d
|
(65,7; 76,8)
|
(33,3; 50,1)
| |
Einseitiger p-Werte
|
< 0.0001
| |
CR oder besser (sCR+CR)
|
98 (38,5)
|
7 (5,3)
| |
sCR
|
90 (35,4)
|
6 (4,5)
| |
CR
|
8 (3,1)
|
1 (0,8)
| |
VGPR
|
55 (21,7)
|
13 (9,8)
| |
PR
|
28 (11,0)
|
35 (26,5)
| |
MRD-negativ Status bei NGS and ≥ CR
| |
MRD Negativität-Rate, n (%)f
|
51 (20,1)
|
1 (0,8)
| |
KI-95 (%)d
|
(15,2; 25,0)
|
(0,0; 2,2)
|
KI=Konfidenzintervall; CR=komplettes Ansprechen; MRD=minimal residual disease; PR=Partielles Ansprechen; sCR=stringentes komplettes Ansprechen; VGPR=sehr gutes partielles Ansprechen.
a Kaplan-Meier Schätzung.
b Basierend auf stratifiziertem univariatem Cox proportional hazards model.
c Einseitiger p-Wert basierend auf stratifiziertem log-rank Test.
d Zweiseitiger Forest-Konfidenzintervall.
e Einseitiger p-Wert basierend auf stratifiziertem Cochran-Mantel-Haenszel (CMH) Test.
f MRD-Negativität wurde definiert als der Anteil aller Patienten in der ITT-Population, die eine CR oder stringentes CR und zu einem beliebigen Zeitpunkt innerhalb von drei Monaten vor Erreichen der CR oder stringenten CR bis zum Zeitpunkt der Progression oder des Todes MRD-negativ waren. Basierend auf einem Schwellenwert von 10-5 unter Verwendung von ClonoSEQ, ein next-generation sequencing (NGS) Assay.
Zum Zeitpunkt der finalen PFS-Analyse (Stichtag der Datenerhebung 28.04.2023) mit einer medianen Nachbeobachtungszeit von 30,9 Monaten betrug das mediane PFS für Abecma 13,8 Monate (95% KI: 11,8; 16,1) im Vergleich zu 4,4 Monate für die Standart-Regimen (95% KI: 3,4; 5,8); HR = 0,49 (95% KI: 0,38; 0,63), konsistent mit den Ergebnissen der Interimsanalyse.
Bei der finalen PFS-Analyse wurden 74% der geplanten OS-Ereignisse erreicht. Patienten, die ein Standart-Regime erhielten, konnten bei bestätigtem Fortschreiten der Erkrankung Abecma erhalten. Die OS-Daten sind daher durch 74 (56,1%) Patienten aus dem Standart-Regime-Arm, die Abecma als Folgetherapie erhielten, beeinflusst. Das mediane OS für Abecma betrug 41,4 Monate (95% KI: 30,9; NA) gegenüber 37,9 Monate für die Standart-Regimen (95% KI: 23,4; NA); HR = 1,01 (95% KI: 0,73; 1,40).
Patient reported outcome (PRO)
Deskriptive Analysen
Drei PRO-Messungen (EORTC QLQ-C30, EORTC QLQ-MY20, EQ-5D-5L) wurden zu Studienbeginn (Screening), monatlich bis Monat 24 und danach alle drei Monate durchgeführt. Von den Patienten, die den Fragebogen beantworteten (Abecma n = 211; Standard-Regime n = 108), zeigten sich bei den mit Abecma behandelten Patienten Trends in Richtung Verbesserungen und Unterschiede in den Durchschnittswert-Veränderungen in den meisten PRO-Bereichen, einschliesslich Müdigkeit, Schmerzen, körperliche Funktionsfähigkeit und GHS/QoL, gegenüber dem Ausgangswert im Vergleich zu den mit Standart-Regime behandelten Patienten (Siehe Abbildung 1).
Abbildung 1: EORTC QLQ-C30 - Durchschnittswert-Veränderungen in den Monaten 3, 6, 9, 12 und 15 gegenüber dem Ausgangswert für die Bereiche Müdigkeit, Schmerzen, körperliche Funktionsfähigkeit und GHS/QoL in der KarMMa-3 Studie
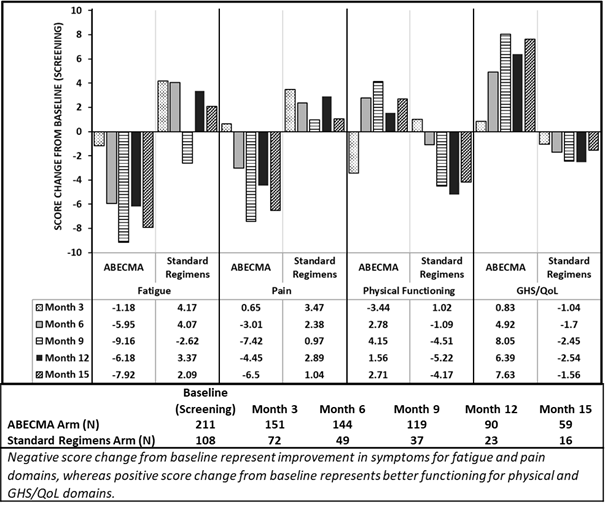
Constrained longitudinal Datenanalyse (cLDA)
Beim Vergleich der mittleren Veränderungen der Least Squares (LS) vom Ausgangswert bis zum 25. Monat unter Verwendung von cLDA waren die mittleren LS-Veränderungswerte für die meisten Bereiche der drei PRO-Messungen mit bedeutenden Effektgrössen (Hedge's g > 0.2) zugunsten der mit Abecma behandelten Patienten (Siehe Abbildung 2).
Abbildung 2: Forest plot der Unterschiede zwischen den Gruppen in der gesamten cLDA bei der mittleren Veränderung der LS-Werte gegenüber dem Ausgangswert nach Behandlungsgruppen a,b,c in der KarMMa-3 Studie (Abecma n = 211; Standard-Regimen n = 108)
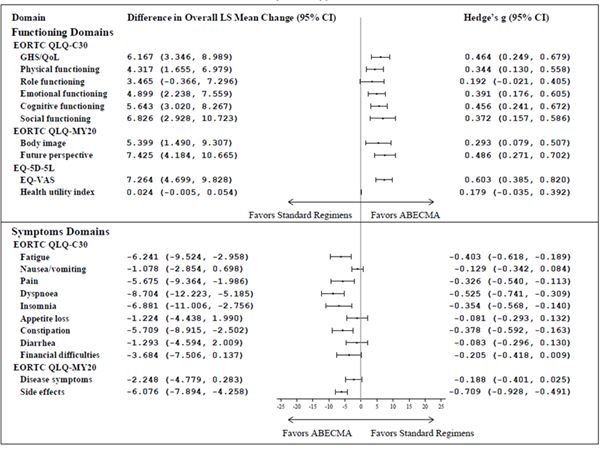
CI = Konfidenzintervall; EORTC QLQ-C30 = European Organization for Research and Treatment of Cancer Quality of Life-of-Core 30 Questionnaire; EORTC QLQ-MY20 = European Organization for Research and Treatment of Cancer Quality of Life-of-Questionnaire Multiple Myeloma Module; EQ-VAS = Visual Analogue Scale; GHS = Global health status; LS = Least square; QoL = Quality of Life.
a Guideline von Cohen (1998, 1992) für die Interpretation der Hedge's g values ist 0.20 Indikation für kleine Effekte; 0.50 für mittlere Effekte, und 0.80 für grosse Effekte.
b Primäre Interessensbereiche: EORTC QLQ-C30 Bereiche des globalen Gesundheitszustands/quality of life (QoL), physische Funktion, kognitive Funktion, Müdigkeit und Schmerzen; EORTC QLQ-MY20 Bereiche der Krankheitssymptome und Nebenwirkungen der Behandlung; EQ-5D-5L Gesundheitsindex und EQ-VAS. Die übrigen Bereiche gelten als sekundäre Bereiche.
c Die Analyse beinhaltete keine Multiplikatoren-Bereinigung.
PRO-Time-to-Event Analysen
In der KarMMa-3 Studie wurde die Time-to-Event anhand der Kaplan-Meier-Schätzung ausgewertet. Die Analyse zeigte bei Patienten, die mit Abecma versus Standard-Regime behandelt wurden, die Zeit bis zur Bestätigung einer klinisch bedeutsamen Verbesserung oder Verschlechterung in den PRO Interessensbereichen. Das Eintreten einer Verschlechterung oder Verbesserung wurde als Veränderung gegenüber dem Ausgangswert auf der Grundlage validierter Schwellenwerte definiert und durch eine nachfolgende Bewertung ≥84 Tage nach dem Eintreten bestätigt. Diese wurden in Hazard Ratio (HR) angegeben; HR<1,0 für Verschlechterung und HR>1,0 für Verbesserung, sprach für Abecma. Bei Patienten, die mit Abecma behandelt wurden, verlängerte sich die Zeit bis zur bestätigten Verschlechterung in den meisten Bereichen aller drei PRO's signifikant (HR>1,0). Mit Abecma behandelte Patienten hatten auch eine kürzere Zeitspanne bis zu einer bestätigten Verbesserung in den meisten Bereichen der PRO-Messung (HR>1,0).
KarMMa
KarMMa war eine offene, einarmige, multizentrische Studie zur Beurteilung der Wirksamkeit und Sicherheit von Abecma bei erwachsenen Patienten mit rezidiviertem und refraktärem multiplem Myelom, die mindestens drei vorhergehende Antimyelom-Therapien erhalten hatten, darunter ein immunmodulatorischer Wirkstoff, einen Proteasom-Inhibitor und einen Anti-CD38-Antikörper.
Die Studie bestand aus einer Vorbehandlung (Screening, Leukapherese und Überbrückungstherapie [falls erforderlich]), einer Behandlung (lymphodepletierende Chemotherapie [LDC] und Abecma-Infusion) und einer Nachsorge (laufend) für mindestens 24 Monate nach der Abecma-Infusion oder bis zur dokumentierten Krankheitsprogression, je nachdem, welcher Zeitraum länger war. Der LDC-Abschnitt war ein 3-tägiger Zyklus von Cyclophosphamid (300 mg/m2 i.v. Infusion täglich über 3 Tage) und Fludarabin (30 mg/m2 i.v. Infusion täglich über 3 Tage), der 5 Tage vor dem angestrebten Infusionsdatum von Abecma begann. Die Patienten mussten nach der Abecma-Infusion 14 Tage lang im Spital bleiben und wurden hinsichtlich potenzieller CRS und Neurotoxizität überwacht und behandelt.
Die mit Abecma behandelte Population wies einen hohen Grad an Refraktärität gegenüber früheren Antimyelom-Behandlungen auf: 84,4 % der Studienteilnehmenden waren dreifach refraktär (d.h. refraktär gegenüber einem immunmodulatorischen Wirkstoff, einem Protease-Inhibitor und einem Anti-CD38-Antikörper).
Die Zieldosen in der klinischen Studie waren 150, 300 oder 450 x 106 CAR-positive T-Zellen pro Infusion. Der zulässige Dosisbereich betrug 150 bis 540 x 106 CAR-positive T-Zellen. Die folgende Tabelle 3 zeigt die in der klinischen Studie verwendeten Zieldosen, basierend auf den gesamten CAR-positiven T-Zellen, und den entsprechenden Bereich der tatsächlich verabreichten Dosis, definiert als CAR-positive lebensfähige T-Zellen.
Tabelle 4: Gesamtdosis der CAR-positiven T-Zellen mit dem entsprechenden Dosisbereich der CAR-positiven lebensfähigen T-Zellen (x106)- KarMMa Studie
|
Zieldosis basierend auf den gesamten CAR-positiven T-Zellen, einschliesslich lebensfähiger und nicht lebensfähiger Zellen (x106)
|
CAR-positive lebensfähige T-Zellen (x106)
(min, max)
| |
150
|
133 bis 181
| |
300
|
254 bis 299
| |
450
|
307 bis 485
|
Von 140 Patienten, die einer Leukapherese unterzogen wurden, erhielten 128 Patienten Abecma. Einer der 140 Patienten hat das Produkt aufgrund von Herstellungsmängeln nicht erhalten. 11 weitere Patienten wurden nicht mit Abecma behandelt und zwar aufgrund der Entscheidung des Arztes (n = 3), Abbruch der Teilnahme des Patienten (n = 4), unerwünschter Ereignisse (n = 1), Krankheitsprogression (n = 1) oder Tod (n = 2) vor dem Erhalt von Abecma.
Das mediane Alter der Studienpopulation betrug 60,5 Jahre (Bereich: 33 bis 78 Jahre); 35 % waren mindestens 65 Jahre alt und 59 % waren Männer. Der Eastern Cooperative Oncology Group (ECOG) Performance Status bei Baseline betrug 0 bei 45 %, 1 bei 53 % und 2 bei 2 % der Patienten.
Die meisten Patienten (87,5 %), die mit Abecma behandelt wurden, erhielten eine Überbrückungstherapie zur Kontrolle ihres multiplen Myeloms während dem Herstellungsprozess. Die mediane Zeit von der Leukapherese bis zur Verfügbarkeit des Produkts betrug 32 Tage (Bereich: 24 bis 55 Tage) und die mediane Zeit von der Leukapherese bis zur Infusion 40 Tage (Bereich: 33 bis 79 Tage). Die mediane tatsächliche erhaltene Dosis innerhalb aller Zieldosisstufen lag bei 315,3 x 106 CAR-positiven Zellen (Bereich: 150,5 bis 518,4).
Die Wirksamkeit wurde auf der Grundlage der Gesamtansprechrate (overall response rate, ORR), der Rate des vollständigen Ansprechens (complete response, CR) und der Dauer des Ansprechens (duration of response, DOR) von einem unabhängigen Prüfausschuss (Independent Review Committee, IRC) ermittelt.
Ein weiterer Endpunkt war eine minimale Resterkrankung (minimal residual disease, MRD), die mittels Next-Generation-Sequenzierung (NGS) beurteilt wurde.
Die Wirksamkeitsergebnisse der Zieldosisstufen von 150 bis 450 x 106 CAR-positiven T-Zellen werden in Tabelle 4 dargestellt. In der Primäranalyse, basierend auf der behandelten Population, betrug die ORR 73,4 % (KI 95 %: 65,8; 81,1) und die Rate des vollständigen Ansprechens (CR) betrug 32,8 % (KI 95 %: 24,7; 40,9). Bei Patienten mit partiellem Ansprechen (partial response, PR) oder besser betrug die mediane DOR 10,6 Monate (KI 95 %: 8,0; 11,4). Bei Patienten mit CR oder besser lag die mediane DOR bei 23,3 Monaten (KI 95 %: 11,4; 23,3). Die mediane Nachkontrolldauer betrug bei allen behandelten Patienten 15,4 Monate (Bereich 0,2; 24,2).
Von 140 Patienten in der eingeschlossenen Population betrug die ORR 67,1 % und die CR betrug 30%. Andere Wirksamkeitsergebnisse für die eingeschlossenen Population stimmten mit denen der behandelten Population überein.
Tabelle 5: Zusammenfassung der Wirksamkeitsergebnisse basierend auf der KarMMa-Studie
|
|
Eingeschlossene Population
(n = 140)
|
Behandelte Population
Zieldosis von Abecma (CAR-positive T-Zellen)
| |
[150 x 106]
(n = 4)
|
[300 x 106]
(n = 70)
|
[450 x 106]
(n = 54)
|
[150 bis 450 x 106]
(n = 128)
| |
Gesamtansprechrate (SCR + CR + VGPR + PR), n (%)
|
94 (67,1)
|
2 (50,0)
|
48 (68,6)
|
44 (81,5)
|
94 (73,4)
| |
KI 95 %a
|
59,4, 74,9
|
6,8; 93,2
|
56,4; 79,1
|
68,6; 90,7
|
65,8; 81,1
| |
CR oder besser, n (%)
|
42 (30,0)
|
1 (25,0)
|
20 (28,6)
|
21 (38,9)
|
42 (32,8)
| |
KI 95 %a
|
22,4, 37,6
|
0,6; 80,6
|
18,4; 40,6
|
25,9; 53,1
|
24,7; 40,9
| |
VGPR oder besser, n (%)
|
68 (48,6)
|
2 (50,0)
|
31 (44,3)
|
35 (64,8)
|
68 (53,1)
| |
KI 95 %a
|
40,3, 56,9
|
6,8; 93,2
|
32,4; 56,7
|
50,6; 77,3
|
44,5; 61,8
| |
Patienten mit MRD-negativemb Status und ≥ CR, n
|
|
1
|
17
|
15
|
33
| |
Basierend auf der behandelten Population, %
|
─
|
25,0
|
24,3
|
27,8
|
25,8
| |
KI 95 %a
|
|
0,6; 80,6
|
14,8; 36,0
|
16,5: 41,6
|
18,5; 34,3
| |
Basierend auf Studienteilnehmenden mit ≥ CR, %
|
|
100
|
85,0
|
71,4
|
78,6
| |
KI 95 %a
|
|
2,5; 100,0
|
62,1; 96,8
|
47,8; 88,7
|
63,2; 89,7
| |
Zeit bis zum Ansprechenc, n
|
94
|
2
|
48
|
44
|
94
| |
Median (Monate)
|
1
|
1
|
1
|
1
|
1
| |
Min, Max
|
0,5; 8,8
|
1,0; 1,0
|
0,5; 8,8
|
0,9; 2,0
|
0,5; 8,8
| |
Dauer des Ansprechensc (PR oder besser), n
|
94
|
2
|
48
|
44
|
94
| |
Mediand (Monate)
|
10,6
|
13,0
|
8,5
|
11,3
|
10,6
| |
KI 95 %a
|
8,0; 11,4
|
2,8; 23,3
|
5,4; 10,9
|
10,3; NE
|
8,0; 11,4
| |
Dauer des Ansprechens (CR oder besser), n
|
42
|
1
|
20
|
21
|
42
| |
Mediand (Monate)
|
23,3
|
23,3
|
16,2
|
NE
|
23,3
| |
KI 95 %a
|
11,4; 23,3
|
NE; NE
|
8,0; NE
|
11,4; NE
|
11,4; 23,3
| |
Gesamtüberlebene (OS), Monate, n
|
140
|
4
|
70
|
54
|
128
| |
Median (Monate)
|
21,4
|
18,2
|
NE
|
NE
|
NE
| |
KI 95 %a
|
19,3; NE
|
9,4; NE
|
18,0; NE
|
NE; NE
|
18,9; NE
| |
Ereignisfreie 6-Monats-Rate, %
|
87,4
|
100
|
89,6
|
86,9
|
88,8
| |
Ereignisfreie 12-Monats-Rate, %
|
75,8
|
75,0
|
78,5
|
77,3
|
77,9
|
CAR = chimärer Antigenrezeptor; KI = Konfidenzintervall; CR = complete response (vollständiges Ansprechen); Max = Maximum; Min = Minimum; MRD = Minimal Residual Disease (minimale Resterkrankung); NE = not estimable (nicht abschätzbar); PR = partial response (partielles Ansprechen); sCR = stringent complete response (stringentes vollständiges Ansprechen); VGPR = very good partial response (sehr gutes partielles Ansprechen).
a Für das Total («behandelte Population» und «aufgenommene Population»): Forest-KI; für individuelle Zieldosisstufen: Exaktes KI nach Clopper-Pearson.
b Basierend auf einem Schwellenwert von 10-5 unter Verwendung eines Next-Generation-Sequenzierungsassays.
c Ansprechen ist definiert als das Erreichen von sCR, CR, VGPR oder PR gemäss IMWG-Kriterien.
d Der Median basiert auf der Kaplan-Meier-Schätzung.
e Das OS war definiert als Zeit vom Datum der Leukapherese (aufgenommene Population) oder der Abecma-Infusion (behandelte Population) bis zum Tod aufgrund jeglicher Ursache.
Hinweis: Die Zieldosis beträgt 450 x 106 CAR-positive T-Zellen in einem Bereich von 150 bis 540 × 106 CAR-positiven T-Zellen. Die 150 × 106 CAR-positive T-Zellen-Dosis ist nicht Teil des zugelassenen Dosisbereichs.
Gesundheitsbezogene Lebensqualität (health-related quality of life, HRQoL)
Die HRQoL wurde anhand des C30-Fragebogens zur Lebensqualität (EORTC-QLQ-C30) und des Moduls zu multiplem Myelom (EORTC-QLQ-MY20) der European Organisation for Research and Treatment of Cancer (EORTC) beurteilt, und zwar mit primärem Fokus auf Ermüdung, Schmerzen, körperlicher Funktionsfähigkeit, kognitive Funktionsfähigkeit, allgemeine Gesundheit/Lebensqualität, Nebenwirkungen und Krankheitssymptome auf Subskalen. Gemäss den Ergebnissen aus Daten, die 10 Monate nach der Abecma-Infusion gewonnen wurden, kam es bei den mit Abecma behandelten Patienten kurz nach der Infusion zu klinisch bedeutsamen Verbesserungen in Bezug auf Ermüdung, Schmerzen, körperliche Funktionsfähigkeit und allgemeine Gesundheits-Scores, die zu mehreren Zeitpunkten von Monat 3 bis Monat 9 nach der Behandlung statistisch signifikant (p < 0,05) wurden und zwar ohne Verschlechterung der kognitiven Funktionsfähigkeit, Krankheitssymptome oder Nebenwirkungen. Bei den meisten Endpunkten und Beobachtungspunkten berichtete ein grösserer Prozentsatz der Patienten über eine klinisch bedeutsame Verbesserung und nicht über eine Verschlechterung.
Real-World (RW)-Evidenzstudie
Die RW-Evidenzstudie (Studie NDS-MM-003) war eine retrospektive Beobachtungsstudie, in der Daten über Patienten im Real-World Setting mit rezidiviertem und refraktärem multiplem Myelom (RRMM) gesammelt wurden, die mindestens drei vorgängige Therapien erhalten hatten, darunter einen immunmodulatorischen Wirkstoff, einen PI und einen Anti-CD38-Antikörper. Aus dieser Gruppe wurden Patienten ausgewählt, welche die Auswahlkriterien so nah wie möglich an der KarMMa-Studie erfüllten (d.h. keine Komorbiditäten mit Beginn einer neuen Therapie, nachdem sie gegenüber der letzten Anti-Myelom-Therapie refraktär geworden waren). Die ORR und das Gesamtüberleben (OS) wurden für die beiden Gruppen unter Verwendung der Propensity-Score-Methode bewertet, um die vergleichende Wirksamkeit der mit den verfügbaren Therapien behandelten Patienten im Vergleich zu Abecma in der KarMMa-Studie zu beurteilen. Das relative ORR-Risiko betrug 2,4 (95 % CI: 1,7; 3,3) p < 0,0001. Die OS-Hazard-Ratio betrug 0,41 (95 % CI 0,26, 0,65), was die mit Abecma behandelte Kohorte im Vergleich zu der entsprechenden RRMM-Kohorte, die mit den verfügbaren Therapien behandelt wurde, signifikant begünstigte (p = 0,0002).
Sicherheit und Wirksamkeit bei älteren Patienten
In klinischen Studien zu Abecma waren 163 Patienten (39,9 %) mindestens 65 Jahre alt und 17 (4,2 %) mindestens 75 Jahre alt. Es wurden keine klinisch bedeutsamen Unterschiede bei der Sicherheit oder Wirksamkeit von Abecma zwischen diesen Patienten und Patienten, die jünger als 65 Jahre alt waren, beobachtet.
|


