Eigenschaften/WirkungenATC-Code
A16AX16
Wirkungsmechanismus
Givosiran ist eine doppelsträngige, kleine interferierende Ribonukleinsäure (small interfering Ribonucleic Acid; siRNA), die den Abbau von Aminolävulinsäure-Synthase-1(ALAS1)-Boten-Ribonukleinsäure (mRNA) in den Leberzellen durch RNA-Interferenz bewirkt, wodurch es zu einer Verringerung von induzierter ALAS1-mRNA in der Leber in Richtung Normwert kommt. Dies führt zu geringeren Blutspiegeln der neurotoxischen Zwischenprodukte Aminolävulinsäure (ALA) und Porphobilinogen (PBG), den wichtigsten kausalen Faktoren für Attacken und andere Erkrankungsmanifestationen der AHP.
Pharmakodynamik
In der placebokontrollierten Studie an Patienten mit AHP, die einmal monatlich 2,5 mg/kg Givosiran erhielten (ENVISION), wurde 14 Tage nach der ersten Dosis eine mediane Reduktion von 83,7 % ALA bzw. 75,1 % PBG im Urin im Vergleich zur Baseline beobachtet. Die maximale Reduktion der ALA- und PBG-Werte wurde etwa in Monat 3 mit einer medianen Reduktion von 93,8 % bei ALA und von 94,5 % bei PBG im Vergleich zur Baseline erreicht. Bei der weiteren Verabreichung einmal pro Monat blieben die Werte konstant.
Die beobachteten Daten und Modellierungen zeigten, dass die Gabe von 2,5 mg/kg Givosiran einmal monatlich zu einer stärkeren Reduktion und geringeren Schwankungen der ALA-Werte führten als Dosierungen von weniger als 2,5 mg/kg oder Verabreichungen alle 3 Monate.
Klinische Wirksamkeit
Die Wirksamkeit von Givosiran wurde in einer randomisierten, doppelblinden, placebokontrollierten, multinationalen Studie (ENVISION) untersucht.
ENVISION
Insgesamt 94 Patienten mit AHP (89 Patienten mit akuter intermittierender Porphyrie (AIP), 2 Patienten mit Porphyria variegata (PV), 1 Patient mit hereditärer Koproporphyrie (HCP) und 2 Patienten ohne identifizierte Mutation in einem Porphyrie-Gen) wurden 1:1 randomisiert und erhielten während der 6monatigen Doppelblind-Phase einmal monatlich subkutane Injektionen mit Givosiran 2,5 mg/kg oder Placebo. Unter den für Givosiran randomisierten Patienten befanden sich 46 Patienten mit AIP, 1 Patient mit PV und 1 Patient mit HCP. Als Einschlusskriterium für diese Studie galt das Auftreten von mindestens 2 Porphyrie-Attacken in den 6 Monaten vor Studienteilnahme, die einen Krankenhausaufenthalt, einen dringenden Arztbesuch oder die intravenöse (i.v.) Gabe von Hämin zu Hause notwendig machten. Während der Studie war die Anwendung von Hämin zur Behandlung akuter Porphyrie-Attacken erlaubt. Das mediane Alter der Patienten in der ENVISION-Studie betrug 37,5 Jahre (Bereich von 19 bis 65 Jahren); 89,4 % der Patienten waren weiblich und 77,7 % waren weiss. Die Behandlungsarme waren im Hinblick auf die annualisierte Porphyrie-Attackenrate bezüglich der Anamnese (mediane Gesamt-Baseline-Rate: 8 pro Jahr), der vorherigen Hämin-Prophylaxe, der Anwendung von Opioid-Arzneimitteln und der Patienteneinschätzung der chronischen Symptome zwischen den Attacken ausgeglichen.
Das wichtigste Mass für die Wirksamkeit war die annualisierte Attackenrate (AAR; annualised attack rate) der kombinierten Porphyrie-Attacken während der 6monatigen Doppelblind-Phase und bestand aus 3 Komponenten: Attacken, die einen Krankenhausaufenthalt, einen dringenden Arztbesuch oder eine intravenöse Hämin-Verabreichung zu Hause erforderten. Dieses kombinierte Wirksamkeitsmass wurde als primärer Endpunkt bei Patienten mit AIP und als sekundärer Endpunkt in der Gesamtpopulation der AHP-Patienten bewertet. Die Behandlung mit diesem Arzneimittel führte bei Patienten mit AIP zu einer signifikanten Verringerung der AAR der kombinierten Porphyrie-Attacken von 74 % im Vergleich zum Placebo (Tabelle 1). Vergleichbare Ergebnisse konnten bei Patienten mit AHP beobachtet werden, bei denen die AAR um 73 % zurückging. Übereinstimmende Ergebnisse wurden für alle drei Einzelkomponenten des kombinierten Endpunkts „kombinierte Porphyrie-Attacken“ beobachtet.
Die über einen Zeitraum von 6 Monaten beobachteten Ergebnisse blieben bis einschliesslich Monat 12 bestehen, mit einer medianen AAR (Q1, Q3) von 0,0 (0,0; 3,5) bei Patienten, mit fortgesetzter Gabe des Arzneimittels während der offenen Verlängerungsphase.
Givosiran verringerte bei Patienten mit AHP im Vergleich zum Placebo die Porphyrie-Attacken in allen vordefinierten Untergruppen, einschliesslich Alter, Geschlecht, ethnischer Herkunft, Region, Baseline-Body-Mass-Index (BMI), vorheriger Anwendung der Hämin-Prophylaxe, Attackenrate in der Anamnese, früherer chronischer Opioid-Anwendung in der attackenfreien Phase und dem Auftreten früherer chronischer Symptome ausserhalb Attacken.
Weitere Endpunkte der klinischen Wirksamkeit wurden bei AIP-Patienten untersucht und in Tabelle 1 zusammengefasst.
Tabelle 1: Ergebnisse für die klinische Wirksamkeit bei Patienten mit AIP während der 6monatigen Doppelblind-Phase der ENVISION-Studie
|
Endpunkt
|
Placebo
|
Givosiran
| |
(N = 43)
|
(N = 46)
| |
Annualisierte Attackenrate der kombinierten Porphyrie-Attackena
| |
Mittlere AAR (95 % KI)b
|
12,5 (9,4; 16,8)
|
3,2 (2,3; 4,6)
| |
Verhältnis der Raten (95 % KI)b (Givosiran/Placebo)
|
0,26 (0,16; 0,41)
| |
P-Wertb
|
<0,001
| |
Mediane AAR, (Q1, Q3)
|
10,7 (2,2; 26,1)
|
1,0 (0,0; 6,2)
| |
Anzahl der Patienten mit 0 Attacken (%)
|
7 (16,3)
|
23 (50,0)
| |
Annualisierte Tage der Hämin-Anwendung
| |
Mittelwert (95 % KI)b
|
29,7 (18,4; 47,9)
|
6,8 (4,2; 10,9)
| |
Verhältnis (95 % KI)b (Givosiran/Placebo)
|
0,23 (0,11; 0,45)
| |
P-Wertb
|
<0,001
| |
Täglicher Worst-Pain-Scorec
| |
Baseline, median (Q1, Q3)
|
3,3 (1,9; 5,6)
|
2,2 (1,2; 4,5)
| |
Median der Behandlungsdifferenz (95 %) (Givosiran-Placebo)
|
−10,1 (−22,8; 0,9)
| |
P-Wert
|
<0,05
| |
PCS des SF-12d
| |
Baseline, Mittelwert (SA)
|
38,4 (9,4)
|
39,4 (9,6)
| |
Änderung von der Baseline in Monat 6, LS-Mittelwert (95 % KI)
|
1,4 (−1,0; 3,9)
|
5,4 (3,0; 7,7)
| |
Differenz der LS-Mittelwerte (95 % KI) (Givosiran-Placebo)
|
3,9 (0,6; 7,3)
| |
Nominaler P-Wert
|
<0,05
|
AAR, Annualised Attack Rate (annualisierte Attackenrate); AIP, Acute Intermittent Porphyria (akute intermittierende Porphyrie); KI, Konfidenzintervall; Q1, Quartil 1; Q3, Quartil 3; LS, Least Square (Kleinste-Quadrate-Mittelwert); PCS, Physical Component Summary (Zusammenfassung der physischen Komponenten); SF-12, aus 12 Fragen bestehende Kurzform des Gesundheitsfragebogens
a Die kombinierten Porphyrie-Attacken umfassen drei Komponenten: Attacken, die einen Krankenhausaufenthalt, einen dringenden Arztbesuch oder eine intravenöse Hämin-Gabe zu Hause erfordern.
b Basierend auf einem negativen binomialen Regressionsmodell. Ein Ratenverhältnis <1 stellt ein positives Ergebnis für Givosiran dar.
c Die Patienten nahmen auf einer numerischen Bewertungsskala von 0 bis 10 eine tägliche Selbsteinschätzung ihrer schlimmsten Schmerzen vor. Eine niedrige Bewertung bedeutet weniger Symptome. Der Median der Behandlungsdifferenz und das KI wurden anhand der Hodges-Lehmann-Methode berechnet; der p-Wert basiert auf dem Wilcoxon-Rangsummentest, der nachträglich durchgeführt wurde, nachdem die Daten eine signifikante Abweichung von der Normalverteilung aufwiesen.
d Ein höherer Wert bedeutet eine höhere gesundheitsbezogene Lebensqualität; analysiert mit der MMRM-Methode (mixed-effect model repeated measures method). Der Endpunkt wurde nicht formell auf statistische Signifikanz getestet; ein nominaler P-Wert wurde berichtet.
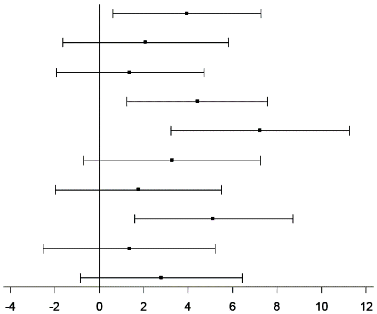
Neben der deutlicheren Verbesserung des SF-12 PCS Scores gegenüber der Baseline im Vergleich zu mit Placebo behandelten Patienten in Monat 6 gab es konsistente Wirksamkeitsbelege für dieses Arzneimittel, in den Bereichen körperliche Schmerzen, körperliche Rollenfunktion und soziale Funktionsfähigkeit. Dies galt jedoch nicht für die Bereiche allgemeine Gesundheitswahrnehmung, körperliche Funktionsfähigkeit, emotionale Rollenfunktion, Vitalität und psychisches Wohlbefinden (Abbildung 1).
Abbildung 1: Veränderung der Bewertungen der SF-12-Bereiche von der Baseline bis Monat 6 bei Patienten mit AIP
|
SF-12-Bereich
|
Givosiran – Placebo
|
|
Pbo (n)
|
Givo (n)
|
Differenz der LS-Mittelwerte
|
95% Kl
| |
Zusammenfassung der physischen Komponenten (PCS)
|
|
|
42
|
45
|
3,9
|
(0,6; 7,3)
| |
Zusammenfassung der psychischen Komponenten (MCS)
|
42
|
45
|
2,1
|
(−1,7; 5,8)
| |
Körperliche Funktionsfähigkeit
|
43
|
46
|
1,4
|
(−2,0; 4,7)
| |
Körperliche Rollenfunktion
|
43
|
46
|
4,4
|
(1,3; 7,5)
| |
Körperliche Schmerzen
|
43
|
46
|
7,2
|
(3,2; 11,2)
| |
Allgemeine Gesundheitswahrnehmung
|
42
|
46
|
3,3
|
(−0,7; 7,2)
| |
Vitalität
|
42
|
45
|
1,7
|
(−2,0; 5,5)
| |
Soziale Funktionsfähigkeit
|
42
|
45
|
5,1
|
(1,6; 8,7)
| |
Emotionale Rollenfunktion
|
43
|
46
|
1,4
|
(−2,5; 5,2)
| |
Psychisches Wohlbefinden
|
42
|
45
|
2,8
|
(−0,9; 6,4)
| |
|
|
|
|
| |
|
Spricht für Placebo
|
Spricht für Givosiran
|
|
|
|
|
|
AIP, Acute Intermittent Porphyria (akute intermittierende Porphyrie); KI, Konfidenzintervall; Givo, Givosiran; Pbo, Placebo; LS, Least Square (kleinste Quadrate); MCS, Mental Component Summary (Zusammenfassung der psychischen Komponenten); PCS, Physical Component Summary (Zusammenfassung der körperlichen Komponenten); SF-12, Version 2 der aus 12 Fragen bestehenden Kurzform des Gesundheitsfragebogens.
In einer Gesamteinschätzung durch die Patienten (Patient Global Impression of Change – PGIC) bewertete ein grösserer Anteil der Patienten mit AIP, die mit Givosiran (61,1 %) behandelt wurden ihren Gesamtstatus seit Studienbeginn als „sehr viel besser“ oder „viel besser“ als die mit Placebo behandelten Patienten (20 %).
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Swissmedic hat für dieses Arzneimittel eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei der Behandlung von AHP anerkannt (siehe «Dosierung/Anwendung» und «Pharmakokinetik» bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
|

