ZusammensetzungWirkstoff(e)
Ciltacabtagen-Autoleucel ist eine Immuntherapie mit gentechnisch veränderten autologen T-Zellen, die mit einem lentiviralen Vektor (LVV) transduziert wurden, der einen chimären Antigenrezeptor (CAR) kodiert und gegen das B-Zell-Reifungsantigen (BCMA) gerichtet ist.
Hilfsstoffe
Cryostor CS5 mit Dimethylsulfoxid.
Indikationen/AnwendungsmöglichkeitenCARVYKTI ist für die Behandlung erwachsener Patienten mit rezidiviertem und refraktärem Multiplem Myelom indiziert:
·die zuvor mindestens zwei Therapielinien erhalten haben, inklusive einem immunmodulatorischen Wirkstoff, einem Proteasom-Inhibitor und einem Anti-CD38-Antikörper, und welche refraktär zu Lenalidomid sind.
·die zuvor mindestens drei Therapien mit mindestens einem Proteasom-Inhibitor, einem immunmodulatorischen Wirkstoff und einem Anti-CD38-Antikörper erhalten haben, und welche eine Progredienz zur letzten Therapie gezeigt haben.
Dosierung/AnwendungNur für die autologe Anwendung. Nur für die intravenöse Anwendung.
CARVYKTI muss in einem qualifizierten Behandlungszentrum mit unmittelbarem Zugang zu geeigneten intensiv-medizinischen Überwachungsmöglichkeiten verabreicht werden. Die CARVYKTI-Therapie muss unter Leitung und Aufsicht eines Arztes bzw. einer Ärztin eingeleitet werden, der bzw. die Erfahrung in der Behandlung von hämatologischen Malignomen hat und für die Verabreichung und das Management von Patienten, die mit CARVYKTI behandelt werden, einschliesslich der Behandlung des Zytokinfreisetzungssyndroms (CRS) und von Neurotoxizität, geschult ist.
Eine Einzeldosis von CARVYKTI besteht aus 0,5–1,0☓106 CAR-positiven lebensfähigen T-Zellen pro kg Körpergewicht mit maximal 1☓108 CAR-positiven lebensfähigen T-Zellen als Suspension in einem patientenspezifischen Infusionsbeutel.
Neben T-Zellen kann CARVYKTI natürliche Killerzellen enthalten.
Übliche Dosierung
Erwachsene (≥18 Jahre)
Die Angaben zur Vorbehandlung und Prämedikation sollen beachtet werden (siehe «VERABREICHUNGSSCHEMA»).
CARVYKTI wird als Einzeldosis einer Suspension aus CAR-positiven lebensfähigen T-Zellen mit dem chimären Antigenrezeptor infundiert.
Die Dosis besteht aus 0,5–1,0 × 106 CAR-positiven lebensfähigen T-Zellen pro kg Körpergewicht. Die maximale Dosis pro Infusion beträgt 1 × 108 CAR-positive lebensfähige T-Zellen.
Patienten mit Leberfunktionsstörungen
Es wurden keine Studien zu Leberfunktionsstörungen mit CARVYKTI durchgeführt.
Patienten mit Nierenfunktionsstörungen
Es wurden keine Studien zu Nierenfunktionsstörungen mit CARVYKTI durchgeführt.
Ältere Patienten
Bei Patienten ≥65 Jahren ist keine Dosisanpassung erforderlich.
Kinder und Jugendliche (17 Jahre und jünger)
Die Sicherheit und Wirksamkeit von CARVYKTI bei Kindern und Jugendlichen unter 18 Jahren wurden nicht untersucht.
Es liegen keine Daten vor.
VERABREICHUNGSSCHEMA
Vorbereitung des Patienten auf die Infusion mit CARVYKTI
Vor Beginn der lymphodepletierenden Chemotherapie muss die Verfügbarkeit von CARVYKTI bestätigt sein.
Lymphodepletierende Chemotherapie
Eine lymphodepletierende Chemotherapie, bestehend aus täglich 300 mg/m2 Cyclophosphamid intravenös und täglich 30 mg/m2 Fludarabin intravenös, sollte für 3 Tage verabreicht werden. Die Infusion von CARVYKTI sollte 5 bis 7 Tage nach Beginn der lymphodepletierenden Chemotherapie durchgeführt werden. Die lymphodepletierende Chemotherapie sollte wiederholt werden, wenn sich Toxizitäten aufgrund der Lymphozytendepletion nach 14 Tagen oder mehr nicht bis auf Grad 1 oder weniger verbessert haben, und sich dadurch die Gabe von CARVYKTI verzögert. Die Wiederholung sollte frühestens 21 Tage nach der ersten Dosis der initialen lymphodepletierenden Chemotherapie in Betracht gezogen werden. Hinsichtlich Dosisanpassungen ist die Fachinformation des jeweiligen Herstellers von Fludarabin bzw. Cyclophoyphamid zu beachten.
Die lymphodepletierende Chemotherapie ist auf einen späteren Zeitpunkt zu verschieben, wenn ein Patient auf eine vorgängige Überbrückungstherapie mit schwerwiegenden Nebenwirkungen reagiert (einschliesslich einer signifikanten aktiven Infektion, kardialer Toxizität und pulmonaler Toxizität).
Klinische Beurteilung vor der Infusion von CARVYKTI
Die Infusion von CARVYKTI sollte in folgenden Fällen auf einen späteren Zeitpunkt verschoben werden:
·Bei Vorliegen einer klinisch signifikanten aktiven Infektion oder entzündlicher Erkrankungen.
·Andauernde schwerwiegende Nebenwirkungen (insbesondere pulmonale oder kardiale Nebenwirkungen oder Hypotonie), einschliesslich solcher nach vorherigen Chemotherapien.
·Bei Vorliegen nicht-hämatologischer Toxizitäten der Konditionierung mit Cyclophosphamid und Fludarabin vom Grad 3 und höher, ausgenommen Grad 3 Übelkeit, Erbrechen, Diarrhoe oder Obstipation. Die Infusion von CARVYKTI sollte verschoben werden, bis diese Nebenwirkungen auf Grad ≤1 abgeklungen sind.
·Entwicklung einer klinisch signifikanten Verschlechterung des Multiplen Myeloms, welche zu einer medizinisch signifikanten Organfunktionsstörung führt oder eine klinische Verschlechterung nach einer lymphodepletierenden Chemotherapie.
·Bei Vorliegen einer aktiven Graft-versus-Host-Erkrankung.
Prämedikation
Alle Patienten sollten (30 bis 60 Minuten) vor der Infusion von CARVYKTI die folgende Prämedikation erhalten:
·Antipyretika (650 bis 1'000 mg Paracetamol oral oder intravenös).
·Antihistaminikum (25 bis 50 mg Diphenhydramin oder ein äquivalenter Wirkstoff oral oder intravenös).
Eine Prophylaxe mit systemischen Kortikosteroiden sollte vermieden werden, da diese die Aktivität von CARVYKTI beeinflussen können.
Vorbereitung von CARVYKTI zur Infusion
Dieses Arzneimittel enthält genetisch veränderte menschliche Blutzellen. Das medizinische Fachpersonal, das mit CARVYKTI arbeitet, muss geeignete Vorsichtsmassnahmen treffen (Tragen von Handschuhen und Schutzbrille), um eine potenzielle Übertragung von Infektionskrankheiten zu vermeiden.
Vorbereitung von CARVYKTI zur Infusion
Das Produkt darf erst unmittelbar vor der Anwendung aufgetaut werden. Das Auftauen von CARVYKTI und die Infusion müssen zeitlich aufeinander abgestimmt werden. Die Startzeit der Infusion muss im Voraus festgelegt werden, damit mit dem Auftauen so begonnen werden kann, dass CARVYKTI zur Verfügung steht, wenn der Patient für die Infusion bereit ist.
·Bestätigung der Identität des Patienten: Vor der Vorbereitung von CARVYKTI muss bestätigt werden, dass die Identität des Patienten mit den patientenspezifischen Angaben auf der CARVYKTI-Kassette übereinstimmt. Den Beutel mit CARVYKTI nicht aus der Kassette nehmen, wenn die patientenspezifischen Angaben auf dem Etikett nicht mit dem zu behandelnden Patienten übereinstimmen.
·Nach Bestätigung der Identität des Patienten, den Beutel mit CARVYKTI aus der Kassette nehmen.
·Der Infusionsbeutel muss vor und nach dem Auftauen auf Beschädigungen oder Risse untersucht werden. Wenn der Infusionsbeutel beschädigt ist, darf der Inhalt nicht infundiert werden und die lokalen Vorschriften sind zu befolgen (gegebenenfalls ist die Zulassungsinhaberin zu kontaktieren).
·Der Infusionsbeutel sollte vor dem Auftauen in einen zweiten verschliessbaren (vorzugsweise sterilen) Kunststoffbeutel gegeben werden.
·CARVYKTI sollte unter Verwendung eines Wasserbads oder einer trockenen Auftaumethode bei 37°C ± 2°C aufgetaut werden, bis im Infusionsbeutel kein Eis mehr zu sehen ist. Insgesamt sollte der Auftauvorgang nicht länger als 15 Minuten dauern.
·Den Infusionsbeutel aus dem verschliessbaren Kunststoffbeutel nehmen und abtrocknen. Den Inhalt des Beutels vorsichtig mischen, um verklumptes Zellmaterial zu dispergieren. Sind weiterhin sichtbare Zellklumpen vorhanden, den Inhalt des Beutels weiter vorsichtig mischen. Kleinere Klümpchen Zellmaterial sollten durch vorsichtiges Hin- und Herbewegen des Beutels dispergiert werden. CARVYKTI darf vor der Infusion nicht in ein anderes Behältnis vorfiltriert, gewaschen, zentrifugiert und/oder in einem neuen Medium resuspendiert werden.
·Nach dem Auftauen muss die Infusion von CARVYKTI innerhalb von 2,5 Stunden bei Raum-/Umgebungstemperatur (20°C bis 25°C) durchgeführt und abgeschlossen werden.
·Das Produkt nach dem Auftauen nicht wieder einfrieren und nicht im Kühlschrank lagern.
Anwendung
·CARVYKTI muss in einem qualifizierten Behandlungszentrum angewendet werden.
·Es ist darauf zu achten, dass vor Infusionsbeginn und während der Erholungsphase zwei Dosen Tocilizumab zur Anwendung im Falle eines Zytokinfreisetzungssyndroms und eine Notfallausrüstung zur Verfügung stehen. Das Behandlungszentrum muss innerhalb von 8 Stunden nach Verabreichung der letzten Tocilizumab Dosis Zugang zu einer zusätzlichen Dosis haben.
·Die Identität des Patienten muss mit den Patientenangaben auf dem Infusionsbeutel übereinstimmen. CARVYKTI darf nicht infundiert werden, wenn die patientenspezifischen Angaben auf dem Etikett nicht mit dem zu behandelnden Patienten übereinstimmen.
·CARVYKTI wird nach dem Auftauen durch intravenöse Infusion innerhalb von 2,5 Stunden unter Verwendung von Infusionssets mit einem Inline-Filter verabreicht. Dabei soll der gesamte Inhalt des Infusionsbeutels infundiert werden.
·KEINEN Leukodepletionsfilter verwenden.
·Der Inhalt des Beutels sollte während der Infusion von CARVYKTI vorsichtig bewegt werden, um Zellklumpen zu dispergieren.
·Nachdem der gesamte Inhalt des Infusionsbeutels infundiert worden ist, sollte der Infusionsschlauch einschliesslich des Inline-Filters mit Natriumchlorid 9 mg/ml (0,9%) Lösung (physiologische Kochsalzlösung) nachgespült werden, um sicherzustellen, dass das Arzneimittel vollständig verabreicht wurde.
Bezüglich spezieller Vorsichtsmassnahmen für die Entsorgung siehe «Hinweise für die Handhabung».
Überwachung des Patienten nach der Infusion
Die Patienten sollten die ersten 14 Tage nach der Infusion von CARVYKTI täglich und danach regelmässig, im Ermessen des Arztes bzw. der Ärztin, über weitere zwei Wochen in einem qualifizierten Behandlungszentrum auf Anzeichen und Symptome eines Zytokinfreisetzungssyndroms (CRS), neurologischer Ereignisse und anderer Toxizitäten überwacht werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Patienten sind anzuweisen, sich nach der Infusion mindestens 4 Wochen lang in der Nähe (maximal 2 Stunden entfernt) eines qualifizierten Behandlungszentrums aufzuhalten.
Massnahmen bei schweren unerwünschten Wirkungen
Zytokinfreisetzungssyndrom
Das Zytokinfreisetzungssyndrom (CRS) soll basierend auf dem klinischen Erscheinungsbild identifiziert werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei Verdacht auf CRS sollen die in Tabelle 1 empfohlenen Massnahmen ergriffen werden. Gegebenenfalls ist eine unterstützende Behandlung (beispielsweise mit Antipyretika, IV-Infusionslösung Vasopressoren, Sauerstofftherapie usw.) zu verabreichen. Zur Überwachung auf disseminierte intravasale Koagulopathie, der hämatologischen Parameter sowie der Lungen-, Herz-, Nieren- und Leberfunktion sind Laboruntersuchungen zu erwägen. Bei Patienten mit hochgradigem CRS und hämophagozytischer Lymphohistiozytose (HLH) mit anhaltend hohem oder lebensbedrohlichem Schweregrad nach vorgängiger Gabe von Tocilizumab und Kortikosteroiden kann die Gabe anderer monoklonaler Antikörper gegen Zytokine (z.B. Anti-IL1 und/oder Anti-TNFα) oder eine Therapie zur Verringerung und Eliminierung der CAR-T-Zellen in Betracht gezogen werden.
Bei Verdacht auf gleichzeitige Neurotoxizität während des CRS ist Folgendes zu verabreichen:
·Kortikosteroide entsprechend der aggressiveren Intervention basierend auf dem Grad des CRS und der Neurotoxizität gemäss Tabelle 1 und 2
·Tocilizumab entsprechend dem Grad des CRS gemäss Tabelle 1
·Antikonvulsiva entsprechend dem Grad der Neurotoxizität gemäss Tabelle 2.
Tabelle 1: CRS-Einstufung und Behandlungsempfehlungen
|
CRS-Grada
|
Tocilizumabb
|
Kortikosteroidef
| |
Grad 1
Temperatur ≥38 °Cc
|
8 mg/kg Tocilizumab intravenös (i.v.) über 1 Stunde (höchstens 800 mg) kann in Betracht gezogen werden
|
Nicht zutreffend
| |
Grad 2
Symptome erfordern eine moderate Intervention und sprechen auf diese an.
Temperatur ≥38 °Cc mit:
Hypotonie, die keine Vasopressoren erfordert
und/oder
Hypoxie, Sauerstoffbedarf über Kanülee oder blow-by
oder
Organtoxizität Grad 2
|
Tocilizumab 8 mg/kg über 1 Stunde i.v. verabreichen (höchstens 800 mg).
Bei Bedarf Tocilizumab alle 8 Stunden erneut verabreichen, wenn der Patient nicht auf intravenöse Flüssigkeitsgabe von bis zu 1 Liter oder eine Erhöhung der Sauerstoffzufuhr anspricht.
|
1 mg/kg Methylprednisolon zweimal täglich i.v. oder Dexamethason (z.B. 10 mg alle 6 Stunden i.v.) in Betracht ziehen.
| |
Wenn innerhalb von 24 Stunden keine Besserung eintritt oder sich der Zustand rasch verschlechtert, erneut Tocilizumab verabreichen und die Dexamethason-Dosis erhöhen (20 mg alle 6-12 Stunden i.v.).
Nach 2 DosenTocilizumab alternative Anti-Zytokin-Therapeutika in Betracht ziehen.d
Auf maximal 3 Dosen Tocilizumab innerhalb von 24 Stunden beschränken, insgesamt maximal 4 Dosen verabreichen.
| |
Grad 3
Symptome erfordern eine aggressive Intervention und sprechen auf diese an.
Temperatur ≥38 °Cc mit:
Hypotonie, die einen Vasopressor mit oder ohne Vasopressin erfordert,
und/oder
Hypoxie, Sauerstoffbedarf über High Flow-Nasenkanülee, Sauerstoffmaske, Maske ohne Rückatmung oder Venturi-Maske
oder
Organtoxizität Grad 3 oder Transaminitis Grad 4.
|
Gemäss Grad 2
|
1 mg/kg Methylprednisolon zweimal täglich i.v. oder Dexamethason (z.B. 10 mg alle 6 Stunden i.v.) verabreichen.
| |
Wenn innerhalb von 24 Stunden keine Besserung eintritt oder sich der Zustand rasch verschlechtert, erneut Tocilizumab verabreichen und die Dexamethason-Dosis erhöhen (20 mg alle 6-12 Stunden i.v.).
Wenn innerhalb von 24 Stunden keine Besserung eintritt oder sich der Zustand rasch verschlechtert, auf 2 mg/kg Methylprednisolon alle 12 Stunden i.v. umstellen
Nach 2 Dosen Tocilizumab sind alternative Anti-Zytokin-Therapeutika in Betracht zu ziehen.d
Auf maximal 3 Dosen Tocilizumab innerhalb von 24 Stunden beschränken, insgesamt maximal 4 Dosen verabreichen
| |
Grad 4
Lebensbedrohliche Symptome.
Bedarf für Ventilation, kontinuierliche venovenöse Hämodialyse (CVVHD).
Temperatur ≥38 °Cc mit:
Hypotonie, die mehrere Vasopressoren (ausgenommen Vasopressin) erfordert
und/oder
Hypoxie, Sauerstoffbedarf mit positivem Druck (z.B. CPAP, BiPAP, Intubation und mechanische Ventilation)
oder
Organtoxizität Grad 4 (ausgenommen Transaminitis).
|
Gemäss Grad 2
|
20 mg Dexamethason alle 6 Stunden i.v. verabreichen.
| |
Nach 2 Dosen Tocilizumab alternative Anti-Zytokin-Therapeutika in Betracht ziehend. Auf maximal 3 Dosen Tocilizumab innerhalb von 24 Stunden beschränken, insgesamt maximal 4 Dosen verabreichen.
Bei ausbleibender Besserung innerhalb von 24 Stunden Methylprednisolon (1-2 g i.v. verabreichen, bei Bedarf Wiederholung alle 24 Stunden, gemäss klinischer Indikation ausschleichen) oder andere Immunsuppressiva (z.B. andere Anti-T-Zell-Therapeutika) in Betracht ziehen.
|
a Basierend auf den ASTCT 2019-Kriterien zur Einstufung (Lee et.al, 2019), modifiziert zur Aufnahme von Organtoxizität.
b Details siehe Fachinformation vonTocilizumab.
c Auf das CRS zurückzuführen. Fieber muss nicht immer gleichzeitig mit Hypotonie oder Hypoxie auftreten, da es durch die gegebenen Medikamente wie Antipyretika oder Antizytokine (z.B. Tocilizumab oder Steroide) maskiert werden kann. Die Abwesenheit von Fieber hat keinen Einfluss auf die Entscheidung über die Massnahmen bei CRS. In diesem Fall werden die Massnahmen bei CRS von der Hypotonie/Hypoxie und dem schwereren Symptom, das keiner anderen Ursache zuzuschreiben ist, bestimmt.
d Monoklonale Antikörper, die sich gegen Zytokine richten, können je nach institutioneller Praxis bei nicht ansprechendem CRS in Betracht gezogen werden.
e Eine Low-Flow-Nasenkanüle entspricht ≤6 l/min, eine High-Flow-Nasenkanüle entspricht > 6 l/min.
f Kortikosteroidgabe bis zur Besserung der unerwünschten Wirkung auf Grad 1 oder weniger fortsetzen. Kortikosteroide ausschleichen, wenn die Korikosteroid-Gesamtexposition mehr als 3 Tage beträgt.
Neurologische Toxizitäten
Neurologische Toxizitäten, die schwerwiegend oder lebensbedrohlich sein können, sind nach der Behandlung mit CARVYKTI aufgetreten, auch gleichzeitig mit CRS, nach Abklingen des CRS und ohne CRS (siehe Abschnitt «Unerwünschte Wirkungen - Beschreibung spezifischer unerwünschter Wirkungen - Neurologische Toxizitäten»).
In Tabelle 2 sind allgemeine Massnahmen bei neurologischer Toxizität, z.B. einem Immuneffektorzell-assoziierten Neurotoxizitätssyndrom (ICANS) zusammengefasst.
Beim ersten Anzeichen einer neurologischen Toxizität, ICANS eingeschlossen, sind andere Ursachen für neurologische Symptome auszuschliessen. Die Patienten sollten nach der Infusion mindestens 4 Wochen lang auf Anzeichen oder Symptome neurologischer Toxizitäten überwacht und umgehend behandelt werden. Bei schweren oder lebensbedrohlichen neurologischen Toxizitäten sind eine intensivmedizinische Versorgung und eine unterstützende Behandlung erforderlich (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei Verdacht auf gleichzeitiges CRS während der Neurotoxizität ist Folgendes zu verabreichen:
·Kortikosteroide entsprechend der aggressiveren Intervention basierend auf dem Grad des CRS und der Neurotoxizität gemäss Tabelle 1 und 2,
·Tocilizumab entsprechend dem Grad des CRS gemäss Tabelle 1,
·Antikonvulsiva entsprechend dem Grad der Neurotoxizität gemäss Tabelle 2.
Die Patienten sollten angewiesen werden, umgehend einen Arzt bzw. eine Ärztin aufzusuchen, wenn zu irgendeinem Zeitpunkt Anzeichen oder Symptome einer neurologischen Toxizität auftreten.
Tabelle 2: Empfehlungen zur Behandlung des ICANS
|
Grad des ICANSa
|
Kortikosteroide
| |
Grad 1
ICE-Score 7-9b
oder getrübter Bewusstseinszustand: wacht spontan auf
|
10 mg Dexamethasonc alle 6 bis 12 Stunden i.v. über 2 bis 3 Tage in Betracht ziehen.
Gabe nicht-sedierender Antiepileptika (z.B. Levetiracetam) zur Vorbeugung von Krampfanfällen erwägen
| |
Grad 2
ICE-Score 3-6b
oder getrübter Bewusstseinszustandb: wacht auf Ansprache auf
|
10 mg Dexamethasonc alle 6 Stunden i.v. für 2- 3 Tage oder bei anhaltenden Symptomen länger verabreichen.
Ausschleichen der Kortikosteroide in Betracht ziehen, wenn die Kortikosteroid-Gesamtexposition mehr als 3 Tage beträgt.
Gabe nicht-sedierender Antiepileptika (z.B. Levetiracetam) zur Vorbeugung von Krampfanfällen erwägen
| |
Grad 3
ICE-Score 0-2b
(Wenn ICE-Score = 0, aber Patient ist erweckbar (z.B. wach mit globaler Aphasie) und untersuchungsfähig)
oder getrübter Bewusstseinszustand: erwacht nur bei taktilem Reiz,
oder Krampfanfälle, entweder:
·jeder klinische Krampfanfall, fokal oder generalisiert, der sich rasch zurückbildet, oder
·nicht konvulsive Krampfanfälle im EEG, die bei Intervention abklingen,
oder erhöhter intrakranieller Druck (ICP): fokales/lokales Ödem in der Neurobildgebungd.
|
10 mg-20 mg Dexamethasonc alle 6 Stunden i.v. verabreichen.
Wenn innerhalb von 48 Stunden keine Besserung eintritt oder sich die neurologische Toxizität verschlechtert, die Dexamethasonc-Dosis auf mindestens 20 mg i.v. alle 6 Stunden erhöhen; über 7 Tage ausschleichen,
ODER auf Hochdosis-Methylprednisolon-Therapie eskalieren (1 g/Tag, bei Bedarf alle 24 Stunden wiederholen, Ausschleichen gemäss klinischer Indikation).
Gabe nicht-sedierender Antiepileptika (z.B. Levetiracetam) zur Vorbeugung von Krampfanfällen erwägen
| |
Grad 4
ICE-Score 0b (Patient nicht erweckbar und nicht in der Lage, ICE-Test durchzuführen)
oder getrübter Bewusstseinszustand, entweder:
·der Patient ist nicht erweckbar oder benötigt starke oder sich wiederholende taktile Reize, um zu erwachen, oder
·Stupor oder Koma,
oder Krampfanfälle, entweder:
·lebensbedrohlicher prolongierter Krampfanfall (Dauer > 5 min) oder
·repetitive klinische oder elektrische Anfälle ohne zwischenzeitliche Rückkehr zum Ausgangszustand,
oder motorische Befundee:
·tiefgreifende fokale motorische Schwäche wie Hemiparese oder Paraparese,
oder erhöhter ICP/zerebrales Ödem mit Anzeichen/Symptomen wie:
·diffuses Hirnödem in der Neurobildgebung
·dezerebrale oder dekortikale Körperhaltung oder
·Lähmung des VI. Hirnnervs oder
·Papillenödem oder
·Cushing-Reflex
|
10 mg-20 mg Dexamethasonc alle 6 Stunden i.v. verabreichen.
Wenn innerhalb von 24 Stunden keine Besserung eintritt oder sich die neurologische Toxizität verschlechtert, auf Hochdosis-Methylprednisolon-Therapie eskalieren (1-2 g/Tag, bei Bedarf alle 24 Stunden wiederholen, Ausschleichen gemäss klinischer Indikation).
Gabe nicht-sedierender Antiepileptika (z.B. Levetiracetam) zur Vorbeugung von Krampfanfällen erwägen
Bei Verdacht auf erhöhten ICP/zerebrales Ödem Hyperventilation und hyperosmolare Therapie in Betracht ziehen. Hochdosis-Methylprednisolon verabreichen (1-2 g/Tag, bei Bedarf alle 24 Stunden wiederholen, Ausschleichen gemäss klinischer Indikation) sowie neurologische und/oder neurochirurgische Konsultation in Betracht ziehen
|
Hinweis: Der Grad des ICANS und die Behandlung richten sich nach dem schwersten Ereignis (ICE-Score, Bewusstseinsgrad,
Krampfanfälle, motorische Befunde, erhöhter ICP/zerebrales Ödem), das nicht auf eine andere Ursache zurückzuführen ist.
a ASTCT 2019-Kriterien zur Einstufung neurologischer Toxizität (Lee et.al, 2019),
b Ist der Patient erweckbar und kann eine Beurteilung der Immuneffektorzellen-assoziierten Enzephalopathie (ICE) durchgeführt werden, ist Folgendes zu beurteilen: Orientierung (Orientierung bezüglich Jahr, Monat, Stadt, Krankenhaus = 4 Punkte); Benennen (auf 3 Objekte zeigen/diese benennen, z.B. Uhr, Stift, Knopf = 3 Punkte); Befolgen von Anweisungen (z.B. «Zeigen Sie mir 2 Finger» oder «Schliessen Sie Ihre Augen und strecken Sie die Zunge heraus» = 1 Punkt); Schreibfähigkeit, einen Standardsatz schreiben = 1 Punkt; und Konzentrationsvermögen (von 100 in Zehnerschritten rückwärts zählen = 1 Punkt). Wenn der Patient nicht erweckbar und nicht imstande ist, die ICE-Beurteilung durchzuführen (ICANS Grad 4) = 0 Punkte
c Alle Hinweise zur Verabreichung von Dexamethason beziehen sich auf Dexamethason oder ein gleichwertiges Medikament.
d Intrakranielle Blutung mit oder ohne assoziiertes Ödem gilt nicht als neurotoxisches Merkmal und wird nicht nach der ICANS-Einstufung klassifiziert. Die Einstufung kann nach CTCAE v5.0 vorgenommen werden.
e Die Einstufung von Tremor und Myoklonus im Zusammenhang mit Effektor-Zell-Therapien kann gemäss CTCAE v5.0 vorgenommen werden, hat jedoch keinen Einfluss auf das ICANS-Grading
Art der Anwendung
Nur für die intravenöse Anwendung.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen der im Abschnitt «Zusammensetzung» aufgeführten Hilfsstoffe.
Die Kontraindikationen der lymphodepletierenden Chemotherapie sind zu beachten.
Warnhinweise und VorsichtsmassnahmenAllgemein
Patienten mit aktiver oder anamnestisch erfasster signifikanter Erkrankung des Zentralnervensystems (ZNS) oder unzureichender Nieren-, Leber-, Lungen- oder Herzfunktion sind voraussichtlich anfälliger für die Folgeerscheinungen der nachstehend beschriebenen unerwünschten Wirkungen und erfordern besondere Aufmerksamkeit.
Schnell fortschreitende Erkrankung
Bei Patienten, die für eine Behandlung mit CARVYKTI in Betracht gezogen werden, sollten die behandelnden Ärzte die Auswirkungen einer schnell fortschreitenden Erkrankung auf die Eignung der Patienten eine CAR-T Infusion zu erhalten, beurteilen. Einige Patienten profitieren möglicherweise nicht von der Behandlung mit CARVYKTI, aufgrund eines potenziell erhöhten Risikos für einen frühen Tod, falls die Erkrankung während der Überbrückungstherapie schnell fortschreitet.
Zytokinfreisetzungssyndrom (Cytokine Release Syndrome, CRS)
Nach der Infusion von CARVYKTI kann es zum Auftreten eines CRS kommen, das mit tödlichen oder lebensbedrohlichen Reaktionen einhergehen kann.
In der Studie MMY2001 entwickelten 95% aller Patienten nach der Infusion von CARVYKTI ein CRS, mehrheitlich vom Grad 1 oder Grad 2 (90%) (siehe «Unerwünschte Wirkungen»). Der mediane Zeitraum von der Infusion von CARVYKTI (Tag 1) bis zum Auftreten des CRS betrug 7 Tage (Bereich: 1 bis 12 Tage). Bei ungefähr 90% der Patienten kam es nach Tag 3 nach der Infusion von CARVYKTI zum Auftreten eines CRS.
In fast allen Fällen lag die Dauer des CRS zwischen 1 und 14 Tagen (mediane Dauer 4 Tage), wobei das CRS bei 88% der Patienten ≤7 Tage andauerte.
In der Studie MMY3002 entwickelten 151/196 Patienten (77%) nach der Infusion von CARVYKTI ein CRS, mehrheitlich vom Grad 1 oder Grad 2 (siehe «Unerwünschte Wirkungen»). Der mediane Zeitraum von der Infusion von CARVYKTI (Tag 1) bis zum Auftreten des CRS betrug 8 Tage (Bereich: 1 bis 23 Tage). In allen Fällen lag die Dauer des CRS zwischen 1 und 17 Tagen (mediane Dauer: 3 Tage), wobei das CRS bei 89% der Patienten ≤7 Tage andauerte.
Klinische Anzeichen und Symptome von CRS sind unter anderem Fieber (mit oder ohne Rigor), Schüttelfrost, Hypotonie, Hypoxie und erhöhte Leberenzyme. Zu den Risikofaktoren für ein schweres CRS zählen eine hohe Tumorlast vor der Infusion, eine aktive Infektion und das frühzeitige Auftreten von Fieber oder anhaltendes Fieber nach 24 Stunden symptomatischer Behandlung. Auch können Infektionen gleichzeitig mit einem CRS auftreten und das Risiko eines tödlichen Verlaufs erhöhen. Als potenziell lebensbedrohliche Komplikationen eines CRS können Herzinsuffizienz, neurologische Toxizität und HLH auftreten. Es wurde berichtet, dass CRS mit Befunden von hämophagozytischer Lymphohistiozytose/Makrophagenaktivierungssyndrom (HLH/MAS) assoziiert ist und dass sich die Physiologie der Syndrome überschneiden kann. Bei Patienten, die eine HLH entwickeln, kann sich das Risiko für eine schwere Blutung erhöhen. Die Patienten sollten engmaschig auf Anzeichen oder Symptome dieser Ereignisse, einschliesslich Fieber, überwacht werden und die Behandlung sollte gemäss den institutionellen Standards erfolgen.
Es sollte eine angemessene prophylaktische und therapeutische Behandlung von Infektionen erfolgen, und alle aktiven Infektionen müssen vor der Infusion von CARVYKTI vollständig abgeklungen sein.
Vor der Infusion von CARVYKTI muss sichergestellt sein, dass mindestens zwei Dosen Tocilizumab zur Verfügung stehen. Die Patienten sollten die ersten 14 Tage nach der Infusion von CARVYKTI täglich und danach regelmässig über weitere zwei Wochen in einem qualifizierten Behandlungszentrum auf Anzeichen und Symptome eines CRS überwacht werden.
Die Patienten sind dazu anzuhalten, sich sofort an einen Arzt oder an eine Ärztin zu wenden, falls zu irgendeinem Zeitpunkt Anzeichen oder Symptome eines CRS auftreten. Bei den ersten Anzeichen eines CRS ist der Patient umgehend hinsichtlich einer Spitaleinweisung zu beurteilen, und es sind unterstützende Therapiemassnahmen, d.h. eine Behandlung mit Tocilizumab oder Tocilizumab in Kombination mit Kortikosteroiden gemäss Tabelle 1 einzuleiten (siehe «Dosierung/Anwendung»).
Bei Patienten mit schwerem oder therapierefraktärem CRS ist eine diagnostische Abklärung auf HLH zu erwägen. Bei Patienten mit hoher Tumorlast vor der Infusion, frühzeitigem Auftreten von Fieber oder anhaltendem Fieber nach 24 Stunden sollte die frühzeitige Gabe von Tocilizumab in Betracht gezogen werden. Bei einem CRS sollte die Anwendung von myeloischen Wachstumsfaktoren, insbesondere des Granulozyten-Makrophagen-Kolonie-stimulierenden Faktors (GM-CSF), vermieden werden. Bei Patienten mit hoher Tumorlast sollte in Betracht gezogen werden, die zu Behandlungsbeginn vorhandene Krankheitslast durch eine Überbrückungstherapie vor der Infusion von CARVYKTI zu reduzieren.
Neurologische Toxizitäten
Neurologische Toxizitäten treten nach der Behandlung mit CARVYKTI häufig auf und können tödlich oder lebensbedrohlich sein (siehe «Unerwünschte Wirkungen»). Neurologische Toxizitäten umfassten ICANS, bewegungsbezogene und neurokognitive Toxizität mit Anzeichen und Symptomen von Parkinsonismus, Guillain-Barré Syndrom, peripheren Neuropathien und Hirnnervenlähmungen. Die Patienten sind über die Anzeichen und Symptome dieser neurologischen Toxizitäten sowie über das verzögerte Auftreten einiger dieser Toxizitäten aufzuklären. Die Patienten sind anzuweisen, jederzeit und bei jeglichem Auftreten von Anzeichen oder Symptomen dieser neurologischen Toxizitäten unverzüglich einen Arzt aufzusuchen, um weitere Untersuchungen und Massnahmen einzuleiten.
Immuneffektorzell-assoziiertes Neurotoxizitätssyndrom (ICANS)
Bei Patienten, die mit CARVYKTI behandelt werden, kann es nach der Behandlung mit CARVYKTI zu einem tödlichen oder lebensbedrohlichen ICANS kommen, einschliesslich vor dem Auftreten eines CRS, zeitgleich mit einem CRS, nach Abklingen eines CRS oder bei Fehlen eines CRS. Zu den Symptomen zählten Aphasie, verlangsamtes Sprechen, Dysgraphie, Enzephalopathie, Bewusstseinsstörung und Verwirrtheit.
Bei Patienten mit hoher Tumorlast sollte erwogen werden, die vorhandene Krankheitslast durch eine Überbrückungstherapie vor der Infusion von CARVYKTI zu reduzieren, um dadurch das Risiko der Entwicklung einer neurologischen Toxizität zu senken (siehe «Unerwünschte Wirkungen»). Die Patienten sollten in den vier Wochen nach der Infusion auf Anzeichen und Symptome eines ICANS überwacht werden. Bei ersten Anzeichen eines ICANS ist der Patient umgehend hinsichtlich einer Spitaleinweisung zu beurteilen, und es sind unterstützende Therapiemassnahmen gemäss Tabelle 2 einzuleiten (siehe «Dosierung/Anwendung»). Bei einem CRS oder ICANS können eine frühzeitige Erkennung und intensive Behandlung wichtig sein, um ein Auftreten oder eine Verschlimmerung neurologischer Toxizitäten zu verhindern.
Bewegungsbezogene und neurokognitive Toxizität mit Anzeichen und Symptomen von Parkinsonismus
In Studien mit CARVYKTI wurde über bewegungsbezogene neurologische Toxizität und neurokognitive Toxizität mit Anzeichen und Symptomen von Parkinsonismus berichtet. Es wurde eine Reihe von Symptomen mit unterschiedlichem Beginn beobachtet, die mehr als einen Symptombereich umfassten, darunter Bewegungsstörungen (z.B. Mikrographie, Tremor, Bradykinesie, Rigor, gebeugte Haltung, schlurfender Gang), kognitive Störungen (z. B., Gedächtnisverlust, Aufmerksamkeitsstörung, Verwirrtheit) und Persönlichkeitsveränderungen (z.B. verminderte Mimik, flacher Affekt, Hypomimie, Apathie), oft mit subtilem Beginn (z.B. Mikrografie, flacher Affekt), und die bei einigen Patienten zu Arbeitsunfähigkeit oder Pflegebedürftigkeit führten. Die meisten dieser Patienten wiesen eine Kombination von zwei oder mehr Faktoren auf, wie etwa eine hohe Tumorlast (≥80% Plasmazellen im Knochenmark oder Serum-M-Gradient ≥5 g/dl oder freie Leichtketten im Serum ≥5'000 mg/Liter), ein vorgängiges CRS Grad 2 oder höher, ein vorgängiges ICANS und hohe Expansion und Persistenz der CAR-T-Zellen. Die Behandlung mit Levodopa/Carbidopa (n = 4) führte bei diesen Patienten nicht zu einer Verbesserung der Symptomatik.
Die Patienten sind auf Anzeichen und Symptome von Parkinsonismus zu überwachen, welche möglicherweise verzögert auftreten und mit unterstützenden Pflegemassnahmen behandelt werden.
Guillain-Barré Syndrom
Nach der Behandlung mit CARVYKTI wurde über das Auftreten des Guillain-Barré-Syndroms (GBS) berichtet. Die berichteten Symptome umfassten solche, die mit denen der Miller-Fisher-Variante des GBS übereinstimmen, d.h. motorische Schwäche, Sprechstörungen und Polyradiculoneuritis (siehe «Unerwünschte Wirkungen»).
Patienten sollen auf GBS überwacht werden. Patienten, die eine periphere Neuropathie aufweisen, sollen auf GBS untersucht werden. Eine Behandlung mit intravenösem Immunglobulin (IVIG) soll in Betracht gezogen und je nach Schweregrad der Toxizität bis zur Plasmapherese eskaliert werden.
Periphere Neuropathie
In Studien mit CARVYKTI wurde über das Auftreten von peripherer Neuropathie, einschliesslich sensorischer, motorischer und sensomotorischer peripherer Neuropathie berichtet.
Die Patienten sind auf Anzeichen und Symptome peripherer Neuropathien zu überwachen. Je nach Schweregrad und Verlauf der Anzeichen und Symptome kann eine kurzzeitige Behandlung mit systemischen Kortikosteroiden in Betracht gezogen werden
Hirnnervenlähmungen
In Studien mit CARVYKTI wurde über das Auftreten von Lähmungen des 7., 3., 5. und 6. Hirnnervs, von denen einige beidseitig auftraten, sowie über eine Verschlechterung der Hirnnervenlähmung nach einer Besserung und über das Auftreten einer peripheren Neuropathie bei Patienten mit Hirnnervenlähmung berichtet.
Die Patienten sind auf Anzeichen und Symptome von Hirnnervenlähmungen zu überwachen. Je nach Schweregrad und Progredienz der Anzeichen und Symptome kann eine kurzzeitige Behandlung mit systemischen Kortikosteroiden in Betracht gezogen werden.
Länger anhaltende und wiederkehrende Zytopenien
Nach der lymphodepletierenden Chemotherapie und der Infusion von CARVYKTI kann es bei Patienten über mehrere Wochen hinweg zu Zytopenien kommen. Diese sollten gemäss den lokal geltenden Leitlinien behandelt werden. In den Studien mit CARVYKTI trat bei nahezu allen Patienten mindestens eine Zytopenie vom Grad 3 oder 4 als unerwünschte Wirkung auf. Bei der Mehrheit der Patienten kam es innerhalb von weniger als zwei Wochen nach der Infusion (Median) zum ersten Auftreten einer Zytopenie vom Grad 3 oder 4, deren Schweregrad sich bei den meisten Patienten bis Tag 30 auf ≤ Grad 2 verringerte (siehe «Unerwünschte Wirkungen»).
Nach der Infusion von CARVYKTI ist das Blutbild zu überwachen. Bei einer Thrombozytopenie sollten unterstützende Therapiemassnahmen mit Transfusionen in Betracht gezogen werden. Eine länger anhaltende Neutropenie wurde mit einem erhöhten Infektionsrisiko in Verbindung gebracht. Myeloische Wachstumsfaktoren, insbesondere GM-CSF, können CRS-Symptome potenziell verstärken und werden in den ersten 3 Wochen nach der Infusion von CARVYKTI oder bis zum vollständigen Abklingen des CRS nicht empfohlen.
Schwerwiegende Infektionen und febrile Neutropenie
Nach der Infusion von CARVYKTI traten bei Patienten schwerwiegende Infektionen auf, die mitunter lebensbedrohlich waren oder tödlich verliefen (siehe «Unerwünschte Wirkungen»).
Die Patienten sollten auf Anzeichen und Symptome einer Infektion überwacht werden. Dazu sollten vor und während der Behandlung mit CARVYKTI entsprechende Tests zur Infektionsüberwachung stattfinden und die Patienten gegebenenfalls angemessen behandelt werden. Es sollte eine prophylaktische antimikrobielle Behandlung nach den vor Ort geltenden Leitlinien durchgeführt werden. Es ist bekannt, dass Infektionen den Verlauf und die Behandlung eines gleichzeitig vorhandenen CRS erschweren. Bei Vorliegen einer klinisch signifikanten aktiven Infektion bei einem Patienten sollte die Behandlung mit CARVYKTI erst dann begonnen werden, wenn die Infektion unter Kontrolle ist.
Bei einer febrilen Neutropenie sollte die Infektion abgeklärt und der medizinischen Indikation entsprechend mit Breitbandantibiotika, Flüssigkeit und sonstiger unterstützender Versorgung behandelt werden. Bei Patienten, die mit CARVYKTI behandelt werden, kann sich das Risiko für eine schwere/ tödliche COVID-19-Infektion erhöhen. Die Patienten sind über die Notwendigkeit von Präventionsmassnahmen aufzuklären.
Virusreaktivierung
Bei Patienten mit Hypogammaglobulinämie kann es zu einer HBV-Reaktivierung kommen, die in einigen Fällen zu fulminanter Hepatitis, Leberversagen und zum Tod führt.
Es liegen derzeit keine Erfahrungen mit der Herstellung von CARVYKTI für Patienten vor, die positiv auf HIV, aktives HBV und aktives HCV getestet wurden. Vor der Zellentnahme für die Herstellung sollte ein Screening auf HBV, HCV, HIV und andere infektiöse Erreger im Einklang mit den lokalen, klinischen Leitlinien durchgeführt werden
Hypogammaglobulinämie
Bei Patienten, die CARVYKTI erhalten, kann eine Hypogammaglobulinämie auftreten.
Nach der Behandlung mit CARVYKTI sollen die Immunglobulinspiegel überwacht und bei einem IgG < 400 mg/dl soll IVIG verabreicht werden. Die Patienten sollen gemäss den lokalen klinischen Richtlinien entsprechend behandelt werden, einschliesslich Antibiotika- oder antivirale Prophylaxe und Überwachung auf Infektionen.
Lebendimpfstoffe
Die Sicherheit einer Impfung mit viralen Lebendvakzinen während oder nach einer Behandlung mit CARVYKTI wurde nicht untersucht. Eine Impfung mit einem Lebendvirusvakzin wird mindestens 6 Wochen vor Beginn der lymphodepletierenden Chemotherapie, während der Behandlung mit CARVYKTI und bis zur Wiederherstellung des Immunsystems nach der Behandlung mit CARVYKTI nicht empfohlen.
Sekundäre Malignome
Patienten, die mit CARVYKTI behandelt werden, können sekundäre Malignome entwickeln. Bei Patienten, die mit gentechnisch veränderten autologen, gegen BCMA und CD-19 gerichteten T-Zell-Immuntherapien behandelt wurden, sind T-Zell-Malignome aufgetreten. Diese können bereits wenige Wochen nach der Behandlung auftreten. Nach der Behandlung mit CARVYKTI sind bei Patienten T-Zell-Lymphome, einschliesslich CAR-positiver Tumore, aufgetreten (siehe «Unerwünschte Wirkungen»).
Nach der Behandlung mit CARVYKTI sind bei Patienten das myelodysplastische Syndrom und akute myeloische Leukämie aufgetreten, darunter auch Fälle mit tödlichem Ausgang (siehe «Unerwünschte Wirkungen»). Patienten sollen lebenslang auf sekundäre Malignome überwacht werden. Falls ein sekundäres hämatologisches Malignom auftritt, soll die Zulassungsinhaberin kontaktiert werden, um den Fall zu erfassen und um Anweisungen zur Entnahme von Patientenproben für die Untersuchung zu erhalten. Bei Patienten mit HIV-Infektion soll die Zulassungsinhaberin bezüglich der Untersuchung aller Arten von sekundären Malignomen kontaktiert werden, einschliesslich solcher, die nicht von T-Zellen stammen.
Überempfindlichkeit
Die Infusion von CARVYKTI kann allergische Reaktionen auslösen. Schwerwiegende Überempfindlichkeitsreaktionen, einschliesslich einer Anaphylaxie, können auch durch Dimethylsulfoxid (DMSO) oder Restmengen von Kanamycin in CARVYKTI bedingt sein. Die Patienten sollen nach der Infusion über 2 Stunden engmaschig auf Anzeichen und Symptome von schweren Überempfindlichkeitsreaktionen überwacht werden. Die Patienten sind unverzüglich und entsprechend dem Schweregrad der Überempfindlichkeitsreaktion zu behandeln.
Blut-, Organ-, Gewebe- und Zellspende
Mit CARVYKTI behandelte Patienten sollten kein Blut, keine Organe, keine Gewebe und keine Zellen für eine Transplantation spenden.
InteraktionenEs wurden keine Studien zur Erfassung von Interaktionen mit CARVYKTI durchgeführt.
HIV und das zur Herstellung von CARVYKTI verwendete Lentivirus weisen wenige und kurze Abschnitte an identischem genetischem Material (RNA) auf. Daher können manche zum Nachweis von HIV verwendete Nukleinsäuretests (Nucleic Acid Tests, NATs) bei Patienten, die CARVYKTI erhalten haben, zu einem falsch positiven Ergebnis führen.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen keine Daten zur Anwendung von CARVYKTI bei Schwangeren vor. Es wurden keine tierexperimentellen Studien zur Erfassung einer Reproduktions- und Entwicklungstoxizität von CARVYKTI durchgeführt. Es ist nicht bekannt, ob CARVYKTI das Potential besitzt, über die Plazenta auf den Fötus übertragen zu werden und beim Fötus Toxizitäten verursachen kann. Daher wird CARVYKTI während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, nicht empfohlen. Schwangere sollten über die potenziellen Risiken für den Fötus aufgeklärt werden. Eine Schwangerschaft nach einer Therapie mit CARVYKTI sollte mit dem behandelnden Arzt bzw. der behandelnden Ärztin besprochen werden.
Bei Schwangeren, die CARVYKTI erhalten haben, kann es zu einer Hypogammaglobulinämie kommen. Bei Neugeborenen von Müttern, die mit CARVYKTI behandelt worden sind, sollte eine Untersuchung der Immunglobulinspiegel in Erwägung gezogen werden.
Frauen und Männer im reproduktionsfähigen Alter
Schwangerschaftstests
Bei Frauen im gebärfähigen Alter sollte vor Beginn der Behandlung mit CARVYKTI der Schwangerschaftsstatus festgestellt werden.
Verhütung
Es liegen nicht genügend Expositionsdaten vor, um eine Empfehlung bezüglich der Dauer der Kontrazeption nach Behandlung mit CARVYKTI zu erteilen.
In klinischen Studien wurde Patientinnen im gebärfähigen Alter geraten, eine hochwirksame Verhütungsmethode anzuwenden, und männliche Patienten mit gebärfähigen oder schwangeren Partnerinnen wurden angewiesen, bis ein Jahr nach Erhalt der CARVYKTI-Infusion eine Barrieremethode zur Empfängnisverhütung anzuwenden.
Bezüglich der Notwendigkeit einer Empfängnisverhütung bei Patienten, die eine lymphodepletierende Chemotherapie erhalten, sind die Hinweise in der Fachinformation für die betreffende Chemotherapie zu beachten.
Stillzeit
Es liegen keine Daten zum Übergang von CARVYKTI in die Muttermilch, zu den Auswirkungen auf das gestillte Kind oder zum Einfluss auf die Muttermilchproduktion vor. Die Vorteile des Stillens für die Entwicklung und Gesundheit sollten ebenso erwogen werden wie die klinische Notwendigkeit für CARVYKTI seitens der Mutter und die möglichen nachteiligen Auswirkungen auf den gestillten Säugling durch CARVYKTI bzw. durch die zugrunde liegende Erkrankung der Mutter.
Fertilität
Es liegen keine Daten zu den Auswirkungen von CARVYKTI auf die Fertilität vor. Es wurden keine tierexperimentellen Studien zu den Auswirkungen von CARVYKTI auf die Fertilität von Männern und Frauen durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenAufgrund des Potenzials für neurologische Ereignisse besteht bei Patienten, die CARVYKTI erhalten, in den ersten 8 Wochen nach der Infusion das Risiko einer Veränderung oder Einschränkung des Bewusstseinszustands oder der Koordination. Den Patienten ist anzuraten, sich in dieser ersten Phase und im Falle eines erneuten Auftretens neurologischer Symptome nicht ans Steuer eines Fahrzeugs zu setzen und keine gefährlichen Tätigkeiten auszuüben, z.B. keine schweren oder potenziell gefährlichen Maschinen zu bedienen.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die in diesem Abschnitt beschriebenen Sicherheitsdaten spiegeln die Exposition gegenüber CARVYKTI in drei offenen klinischen Studien wider, in denen 396 erwachsene Patienten mit Multiplem Myelom eine CARVYKTI-Infusion erhielten (siehe «Klinische Wirksamkeit»): Studie MMY2001 (n = 106), die Patienten aus der Hauptkohorte der Phase Ib/II (Vereinigte Staaten; n = 97 mit einer medianen Nachbeobachtungsdauer von 27,7 Monaten) und einer weiteren Kohorte (Japan; n = 9) einschloss, Phase II Studie MMY2003 (n = 94) und Phase III Studie MMY3002 (n = 196). Patienten, welche an den Studien MMY2001, MMY2003 oder MMY3002 teilgenommen haben, qualifizieren sich nach deren Abschluss für die Teilnahme an einer separaten Langzeit-Follow-up-Studie (MMY4002).
Die häufigsten unerwünschten Wirkungen von CARVYKTI (≥20%) waren Neutropenie, Fieber, CRS, Thrombozytopenie, Anämie, Schmerzen des Muskel- und Skelettsystems, Ermüdung, Lymphopenie, Leukopenie, Hypotonie, Diarrhoe, Infektion der oberen Atemwege, Hypogammaglobulinämie, Erhöhung der Transaminasen, Kopfschmerzen, Übelkeit und Husten.
Bei 43% der Patienten traten schwerwiegende unerwünschte Wirkungen auf. Schwerwiegende unerwünschte Wirkungen bei ≥5% der Patienten waren CRS (11%), Pneumonie (7%) und Sepsis (5%).
Die häufigste (≥10%) nichthämatologische unerwünschte Wirkung vom Grad ≥3 war eine Erhöhung der Transaminasen (11%).
Die häufigsten (≥25%) hämatologischen Anomalien vom Grad ≥3 waren Neutropenie (88%), Thrombozytopenie (44%), Anämie (44%), Lymphopenie (33%) und Leukopenie (32%).
Nachstehend sind die unerwünschten Wirkungen bei Patienten unter Behandlung mit CARVYKTI zusammengefasst.
Innerhalb jeder MedDRA-Systemorganklasse sind die unerwünschten Arzneimittelwirkungen nach Häufigkeit geordnet, wobei die häufigsten Reaktionen als erste genannt sind, und gemäss folgender Konvention klassifiziert: Sehr häufig (≥1/10), häufig (≥1/100 bis < 1/10), gelegentlich (≥1/1'000 bis < 1/100), selten (≥1/10'000 bis < 1/1'000), sehr selten (< 1/10'000), nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 3: Unerwünschte Wirkungen bei Patienten mit Multiplem Myelom unter Behandlung mit CARVYKTI (n = 396)
|
Systemorganklasse
|
Häufigkeit
|
Unerwünschte Wirkung
|
Inzidenz (%)
| |
Alle Grade
|
Grad ≥3
| |
Infektionen und parasitäre Erkrankungen
|
Sehr häufig
|
Infektion der oberen Atemwege1
|
30
|
2
| |
Virusinfektion2
|
17
|
4
| |
Bakterielle Infektion3#
|
13
|
5
| |
Pneumonie4#
|
12
|
9
| |
Häufig
|
Sepsis5#
|
9
|
7
| |
Gastroenteritis6
|
6
|
1
| |
Harnwegsinfektion7
|
5
|
1
| |
Pilzinfektion8
|
3
|
< 1
| |
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen)
|
Häufig
|
Hämatologische bösartige Erkrankung9#
|
5
|
4
| |
Erkrankungen des Blutes und des Lymphsystems
|
Sehr häufig
|
Neutropenie
|
89
|
88
| |
Thrombozytopenie
|
60
|
44
| |
Anämie10
|
60
|
44
| |
Lymphopenie
|
34
|
33
| |
Leukopenie
|
33
|
32
| |
Koagulopathie11
|
12
|
3
| |
Häufig
|
Febrile Neutropenie
|
8
|
8
| |
Lymphozytose12
|
3
|
1
| |
Erkrankungen des Immunsystems
|
Sehr häufig
|
Zytokin-Freisetzungssyndrom#
|
83
|
4
| |
Hypogammaglobulinämie13
|
29
|
5
| |
Häufig
|
Hämophagozytische Lymphohistiozytose#
|
3
|
2
| |
Stoffwechsel- und Ernährungsstörungen
|
Sehr häufig
|
Hypophosphatämie
|
17
|
4
| |
Hypokaliämie
|
17
|
2
| |
Hypokalzämie
|
16
|
3
| |
Appetit vermindert
|
15
|
1
| |
Hypomagnesiämie
|
12
|
< 1
| |
Hypoalbuminämie
|
11
|
< 1
| |
Hyponatriämie
|
10
|
2
| |
Hyperferritinämie14
|
10
|
2
| |
Psychiatrische Erkrankungen
|
Häufig
|
Delirium15
|
3
|
< 1
| |
Persönlichkeitsveränderungen16
|
3
|
1
| |
Erkrankungen des Nervensystems
|
Sehr häufig
|
Kopfschmerz
|
24
|
0
| |
motorische Funktionsstörung17
|
13
|
2
| |
Schwindelgefühl18
|
13
|
1
| |
Immuneffektorzellen-assoziiertes Neurotoxizitätssyndrom#
|
11
|
2
| |
Enzephalopathie19#
|
10
|
2
| |
Schlafstörung20
|
10
|
1
| |
Häufig
|
Hirnnervenlähmungen21
|
7
|
1
| |
Periphere Neuropathie22
|
7
|
1
| |
Aphasie23
|
5
|
< 1
| |
Tremor24
|
5
|
< 1
| |
Ataxie25
|
4
|
< 1
| |
Neurotoxizität#
|
1
|
1
| |
Parese26
|
1
|
< 1
| |
Gelegentlich
|
Guillain-Barre Syndrom
|
< 1
|
< 1
| |
Herzerkrankungen
|
Sehr häufig
|
Tachykardie27
|
13
|
1
| |
Häufig
|
Herzrhythmusstörungen28
|
4
|
2
| |
Gefässerkrankungen
|
Sehr häufig
|
Hypotonie29
|
33
|
6
| |
Hypertonie
|
11
|
4
| |
Blutung30#
|
10
|
2
| |
Häufig
|
Thrombose31
|
4
|
1
| |
Kapillarlecksyndrom
|
1
|
0
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
|
Sehr häufig
|
Husten32
|
21
|
0
| |
Dyspnoe33#
|
14
|
3
| |
Hypoxie34
|
13
|
4
| |
Erkrankungen des Gastrointestinaltrakts
|
Sehr häufig
|
Diarrhoe35
|
31
|
3
| |
Übelkeit
|
23
|
< 1
| |
Obstipation
|
15
|
0
| |
Erbrechen
|
12
|
0
| |
Häufig
|
Abdominalschmerz36
|
8
|
0
| |
Leber- und Gallenerkrankungen
|
Häufig
|
Hyperbilirubinämie
|
3
|
1
| |
Erkrankungen der Haut und des Unterhautgewebes
|
Häufig
|
Ausschlag37
|
9
|
0
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
Sehr häufig
|
Schmerzen des Muskel- und Skelettsystems38
|
38
|
3
| |
Erkrankungen der Nieren und Harnwege
|
Häufig
|
Nierenversagen39
|
6
|
4
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Sehr häufig
|
Fieber
|
84
|
6
| |
Ermüdung (Fatigue)40
|
35
|
4
| |
Ödem41
|
16
|
1
| |
Schüttelfrost
|
14
|
0
| |
Schmerz42
|
11
|
1
| |
Untersuchungen
|
Sehr häufig
|
Transaminase-Erhöhung43
|
25
|
11
| |
Gamma-Glutamyltransferase erhöht
|
10
|
6
| |
Häufig
|
alkalische Phosphatase im Blut erhöht
|
8
|
3
| |
C-reaktives Protein erhöht
|
7
|
1
|
Unerwünschte Wirkungen sind nach MedDRA Version 25.0 angegeben
# Schliesst Ereignisse mit tödlichem Verlauf ein.
1 Infektion der oberen Atemwege beinhaltet Bronchitis, Nasenverstopfung, Nasopharyngitis, Rachenentzündung, Pharyngitis, Atemwegskongestion, Atemwegsinfektion, Rhinitis, Rhinorrhoe, Rhinovirusinfektion, Sinus Sekretstauung, Sinusitis, Infektion der oberen Atemwege, virale Pharyngitis und virale Infektion der oberen Atemwege.
2 Virusinfektion beinhaltet Adenovirus-Infektion, Adenovirus-Test positiv, asymptomatische COVID-19 Infektion, COVID-19 Infektion, Coronavirus-Infektion, Zytomegalievirus-Infektion, Reaktivierung einer Zytomegalie-Virusinfektion, Zytomegalievirus-Syndrom, Virämie durch Zytomegalie-Virus, Reaktivierung einer Hepatitis B, Herpes-simplex-Reaktivierung, Herpesvirus-Infektion, Herpes zoster, disseminierte Herpes zoster-Infektion, humanes Herpesvirus 6-Infektion, Human-Rhinovirus-Test positiv, Grippe, virale Lymphangitis, Infektion mit Metapneumovirus, oraler Herpes, Parainfluenzavirus-Infektion, Parvovirus-B19-Infektion, Parvovirusinfektion, Respiratory Syncytial Virus-Infektion, Virusinfektion der Atemwege und Rotaviren-Infektion.
3 Bakterielle Infektion beinhaltet Abszess an Gliedmassen, Bordetella-Infektion, Zellulitis der Brust, bakterielle Bronchitis, Campylobacter-Infektion, Infektion an der Katheterstelle, Zellulitis, Chalazion, Citrobacter-Infektion, Clostridium-difficile-Kolitis, Clostridium-difficile-Infektion, gerätebedingte Infektion, Enterokokken-Infektion, Escherichia-Infektion, Follikulitis, Hordeolum, Klebsiella-Infektion, Lungenabszess, Perichondritis, perirektaler Abszess, Infektion nach einem Eingriff, akute Pyelonephritis, Salmonellose, bakterielle Sinusitis, Hautinfektion, Weichteilinfektion, Staphylokokken-Infektion, Superinfektion mit Bakterien, Zahninfektion, Infektion an der Stelle eines Gefässzugangs und Infektion eines Gefäss-Medizinprodukts.
4 Pneumonie beinhaltet atypische Pneumonie, bronchopulmonale Aspergillose, COVID-19-Pneumonie, Infektion der unteren Atemwege, Lungeninfiltration, Metapneumovirus-Pneumonie, Pneumonie durch Pneumocystis jiroveci, Pneumonie, Aspirationspneumonie, Pneumonia moraxella, Pneumonie durch Pseudomonas, Pneumonie durch Streptokokken und virale Pneumonie.
5 Sepsis beinhaltet Bakteriämie, bakterielle Sepsis, Candidasepsis, Bakteriämie in Zusammenhang mit einem Medizinprodukt, Enterokokken-Bakteriämie, Haemophilus-Sepsis, neutropenische Sepsis, Pseudomonas-Bakteriämie, Sepsis durch Pseudomonas, Sepsis, septischer Schock, Staphylokokken-Bakteriämie, Streptokokkensepsis, systemische Candidiasis und Urosepsis.
6 Gastroenteritis beinhaltet bakterielle Enterokolitis, infektiöse Enterokolitis, virale Enterokolitis, Enterovirusinfektion, Gastroenteritis, Gastroenteritis durch Cryptosporidien, Gastroenteritis durch Rotavirus, Gastroenteritis durch Salmonellen, virale Gastroenteritis, Gastrointestinalinfektion und Infektion des Dickdarms.
7 Harnwegsinfektion beinhaltet Zystitis, Harnwegsinfektion durch Escherichia, Harnwegsinfektionen, bakterielle Harnwegsinfektion und virale Harnwegsinfektion.
8 Pilzinfektion beinhaltet Candida-Infektion, zerebrale Aspergillose, orale Candidose, Aspergillus-Sinusitis, Pilzinfektion der Zunge und vulvovaginale Candidose.
9 Hämatologische bösartige Erkrankung beinhaltet myelodysplastisches Syndrom, myelodysplastisches Syndrom mit Mehrlinien-Dysplasie, akute myeloische Leukämie und periphere T-Zell Lymphome ohne weitere Spezifizierung.
10 Anämie beinhaltet Anämie und Eisenmangelanämie.
11 Koagulopathie beinhaltet aktivierte partielle Thromboplastinzeit verlängert, Fibrinogen im Blut erniedrigt, Gerinnungstest anomal, Koagulopathie, disseminierte intravaskuläre Gerinnung, Hypofibrinogenämie, International normalised ratio erhöht, Prothrombinspiegel erhöht und Prothrombinzeit verlängert.
12 Lymphozytose beinhaltet Lymphozytenzahl erhöht und Lymphozytose.
13 Hypogammaglobulinämie beinhaltet Immunglobulin G im Blut erniedrigt und Hypogammaglobulinämie.
14 Hyperferritinämie beinhaltet Hyperferritinämie und Serumferritin erhöht.
15 Delirium beinhaltet Agitiertheit, Delirium, Desorientiertheit, euphorische Stimmung, Halluzinationen, Reizbarkeit und Unruhe.
16 Persönlichkeitsveränderung beinhaltet flacher Affekt, Gleichgültigkeit, Persönlichkeitsveränderung und verminderter Gesichtsausdruck.
17 Motorische Funktionsstörung beinhaltet Agraphie, Dysgraphie, Augenlidptosis, Mikrographie, motorische Funktionsstörung, Muskelrigidität, Muskelspasmen, Muskelspannung, Muskelschwäche, Myoklonus und Parkinsonismus.
18 Schwindelgefühl beinhaltet Schwindelgefühl, Schwindelgefühl bei Belastung, Schwindel orthostatisch, Präsynkope, Synkope und Vertigo.
19 Enzephalopathie beinhaltet Amnesie, Bradyphrenie, Verwirrtheitszustand, getrübter Bewusstseinszustand, Aufmerksamkeitsstörungen, Enzephalopathie, Lethargie, Erinnerungsvermögen eingeschränkt, geistige Beeinträchtigungen, Gemütszustand verändert, psychomotorische Verlangsamung und verlangsamte Reaktion auf Stimuli.
20 Schlafstörungen beinhalten Hypersomnie, Schlaflosigkeit, Schlafstörung und Somnolenz.
21 Hirnnervenparalysen beinhalten Bell-Parese, Hirnnervenparalyse, Erkrankung des Nervus facialis, Gesichtslähmung, Gesichtsparese, Lähmung des III. Hirnnervs, Trigeminuslähmung und Lähmung des VI. Hirnnervs.
22 Periphere Neuropathie beinhaltet periphere Neuropathie, periphere motorische Neuropathie, periphere sensomotorische Neuropathie, periphere sensorische Neuropathie und Polyneuropathie.
23 Aphasie beinhaltet Aphasie, Dysarthrie, langsame Sprache und Sprechstörung.
24 Tremor beinhaltet Ruhetremor und Tremor.
25 Ataxie beinhaltet Ataxie, Gleichgewichtsstörung, Dysmetrie und Gangstörung.
26 Parese beinhaltet Hemiparese, Parese und Peronaeuslähmung.
27 Tachykardie beinhaltet Sinustachykardie und Tachykardie.
28 Herzrhythmusstörungen beinhalten Vorhofflimmern, Vorhofflattern, atrioventrikulärer Block zweiten Grades, supraventrikuläre Tachykardie, ventrikuläre Extrasystolen und ventrikuläre Tachykardie.
29 Hypotonie beinhaltet Hypotonie und Orthostasesyndrom.
30 Blutung beinhaltet Blutung an der Katheterstelle, Hirnblutung, Bindehautblutung, Kontusion, Epistaxis, Augenkontusion, Hämatemesis, Blutstuhl, Hämatom, Hämaturie, Hämoptoe, Blutung im unteren Gastrointestinaltrakt, Lungenblutung, Netzhautblutung, retroperitoneale Blutung, Subarachnoidalblutung und subdurales Hämatom.
31 Thrombose beinhaltet tiefe Beinvenenthrombose, durch Medizinprodukt bedingte Thrombose, Embolie, Jugularvenenthrombose, Lungenembolie und Venenthrombose einer Extremität.
32 Husten beinhaltet Husten, Husten mit Auswurf und Hustensyndrom der oberen Atemwege.
33 Dyspnoe beinhaltet akute respiratorische Insuffizienz, Dyspnoe, Belastungsdyspnoe, respiratorische Insuffizienz, Tachypnoe und Giemen.
34 Hypoxie beinhaltet Hypoxie und Sauerstoffsättigung erniedrigt.
35 Diarrhoe beinhaltet Kolitis und Diarrhoe.
36 Abdominalschmerz beinhaltet abdominale Beschwerden, Abdominalschmerz, Schmerzen Unterbauch, Schmerzen Oberbauch und Dyspepsie.
37 Hautausschlag beinhaltet bullöse hämorrhagische Dermatose, Dermatitis exfoliativa generalisiert, psoriasiforme Dermatitis, Medikamentenausschlag, Erythem, Pityriasis lichenoides et varioliformis acuta, Hautausschlag, erythematöser Hautausschlag, makulo-papulöser Ausschlag, pustulöser Ausschlag, blasiger Hautausschlag und Urtikaria.
38 Schmerzen des Muskel- und Skelettsystems beinhaltet Arthralgie, Rückenschmerzen, Knochenschmerzen, Gelenksteife, Muskelzerrung, Brustschmerzen die Skelettmuskulatur betreffend, muskuloskelettale Beschwerden, Schmerzen des Muskel- und Skelettsystems, muskuloskelettale Steifigkeit, Myalgie, Myositis, Nackenschmerzen, Thoraxschmerz nicht kardialen Ursprungs, Osteoarthrose, Schmerz in einer Extremität, Rotatorensyndrom der Schulter, Wirbelsäulenschmerz und Tendonitis.
39 Nierenversagen beinhaltet akute Nierenschädigung, Kreatinin im Blut erhöht, chronische Nierenerkrankung, Nierenversagen und Nierenfunktionsbeeinträchtigung.
40 Ermüdung beinhaltet Asthenie, Ermüdung und Unwohlsein.
41 Ödem beinhaltet Gesichtsödem, Flüssigkeitsretention, generalisierte Ödeme, Hypervolämie, lokalisiertes Ödem, Ödem, Ödem peripher, Gaumenödem, Periorbitalödem, periphere Schwellung, Lungenstauung und Lungenödem.
42 Schmerz beinhaltet anorektale Beschwerden, Schmerzen an der Katheterstelle, Ohrschmerzen, Augenschmerzen, Flankenschmerz, Frakturschmerz, Entzündungsschmerz, schmerzhaftes Schlucken, Schmerz, Kieferschmerzen, Hautschmerzen, Beckenschmerz, Proktalgie, Rhinalgia, Sakralschmerz, Sinusschmerzen, Hodenschmerz und Zahnschmerzen.
43 Erhöhung der Transaminasen beinhaltet Alaninaminotransferase erhöht und Aspartataminotransferase erhöht.
Von den 196 Patienten in der Studie MMY3002 wiesen 20 Patienten mit einem erhöhten Krankheitsrisiko unter der Überbrückungstherapie vor der Infusion mit CARVYKTI eine frühe und schnelle Krankheitsprogression auf. Sie erhielten daraufhin CARVYKTI als weiterführende Therapie (siehe «Klinische Wirksamkeit»). Bei einem dieser Patienten (5%) wurde über behandlungsbedingte bewegungsbezogene und neurokognitive unerwünschte Ereignisse mit leichtem Schweregrad (Grad 1 oder 2) berichtet. CRS vom Grad 3 und 4 wurde mit einer höheren Rate (25%) berichtet, darunter CRS-Ereignisse, mit Komplikationen durch eine HLH (10%) oder eine disseminierte intravasale Koagulopathie (DIC) (10%). ICANS wurde mit einer höheren Rate (35%) und einem höheren Schweregrad (10%) für Grad 3 berichtet. Bei fünf Patienten trat ein tödliches Ereignis im Zusammenhang mit CARVYKTI auf (2 durch Blutungen im Zusammenhang mit HLH oder DIC und 3 aufgrund von Infektionen mit Todesfolge).
Beschreibung spezifischer unerwünschter Wirkungen
Zytokinfreisetzungssyndrom
Im Datenpooling der Studien (n = 396) wurde bei 83% der Patienten (n = 330) über ein CRS berichtet. Von den CRS-Ereignissen waren 79% (n = 314) Grad 1 oder 2, 4% (n = 15) Grad 3 oder 4 und < 1% (n = 1) Grad 5. Bei 98% der Patienten (n = 323) war das CRS reversibel.
Die Dauer des CRS betrug bei allen Patienten ≤18 Tage, ausgenommen bei einem Patienten, bei welchem das CRS 97 Tage andauerte und welcher als Komplikation eine sekundäre HLH mit tödlichem Ausgang entwickelte. Die häufigsten (≥10%) Anzeichen oder Symptome im Zusammenhang mit einem CRS waren Fieber (81%), Hypotonie (28%), erhöhte Aspartataminotransferase (AST) (12%) und Hypoxie (10%). Für Empfehlungen zu Überwachung und Behandlung siehe «Warnhinweise und Vorsichtsmassnahmen».
Neurologische Toxizitäten
Im Datenpooling der Studien (n = 396) traten bei 23% (n = 89) der Patienten neurologische Toxizitäten auf, die bei 5% (n = 21) vom Grad 3 oder 4 und bei 1% vom Grad 5 (n = 3; eine aufgrund von ICANS, eine aufgrund von bewegungsbedingter und neurokognitiver Toxizität mit Anzeichen und Symptomen von Parkinsonismus sowie eine aufgrund von Enzephalopathie) waren.
Darüber hinaus wurde über einen tödlichen Ausgang bei 11 Patienten berichtet, die zum Zeitpunkt des Todes eine anhaltende neurologische Toxizität aufwiesen. 10 Todesfälle waren auf Infektionen zurückzuführen, einschliesslich 2 Todesfälle von Patienten mit anhaltenden Anzeichen und Symptomen von Parkinsonismus, wie nachstehend erläutert, und ein Todesfall war auf Atemversagen zurückzuführen. Für Empfehlungen zur Überwachung und Behandlung siehe «Warnhinweise und Vorsichtsmassnahmen».
Immuneffektorzell-assoziiertes Neurotoxizitätssyndrom
Im Datenpooling der Studien (n = 396), trat ICANS bei 11% der Patienten (n = 45) auf, bei 2% (n = 7) lag ein ICANS vom Grad 3 oder 4 und bei < 1% (n = 1) lag ein ICANS vom Grad 5 vor. Symptome beinhalteten Aphasie, langsame Sprache, Dysgraphie, Enzephalopathie, getrübter Bewusstseinszustand und Verwirrtheitszustand. Der mediane Zeitraum von der Infusion von CARVYKTI bis zum ersten Auftreten des ICANS betrug 8 Tage (Bereich: 2 bis 15 Tage, mit Ausnahme von 1 Patienten mit Auftreten nach 26 Tagen) und die mediane Dauer betrug 3 Tage (Bereich: 1 bis 29 Tage, mit Ausnahme von 1 Patienten, der in der Folge nach 40 Tagen verstarb).
Bewegungsbezogene und neurokognitive Toxizität mit Anzeichen und Symptomen von Parkinsonismus
Von den 89 Patienten im Datenpool derStudien (n = 396) mit jeglicher Neurotoxizität, wiesen neun männliche Patienten mehrere Anzeichen und Symptome von Parkinsonismus auf, die von ICANS abzugrenzen waren. Die höchsten Toxizitätsgrade von Parkinsonismus waren: Grad 1 (n = 1), Grad 2 (n = 2), Grad 3 (n = 6). Die mediane Dauer von der Verabreichung von CARVYKTI bis zum Auftreten eines Parkinsonismus betrug 38 Tage (Bereich: 14 bis 914 Tage). Ein Patient (Grad 3) starb aufgrund von neurologischer Toxizität mit anhaltendem Parkinsonismus 247 Tage nach der Verabreichung von CARVYKTI, und zwei Patienten (Grad 2 und Grad 3) mit anhaltendem Parkinsonismus starben aufgrund von Infektionen 162 und 119 Tage nach der Verabreichung von CARVYKTI. Ein Patient erholte sich (Grad 3). Bei den verbleibenden 5 Patienten hielten die Parkinsonismus-Symptome bis 996 Tage nach der Verabreichung von CARVYKTI an. Alle 9 Patienten hatten eine Vorgeschichte mit vorangegangenem CRS (n = 1 Grad 1; n = 6 Grad 2; n = 1 Grad 3; n = 1 Grad 4) und 6 von 9 mit vorangegangenem ICANS (n = 5 Grad 1; n = 1 Grad 3).
Guillain-Barré-Syndrom
Im Datenpool der Studien (n = 396) wurde über einen Patienten mit GBS nach der Behandlung mit CARVYKTI berichtet. Obwohl die GBS-Symptome nach einer Behandlung mit Kortikosteroiden und IVIG abklangen, starb der Patient 139 Tage nach der Verabreichung von CARVYKTI aufgrund von Enzephalopathie infolge einer Gastroenteritis mit anhaltenden GBS-Symptomen.
Periphere Neuropathie
Im Datenpool der Studien (n = 396) traten bei 27 Patienten periphere Neuropathien in Form von sensorischen, motorischen oder sensomotorischen Neuropathien auf. Die mediane Zeit bis zum Auftreten der Symptome betrug 57 Tage (Bereich: 1 bis 914 Tage), die mediane Dauer der peripheren Neuropathien betrug 140 Tage (Bereich: 1 bis 766 Tage), einschliesslich solcher mit anhaltender Neuropathie. Von diesen 27 Patienten hatten 5 periphere Neuropathien vom Grad 3 oder 4 (die bei einem Patienten ohne berichtete Behandlung abklang und bei den anderen 4 Patienten anhielt, einschliesslich eines Patienten, bei dem es nach einer Behandlung mit Dexamethason zu einer Besserung kam); die verbleibenden 22 Patienten hatten periphere Neuropathien vom Grad ≤2; die peripheren Neuropathien klangen bei 6 der Patienten ohne berichtete Behandlung ab, gingen bei 2 Patienten nach der Behandlung mit Duloxetin zurück und hielten bei den 10 anderen Patienten an.
Hirnnervenlähmungen
Im Datenpooling der Studien (n = 396) traten bei 27 Patienten Hirnnervenlähmungen auf. Die mediane Zeit von der Verabreichung von CARVYKTI bis zum Auftreten betrug 22 Tage (Bereich: 17 bis 101 Tage). Die mediane Zeit bis zum Abklingen betrug 56 Tage (Bereich 1 bis 209 Tage) nach dem Auftreten der Symptome.
Länger anhaltende und wiederkehrende Zytopenien
Im Datenpooling der Studien (n = 396) traten am Tag 1 nach Verabreichung Zytopenien vom Grad 3 oder 4 auf, die bis Tag 30 nach der Infusion von CARVYKTI nicht bis auf mindestens Grad 2 abgeklungen waren, darunter Thrombozytopenie (33%), Neutropenie (29%), Lymphopenie (25%) und Anämie (3%). Nach Tag 60 nach der Infusion von CARVYKTI traten bei 23%, 21%, 7% und 4% der Patienten eine Lymphopenie, Neutropenie, Anämie bzw. Thrombozytopenie von Grad 3 oder 4 auf, nachdem sich ihre Zytopenie von Grad 3 oder 4 zunächst erholt hatte.
In Tabelle 4 sind die Inzidenzen von Zytopenien vom Grad 3 oder 4 nach der Infusion aufgeführt, die sich bis Tag 30 bzw. Tag 60 nicht bis mindestens Grad 2 gebessert hatten.
Tabelle 4: Inzidenzen länger anhaltender und wiederkehrender Zytopenien nach Behandlung mit CARVYKTI im Datenpooling der Studien(n = 396)
|
|
Grad 3/4 (%) nach Infusion an Tag 1
|
Anfangs Grad 3/4 (%), keine Besserunga bis ≤ Grad 2 bis Tag 30
|
Anfangs Grad 3/4 (%), keine Besserunga bis ≤ Grad 2 bis Tag 60
|
Auftreten von Grad 3/4 (%) > Tag 60 (nach anfänglicher Besserunga von Grad 3/4)
| |
Thrombozytopenie
|
191 (48%)
|
132 (33%)
|
76 (19%)
|
14 (4%)
| |
Neutropenie
|
381 (96%)
|
114 (29%)
|
44 (11%)
|
81 (21%)
| |
Lymphopenie
|
391 (99%)
|
98 (25%)
|
46 (12%)
|
90 (23%)
| |
Anämie
|
180 (46%)
|
11 (3%)
|
12 (3%)
|
26 (7%)
| |
a
Es wird der Laborbefund mit dem höchsten Toxizitätsgrad an einem Kalendertag verwendet. Definition einer Besserung: Es müssen an verschiedenen Tagen hintereinander 2 Befunde vorliegen, die auf eine Besserung bis auf Grad ≤2 hindeuten, wenn der Zeitraum, in dem die Besserung eintritt, ≤10 Tage beträgt.
Hinweise: In die Analyse fliessen Laborbefunde ein, die nach Tag 1 bis zum Tag 100 für die Studien MMY2001 und MMY2003 oder bis zum Tag 112 für die Studie MMY3002 bzw. bis zum Beginn der nachfolgenden Therapie, je nachdem, was zuerst eintritt, ermittelt wurden.
Thrombozytopenie: Grad 3/4 – Thrombozyten < 50'000 Zellen/µl.
Neutropenie: Grad 3/4 – Neutrophile < 1'000 Zellen/µl.
Lymphopenie: Grad 3/4 – Lymphozyten < 0,5 x 109 Zellen/l.
Anämie: Grad 3 - Hämoglobin < 8g/dl. Grad 4 ist nicht durch Laborwerte definiert gemäss NCI-CTCAE v5.
Die Prozentangaben beziehen sich auf die Anzahl der behandelten Studienteilnehmer.
|
Schwerwiegende Infektionen
Infektionen traten bei 206 Patienten (52%) im Datenpooling der Studien auf (n = 396); 66 (17%) hatten eine Infektion vom Grad 3 oder 4, und 17 Patienten (4%) entwickelten eine Infektion mit tödlichem Verlauf (COVID-19 Pneumonie, Pneumonie, Sepsis, Clostridium difficile-Kolitis, septischer Schock, bronchopulmonale Aspergillose, Sepsis durch Pseudomonas, neutropenische Sepsis, Lungenabszess). Die am häufigsten berichteten (≥2%) Infektionen vom Grad 3 oder höher waren Pneumonie, COVID-19 Pneumonie und Sepsis. Bei 6% der Patienten trat eine febrile Neutropenie auf, die bei 2% schwerwiegend war. Für Empfehlungen zu Überwachung und Behandlung siehe «Warnhinweise und Vorsichtsmassnahmen».
Hypogammaglobulinämie
Im Datenpooling der Studien (n = 396) wurde bei 30% der Patienten über Hypogammaglobulinämie berichtet, wobei bei 5% der Patienten eine Hypogammaglobulinämie vom Grad 3 vorlag; bei 91% (359/396) der mit CARVYKTI behandelten Patienten fielen die IgG-Laborwerte nach der Behandlung mit CARVYKTI unter 500 mg/dl. 53% der Patienten erhielten nach Verabreichung von CARVYKTI IVIG entweder aufgrund einer unerwünschten Wirkung oder als Prophylaxe. Für Empfehlungen zu Überwachung und Behandlung siehe «Warnhinweise und Vorsichtsmassnahmen».
Hämatologische bösartige Erkrankung
Myeloische Neoplasmen
In der Studie MMY2001 (n = 106) traten bei 8% (n = 9) der Patienten (4 Ereignisse pro 100 Personenjahre nach der Behandlung mit CARVYKTI) bis zum Abschluss der Studie (mediane Nachbeobachtungsdauer von 33,0 Monaten) myeloische Neoplasien auf. Es gab 6 Fälle von myelodysplastischem Syndrom (MDS), 2 Fälle von akuter myeloischer Leukämie (AML) und 1 Fall von MDS gefolgt von AML. Die mediane Dauer bis zum Auftreten von myeloischen Neoplasmen betrug 478 Tage (Bereich: 162 bis 870 Tage) nach der Behandlung mit CARVYKTI. 7 dieser 9 Patienten starben nach der Entwicklung von myeloischen Neoplasien, wobei 4 Todesfälle mit den myeloischen Neoplasmen in Verbindung gebracht wurden. 2 der 9 Fälle von myeloischen Neoplasien traten nach Beginn der nachfolgenden Antimyelom-Therapie auf. Die 9 Patienten, bei welchen myeloische Neoplasien auftraten, waren stark vorbehandelt mit 4 bis 18 vorhergehenden Therapien, hatten alle zuvor eine Behandlung mit Alkylanzien erhalten und sich einer autologen Stammzelltransplantation unterzogen. Bei allen Patienten lagen vor der Behandlung mit CARVYKTI genetische Mutationen vor, die mit der Entwicklung von MDS oder AML in Verbindung gebracht werden.
In der Studie MMY3002 (n = 196) traten bis zum Stichtag 27. Februar 2024 (mediane Nachbeobachtungsdauer 28,1 Monate) bei 3% (n = 5) der Patienten myeloische Neoplasien auf (1,2 Ereignisse pro 100 Personenjahre nach der Behandlung mit CARVYKTI). Es gab 2 Fälle von MDS, 1 Fall von akuter myeloischer Leukämie und 2 Fälle von MDS gefolgt von AML. Die mediane Dauer bis zum Auftreten von myeloischen Neoplasien betrug 385 Tage (Bereich: 56 bis 758 Tage) nach der Behandlung mit CARVYKTI. 5 Patienten starben nach der Entwicklung einer myeloischen Neoplasie, wobei alle 5 Todesfälle mit der myeloischen Neoplasie in Verbindung gebracht wurden. Nach Beginn der nachfolgenden Antimyelom-Therapie traten keine myeloischen Neoplasien auf. Alle Patienten waren zuvor mit Alkylanzien und Lenalidomid behandelt worden, und die Mehrzahl der Patienten hatte zuvor eine autologe Stammzelltransplantation erhalten. Zwei Patienten waren zuvor wegen anderer hämatologischer Malignome behandelt worden. Bei allen Patienten lagen vor der Behandlung mit CARVYKTI genetische Mutationen vor, die mit der Entwicklung von MDS oder AML in Verbindung gebracht werden.
Bis zum Stichtag 27. Februar 2024 traten in der Langzeit-Follow-up-Studie (mediane Nachbeobachtungsdauer 31,8 Monate) 3 zusätzliche Fälle von myeloischen Neoplasien auf, was einer kumulativen Langzeit-Inzidenzrate von 2 Ereignissen pro 100 Personenjahre nach der Behandlung mit CARVYKTI entspricht. Die mediane Dauer bis zum Auftreten einer myeloischen Neoplasie in der Langzeit-Follow-up-Studie betrug 954 Tage nach der Behandlung mit CARVYKTI. Fälle von MDS und AML wurden auch in der Zeit nach der Markteinführung gemeldet.
T-Zell-Lymphom
In der Studie MMY3002 (n = 196) trat bei 2 Patienten (1%) ein T-Zell-Lymphom auf (0,5 Ereignisse pro 100 Personenjahre nach der Behandlung mit CARVYKTI). Bei diesen Patienten wurde am Tag 159 und am Tag 688 nach der Behandlung mit CARVYKTI ein nicht näher spezifiziertes peripheres T-Zell-Lymphom diagnostiziert. In den Tumoren wurde das CAR-Transgen nachgewiesen.
Bis zum Stichtag 27. Februar 2024 traten in der MMY4002 (mediane Nachbeobachtungsdauer von 31,8 Monaten) keine weiteren Fälle von T-Zell-Lymphomen auf, was einer kumulativen Langzeit-Inzidenzrate von 0,2 Ereignissen pro 100 Personenjahre nach der Behandlung mit CARVYKTI entspricht. Fälle von T-Zell-Lymphomen, darunter auch CAR-positive T-Zell-Lymphome, wurden in der Zeit nach der Markteinführung gemeldet.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs liegen keine Daten zu den Anzeichen oder Folgekomplikationen einer Überdosierung von CARVYKTI vor.
Eigenschaften/WirkungenATC-Code
L01XL05
Wirkungsmechanismus
CARVYKTI ist eine mit gentechnisch veränderten autologen T-Zellen durchgeführte und gegen BCMA gerichtete Immuntherapie, bei der eine Umprogrammierung der T-Zellen eines Patienten mit Hilfe eines Transgens erfolgt, das einen chimären Antigenrezeptor (Chimeric Antigen Receptor, CAR) codiert, um BCMA-exprimierende Zellen zu erkennen und zu eliminieren. BCMA wird hauptsächlich auf der Oberfläche von Zellen der B-Linie des Multiplem Myeloms sowie von B-Zellen im Spätstadium und Plasmazellen exprimiert. Das CAR-Protein in CARVYKTI besteht aus zwei gegen BCMA gerichteten Einzeldomänenantikörpern mit hoher Avidität für humanes BCMA, einer kostimulatorischen Domäne 4-1BB und einer zytoplasmatischen Signaldomäne CD3-zeta (CD3ζ). Bei Bindung an BCMA exprimierende Zellen übermittelt der CAR ein Signal, welches die Aktivierung und Expansion der T-Zellen und die Eliminierung von Zielzellen fördert.
In-vitro-Experimente mit Kokulturen zeigten, dass die durch Ciltacabtagen-Autoleucel vermittelte Zytotoxizität und die Zytokinfreisetzung (Interferon-gamma, [IFN-γ], Tumornekrosefaktor [TNF-α], Interleukin [IL]-2) BCMA-abhängig waren.
Pharmakodynamik
Nach einer Einzelinfusion von CARVYKTI geht die Expansion CARpositiver T-Zellen mit Verringerungen von löslichem BCMA im Serum, des M-Gradienten und/oder freier Leichtketten im Serum einher. Bei allen Patienten wurde nach der Infusion ein Anstieg der Konzentrationen von IL-6, IL-10, IFN-γ und IL-2-Rezeptor alpha festgestellt, der an Tag 7 bis 14 einen Höchstwert erreichte. Generell gingen die Serumkonzentrationen aller Zytokine innerhalb von 2 bis 3 Monaten nach der Infusion wieder bis auf die Anfangswerte zurück.
Immunogenität
Mithilfe eines validierten Assays zum Nachweis von Bindungsantikörpern gegen CARVYKTI wurde die Immunogenität von CARVYKTI vor der Infusion sowie zu mehreren Zeitpunkten nach der Infusion untersucht. In der Studie MMY2001 waren 19 von 97 Patienten (19,6%) positiv auf Anti-CAR-Antikörper. In der Studie MMY3002 waren 37 von 176 Patienten (21%) positiv auf Anti-CAR-Antikörper.
Es gab keine eindeutigen Hinweise darauf, dass die Anti-CAR-Antikörper die Kinetik von CARVYKTI bei der anfänglichen Expansion und Persistenz, die Wirksamkeit oder die Sicherheit beeinträchtigen.
Klinische Wirksamkeit
Studie MMY2001
MMY2001 war eine offene Studie zur Beurteilung von CARVYKTI zur Behandlung von Patienten mit rezidiviertem oder refraktärem Multiplem Myelom, die vorgängig einen Proteasom-Inhibitor, ein immunmodulatorisches Agens und einen Anti-CD38-Antikörper erhalten hatten und bei denen die Krankheit während oder nach der letzten Therapie fortgeschritten war.
Insgesamt wurde bei 113 Patienten eine Leukapherese durchgeführt. Für jeden Patienten wurde CARVYKTI hergestellt. Sechzehn Patienten wurden nicht mit CARVYKTI behandelt (n = 12 nach Leukapherese und n = 4 nach der lymphodepletierenden Chemotherapie), da entweder der Patient seine Einwilligung zurückzog (n = 5), eine Krankheitsprogression aufgetreten war (n = 2) oder der Patient verstarb (n = 9).
Von den 97 behandelten Patienten betrug der mediane Zeitraum vom Tag nach Eingang des Leukapheresematerials in der Herstellungseinrichtung bis zur Freigabe des Produkts für die Infusion 29 Tage (Bereich: 23 bis 64 Tage), und der mediane Zeitraum von der anfänglichen Leukapherese bis zur Infusion von CARVYKTI betrug 47 Tage (Bereich: 41 bis 167 Tage).
Nach der Leukapherese und vor der Infusion von CARVYKTI erhielten 73 der 97 behandelten Patienten (75%) eine Überbrückungstherapie. Die am häufigsten als Überbrückungstherapie angewendeten Wirkstoffe (≥20% der Patienten) waren Dexamethason: 62 Patienten (64%), Bortezomib: 26 Patienten (27%), Cyclophosphamid: 22 Patienten (23%) und Pomalidomid: 21 Patienten (22%).
CARVYKTI wurde als einzelne intravenöse Infusion 5 bis 7 Tage nach Beginn einer lymphodepletierenden Chemotherapie (täglich Cyclophosphamid 300 mg/m2 intravenös und täglich Fludarabin 30 mg/m2 intravenös über 3 Tage) gegeben. Siebenundneunzig Patienten erhielten CARVYKTI in einer medianen Dosis von 0,71 × 106 CAR-positiven lebensfähigen T-Zellen/kg (Bereich: 0,51 bis 0,95 × 106 Zellen/kg). Alle Patienten wurden für die Infusion von CARVYKTI und für einen Zeitraum von mindestens 10 Tagen danach stationär aufgenommen.
Von den 113 Patienten, bei denen eine Leukapherese durchgeführt wurde, waren 58% männlich, 74% waren kaukasisch und 15% Afroamerikaner. Das mediane Alter der Patienten betrug 62 Jahre (Bereich: 29 bis 78 Jahre). Die Patienten hatten im Median 5 (Bereich: 3 bis 18) vorgängige Therapielinien erhalten, und 88% der Patienten hatten vorgängig eine Transplantation autologer Stammzellen (ASCT) erhalten. Neunundneunzig Prozent der Patienten waren gegen ihre letzte vorgängige Therapielinie refraktär, und 89% waren gegen einen Proteasom-Inhibitor (PI), ein immunmodulatorisches Agens und einen Anti-CD38-Antikörper refraktär.
Von den 97 behandelten Patienten waren 59% männlich, 71% waren kaukasisch und 18% waren Schwarz oder Afroamerikaner. Das mediane Alter der Patienten betrug 61 Jahre (Bereich: 43 bis 78 Jahre). Die Patienten hatten im Median 6 (Bereich: 3 bis 18) vorgängige Therapielinien erhalten, und 90% der Patienten hatten vorgängig eine Transplantation autologer Stammzellen (ASCT) erhalten. Neunundneunzig Prozent der Patienten waren gegen ihre letzte vorgängige Therapielinie refraktär, und 88% waren gegen einen Proteasom-Inhibitor (PI), ein immunmodulatorisches Agens und einen Anti-CD38-Antikörper refraktär.
Patienten mit bekannter aktiver oder anamnestisch erfasster signifikanter Erkrankung des Zentralnervensystems (ZNS), einschliesslich eines Multiplen Myeloms mit Manifestation im ZNS, allogener Stammzelltransplantation innerhalb von 6 Monaten vor der Apherese oder laufender Behandlung mit Immunsuppressiva, einer Kreatininclearance < 40 ml/min, einer absoluten Lymphozytenkonzentration < 300/µl, einem Anstieg der Lebertransaminasen auf über das 3-Fache der oberen Normgrenze, einer Ejektionsfraktion < 45% oder mit aktiver schwerwiegender Infektion wurden von der Teilnahme an der Studie ausgeschlossen.
Die Wirksamkeitsergebnisse beruhten auf der Gesamtansprechrate, die von einem unabhängigen Bewertungsgremium nach IMWG-Kriterien beurteilt wurde (siehe Tabelle 5).
Tabelle 5: Wirksamkeitsergebnisse für Studie MMY2001
|
|
Alle behandelten Patienten (n = 97)
|
Alle Patienten mit Leukapherese (n = 113)
| |
Gesamtansprechrate (Overall Response Rate (sCRa + VGPR + PR), n (%)
|
95 (97,9)
|
95 (84,1)
| |
95%-KI (%)
|
(92,7; 99,7)
|
(76,0; 90,3)
| |
Stringentes komplettes Ansprechen (sCRa) n (%)
|
80 (82,5)
|
80 (70,8)
| |
Sehr gutes partielles Ansprechen (VGPR) n (%)
|
12 (12,4)
|
12 (10,6)
| |
Partielles Ansprechen PR) n (%)
|
3 (3,1)
|
3 (2,7)
| |
Dauer des Ansprechens (DOR)b
| |
Anzahl der Responder
DOR (Monate): Median (95%-KI):
|
95
NE (23,3; NE)
|
-
| |
Anzahl der Responder mit sCRa
DOR, wenn das beste Ansprechen sCRa ist (Monate): Median (95%-KI)
|
80
NE (28,3; NE)
|
-
| |
Anzahl der Responder mit VGPR oder besser DOR, wenn das beste Ansprechen VGPR oder besser ist (Monate): Median (95%-KI):
|
92
NE (24,4; NE)
|
-
| |
Dauer des Zeitraums bis zum Ansprechen (Monate)
| |
Anzahl der Responder
Median
Bereich
|
95
0,95
(0,9; 10,7)
|
-
| |
Dauer des Zeitraums bis zur sCRa (Monate)
| |
Anzahl der Responder mit sCRa
Median
Bereich
|
80
2,89
(0,9; 17,8)
|
-
| |
Hinweise: Basierend auf einer medianen Nachbeobachtungsdauer von 27,7 Monaten
a Bei jeder vollständigen Remission handelte es sich um ein stringentes CR
NE = not estimable (nicht abschätzbar)
b Die geschätzte DOR-Rate betrug 60,3% (95%-KI: 49,6%; 69,5%) nach 24 Monaten und 51,2% (95%-KI: 39,0%; 62,1%) nach 30 Monaten.
|
Tabelle 6: Zusammenfassung der Häufigkeit von MRD-Negativität
|
|
Alle behandelten Patienten (n = 97)
|
Alle Patienten mit Leukapherese (n = 113)
| |
Anteil der Patienten mit MRD-Negativität, n (%)
|
56 (57,7)
|
56 (49,6)
| |
95%-KI (%)
|
(47,3; 67,7)
|
(40.0, 59,1)
| |
MRD-negative Patienten mit sCR n (%)a
|
42 (43,3)
|
42 (37,2)
| |
95%-KI (%)
|
33,3; 53,7
|
(28,3; 46,8)
| |
|
Auswertbare Patienten (n = 61)
| |
Anteil der Patienten mit MRD-Negativität, n (%)
|
56 (91,8)
|
-
| |
95%-KI (%)
|
(81,9; 97,3)
|
-
| |
MRD = Minimale Resterkrankung
Hinweise: Basierend auf einer medianen Nachbeobachtungsdauer von 27.7 Monaten.
a Es wurden nur MRD-Beurteilungen (10 -5 Testschwelle) innerhalb von 3 Monaten nach Erreichen einer CR/sCR bis Tod/Progression/Anschlusstherapie (ausschliesslich) berücksichtigt. Bei jeder vollständigen Remission handelte es sich um ein stringentes CR.
|
Bei einer medianen Nachbeobachtungsdauer von 27,7 Monaten wurde das mediane progressionsfreie Überleben (Progression Free Survival, PFS) nicht erreicht (95%-KI: 24,5, nicht abschätzbar). Die PFS-Rate nach 12 Monaten (95%-KI) betrug 76,3% (66,5%, 83,6%). Die 24-Monats-PFS-Rate (95%-KI) betrug 62,7% (52,2%; 71,5%).
Bei Patienten mit sCR (bei jeder vollständigen Remission handelte es sich um ein stringentes CR) wurde das mediane PFS nicht erreicht (95%-KI: 30,1%, nicht abschätzbar), wobei die geschätzte PFS-Rate nach 12 Monaten 88,8% (95%-KI: 79,5%, 94,0%) betrug. Die 24-Monats-PFS-Rate betrug 73,5% (95%-KI: 62,3%; 81,9%).
Das mediane Gesamtüberleben (Overall Survival, OS) wurde nicht erreicht (95%-KI: nicht abschätzbar, nicht abschätzbar). Die OS-Rate nach 12 Monaten betrug 87,6% (95%-KI: 79,2%, 92,8%). Die 24-Monats-OS-Rate betrug 76,2% (95%-KI: 66,5%; 83,5%).
Die gesundheitsbezogene Lebensqualität (Health-related quality of life, HRQoL) wurde zu Beginn der Studie (n = 63) und nach der Infusion mithilfe des Fragebogens EORTC QLQ-C30 erfasst. Die adjustierte mittlere (95%-KI) Veränderung gegenüber dem Anfangsergebnis auf der Schmerz-Subskala des EORTC QLQ-C30 betrug -1,9 (-8,5; -4,6) an Tag 7, -9,9 (-16,5; -3,3) an Tag 28, -6,3 (-12,9; -0,4) an Tag 56, -9,4 (-16,3; -2,5) an Tag 78 und -10,5 (-17,3; -3,8) an Tag 100, was insgesamt auf eine Verringerung der Schmerzen nach der Infusion von CARVYKTI hindeutete. Bei 72,2% der Patienten waren hinsichtlich des Ergebnisses auf der Schmerz-Subskala an Tag 100 klinisch bedeutsame Verbesserungen festzustellen, bei 53,8% war dies hinsichtlich des Ergebnisses auf der Fatigue-Subskala der Fall, bei 57,7% hinsichtlich des Ergebnisses auf der Subskala für die körperliche Funktion und bei 53,7% hinsichtlich des Ergebnisses auf der Subskala für den Gesundheitszustand insgesamt.
Studie MMY3002
MMY3002 ist eine randomisierte, offene, multizentrische Phase-3-Studie zur Bewertung der Wirksamkeit von CARVYKTI für die Behandlung von Patienten mit rezidiviertem und Lenalidomid-refraktärem multiplem Myelom, die zuvor mindestens eine vorherige Therapielinie mit einem Proteasom-Inhibitor und einem immunmodulatorischen Wirkstoff erhalten haben. Insgesamt wurden 419 Patienten randomisiert und erhielten entweder eine Abfolge von Leukapherese, Überbrückungstherapie, Lymphozytendepletion und CARVYKTI (n = 208) oder die Standardbehandlung, die nach Ermessen des Arztes entweder Daratumumab, Pomalidomid und Dexamethason oder Bortezomib, Pomalidomid und Dexamethason (n = 211) beinhaltete.
Patienten mit bekannter aktiver oder anamnestisch erfasster Beteiligung des zentralen Nervensystems, Patienten mit klinischen Anzeichen einer Meningealbeteiligung des multiplen Myeloms und Patienten mit Morbus Parkinson oder einer anderen neurodegenerativen Erkrankung in der Vorgeschichte wurden von der Studie ausgeschlossen.
Von den 419 Patienten, die randomisiert wurden (208 für CARVYKTI und 211 für die Standardbehandlung), waren 57% männlich, 75% waren kaukasisch, 3% waren Schwarz oder afroamerikanisch und 7% waren hispanisch oder lateinamerikanisch. Das mediane Alter der Patienten betrug 61 Jahre (Bereich: 27 bis 80 Jahre). Die Patienten hatten im Median 2 vorgängige Therapielinien (Bereich: 1 bis 3) erhalten, und 85% der Patienten hatten vorgängig eine Transplantation autologer Stammzellen (ASCT) erhalten. Neunundneunzig Prozent der Patienten waren gegen ihre letzte vorgängige Therapielinie refraktär. Achtundvierzig Prozent waren gegen einen Proteasom-Inhibitor (PI) und 100% gegen ein immunmodulatorisches Agens refraktär.
Bei allen 208 Patienten, die dem CARVYKTI-Arm zugeteilt wurden, wurde eine Leukapherese durchgeführt. Nach der Leukapherese und vor der Verabreichung von CARVYKTI erhielten alle 208 randomisierten Patienten die gemäss Studienprotokoll vorgesehene Überbrückungstherapie (Standardbehandlung). Von diesen 208 Patienten wurden 12 aufgrund von Krankheitsprogression (n = 10) oder Tod (n = 2) nicht mit CARVYKTI behandelt; bei 20 Patienten trat vor der Infusion mit CARVYKTI eine Krankheitsprogression auf, sie konnten CARVYKTI jedoch als weiterführende Therapie erhalten.
Bei den 176 Patienten, die CARVYKTI als Studienbehandlung erhielten, betrug der mediane Zeitraum vom Tag nach Eingang des Leukapheresematerials in der Herstellungseinrichtung bis zur Freigabe des Produkts für die Infusion 44 Tage (Bereich: 25 bis 127 Tage) und der mediane Zeitraum von der anfänglichen Leukapherese bis zur Infusion von CARVYKTI betrug 79 Tage (Bereich: 45 bis 246 Tage).
CARVYKTI wurde als einmalige intravenöse Infusion 5 bis 7 Tage nach Beginn einer lymphodepletierenden Chemotherapie (täglich Cyclophosphamid 300 mg/m2 intravenös und täglich Fludarabin 30 mg/m2 intravenös über 3 Tage) mit einer medianen Dosis von 0,71 × 106 CAR-positiven lebensfähigen T-Zellen/kg (Bereich: 0,39 bis 1,07 × 106 Zellen/kg) verabreicht.
Der primäre Messwert für die Wirksamkeit war das progressionsfreie Überleben (PFS), das anhand des Intent-To-Treat-Analysesets analysiert wurde (siehe Tabelle 7 und Abbildung 1). Nach einer medianen Nachbeobachtungszeit von 15,9 Monaten betrug das mediane PFS 11,8 Monate (95%-KI: 9,7; 13,8) im Vergleichsarm und war nicht abschätzbar (95%-KI: 22,8, nicht abschätzbar) im CARVYKTI-Arm (Hazard Ratio: 0,26 [95%-KI: 0,18; 0,38]). Die geschätzte PFS-Rate nach 12 Monaten betrug 75,9% (95%-KI: 69,4%; 81,1%) im CARVYKTI-Arm und 48,6% (95%-KI: 41,5%; 55,3%) im Vergleichsarm. Im CARVYKTI-Arm wurde die geschätzte mediane Ansprechdauer (DOR) nicht erreicht. Im Vergleichsarm betrug die geschätzte mediane Ansprechdauer 16,6 Monate (95%-KI: 12,9; nicht abschätzbar).
Tabelle 7: Wirksamkeitsergebnisse für Studie MMY3002 (Intent-To-Treat-Analyseset)
|
|
CARVYKTI (n = 208)
|
Vergleichsbehandlung
(n = 211)
| |
Progressionsfreies Überlebena
|
|
| |
Anzahl der Ereignisse, n (%)
|
65 (31,3)
|
122 (57,8)
| |
Median, Monate [95%-KI]b
|
NA [22,8; NE]
|
11,8 [9,7; 13,8]
| |
Hazard Ratio [95%-KI]c
|
0,26 [0,18; 0,38]
| |
p-Wertd
|
< 0,0001
| |
Rate eines vollständigen Ansprechens oder bessera, % [95%-KI]
|
73,1 [66,5; 79,0]
|
21,8 [16,4; 28,0]
| |
p-Werte
|
< 0,0001
| |
Gesamtansprechrate (ORR)a, % [95%-KI]
|
84,6 [79,0; 89,2]
|
67,3 [60,5; 73,6]
| |
p-Werte
|
< 0,0001
| |
MRD-Gesamtnegativitätsrate, % [95%-KI]
|
60,6 [53,6; 67,3]
|
15,6 [11,0; 21,3]
| |
p-Wertf
|
< 0,0001
| |
Gesamtüberleben (OS)
|
| |
Anzahl der Ereignisse, n (%)
|
39 (18,8)
|
47 (22,3)
| |
Median, Monate [95%-KI]b
|
NE [NE, NE]
|
26,7 [22,5, NE]
| |
Hazard Ratio [95%-KI]g
|
0,78 [0,50; 1,20]
| |
p-Werth
|
0,2551
|
NE = not estimable (nicht abschätzbar); KI = Konfidenzintervall; MRD = Minimale Resterkrankung
Hinweis: Basierend auf einer medianen Nachbeobachtungszeit von 15,9 Monaten
a Gemäss dem Konsens der International Myeloma Working Group (IMWG), bewertet mittels eines computergestützten Algorithmus
b Kaplan-Meier-Schätzung
c Basierend auf einem stratifizierten Cox-Proportional-Hazard-Modell, das ausschliesslich PFS-Ereignisse berücksichtigt, die mehr als 8 Wochen nach der Randomisierung auftraten. Eine Hazard Ratio < 1 gibt einen Vorteil für den CARVYKTI-Arm an. Bei allen stratifizierten Analysen erfolgte die Stratifizierung auf Grundlage der Entscheidung des Prüfarztes (PVd oder DPd), des ISS-Stagings (I, II, III) und der Anzahl der vorherigen Therapielinien (1 vs. 2 oder 3), die randomisiert wurden.
d Stratifizierter gewichteter Log-Rank-Test (Gewichtung von 0 in der Log-Rank-Statistik bei den ersten 8 Wochen nach der Randomisierung und 1 danach)
e Stratifizierter Cochran-Mantel-Haenszel-Chi-Quadrat-Test
f Exakter Test nach Fisher
g Basierend auf einem stratifizierten Cox-Proportional-Hazard-Modell. Eine Hazard Ratio < 1 gibt einen Vorteil für den CARVYKTI-Arm an.
h Stratifizierter Log-Rank-Test
Abbildung 1: Kaplan-Meier-Kurve des PFS in Studie MMY3002 (Intent-To-Treat-Analyseset)
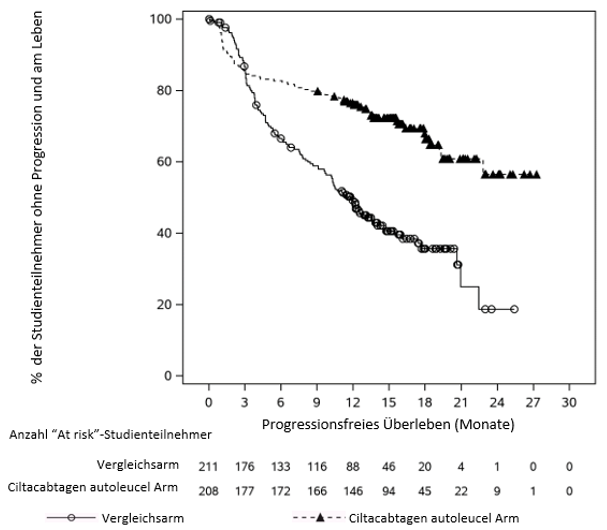
Hinweis: Das Intent-to-treat-Analyseset besteht aus Patienten, die in die Studie randomisiert wurden.
Bei den 176 Patienten, die CARVYKTI als Studienbehandlung erhielten, war das mediane PFS nicht abschätzbar (95%-KI: nicht abschätzbar, nicht abschätzbar), wobei die 12-Monats-PFS-Rate 89,7% betrug. Die ORR bei diesen Patienten betrug 99,4% (95%-KI: 96,9%; 100,0%). Die CR/sCR-Rate betrug 86,4% (95%-KI: 80,4%; 91,1%).Bei den 20 Patienten, bei denen es zu einer frühzeitigen und schnellen Krankheitsprogression kam und die CARVYKTI als weiterführende Therapie erhielten, betrug das mediane PFS nach der Infusion von CARVYKTI 7,39 Monate (95%-KI: 1,61; nicht abschätzbar) mit einer 12-Monats-PFS-Rate von 39,4% (95%-KI: 18,6; 59,7), einer ORR von 65% (95%-KI: 40,8%; 84,6%) und einer CR/sCR von 40% (95%-KI: 19,1%; 63,9%).
Bei den 208 Patienten, die für die Behandlung mit CARVYKTI randomisiert wurden, verzögerte sich die mediane Zeit bis zur Verschlechterung der Symptome des multiplen Myeloms (23,7 Monate) im Vergleich zu den 211 Patienten, die für die Standardbehandlung randomisiert wurden (18,9 Monate). Dies wurde mittels MySIm-Q-Fragebogen (Multiple Myeloma Symptom and Impact Questionnaire) gemessen.
PharmakokinetikDie Pharmakokinetik (PK) von CARVYKTI wurde in der Studie MMY2001 bei 97 erwachsenen Patienten mit rezidiviertem und refraktärem Multiplem Myelom untersucht, die eine einzelne CARVYKTI-Infusion mit einer medianen Dosis von 0,71 × 106 CAR-positiven lebensfähigen T-Zellen/kg (Bereich: 0,51 × 106 bis 0,95 × 106 Zellen/kg) erhalten hatten.
Nach einer einzelnen Infusion CARVYKTI war eine initiale Expansionsphase, gefolgt von einer zunächst raschen und dann langsameren Abnahme festzustellen. Es lag jedoch eine hohe Variabilität zwischen den einzelnen Patienten vor.
Tabelle 8: Pharmakokinetische Parameter von CARVYKTI bei Patienten mit Multiplem Myelom
|
Parameter
|
Zusammenfassende Statistik
|
Patienten (n = 97)
| |
Cmax (Kopien/µg genomische DNA)
|
Mittelwert (SD), n
|
48'692 (27'174), 97
| |
tmax (Tag)
|
Median (Bereich), n
|
12,71 (8,73 - 329,77), 97
| |
AUCT0-28 (Kopien*Tag/µg genomische DNA)
|
Mittelwert (SD), n
|
504'496 (385'380), 97
| |
AUCT0-letzte (Kopien*Tag/µg genomische DNA)
|
Mittelwert (SD), n
|
1'098'030 (1'387'010), 97
| |
AUCM0-6 (Kopien*Tag/µg genomische DNA)
|
Mittelwert (SD), n
|
1'033'373 (1'355'394), 96
| |
t½ (Tag)
|
Mittelwert (SD), n
|
23,5 (24,2), 42
| |
tletzte (Tag)
|
Median (Bereich), n
|
125,90 (20,04 – 702,12), 97
|
Nach der Expansion der Zellen in CARVYKTI wurde bei allen Patienten eine Phase mit persistenten Konzentrationen festgestellt. Zum Zeitpunkt der Analyse (n = 65) dauerte es im Median ungefähr 100 Tage (Bereich: 28–365 Tage) nach der Infusion, bis die Konzentration des CAR-Transgens im peripheren Blut bis auf die Basiskonzentration vor Dosisgabe zurückgegangen war. Die Pharmakokinetik von CARVYKTI wurde ebenfalls in der Studie MMY3002 bei 176 erwachsenen Patienten mit Lenalidomid-refraktärem multiplem Myelom untersucht und entsprach im Allgemeinen den Ergebnissen der Studie MMY2001.
CARVYKTI war im Knochenmark nachweisbar, was auf eine Verteilung von CARVYKTI aus dem Blutkreislauf in das Knochenmark hindeutet. Wie im Blutkreislauf ging auch im Knochenmark die Konzentration des Transgens mit der Zeit zurück und wies eine hohe Variabilität zwischen den einzelnen Patienten auf.
Manche Patienten benötigten zur Behandlung eines CRS die Gabe von Tocilizumab, Kortikosteroiden und Anakinra. Die Expansion der Zellen in CARVYKTI setzt sich nach Gabe von Tocilizumab fort. In der Studie MMY2001 waren bei Patienten unter Behandlung mit Tocilizumab (n = 68) die Werte für Cmax und AUCT0-28 der Zellen in CARVYKTI um 81% bzw. 72% höher als bei Patienten (n = 29), die Tocilizumab nicht erhielten. Bei Patienten unter Behandlung mit Kortikosteroiden (n = 28) waren die Werte für Cmax und AUCT0-28 um 75% bzw. 112% höher als bei Patienten (n = 69), die keine Kortikosteroide erhielten. Zudem waren die Werte für Cmax und AUCT0-28 bei Patienten unter Behandlung mit Anakinra (n = 20) um 41% bzw. 72% höher als bei Patienten (n = 77), die Anakinra nicht erhielten. Die Ergebnisse zu Tocilizumab und Kortikosteroiden in Studie MMY3002 entsprachen denen aus Studie MMY2001.
Absorption
NA
Distribution
NA
Metabolismus
NA
Elimination
NA
Kinetik spezieller Patientengruppen
Das Alter (Bereich: 27 bis 78 Jahre) einschliesslich Patienten im Alter von < 65 Jahren (n = 215; 64,8%), 65–75 Jahren (n = 105; 31,6%) und > 75 Jahren (n = 12; 3,6%) hatte keinen Einfluss auf die Pharmakokinetik von CARVYKTI (Cmax und AUCT0-28).
Auch das Geschlecht, das Körpergewicht und die ethnische Zugehörigkeit hatten keinen Einfluss auf die Pharmakokinetik von CARVYKTI (Cmax und AUCT0-28).
Leberfunktionsstörungen
Es wurden keine Studien zu CARVYKTI bei Patienten mit Leberfunktionsstörungen durchgeführt. Bei Patienten mit leichter Leberfunktionsstörung [(Gesamtbilirubin ≤ obere Normgrenze [ULN] und Aspartataminotransferase > ULN) oder (ULN < Gesamtbilirubin ≤1,5-fache ULN)] und Patienten mit normaler Leberfunktion wurden ähnliche Werte für die Cmax und AUCT0-28 für CARVYKTI erhalten.
Nierenfunktionsstörungen
Es wurden keine Studien zu CARVYKTI bei Patienten mit Nierenfunktionsstörungen durchgeführt. Patienten mit leichter Nierenfunktionsstörung (60 ml/min ≤ Kreatininclearance [CRCL] < 90 ml/min),mittelschwere Nierenfunktionsstörung (30 ml/min ≤ CRCL < 60 ml/min) und normaler Nierenfunktion (CRCL ≥90 ml/min) zeigten ähnliche Werte für die Cmax und AUCT0-28 von CARVYKTI.
Präklinische DatenDie nicht-klinische Bewertung der Sicherheit von CARVYKTI bestätigte die Zielspezifität der T-Zellen in CARVYKTI für BCMA.
Kanzerogenität
Es wurden keine Studien zur Erfassung von Genotoxizität oder Kanzerogenität durchgeführt.
Das Risiko einer bei der Herstellung von Ciltacabtagen-Autoleucel nach Transduktion autologer humaner T-Zellen mit einem integrierenden lentiviralen Vektor (LV) auftretenden Insertionsmutagenese wurde durch Bewertung des Integrationsmusters des Vektors in CARVYKTI vor der Infusion untersucht. Diese Analyse genomischer Insertionsstellen wurde mit CARVYKTI-Produkten von 7 Patienten und 3 gesunden Probanden durchgeführt. Es gab keine Hinweise auf eine bevorzugte Integration in der Nähe von wichtigen Genen.
Das Potenzial für eine verstärkte Proliferation der T-Zellen in CARVYKTI wurde in einem In-vitro-Assay auf zytokinunabhängiges Wachstum untersucht. Die Integration von LV in das Genom primärer T-Zellen während der Transduktion führte in Abwesenheit von IL-2 (reguliert das Wachstum und begünstigt das Überleben von T-Zellen) nicht zu einem zytokinunabhängigen unkontrollierten Wachstum der T-Zellen in CARVYKTI.
Reproduktionstoxizität
Es wurden keine tierexperimentellen Studien zur Erfassung einer Reproduktions- und Entwicklungstoxizität von CARVYKTI durchgeführt.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien vorliegen, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Dieses Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei ≤ -120° C in der Dampfphase von Flüssigstickstoff aufbewahren und transportieren, z.B. in einem Gefäss zur Tieftemperaturlagerung.
In der Original-Verpackung, welche die Schutzkassette mit dem Infusionsbeutel enthält, aufbewahren.
Nach dem Auftauen sollte das Produkt sofort angewendet werden, und die Infusion sollte innerhalb von 2,5 Stunden bei Raum-/Umgebungstemperatur (20°C bis 25°C) durchgeführt und abgeschlossen werden. Das aufgetaute Produkt darf nicht geschüttelt, und nicht wieder eingefroren oder in den Kühlschrank gelegt werden.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Nicht bestrahlen, da dies zur Inaktivierung des Produkts führen kann.
Innerhalb der Behandlungseinrichtung sollte CARVYKTI in geschlossenen, bruch- und auslaufsicheren Behältnissen transportiert werden.
CARVYKTI enthält genetisch veränderte menschliche Blutzellen mit einem replikationsinkompetenten lentiviralen Vektor. Nicht verwendetes Arzneimittel und alle Materialien, die mit CARVYKTI in Kontakt gekommen sind (Fest- und Flüssigabfall), sind im Einklang mit allgemeinen Vorsichtsmassnahmen und den lokal geltenden Bestimmungen zu handhaben und zu entsorgen, um eine potenzielle Übertragung von Infektionskrankheiten zu vermeiden.
Zulassungsnummer67956 (Swissmedic)
PackungenInfusionsbeutel aus Ethylenvinylacetat (EVA) mit einem versiegelten Zugabeschlauch und zwei Spike-Ports, die entweder 30 oder 70 ml Zelldispersion enthalten [A].
Jeder Infusionsbeutel ist einzeln in einer Aluminiumkryokassette verpackt.
|
Komponente
|
Obligatorische Hinweise zum Inhalt und zur Aufbewahrung
| |
Kassette
|
Nicht bestrahlen.
KEINEN Leukozytendepletionsfilter verwenden.
Zur intravenösen Anwendung.
Nur für die autologe Anwendung.
Identität des geplanten Empfängers und des Produkts genau überprüfen.
Lagerungshinweise:
Bei ≤ -120 °C in der Dampfphase von Flüssigstickstoff aufbewahren und transportieren.
Das Produkt erst unmittelbar vor der Anwendung auftauen.
Nicht schütteln.
Nicht erneut einfrieren.
Nicht in den Kühlschrank legen.
| |
Infusionsbeutel
|
Nur für die intravenöse Anwendung
Nur für die autologe Anwendung
Identität des Patienten überprüfen
|
ZulassungsinhaberinJanssen-Cilag AG, Zug
Stand der InformationFebruar 2025
|

