Eigenschaften/WirkungenATC-Code
ATC-Code: V03AX04
Wirkungsmechanismus
Difelikefalin ist ein selektiver Kappa-Opioidrezeptor-Agonist mit geringer ZNS-Gängigkeit.
Opioidrezeptoren sind dafür bekannt, dass sie Juckreizsignale und den Entzündungsprozess modulieren, wobei eine Aktivierung der Kappa-Opioidrezeptoren den Juckreiz reduziert und immunmodulatorische Effekte auslöst.
Pharmakodynamik
Das Expositions-Wirkungs-Verhältnis von Difelikefalin und der zeitliche Verlauf des pharmakodynamischen Ansprechens sind nicht bekannt.
Einfluss auf das Elektrokardiogramm
Bei einer Dosierung mit dem 6fachen der empfohlenen Dosis kommt es unter Difelikefalin zu keiner klinisch signifikanten Verlängerung des QTc-Intervalls.
Klinische Wirksamkeit
Placebo-Kontrollierte Studien
In zwei zulassungsrelevanten klinischen Phase III-Studien mit ähnlichem doppelblinden, randomisierten, Placebokontrollierten Design (KALM 1 und KALM 2) erhielten chronisch nierenkranke Hämodialyse-Patienten mit mittelschwerem bis schwerem Pruritus 12 Wochen lang entweder das Placebo oder 0,5 Mikrogramm/kg Difelikefalin intravenös 3-mal wöchentlich nach der Hämodialyse. Bei Patienten, bei denen in einer Woche eine zusätzliche Dialyse durchgeführt wurde, waren maximal 4 Dosen erlaubt. An diesem doppelblinden Behandlungsabschnitt schloss sich eine 52-wöchige offene Verlängerungsstudie mit ausschliesslich aktiver Behandlung an. Der primäre Endpunkt in beiden Studien war der Prozentsatz der Patienten, die nach 12 Wochen eine Reduktion um mindestens 3 Punkte auf der Worst Itching Numerical Rating Scale (Die WI-NRS-Werte liegen zwischen 0 und 10, wobei höhere Werte für eine stärkere Intensität des Juckreizes stehen) gegenüber dem Ausgangswert erreichten. Die wichtigsten sekundären Endpunkte, die in beiden Studien übereinstimmten, waren der Prozentsatz der Patienten mit einer Verbesserung des WI-NRS um mindestens 4 Punkten nach 12 Wochen und die Veränderungen des Juckreizschweregrads und der juckreizbezogenen Lebensqualität (QoL), gemessen anhand des Gesamt-Skindex-10 und des 5-D-Pruritus-Werts. Die wichtigsten Einschlusskriterien waren chronische Nierenerkrankung mit dreimal wöchentlicher Hämodialyse seit mindestens 3 Monaten, mittelschwerer bis schwerer Juckreiz (WI-NRS-Baseline >4) und adäquate Hämodialyse. Die wichtigsten Ausschlusskriterien waren Juckreiz anderer Ursache als eine chronische Nierenerkrankung oder damit verbundener Komplikationen, Juckreiz an den Handinnenflächen und Juckreiz ausschliesslich während der Hämodialysesitzungen.
In die kombinierten Studien wurden 851 Patienten aufgenommen. Das Durchschnittsalter betrug 59 Jahre, 33.1% waren 65 Jahre oder älter, 60% der Patienten waren männlich. Die Krankheitsmerkmale zu Beginn der Studie, wie z. B. die Anwendung von Arzneimitteln zur Linderung von Pruritus, die Zeit seit der Diagnose der chronischen Nierenerkrankung und die Dauer des Pruritus, waren in den Armen mit aktiver Behandlung und dem Placebo vergleichbar. Die mittlere WI-NRS-Baseline lag sowohl in den Difelikefalin, als auch in den Placebo-Armen bei 7,18; die mittlere WI-NRS-Baseline lag bei 7,13 (Bereich 4,2 bis 10) in der Difelikefalin-Gruppe und bei 7,13 (Bereich 4,1 bis 10) in der Placebo-Gruppe. Insgesamt hatten 38% der Patienten zuvor Arzneimittel zur Behandlung von Pruritus angewendet. In allen Studien verbesserte Difelikefalin signifikant den Schweregrad des Juckreizes und die juckreizbezogene Lebensqualität über 12 Wochen, wie aus der Tabelle 2 hervorgeht.
Tabelle 2: Zusammenfassung der primären und wichtigsten sekundären Ergebnisse der KALM-1 und KALM-2 und der gepoolten Datenbank nach Woche 12
|
Endpunkt am
Ende von Woche 12
|
KALM-1 (n = 378)
|
KALM-2 (n = 473)
| |
Difelikefalin
(n = 189)
|
Placebo
(n = 189)
|
Difelikefalin
(n = 237)
|
Placebo
(n = 236)
| |
Primärer Endpunkt
|
|
|
|
| |
WI-NRS
|
|
|
|
| |
Patienten mit einer Verbesserung um ≥ 3 Punkte (%)
|
51,0%
(p < 0,001)
|
27,6%
|
54,0%
(p = 0,02)
|
42,2%
| |
Sekundärer Endpunkt
|
|
|
|
| |
WI-NRS
Patienten mit einer Verbesserung um ≥ 4 Punkte (%)
|
38,9%
(p < 0,001)
|
18,0%
|
41,2%
(p = 0,01)
|
28,4%
| |
Skindex-10
Veränderung ab Baseline
[Punkte]
|
-17,2
(p < 0,001)
|
-12,0
|
-16,6
(p = 0,171)
|
-14,8
| |
5-D-Pruritus
Veränderung ab Baseline
[Punkte]
|
-5,0
(p < 0,001)
|
-3,7
|
-4,9
(p = 0,002)
|
-3,8
|
Abbildung 1 zeigt den mittleren Prozentsatz von KALM-1 und KALM-2 mit einer ≥ 3-Punkte-Verbesserung gegenüber dem Ausgangswert im WI-NRS-Score nach Studienwoche. Basierend auf Odds Ratios wurden statistisch signifikante Verbesserungen zugunsten der Difelikefalin-Gruppe in Woche 3 in KALM-1 und in Woche 2 in KALM-2 beobachtet, die sich in beiden Studien in jeder folgenden Woche bis Woche 12 fortsetzen.
Abbildung 1: Prozentsatz der Patienten mit ≥ 3-Punkte-Verbesserung in Bezug auf den WI-NRS-Score nach Woche in KALM-1 und KALM-2 (ITT-Population)
KALM-1
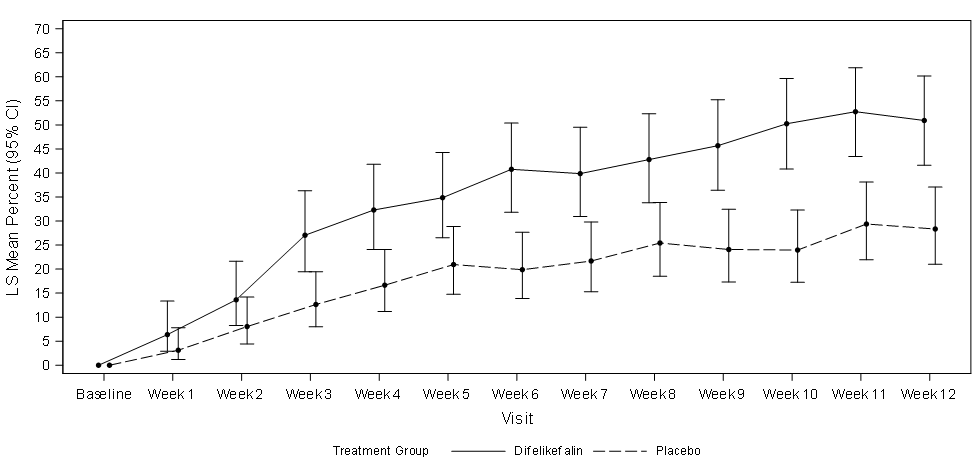
CI = confidence interval (Konfidenzintervall); ITT = intent to treat; LS = least squares (Methode der kleinsten Quadrate, MKQ); WI-NRS = Worst Itching-Numerical Rating Scale (Numerische Rating-Skala des schlimmsten Juckreizes)
KALM-2
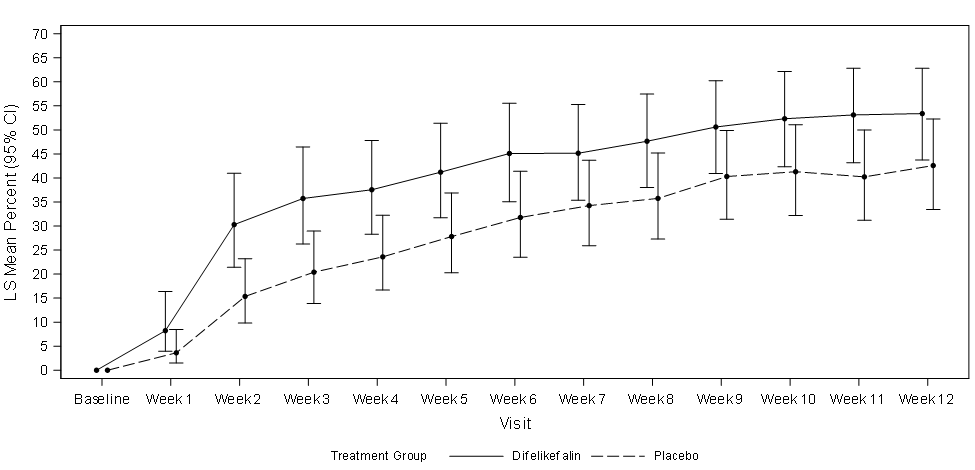
CI = confidence interval (Konfidenzintervall); ITT = intent to treat; LS = least squares (Methode der kleinsten Quadrate, MKQ); WI-NRS = Worst Itching-Numerical Rating Scale (Numerische Rating-Skala des schlimmsten Juckreizes)
Offene Verlängerungsstudien
Bei Patienten, die am Ende des doppelblinden Behandlungszeitraums von Placebo auf Difelikefalin wechselten, wurde nach einem Behandlungszeitraum von 4 Wochen eine Verbesserung auf der 5-D-Pruritus-Skala beobachtet, mit ähnlichem LS-Mittelwert (SE) der Veränderung ab Baseline wie bei Patienten, die ab Studienbeginn Difelikefalin erhielten: -6,0 (0,22) vs. -5,7 (0,23). Die Verbesserung auf der 5-D-Pruritus-Skala wurde in beiden Behandlungsgruppen über den 52wöchigen Behandlungszeitraum aufrechterhalten.
|


