Eigenschaften/WirkungenATC-Code
A10BX16
Wirkungsmechanismus
Diabetes mellitus Typ 2 und chronische Gewichtsregulierung
Tirzepatid ist ein langwirksamer GIP- und GLP-1-Rezeptor-Agonist. Es besteht aus einer Aminosäurekette und einer C20-Fett-di-Säureeinheit, die die Albuminbindung ermöglicht und die Halbwertszeit verlängert.
Tirzepatid bindet hochselektiv an humane GIP- und GLP-1-Rezeptoren und hat eine hohe Affinität zu GIP- und GLP-1-Rezeptoren. Die Aktivität von Tirzepatid am GIP-Rezeptor ist ähnlich dem nativen GIP-Hormon. Die Aktivität von Tirzepatid am GLP-1-Rezeptor ist niedriger im Vergleich zu nativem GLP-1-Hormon.
Tirzepatid verbessert die Insulinsensitivität.
Tirzepatid verringert die Nahrungsaufnahme.
Diabetes mellitus Typ 2
Tirzepatid erhöht die Glucoseempfindlichkeit der β-Zellen. Es verbessert die erste und zweite Phase der Insulinausschüttung und senkt die Plasmaglukagonkonzentrationen, beides in Abhängigkeit der Glucosekonzentration.Tirzepatid verzögert die Magenentleerung, diese Wirkung lässt mit der Zeit nach.
Chronische Gewichtsregulierung
GIP- und GLP-1-Rezeptoren wurden beide in Gehirnregionen gefunden, die wichtig für die Appetitregulierung sind.
Tirzepatid reguliert den Appetit und verringert die Nahrungsaufnahme. Tirzepatid senkt das Körpergewicht und die Körperfettmasse.
Tierstudien haben gezeigt, dass Tirzepatid die Fettverwertung moduliert.
Pharmakodynamik
Glykämische Kontrolle
Tirzepatid verbessert die glykämische Kontrolle durch Senkung der nüchtern und postprandial gemessenen Glucosekonzentration bei Patienten mit Diabetes mellitus Typ 2 über verschiedene Mechanismen.
Nüchternblutzuckerspiegel
Die Behandlung mit Tirzepatid führte zu signifikanten Senkungen des Nüchternblutzuckerspiegels im Vergleich zum Ausgangswert (die Differenz zwischen dem Ausgangswert und Endwert betrug -2.4 mmol/L bis -3.8 mmol/L). Ab einem Zeitraum von zwei Wochen zeigten sich signifikante Senkungen des Nüchternblutzuckerspiegels im Vergleich zum Ausgangswert. Die Verbesserung des Nüchternblutzuckerspiegels setzte sich während der längsten Studiendauer von 104 Wochen fort.
Postprandialer Blutzuckerspiegel
Die Behandlung mit Tirzepatid führte zu signifikanten Senkungen des durchschnittlichen postprandialen Blutzuckerspielgels 2 Stunden nach der Verabreichung (Durchschnitt der drei Mahlzeiten pro Tag), im Vergleich zum Ausgangswert (die Differenz zwischen dem Ausgangswert und Endwert betrug -3.35 mmol/L bis -4.85 mmol/L)
Insulinsekretion
In einer hyperglykämischen Clamp-Studie bei Patienten mit Diabetes mellitus Typ 2 wurde die Insulinsekretion unter Tirzepatid mit Placebo und dem selektiven GLP-1-Rezeptoragonist Semaglutide 1 mg verglichen. Tirzepatid 15 mg verbesserte die Rate für die erste und zweite Phase der Insulinsekretion um 466% und 302% gegenüber dem Ausgangswert. Unter Placebo veränderte sich die Rate für die erste und zweite Phase der Insulinsekretion nicht, und unter Semaglutide 1 mg stiegen die Raten um 298% bzw. 223%.
Insulinsensitivität
Tirzepatid 15 mg verbesserte die Insulinempfindlichkeit des gesamten Körpers um 63%, gemessen anhand des M-Wert, ein Mass für die Glucoseaufnahme in das Gewebe unter Verwendung eines hyperinsulinämischen euglykämischen Clamp. Der M-Wert blieb unter Placebo unverändert und erhöhte sich unter Semaglutide 1 mg um 35%.
Tirzepatid senkt das Körpergewicht bei Patienten mit Adipositas und Übergewicht und bei Patienten mit Diabetes mellitus Typ 2 (unabhängig vom Körpergewicht), was zur Verbesserung der Insulinsensitivität beitragen kann. Die reduzierte Nahrungsaufnahme unter Tirzepatid trägt zur Gewichtsabnahme bei. Die Gewichtsabnahme ist überwiegend auf eine reduzierte Fettmasse zurückzuführen.
Glukagon-Konzentration
Tirzepatid reduzierte die nüchtern und postprandial gemessenen Glukagonkonzentrationen. Tirzepatid 15 mg reduzierte die nüchtern gemessene Glukagonkonzentration um 28% und die AUC von Glucagon nach einer gemischten Mahlzeit um 43%, verglichen mit keiner Veränderung unter Placebo und einer Abnahme des nüchtern gemessenen Glukagons unter Semaglutide 1 mg um 22% und der AUC von Glukagon um 29%.
Magenentleerung
Tirzepatid verzögert die Magenentleerung, dies kann die Glucoseabsorption nach einer Mahlzeit verlangsamen und zu einer günstigen Wirkung auf die postprandiale Glykämie führen. Tirzepatid verlangsamt die Glucoseabsorption nach einer Mahlzeit und reduziert dabei die postprandialen Glucosekonzentrationen. Die Verzögerung ist nach der ersten Anwendung am grössten; diese Wirkung lässt mit der Zeit nach. Die Reduktion der postprandialen Glucosekonzentrationen war bei Menschen mit Diabetes mellitus Typ 2 deutlicher als bei Menschen mit Adipositas oder Übergewicht, ohne Diabetes mellitus Typ 2.
Pankreasenzyme
Diabetes mellitus Typ 2
In den placebokontrollierten Studien Phase 3 führte die Behandlung mit Tirzepatid zu einem mittleren Anstieg der Pankreas-Amylase um 33% bis 38% und der Lipase um 31% bis 42% gegenüber dem Ausgangswert. Patienten unter Placebo zeigten einen Anstieg der Amylase um 4% gegenüber dem Ausgangswert und es wurden keine Veränderungen der Lipase beobachtet. Eine alleinige Erhöhung der Pankreasenzyme ohne weitere Symptome einer akuten Pankreatitis sagt eine akute Pankreatitis nicht voraus.
Chronische Gewichtsregulierung
Die Behandlung mit Tirzepatid führte zu einem mittleren Anstieg der Pankreas-Amylase von 20% bis 25% und der Lipase von 28% bis 35% gegenüber dem Ausgangswert.
Kardiale Elektrophysiologie (QTc Intervalle)
Bei einer Dosierung von bis zu 15 mg führt Tirzepatid nicht zu einer Verlängerung der QTc-Intervalle.
Klinische Wirksamkeit
Diabetes mellitus Typ 2
Glykämische Kontrolle und Körpergewicht
Die Sicherheit und Wirksamkeit von Tirzepatid wurden in fünf globalen, randomisierten, kontrollierten Phase 3 Studien (SURPASS 1-5) untersucht, welche insgesamt 6'263 Patienten mit Typ 2 Diabetes einschlossen, von denen 4'199 mit Tirzepatid behandelt wurden. Primärer Endpunkt für den Nachweis der glykämischen Wirksamkeit war die Änderung (Senkung) des HbA1c. Massgebliche Sekundärendpunkte waren die Änderung (Senkung) des Körpergewichts und der Nüchtern-Serumglucose (fasting serum glucose, FSG) sowie der Anteil der Patienten, die den Zielwert für den HbA1c erreichten (Responderrate). Alle Studien untersuchten Tirzepatid 5, 10 und 15 mg, wobei folgendes Titrationsschema angewendet wurde. Die Initialdosis betrug 2.5 mg pro Woche und konnte jeweils nach 4 Wochen um 2.5 mg erhöht werden, bis zum Erreichen der zugeordneten Zieldosis (5, 10 oder 15 mg).
Die Behandlung mit Tirzepatid bewirkte in allen Studien eine gegenüber dem Vergleichsarm (Placebo, Semaglutide, Insulin degludec oder Insulin glargin) überlegene Senkung des HbA1c und des Körpergewichts über einen Behandlungszeitraum von 40 – 104 Wochen. Die Ergebnisse der einzelnen Studien werden im Folgenden basierend auf einer modifizierten Intent-to-Treat (mITT) Population (alle randomisierten Patienten, welche ≥1 Dosis der Studienmedikation erhielten, ausgenommen solche, die die Behandlung aufgrund eines irrtümlichen Einschlusses beendeten) detailliert beschrieben. Zur Schätzung der Wirksamkeit wurde ein gemischtes Modell für wiederholte Messungen verwendet.
SURPASS 1 – Monotherapie
In einer über 40 Wochen durchgeführten, doppelblinden, placebokontrollierten Studie erhielten 478 Patienten (mittleres Alter zu Studienbeginn ~54 Jahre) mit einer unter Diät und Bewegung unzureichenden glykämischen Kontrolle (mittlerer HbA1c zu Studienbeginn ~7.94%) randomisiert Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich oder Placebo. Die mittlere Diabetesdauer der Patienten zu Studienbeginn betrug ca. 4.7 Jahre.
Tabelle 1. SURPASS 1: Ergebnisse in Woche 40
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Placebo
| |
mITT Population (n)
|
121
|
121
|
120
|
113
| |
HbA1c (%)
|
Ausgangswert
(Mittel)
|
7.97
|
7.88
|
7.88
|
8.08
| |
|
Veränderung gegenüber Ausgangswert
|
-1.87##
|
-1.89##
|
-2.07##
|
+0.04
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-1.91**
[-2.18, -1.63]
|
-1.93**
[-2.21, -1.65]
|
-2.11**
[-2.39, -1.83]
|
-
| |
HbA1c (mmol/mol)
|
Ausgangswert
(Mittel)
|
63.6
|
62.6
|
62.6
|
64.8
| |
|
Veränderung gegenüber Ausgangswert
|
-20.4##
|
-20.7##
|
-22.7##
|
+0.4
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-20.8**
[-23.9, -17.8]
|
-21.1**
[-24.1, -18.0]
|
-23.1**
[-26.2, -20.0]
|
-
| |
Patienten (%) mit erreichtem Ziel-HbA1c
|
<7%
|
86.8**
|
91.5**
|
87.9**
|
19.6
| |
|
≤6.5%
|
81.8††
|
81.4††
|
86.2††
|
9.8
| |
|
<5.7%
|
33.9**
|
30.5**
|
51.7**
|
0.9
| |
Körpergewicht (kg)
|
Ausgangswert
(Mittel)
|
87.0
|
85.7
|
85.9
|
84.4
| |
|
Veränderung gegenüber Ausgangswert
|
-7.0##
|
-7.8##
|
-9.5##
|
-0.7
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-6.3**
[-7.8, -4.7]
|
-7.1**
[-8.6, -5.5]
|
-8.8**
[-10.3, -7.2]
|
-
|
* p <0.05, ** p <0.001 für die Überlegenheit, bereinigt für Multiplizität.
† p <0.05, †† p <0.001 im Vergleich zu Placebo, nicht auf Multiplizität bereinigt.
#p <0.05, ## p <0.001 im Vergleich zum Ausgangswert, nicht auf Multiplizität bereinigt.
SURPASS 2 - Kombinationstherapie mit Metformin
In einer über 40 Wochen durchgeführten, aktiv kontrollierten, offenen Studie (doppelblind in Bezug auf die zugeordnete Dosis von Tirzepatid) erhielten 1'879 Patienten randomisiert Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich oder Semaglutide 1 mg einmal wöchentlich, alle in Kombination mit Metformin. Die mittlere Diabetesdauer der Patienten zu Studienbeginn betrug 9 Jahre.
Tabelle 2. SURPASS 2: Ergebnisse in Woche 40
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Semaglutide
1 mg
| |
mITT Population (n)
|
470
|
469
|
469
|
468
| |
HbA1c (%)
|
Ausgangswert
(Mittel)
|
8.33
|
8.31
|
8.25
|
8.24
| |
|
Veränderung gegenüber Ausgangswert
|
-2.09##
|
-2.37##
|
-2.46##
|
-1.86##
| |
|
Unterschied gegenüber Semaglutide [95% CI]
|
-0.23**
[-0.36, -0.10]
|
-0.51**
[-0.64, -0.38]
|
-0.60**
[-0.73, -0.47]
|
-
| |
HbA1c (mmol/mol)
|
Ausgangswert
(Mittel)
|
67.5
|
67.3
|
66.7
|
66.6
| |
|
Veränderung gegenüber Ausgangswert
|
-22.8##
|
-25.9##
|
-26.9##
|
-20.3
| |
|
Unterschied gegenüber Semaglutide [95% CI]
|
-2.5**
[-3.9, -1.1]
|
-5.6**
[-7,0 -4.1]
|
-6.6**
[-8,0 -5.1]
|
N/A
| |
Patienten (%) mit erreichtem Ziel-HbA1c
|
<7%
|
85.5*
|
88.9**
|
92.2**
|
81.1
| |
|
≤6.5%
|
74.0†
|
82.1††
|
87.1††
|
66.2
| |
|
<5.7%
|
29.3††
|
44.7**
|
50.9**
|
19.7
| |
Körpergewicht (kg)
|
Ausgangswert
(Mittel)
|
92.6
|
94.9
|
93.9
|
93.8
| |
|
Veränderung gegenüber Ausgangswert
|
-7.8##
|
-10.3##
|
-12.4##
|
-6.2##
| |
|
Unterschied gegenüber Semaglutide [95% CI]
|
-1.7**
[-2.6, -0.7]
|
-4.1**
[-5.0, -3.2]
|
-6.2**
[-7.1, -5.3]
|
-
|
* p <0.05, ** p <0.001 für die Überlegenheit, bereinigt für Multiplizität.
† p <0.05, †† p <0.001 im Vergleich zu Semaglutide 1 mg, nicht bereinigt für Multiplizität.
# p <0.05, ## p <0.001 im Vergleich zum Ausgangswert, nicht bereinigt für Multiplizität.
SURPASS 3 – In Kombination zu Metformin mit oder ohne SGLT2i
In einer über 52 Wochen durchgeführten, aktiv kontrollierten, offenen Studie erhielten 1'444 Patienten randomisiert Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich oder Insulin degludec, alle in Kombination mit Metformin mit oder ohne SGLT2i. Zu Studienbeginn erhielten 32% der Patienten SGLT2i. Patienten unter Insulin degludec starteten mit einer Dosis von 10 E/Tag und nachfolgender Anpassung anhand eines Algorithmus mit dem Ziel eines Nüchternblutzucker <5 mmol/l. Die mittlere Diabetesdauer der Patienten zu Studienbeginn betrug 8 Jahre.
Tabelle 3. SURPASS 3: Ergebnisse in Woche 52
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Insulin degludeca
titriert
| |
mITT Population (n)
|
358
|
360
|
358
|
359
| |
HbA1c (%)
|
Ausgangswert (Mittel)
|
8.17
|
8.19
|
8.21
|
8.13
| |
|
Veränderung gegenüber Ausgangswert
|
-1.93##
|
-2.20##
|
-2.37##
|
-1.34##
| |
|
Unterschied gegenüber Insulin degludec [95% CI]
|
-0.59**
[-0.73, -0.45]
|
-0.86**
[-1.00, -0.72]
|
-1.04**
[-1.17, -0.90]
|
-
| |
HbA1c (mmol/mol)
|
Ausgangswert (Mittel)
|
65.8
|
66.0
|
66.3
|
65.4
| |
|
Veränderung gegenüber Ausgangswert
|
-21.1##
|
-24.0##
|
-26.0##
|
-14.6##
| |
|
Unterschied gegenüber Insulin degludec [95% CI]
|
-6.4**
[-7.9, -4.9]
|
-9.4**
[-10.9, -7.9]
|
-11.3**
[-12.8, -9.8]
|
-
| |
Patienten (%) mit erreichtem Ziel-HbA1c
|
<7%
|
82.4**
|
89.7**
|
92.6**
|
61.3
| |
|
≤6.5%
|
71.4††
|
80.3††
|
85.3††
|
44.4
| |
|
<5.7%
|
25.8††
|
38.6††
|
48.4††
|
5.4
| |
Körpergewicht (kg)
|
Ausgangswert (Mittel)
|
94.5
|
94.3
|
94.9
|
94.2
| |
|
Veränderung gegenüber Ausgangswert
|
-7.5##
|
-10.7##
|
-12.9##
|
+2.3##
| |
|
Unterschied gegenüber Insulin degludec [95% CI]
|
-9.8**
[-10.8, -8.8]
|
-13.0**
[-14.0, -11.9]
|
-15.2**
[-16.2, -14.2]
|
-
|
a Die mittlere Dosis von Insulin degludec in Woche 52 betrug 49 Einheiten/Tag.
* p <0.05, ** p <0.001 für die Überlegenheit, bereinigt für Multiplizität.
† p <0.05, †† p <0.001 im Vergleich zu Insulin degludec, nicht bereinigt für Multiplizität.
# p <0.05, ## p <0.001 im Vergleich zum Ausgangswert, nicht bereinigt für Multiplizität.
Kontinuierliche Glucoseüberwachung (CGM)
Eine Untergruppe von Patienten (N=243) nahm an einer Auswertung der 24-Stunden-Glucoseprofile teil, die mit verblindetem CGM erfasst wurden. In Woche 52 verbrachten Patienten unter Tirzepatid (10 mg und 15 mg kombiniert ausgewertet) signifikant mehr Zeit im euglykämischen Bereich, definiert als Glucosewerte zwischen 71 bis 140 mg/dl (3.9 bis 7.8 mmol/l), im Vergleich zu Patienten unter Insulin degludec, mit 73% versus 48% des 24-Stunden-Zeitraums im Bereich.
Nach 52 Wochen verbrachten Patienten aller 3 Tirzepatid Dosierungen einen grösseren Teil des 24-Stunden-Zeitraums mit einem Blutzuckerspiegel im Bereich von 71 bis 180 mg/dl (3.9 bis 10.0 mmol/l) im Vergleich zu Patienten unter Insulin degludec: Tirzepatid (Bereich): 84.9% bis 91.2%; Insulin degludec, 75.0%.
Leberfettgehalt (liver fat content, LFC) und Fettgewebe
Eine Untergruppe von Patienten (N=296) nahm an einer Beurteilung von LFC, viszeralem Fettgewebe (visceral adipose tissue, VAT) und abdominalem subkutanem Fettgewebe (abdominal subcutaneous adipose tissue, ASAT) teil, die anhand von Magnetresonanztomographie beurteilt wurden. In Woche 52 zeigten Patienten unter Tirzepatid (10 mg und 15 mg kombiniert ausgewertet) eine statistisch signifikant grössere mittlere Reduktion des LFC im Vergleich zu Insulin degludec, -8.09% versus -3.38%, ausgehend von 15.67% und 16.58% zu Studienbeginn. Patienten unter Tirzepatid 5 mg, 10 mg und 15 mg zeigten eine signifikant grössere Reduktion des Volumens von VAT (-1.10, -1.53 bzw. -1.65 l) und ASAT (-1.40, -2.25 bzw. -2.05 l) gegenüber den Gesamt-Ausgangswerten von 6.6 l bzw. 10.4 l, jeweils nach 52 Wochen, im Vergleich zu einem Anstieg unter Insulins degludec (0.38 und 0.63 l).
SURPASS 4 – In Kombination mit 1-3 oralen Antidiabetika (Metformin, Sulfonylharnstoffe oder SGLT2i)
In einer aktiv kontrollierten, offenen Studie über einen Zeitraum von bis zu 104 Wochen (primärer Endpunkt nach 52 Wochen) wurden 2'002 Patienten mit Diabetes mellitus Typ 2 und erhöhtem kardiovaskulären Risiko randomisiert auf Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich oder Insulin glargin einmal täglich bei Hintergrund mit Metformin (95%) und/oder Sulfonylharnstoffen (54%) und/oder SGLT2i (25%). Patienten, die mit Insulin glargin behandelt wurden, begannen mit einer Dosis von 10 E/Tag und nachfolgender Anpassung anhand eines Algorithmus mit dem Ziel eines Nüchternblutzuckers von <5.6 mmol/l. Die mittlere Diabetesdauer der Patienten zu Studienbeginn betrug 12 Jahre.
Tabelle 4. SURPASS 4: Ergebnisse in Woche 52
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Insulin glargina
titriert
| |
mITT Population (n)
|
328
|
326
|
337
|
998
| |
52 Wochen
| |
HbA1c (%)
|
Ausgangswert (Mittel)
|
8.52
|
8.60
|
8.52
|
8.51
| |
|
Veränderung gegenüber Ausgangswert
|
-2.24##
|
-2.43##
|
-2.58##
|
-1.44##
| |
|
Unterschied gegenüber Insulin glargin [95% CI]
|
-0.80**
[-0.92, -0.68]
|
-0.99**
[-1.11, -0.87]
|
-1.14**
[-1.26, -1.02]
|
-
| |
HbA1c (mmol/mol)
|
Ausgangswert (Mittel)
|
69.6
|
70.5
|
69.6
|
69.5
| |
|
Veränderung gegenüber Ausgangswert
|
-24.5##
|
-26.6##
|
-28.2##
|
-15.7##
| |
|
Unterschied gegenüber Insulin glargin [95% CI]
|
-8.8**
[-10.1, -7.4]
|
-10.9**
[-12.3, -9.6]
|
-12.5**
[-13.8, -11.2]
|
-
| |
Patienten (%) mit erreichtem Ziel-HbA1c
|
<7%
|
81.0**
|
88.2**
|
90.7**
|
50.7
| |
|
≤6.5%
|
66.0††
|
76.0††
|
81.1††
|
31.7
| |
|
<5.7%
|
23.0††
|
32.7††
|
43.1††
|
3.4
| |
Körpergewicht (kg)
|
Ausgangswert (Mittel)
|
90.3
|
90.7
|
90.0
|
90.3
| |
|
Veränderung gegenüber Ausgangswert
|
-7.1##
|
-9.5##
|
-11.7##
|
+1.9##
| |
|
Unterschied gegenüber Insulin glargin [95% CI]
|
-9.0**
[-9.8, -8.3]
|
-11.4**
[-12.1, -10.6]
|
-13.5**
[-14.3, -12.8]
|
-
|
a Die mittlere Dosis von Insulin glargin in Woche 52 betrug 44 Einheiten/Tag.
* p <0.05, ** p <0.001 für die Überlegenheit, bereinigt für Multiplizität.
† p <0.05, †† p <0.001 im Vergleich zu Insulin glargin, nicht bereinigt für Multiplizität.
# p <0.05, ## p <0.001 im Vergleich zum Ausgangswert, nicht bereinigt für Multiplizität.
SURPASS 5 – Als Add-on zu Basalinsulin mit oder ohne Metformin
In einer über 40 Wochen durchgeführten, doppelblinden, placebokontrollierten Studie wurden 475 Patienten mit unzureichender glykämischer Kontrolle unter Insulin glargin mit oder ohne Metformin randomisiert auf Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich oder Placebo. Die Dosis von Insulin glargin wurde angepasst anhand eines Algorithmus mit dem Ziel eines Nüchternblutzuckers von <5.6 mmol/l. Bei Patienten mit einem HbA1c-Wert von ≤8.0% wurde die Dosis von Insulin glargin innerhalb der ersten Woche (bis zur Verabreichung der zweiten Tirzepatid-Dosis) um 20% reduziert. Bei Patienten mit einem HbA1c-Ausgangswert von >8.0% wurde die Dosis von Insulin glargin nicht verringert. Die mittlere Diabetesdauer der Patienten zu Studienbeginn betrug 13 Jahre.
Tabelle 5. SURPASS 5: Ergebnisse in Woche 40
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Placeboa
| |
mITT Population (n)
|
116
|
118
|
118
|
119
| |
HbA1c (%)
|
Ausgangswert
(Mittel)
|
8.29
|
8.34
|
8.22
|
8.39
| |
|
Veränderung gegenüber Ausgangswert
|
-2.23##
|
-2.59##
|
-2.59##
|
-0.93##
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-1.30**
[-1.52, -1.07]
|
-1.66**
[-1.88, -1.43]
|
-1.65**
[-1.88, -1.43]
|
-
| |
HbA1c (mmol/mol)
|
Ausgangswert
(Mittel)
|
67.1
|
67.7
|
66.4
|
68.2
| |
|
Veränderung gegenüber Ausgangswert
|
-24.4##
|
-28.3##
|
-28.3##
|
-10.2##
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-14.2**
[-16.6, -11.7]
|
-18.1**
[-20.6, -15.7]
|
-18.1**
[-20.5, -15.6]
|
-
| |
Patienten (%) mit erreichtem Ziel-HbA1c
|
<7%
|
93.0**
|
97.4**
|
94.0**
|
33.9
| |
|
≤6.5%
|
80.0††
|
94.7††
|
92.3††
|
17.0
| |
|
<5.7%
|
26.1††
|
47.8††
|
62.4††
|
2.5
| |
Körpergewicht (kg)
|
Ausgangswert
(Mittel)
|
95.5
|
95.4
|
96.2
|
94.1
| |
|
Veränderung gegenüber Ausgangswert
|
-6.2##
|
-8.2##
|
-10.9##
|
+1.7#
| |
|
Unterschied gegenüber Placebo [95% CI]
|
-7.8**
[-9.4, -6.3]
|
-9.9**
[-11.5, -8.3]
|
-12.6**
[-14.2, -11.0]
|
-
|
a Die insgesamt mediane Dosis von Insulin glargin zu Studienbeginn betrug 34 Einheiten/Tag. Die mediane Dosis von Insulin glargin in Woche 40 betrug 38, 36, 29 bzw. 59 Einheiten/Tag unter Tirzepatid 5 mg, 10 mg, 15 mg bzw. Placebo.
* p <0.05, ** p <0.001 für die Überlegenheit, bereinigt für Multiplizität.
† p <0.05, †† p <0.001 im Vergleich zu Placebo, nicht bereinigt für Multiplizität.
# p <0.05, ## p <0.001 im Vergleich zum Ausgangswert, nicht bereinigt für Multiplizität.
Chronische Gewichtsregulierung
Die Sicherheit und Wirksamkeit von Tirzepatid zur chronischen Gewichtsregulierung (Abnahme und Halten des Gewichts) in Kombination mit kalorienreduzierter Ernährung und verstärkter körperlicher Aktivität wurde in zwei randomisierten, doppelblinden, placebokontrollierten Studien Phase 3 bei Patienten ohne Diabetes mellitus (SURMOUNT-1) und mit Diabetes mellitus (SURMOUNT-2) untersucht.
SURMOUNT-1
In einer doppelblinden, placebokontrollierten Studie über 72 Wochen wurden 2'539 erwachsene Patienten (67.5% Frauen) mit Adipositas (BMI ≥30 kg/m2) oder mit Übergewicht (BMI ≥27 kg/m2 bis <30 kg/m2) und mindestens einer gewichtsbedingten Begleiterkrankung wie zum Beispiel behandelte oder unbehandelte Dyslipidämie, Hypertonie, obstruktive Schlafapnoe oder kardiovaskuläre Erkrankung auf Tirzepatid 5 mg, 10 mg oder 15 mg einmal wöchentlich, oder Placebo randomisiert. Patienten mit manifestem Diabetes mellitus Typ 2 waren ausgeschlossen. Jedoch wiesen 40.6% der Studienteilnehmer einen Prädiabetes auf. Das mittlere Alter der Patienten betrug 45 Jahre. Das mittlere Körpergewicht zu Beginn betrug 104.8 kg und der mittlere BMI 38 kg/m2.
In der SURMOUNT-1 Studie wurde die Dosierung von Tirzepatid oder entsprechendem (matching) Placebo in einer Phase über 20 Wochen auf 5 mg, 10 mg oder 15 mg subkutan einmal wöchentlich gesteigert, mit nachfolgender Erhaltungsphase.
Die Gewichtsabnahme unter Tirzepatid begann früh und setzte sich über die Studie hinweg fort. Am Ende der Behandlung (Woche 72) war die Gewichtsabnahme unter Tirzepatid überlegen und klinisch relevant im Vergleich zu Placebo (siehe Tabelle 7 und Abbildung 6). In Woche 72 hatten 89%, 96% und 96% der Patienten mit 5 mg, 10 mg und 15 mg Tirzepatid eine Gewichtsabnahme von ≥5% erreicht, im Vergleich zu 28% der Patienten unter Placebo (P <0.001 für alle Vergleiche mit Placebo). In den Tirzepatid-Gruppen zeigten mehr Patienten eine Gewichtsabnahme von ≥10%, ≥15% und ≥20% gegenüber dem Ausgangswert im Vergleich zu Patienten der Placebo-Gruppe (p <0.001).
Tabelle 7. SURMOUNT-1: Ergebnisse in Woche 72
|
|
Tirzepatid
5 mg
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Placebo
| |
mITT-Population (n)
|
630
|
636
|
630
|
643
| |
Körpergewicht
| |
Ausgangswert (kg)
|
102.9
|
105.9
|
105.5
|
104.8
| |
Veränderung (%) ab Ausgangswert
|
-16.0††
|
-21.4††
|
-22.5††
|
-2.4
| |
Unterschied (%) zu Placebo
[95 % CI]
|
-13.5**
[-14.6, -12.5]
|
-18.9**
[-20.0, -17.8
|
-20.1**
[-21.2, -19.0]
|
-
| |
Unterschied (kg) ab Ausgangswert
|
-16.1††
|
-22.2††
|
-23.6††
|
-2.4††
| |
Unterschied (kg) zu Placebo
[95% CI]
|
-13.8##
[-15.0, -12.6]
|
-19.8##
[-21.0, -18.6]
|
-21.2##
[-22.4, -20.0]
|
-
| |
Patienten (%) mit erreichter Gewichtsabnahme
| |
≥5%
|
89.4**
|
96.2**
|
96.3**
|
27.9
| |
≥10%
|
73.4##
|
85.9**
|
90.1**
|
13.5
| |
≥15%
|
50.2##
|
73.6**
|
78.2**
|
6.0
| |
≥20%
|
31.6##
|
55.5**
|
62.9**
|
1.3
| |
Taillenumfang (cm)
| |
Ausgangswert
|
113.2
|
114.9
|
114.4
|
114.0
| |
Veränderung ab Ausgangswert
|
-14.6††
|
-19.4††
|
-19.9††
|
-3.4††
| |
Unterschied zu Placebo
[95% CI]
|
-11.2##
[-12.3, -10.0]
|
-16.0**
[-17.2, -14.9]
|
-16.5**
[-17.7, -15.4]
|
-
|
##p-Wert <0.001 versus Placebo, ohne Adjustierung für Multiplizität.
**p-Wert <0.001 versus Placebo, mit Adjustierung für Multiplizität.
††p-Wert <0.001 versus Ausgangswert.
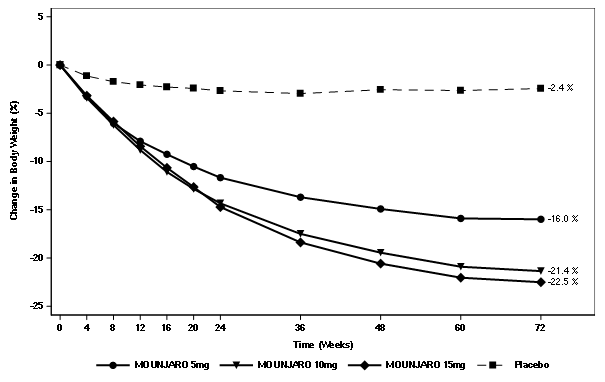
Abbildung 6. Mittlere Veränderung des Körpergewichts (%) gegenüber dem Ausgangswert bis Woche 72
In der Subgruppe mit Prädiabetes zu Studienbeginn (N=1'032) zeigte sich bei 95.3% der mit Tirzepatid behandelten Patienten eine Rückkehr zur Normoglykämie bis Woche 72, im Vergleich zu 61.9% der Patienten unter Placebobehandlung.
SURMOUNT-2
In einer doppelblinden, placebokontrollierten Studie über 72 Wochen wurden 938 erwachsene Patienten mit BMI ≥27 kg/m2 und Diabetes mellitus Typ 2 randomisiert auf Tirzepatid 10 mg oder 15 mg einmal wöchentlich, oder Placebo. Das mittlere Alter der Patienten betrug 54 Jahre und 50.7% waren Frauen. Das mittlere Körpergewicht zu Beginn betrug 100.7 kg und der mittlere BMI 36.1 kg/m2.
Die Dosierung von Tirzepatid oder entsprechendem (matching) Placebo wurde während einer Phase über 20 Wochen auf 10 mg oder 15 mg subkutan einmal wöchentlich gesteigert, mit nachfolgender Erhaltungsphase.
Die Gewichtsabnahme begann früh und setzte sich über die Studie hinweg fort. Am Ende der Behandlung (Woche 72) war die Gewichtsabnahme überlegen und klinisch relevant im Vergleich zu Placebo (siehe Tabelle 8 und Abbildung 7). In Woche 72 hatten 81.6% und 86.4% der Patienten in den Gruppen mit 10 mg und 15 mg Tirzepatid eine Gewichtsabnahme von ≥5%, im Vergleich zu 30.6% der Patienten unter Placebo (P <0.001 für alle Vergleiche mit Placebo). In den Tirzepatid-Gruppen zeigten mehr Patienten eine Gewichtsabnahme von ≥10%, ≥15% und ≥20% gegenüber dem Ausgangswert im Vergleich zu Patienten unter Placebo (p <0.001).
Tabelle 8. SURMOUNT-2: Ergebnisse in Woche 72
|
|
Tirzepatid
10 mg
|
Tirzepatid
15 mg
|
Placebo
| |
mITT-Population (n)
|
312
|
311
|
315
| |
Körpergewicht
| |
Ausgangswert (kg)
|
101.1
|
99.5
|
101.7
| |
Veränderung (%) ab Ausgangswert
|
-13.4††
|
-15.7††
|
-3.3††
| |
Unterschied (%) zu Placebo
[95 % CI]
|
-10.1**
[-11.5, -8.8]
|
-12.4**
[-13.7, -11.0]
|
-
| |
Unterschied (kg) ab Ausgangswert
|
-13.5††
|
-15.6††
|
-3.2††
| |
Unterschied (kg) zu Placebo
[95% CI]
|
-10.3**
[-11.7, -8.8]
|
-12.4**
[-13.8, -11.0]
|
-
| |
Patienten (%) mit erreichter Gewichtsabnahme
| |
≥5%
|
81.6**
|
86.4**
|
30.6
| |
≥10%
|
63.4**
|
69.6**
|
8.7
| |
≥15%
|
41.4**
|
51.8**
|
2.6
| |
≥20%
|
23.0**
|
34.0**
|
1.0
| |
Taillenumfang (cm)
| |
Ausgangswert
|
114.3
|
114.6
|
116.1
| |
Veränderung ab Ausgangswert
|
-11.2††
|
-13.8††
|
-3.4††
| |
Unterschied zu Placebo
[95% CI]
|
-7.8**
[-9.2, -6.4]
|
-10.4**
[-11.8, -8.9]
|
-
|
##p-Wert <0.001 versus Placebo, ohne Adjustierung für Multiplizität.
**p-Wert <0.001 versus Placebo, mit Adjustierung für Multiplizität.
††p-Wert <0.001 versus Ausgangswert.
Während der Studie brachen 9.3% und 13.8% der auf Tirzepatid 10 mg und 15 mg randomisierten Patienten die Behandlung ab, im Vergleich zu 14.9% unter Placebo.
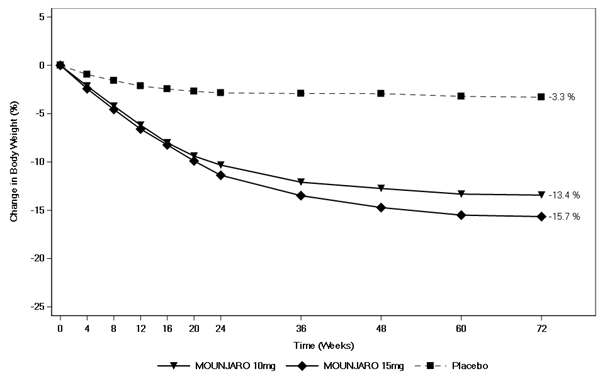
Abbildung 7. Mittlere Veränderung des Körpergewichts (%) gegenüber dem Ausgangswert bis Woche 72
Weitere Informationen
Veränderungen der Körperzusammensetzung
Die Veränderungen der Körperzusammensetzung wurden in einer Substudie zur SURMOUNT-1 mittels Dual-Röntgen-Absorptiometrie (DEXA) untersucht. Die Ergebnisse der DEXA-Untersuchung zeigten, dass die Behandlung mit Tirzepatid mit einer grösseren Reduktion der Fettmasse als der Lean-Body-Mass verbunden war, was zu einer verbesserten Körperzusammensetzung im Vergleich zu Placebo in Woche 72 führte. Darüber hinaus war diese Reduktion der Gesamtfettmasse von einer Reduktion des viszeralen Fetts begleitet. Diese Ergebnisse lassen vermuten, dass der grösste Teil der Gewichtsabnahme insgesamt auf eine Reduktion des Fettgewebes, einschliesslich des viszeralen Fetts, zurückzuführen war.
Kardiovaskuläre Beurteilung
Diabetes mellitus Typ 2
Das kardiovaskuläre (CV) Risiko wurde anhand einer Metaanalyse der Phase 2 und 3 Studien bewertet. Der kombinierte Endpunkt (major adverse cardiac event, MACE-4) umfasste kardiovaskulären Tod, nicht-tödlichen Myokardinfarkt, nicht-tödlichen Schlaganfall oder Hospitalisierung aufgrund instabiler Angina. Alle aufgetretenen Ereignisse wurden durch ein Gremium kardiologischer Spezialisten einer Adjudizierung unterzogen.
In einer primären Metaanalyse berichteten insgesamt 116 Patienten (Tirzepatid: 60 [n=4'410]; alle Komparatoren: 56 [n=2'169]) mindestens ein in der Adjudizierung bestätigtes MACE-4: Die Ergebnisse zeigten, dass Tirzepatid im Vergleich zu den kombiniert ausgewerteten Komparatoren nicht mit einem erhöhten Risiko für kardiovaskuläre Ereignisse verbunden war (HR: 0.81; KI: 0.52 bis 1.26).
Eine zusätzliche Auswertung wurde speziell für die SURPASS-4 Studie durchgeführt, hier eingeschlossen waren Patienten mit gesicherter CV Erkrankung. Insgesamt 109 Patienten (Tirzepatid: 47 [n=995]; Insulin glargin: 62 [n=1'000]) berichteten mindestens 1 in der Adjudizierung bestätigtes MACE-4: Die Ergebnisse zeigten, dass Tirzepatid nicht mit einem erhöhten Risiko für CV Ereignisse verbunden war im Vergleich zu Insulin glargin (HR: 0.74; KI: 0.51 bis 1.08).
Chronische Gewichtsregulierung
Für die SURMOUNT-1 Studie erfolgte eine Auswertung der insgesamt 14 Patienten (Tirzepatid: 9 (0.47%) von 1'896; Placebo: 5 (0.78%) von 643), bei welchen mindestens ein in der Adjudizierung bestätigtes MACE aufgetreten war. Die prozentualen Anteile der Patienten mit einem in der Adjudizierung bestätigten MACE waren ähnlich unter Placebo und Tirzepatid.
Die SURMOUNT-2 Studie wurde ausgewertet. Bei insgesamt 11 Patienten (Tirzepatid: 7 (1.12%) von 623; Placebo: 4 (1.27%) von 315) war mindestens ein in der Adjudizierung bestätigtes MACE aufgetreten. Die prozentualen Anteile der Patienten mit einem in der Adjudizierung bestätigten MACE waren ähnlich unter Placebo und Tirzepatid.
Blutdruck
Diabetes mellitus Typ 2
In den placebokontrollierten Studien Phase 3 führte die Behandlung mit Tirzepatid zu einer mittleren Abnahme des systolischen bzw. diastolischen Blutdrucks von 6 bis 9 mmHg bzw. 3 bis 4 mmHg. Bei Patienten unter Placebo sank der Blutdruck systolisch und diastolisch im Mittel um jeweils 2 mmHg.
Chronische Gewichtsregulierung
Die Behandlung mit Tirzepatid führte zu einer mittleren Abnahme des systolischen bzw. diastolischen Blutdrucks von 7 bis 8 mmHg bzw. 4 bis 5 mmHg. Bei Patienten unter Placebo sank der Blutdruck systolisch und diastolisch im Mittel um jeweils 1 mmHg.
Herzfrequenz
Diabetes mellitus Typ 2
In den placebokontrollierten Studien Phase 3 führte die Behandlung mit Tirzepatid zu einem mittleren Anstieg der Herzfrequenz von 2 bis 4 Schlägen pro Minute. Patienten unter Placebo wiesen einen mittleren Anstieg der Herzfrequenz um 1 Schlag pro Minute auf.
Chronische Gewichtsregulierung
Die Behandlung mit Tirzepatid führte zu einem mittleren Anstieg der Herzfrequenz von 1 bis 3 Schlägen pro Minute. Patienten unter Placebo wiesen einen mittleren Anstieg der Herzfrequenz von 0 Schlägen pro Minute auf.
Spezielle Populationen
Die Wirksamkeit von Tirzepatid zur Behandlung des Diabetes mellitus Typ 2 wurde nicht durch Alter, Geschlecht, Abstammung, ethnische Zugehörigkeit, Region oder durch Ausgangs-BMI, HbA1c, Diabetesdauer und Grad der Leber- oder Nierenfunktionseinschränkung beeinflusst.
Die Wirksamkeit von Tirzepatid zur chronischen Gewichtsregulierung wurde nicht durch Alter, Geschlecht, Abstammung, ethnische Zugehörigkeit, Region, Ausgangs-BMI oder vorhandenem bzw. nicht vorhandenem Prädiabetes beeinflusst.
|


