ZusammensetzungWirkstoffe
Calcipotriol, als Calcipotriol-Monohydrat.
Betamethason, als Betamethasondipropionat.
Hilfsstoffe
Butylhydroxytoluol (E321) max. 270 Mikrogramm/g Gel
Hydriertes Rizinusöl 16,7 mg/g Gel
Polyoxypropylen-Stearylether 11
Paraffin, Dickflussiges.
Indikationen/AnwendungsmöglichkeitenTopische Behandlung von Psoriasis der Kopfhaut bei Erwachsenen.
Topische Behandlung von leichten bis mittelschweren Plaques der Psoriasis vulgaris außerhalb der Kopfhaut bei Erwachsenen.
Dosierung/AnwendungCrysalis Leman Gel muss einmal täglich auf die Läsionen aufgetragen werden. Die empfohlene Behandlungsdauer beträgt 4 Wochen für die Kopfhaut und 8 Wochen für andere Hautpartien. Wenn die Behandlung nach diesem Zeitraum fortgesetzt oder wieder aufgenommen werden muss, sollte sie nach ärztlichem Rat und unter regelmäßiger ärztlicher Überwachung fortgesetzt werden.
Bei der Anwendung von Produkten, die Calcipotriol enthalten, darf die maximale Tagesdosis 15 g nicht überschreiten. Die mit Calcipotriol-haltigen Produkten behandelte Körperfläche darf 30 % nicht überschreiten (siehe Abschnitt Warnhinweise und Vorsichtsmassnahme).
Bei Anwendung auf der Kopfhaut
Alle betroffenen Bereiche der Kopfhaut können mit Crysalis Leman Gel behandelt werden. In der Regel reicht eine Menge zwischen 1 g und 4 g pro Tag zur Behandlung der Kopfhaut aus (4 g entsprechen einem Teelöffel).
Besondere Bevölkerungsgruppen
Nieren- und Leberinsuffizienz
Die Sicherheit und Wirksamkeit von Crysalis Leman Gel bei Patienten mit schwerer Niereninsuffizienz oder schweren Leberfunktionsstörungen wurde nicht untersucht.
pädiatrische Bevölkerung
Die Sicherheit und Wirksamkeit von Crysalis Leman Gel bei Kindern unter 18 Jahren wurde nicht nachgewiesen. Die derzeit verfügbaren Daten für Kinder im Alter von 12 bis 17 Jahren sind unter den Rubriken „Nebenwirkungen“ und „Eigenschaften/Wirkungen“ beschrieben, jedoch können keine Dosierungsempfehlungen gegeben werden.
Anwendung
Das Gel darf nicht direkt auf das Gesicht oder die Augen aufgetragen werden. Um eine optimale Wirkung zu erzielen, wird vom Duschen oder Baden abgeraten. Crysalis Leman Gel sollte über Nacht oder tagsüber auf der Haut verbleiben.
Verwendung der Tube
Die Tube vor Gebrauch schütteln und das Gel auf die betroffenen Stellen auftragen.
Nach der Anwendung die Hände waschen.
Anweisungen für die richtige Anwendung
· Das Arzneimittel darf nur auf Psoriasis angewendet werden, nicht auf Haut ohne Psoriasis.
· Die Tube muss vor Gebrauch geschüttelt und die Kappe entfernt werden.
· Das Gel muss auf einen sauberen Finger oder direkt auf die von Psoriasis betroffene Stelle aufgetragen werden.
· Das Arzneimittel muss mit den Fingerspitzen auf die betroffene Stelle aufgetragen und sanft eingerieben werden, bis die von Psoriasis betroffene Stelle mit einer dünnen Schicht Gel bedeckt ist
· Die behandelte Hautstelle darf nicht verbunden, abgedeckt oder eingewickelt werden
· Die Hände müssen nach der Anwendung von Crysalis Leman Gel gründlich gewaschen werden. Dadurch wird verhindert, dass das Gel versehentlich auf andere Körperteile (insbesondere Gesicht, Mund und Augen) gelangt
· Wenn das Gel versehentlich auf gesunde Haut in der Nähe Ihrer Psoriasis gelangt, muss es abgewischt werden, wenn es sich zu weit ausbreitet
· Um eine optimale Wirkung zu erzielen, wird empfohlen, unmittelbar nach der Anwendung von Crysalis Leman Gel nicht zu duschen oder zu baden.
· Nach dem Auftragen des Gels sollte jeglicher Kontakt mit leicht fettempfindlichen Textilien (z. B. Seide) vermieden werden.
Wenn Sie unter Schuppenflechte auf der Kopfhaut leiden
Kämmen Sie das Haar vor der Anwendung von Crysalis Leman Gel auf der Kopfhaut, um Schuppen zu entfernen. Neigen Sie den Kopf, damit Crysalis nicht ins Gesicht läuft. Ein Scheitel kann die Anwendung von Crysalis Leman Gel erleichtern. Tragen Sie Crysalis Leman Gel mit den Fingerspitzen auf die betroffene Stelle auf und reiben Sie es sanft ein.
Vor der Anwendung von Crysalis Leman Gel müssen die Haare nicht gewaschen werden.
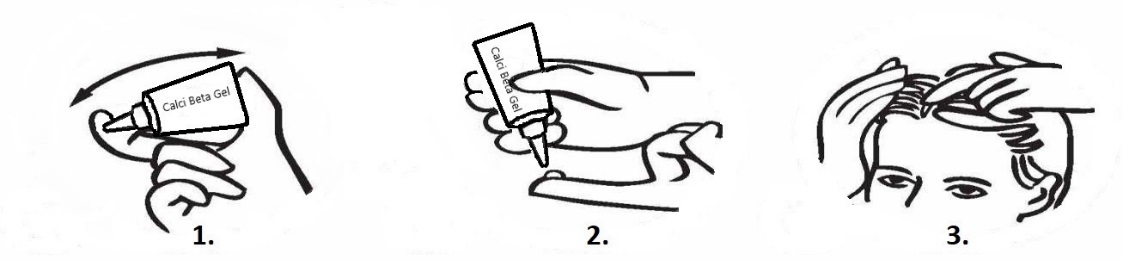
Um eine optimale Wirkung zu erzielen, wird empfohlen, die Haare nicht unmittelbar nach der Anwendung von Crysalis Leman Gel zu waschen. Crysalis Leman Gel sollte über Nacht oder tagsüber auf der Kopfhaut einwirken. Beim Waschen der Haare nach der Anwendung können folgende Hinweise hilfreich sein:
Falls nötig, müssen die Schritte 4 bis 6 ein- oder zweimal wiederholt werden.
Dauer der Behandlung
·Das Gel sollte einmal täglich angewendet werden. Es kann praktischer sein, das Gel am Abend zu verwenden.
·Die normale anfängliche Behandlungsdauer beträgt 4 Wochen für Bereiche auf der Kopfhaut und 8 Wochen für andere Bereiche als die Kopfhaut.
·Der Arzt kann einen anderen Behandlungszeitraum festlegen
·Der Arzt kann sich für eine wiederholte Behandlung entscheiden
·Es sollten nicht mehr als 15 Gramm pro Tag verwendet werden.
Wenn andere Calcipotriol-haltige Arzneimittel verwendet werden, darf die Gesamtmenge an Calcipotriol-haltigen Arzneimitteln 15 Gramm pro Tag nicht überschreiten und die behandelte Fläche darf nicht mehr als 30% der gesamten Körperoberfläche ausmachen.
KontraindikationenÜberempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt Zusammensetzung
Hilfsstoffe genannten Hilfsstoffe.
Crysalis Leman Gel ist bei erythrodermischer, exfoliativer und pustulöser Psoriasis kontraindiziert.
Aufgrund des Gehalts an Calcipotriol ist Crysalis Leman Gel bei Patienten mit Calciumstoffwechselstörungen in der Anamnese kontraindiziert (siehe Abschnitt Warnhinweise und Vorsichtsmassnahmen).
Aufgrund des Vorhandenseins von Kortikosteroiden ist Crysalis Leman Gel in folgenden Fällen kontraindiziert: Hautläsionen viralen Ursprungs (z. B. Herpes oder Windpocken), Hautinfektionen pilzlichen oder bakteriellen Ursprungs, parasitäre Infektionen, Hautveränderungen im Zusammenhang mit Tuberkulose, periorale Dermatitis, Hautatrophie, Dehnungsstreifen, Schwäche des Hautvenennetzes, Ichthyose, Akne vulgaris, Rosazea, Rosazea, Geschwüre und Wunden (siehe Abschnitt Warnhinweise und Vorsichtsmassnahmen).
Warnhinweise und VorsichtsmassnahmenAuswirkungen auf das endokrine System
Crysalis Leman Gel enthält ein stark wirksames Kortikoid (Gruppe III) und sollte nicht gleichzeitig mit anderen Kortikoiden angewendet werden. Die bei einer systemischen Kortikoidbehandlung beobachteten Nebenwirkungen, wie die Unterdrückung der Hypothalamus-Hypophysen-Achse oder die Beeinflussung der Stoffwechselkontrolle bei Diabetes mellitus, können aufgrund des Übergangs in den systemischen Kreislauf auch bei einer topischen Kortikoidbehandlung auftreten.
Die Anwendung unter Okklusivverbänden ist zu vermeiden, da dies die systemische Resorption von Kortikosteroiden erhöht. Die Anwendung auf großen Hautflächen, auf Schleimhäuten oder in Hautfalten ist zu vermeiden, da dies die systemische Resorption von Kortikosteroiden erhöht (siehe Abschnitt Unerwünschte Wirkungen).
In einer Studie an Patienten mit ausgedehnter Psoriasis sowohl auf der Kopfhaut als auch am Körper bei der hochdosiertes Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel (Anwendung auf der Kopfhaut) und hochdosiertes Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Salbe (Anwendung auf dem Körper) kombiniert wurden, 5 von 32 Patienten zeigten nach 4-wöchiger Behandlung eine grenzwertige Abnahme ihres Cortisolspiegels als Reaktion auf eine Stimulation des adrenokortikotropen Hormons (ACTH) (siehe Abschnitt Eigenschaften/Wirkunge).
Sehstörungen
Bei einer systemischen oder lokalen Kortikosteroidtherapie können Sehstörungen auftreten. Bei verschwommenem Sehen oder anderen Sehstörungen während einer Kortikosteroidtherapie ist eine augenärztliche Untersuchung erforderlich, insbesondere zur Abklärung einer Katarakt, eines Glaukoms oder einer selteneren Läsion wie einer zentralen serösen Chorioretinopathie, die bei systemischer oder lokaler Verabreichung von Kortikosteroiden beschrieben werden.
Auswirkungen auf den Kalziumstoffwechsel
Aufgrund des enthaltenen Calcipotriols kann es bei Überschreitung der maximalen Tagesdosis (15 g) zu einer Hyperkalzämie kommen. Der Kalziumspiegel normalisiert sich nach Absetzen der Behandlung. Das Risiko einer Hyperkalzämie ist minimal, wenn die Empfehlungen zu Calcipotriol befolgt werden. Eine Behandlung von mehr als 30 % der Körperoberfläche sollte vermieden werden (siehe Abschnitt Dosierung/Anwendung).
Nebenwirkungen im Zusammenhang mit den Hilfsstoffen
Crysalis Leman Gel enthält Butylhydroxytoluol (E321), das lokale Hautreaktionen (z. B. Kontaktdermatitis) oder Reizungen der Augen und Schleimhäute verursachen kann.
Crysalis Leman Gel enthält hydriertes Rizinusöl, das Hautreaktionen hervorrufen kann.
InteraktionenEs wurden keine Wechselwirkungsstudien mit Crysalis Leman Gel durchgeführt.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen keine ausreichend relevanten Daten zur Anwendung von Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/Gel bei Schwangeren vor. Tierversuche mit Glukokortikoiden haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt Präklinische Daten), aber eine Reihe epidemiologischer Studien (weniger als 300 Schwangerschaften) haben keine angeborenen Anomalien bei Kindern von Müttern gezeigt, die während der Schwangerschaft mit Kortikosteroiden behandelt wurden. Das potenzielle Risiko für den Menschen ist nicht sicher bekannt. Daher sollte Crysalis Leman Gel während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko rechtfertigt.
Stillzeit
Betamethason wird in die Muttermilch ausgeschieden, aber das Risiko einer Nebenwirkung beim Säugling scheint bei therapeutischen Dosen unwahrscheinlich. Es liegen keine Daten zur Ausscheidung von Calcipotriol in die Muttermilch vor. Bei der Verschreibung von Crysalis Leman Gel an stillende Frauen ist Vorsicht geboten. Die Patientin sollte darauf hingewiesen werden, Crysalis Leman Gel während der Stillzeit nicht auf die Brüste aufzutragen.
Fruchtbarkeit
Studien an Ratten nach oraler Verabreichung von Calcipotriol oder Betamethasondipropionat haben keine Beeinträchtigung der Fruchtbarkeit bei männlichen und weiblichen Tieren gezeigt (siehe Abschnitt Präklinische Daten).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenCrysalis Leman Gel hat keinen oder nur einen vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Unerwünschte WirkungenDie Häufigkeit der Nebenwirkungen wurde anhand einer gepoolten Analyse von Daten aus klinischen Studien, einschließlich Sicherheitsstudien nach der Markteinführung und spontanen Meldungen, geschätzt.
Die während der Behandlung am häufigsten berichtete Nebenwirkung ist Juckreiz.
Die Nebenwirkungen sind nach MedDRA-Systemorganklassen (SOC) gegliedert, und die einzelnen Nebenwirkungen sind innerhalb jeder SOC in absteigender Reihenfolge ihrer Häufigkeit aufgeführt. Innerhalb jeder Häufigkeitsklasse sind die Nebenwirkungen in absteigender Reihenfolge ihres Schweregrades aufgeführt.
Sehr häufig (≥ 1/10)
Häufig (≥ 1/100 und < 1/10)
Gelegentlich (≥ 1/1 000 und < 1/100)
Selten (≥ 1/10 000 und < 1/1 000)
Sehr selten (< 1/10 000)
Häufigkeit nicht bekannt (kann anhand der verfügbaren Daten nicht abgeschätzt werden)
|
Infektionen und Parasitenbefall
| |
Gelegentlich ≥ 1/1.000 und < 1/100
|
Hautinfektion*
| |
Follikulitis
| |
Erkrankungen des Immunsystems
| |
Selten ≥ 1/10.000 und < 1/1.000
|
Überempfindlichkeit
| |
Augenerkrankungen
| |
Gelegentlich ≥ 1/1.000 und < 1/100
|
Augenreizung
| |
Häufigkeit nicht bekannt
|
Verschwommene Sicht**
| |
Erkrankungen der Haut und des Unterhautgewebes
| |
Häufig (≥ 1/100 und < 1/10)
|
Pruritus
| |
Gelegentlich (≥ 1/1 000 und < 1/100)
|
Verschlimmerung der Psoriasis
| |
Dermatitis
| |
Erythem
| |
Hautausschlag***
| |
Akne
| |
Brennendes Hautgefühl
| |
Hautreizung
| |
Hauttrockenheit
| |
Selten (≥ 1/10 000 und < 1/1 000)
|
Dehnungsstreifen
| |
Hautabschuppung
| |
Häufigkeit nicht bekannt
|
Veränderung der Haarfarbe****
| |
Allgemeine Störungen und Anomalien an der Verabreichungsstelle
| |
Gelegentlich (≥ 1/1 000 und < 1/100)
|
Schmerzen an der Anwendungsstelle *****
| |
Selten (≥ 1/10 000 und < 1/1 000)
|
Rebound-Effekt
|
*Die gemeldeten Hautinfektionen umfassen bakterielle, pilzbedingte und virale Hautinfektionen.
**Siehe Abschnitt Warnhinweise und Vorsichtsmassnahme.
***Es wurden verschiedene Arten von Hautausschlägen gemeldet, darunter erythematöse Ausschläge und pustulöse Ausschläge.
****Eine vorübergehende Verfärbung von weißem oder grauem Haar in eine gelbliche Farbe an der Applikationsstelle auf der Kopfhaut wurde berichtet.
*****Verbrennungen an der Applikationsstelle sind in den Schmerzen an der Applikationsstelle enthalten.
Calcipotriol
Zu den Nebenwirkungen zählen Reaktionen an der Anwendungsstelle, Juckreiz, Hautreizungen, Brennen und Kribbeln, trockene Haut, Hautrötungen, Hautausschlag, Dermatitis, Ekzeme, Verschlimmerung der Psoriasis, Lichtempfindlichkeit und Überempfindlichkeitsreaktionen, darunter sehr seltene Fälle von Angioödem und Gesichtsödem.
Systemische Wirkungen nach topischer Anwendung können sehr selten auftreten und zu Hyperkalzämie oder Hyperkalziurie führen (siehe Abschnitt Warnhinweise und Vorsichtsmassnahmen).
Betamethason (in Form von Dipropionat)
Nach topischer Anwendung können lokale Reaktionen auftreten, insbesondere bei längerer Anwendung, darunter Hautatrophie, Teleangiektasien, Dehnungsstreifen, Follikulitis, Hypertrichose, periorale Dermatitis, Kontaktekzem, Depigmentierung und Milia colloidea.
Bei der Behandlung von Psoriasis mit topischen Kortikosteroiden besteht das Risiko, dass sich eine generalisierte pustulöse Psoriasis entwickelt.
Systemische Wirkungen nach topischer Anwendung von Kortikosteroiden sind bei Erwachsenen selten, können jedoch schwerwiegend sein. Eine Hemmung der Hypothalamus-Hypophysen-Achse, Katarakte, Infektionen, eine Beeinträchtigung der Stoffwechselkontrolle bei Diabetes mellitus und ein Anstieg des Augeninnendrucks können insbesondere nach längerer Behandlung auftreten. Systemische Wirkungen treten häufiger bei Anwendung unter Okklusion (Plastik, Hautfalten), bei Anwendung auf großen Flächen und bei Langzeitbehandlung auf (siehe Abschnitt Warnhinweise und Vorsichtsmassnahmen).
Pädiatrische Population
Es wurden keine klinisch signifikanten Unterschiede zwischen dem Verträglichkeitsprofil bei Erwachsenen und Jugendlichen beobachtet.
Insgesamt wurden 216 Jugendliche in 3 offenen klinischen Studien behandelt.
Weitere Informationen zu diesen Studien finden Sie im Abschnitt Klinische Wirksamkeit.
Meldung vermuteter Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungDie Anwendung von Dosen, die über die empfohlene Dosis hinausgehen, kann zu einem Anstieg des Kalziumspiegels im Blut führen. Dieser Effekt ist nach Absetzen der Behandlung reversibel. Zu den Symptomen einer Hyperkalzämie zählen Polyurie, Verstopfung, Muskelschwäche, Verwirrtheit und Koma.
Eine übermäßige und längere Anwendung topischer Kortikosteroide kann zu einer Hemmung der Hypothalamus-Hypophysen-Achse führen, was sich in einer sekundären Nebenniereninsuffizienz äußert, die in der Regel reversibel ist. In diesem Fall ist eine symptomatische Behandlung angezeigt.
Bei chronischer Toxizität sollte die Behandlung mit Kortikosteroiden schrittweise abgebrochen werden.
Ein Fall von Fehlgebrauch wurde bei einem Patienten berichtet, der wegen einer ausgedehnten erythrodermischen Psoriasis mit 240 g Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Salbe pro Woche (entspricht einer Tagesdosis von etwa 34 g) über einen Zeitraum von 5 Monaten (empfohlene Höchstdosis 15 g pro Tag) behandelt wurde; Während der Behandlung entwickelte der Patient ein Cushing-Syndrom und nach abruptem Absetzen der Behandlung eine pustulöse Psoriasis.
Eigenschaften/WirkungenATC-Code
D05AX52.
Wirkungsmechanismus
Calcipotriol ist ein Vitamin-D-Analogon. In-vitro-Daten deuten darauf hin, dass Calcipotriol die Differenzierung induziert und die Proliferation von Keratinozyten hemmt. Dies ist der Mechanismus, der zur Erklärung seiner Wirkung bei Psoriasis vorgeschlagen wird.
Wie andere topische Kortikosteroide hat Betamethasondipropionat entzündungshemmende, juckreizstillende, vasokonstriktive und immunsuppressive Eigenschaften, jedoch ohne nachgewiesene heilende Wirkung. Eine Behandlung unter Okklusion kann die Wirkung aufgrund einer stärkeren Penetration in die Hornschicht verstärken. Dadurch erhöht sich jedoch auch das Auftreten von Nebenwirkungen. Der Wirkmechanismus der entzündungshemmenden Wirkung topischer Kortikosteroide ist insgesamt noch nicht vollständig geklärt.
Pharmakodynamik
Die Nebennierenreaktion auf ACTH wurde durch Messung des Cortisolspiegels bei Patienten mit ausgedehnter Psoriasis auf der Kopfhaut und am Körper und einer wöchentlichen Anwendung von bis zu bis zu 106 g Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel in Kombination mit Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Salbe verwendeten. Eine geringfügige Senkung des Cortisolspiegels 30 Minuten nach der Verabreichung von ACTH wurde bei 5 von 32 Patienten (15,6 %) nach 4-wöchiger Behandlung und bei 2 von 11 Patienten (18,2 %), die die Behandlung auf 8 Wochen verlängerten, beobachtet. In allen Fällen war der Cortisolspiegel 60 Minuten nach der Verabreichung von ACTH wieder normal. Bei diesen Patienten wurden keine Veränderungen des Kalziumstoffwechsels beobachtet. Hinsichtlich der hypothalamisch-hypophysären Hemmung zeigt diese Studie, dass sehr hohe Dosen von Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel und Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Salbe eine geringe Wirkung auf die Hypothalamus-Hypophysen-Achse haben können.
Klinische Wirksamkeit
Die Wirksamkeit einer einmal täglichen Anwendung von Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel wurde in zwei randomisierten, doppelblinden, 8-wöchigen klinischen Studien mit insgesamt über 2.900 Patienten mit mindestens leichter Psoriasis der Kopfhaut gemäß dem Investigator's Global Assessment of disease severity (IGA) mindestens leicht ausgeprägt war. Als Vergleichspräparate wurden Betamethasondipropionat in Gelform, Calcipotriol in Gelform und (in einer der Studien) das Gel allein verwendet, jeweils einmal täglich angewendet. Die Ergebnisse für den primären Endpunkt (keine oder sehr leichte Erkrankung gemäß IGA in Woche 8) zeigten, dass Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel signifikant wirksamer war als die Vergleichspräparate. Die Ergebnisse zur Wirkgeschwindigkeit, die auf ähnlichen Daten für Woche 2 basieren, zeigten ebenfalls, dass Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel signifikant wirksamer war als die Vergleichspräparate.
|
% der patienten ohne Erkrankung oder mit sehr leichter Erkrankung
|
Betamethasondipropionat und Calcipotriol-Gel
(n=1 108)
|
Betamethasondipropionat (n=1 118)
|
Calcipotriol (n=558)
|
Trägergel (n=136)
| |
woche 2
|
53,2 %
|
42,8 %1
|
17,2 %1
|
11,8 %1
| |
woche 8
|
69,8 %
|
62,5 %1
|
40,1 %1
|
22,8 %1
|
1 Statistisch weniger wirksam als die Kombination aus Betamethasondipropionat und Calcipotriol-Gel (p < 0,001)
Die Wirksamkeit von Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel bei einmal täglicher Anwendung am Körper (mit Ausnahme der Kopfhaut) wurde in einer randomisierten, doppelblinden, 8-wöchigen klinischen Studie mit 296 Patienten mit leichter bis mittelschwerer Psoriasis vulgaris gemäß der . Die Vergleichsprodukte waren Betamethasondipropionat in Gelform, Calcipotriol in Gelform und das Gel allein, jeweils einmal täglich angewendet. Die primären Ansprechkriterien waren eine nach IGA kontrollierte Erkrankung in Woche 4 und Woche 8. Eine kontrollierte Erkrankung wurde definiert als „abgeheilt“ oder „minimale Erkrankung“ bei Patienten mit einer mittelschweren Erkrankung zu T0 oder als „abgeheilt“ bei Patienten mit einer leichten Erkrankung zu T0.
Sekundäre Ansprechkriterien waren die prozentuale Veränderung des Psoriasis Severity and Area Index (PASI) zwischen T0 und Woche 4 sowie zwischen T0 und Woche 8.
|
% der Patienten mit einer kontrollierten Erkrankung
|
Betamethasondipropionat und Calcipotriol-Gel
(n=126)
|
Betamethasondipropionat (n=68)
|
Calcipotriol (n=67)
|
Trägergel (n=35)
| |
woche 4
|
20,6 %
|
10,3 %1
|
4,5 %1
|
2,9 %1
| |
woche 8
|
31,7 %
|
19,1 %1
|
13,4 %1
|
0,0 %1
|
1 Statistisch weniger wirksam als Betamethasondipropionat und Calcipotriol-Gel (p<0,05)
|
Durchschnittliche Reduzierung des PASI
|
Betamethasondipropionat und Calcipotriol-Gel
(n=126)
|
Betamethasondipropionat (n=68)
|
Calcipotriol (n=67)
|
Trägergel (n=35)
| |
woche 4
|
50,2 (32,7)
|
40,8 (33,3) 1
|
32,1 (23,6)1
|
17,0 (31,8)1
| |
woche 8
|
58,8 (32,4)
|
51,8 (35,0)
|
40,8 (31,9)1
|
11,1 (29,5)1
|
1 Statistisch weniger wirksam als die Kombination aus Betamethasondipropionat und Calcipotriol-Gel (p<0,05)
Eine weitere randomisierte klinische Studie mit 312 Patienten mit mindestens mittelschwerer Psoriasis der Kopfhaut gemäß IGA untersuchte die Anwendung von Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel einmal täglich im Vergleich zu Daivonex für die Kopfhaut zweimal täglich über einen Zeitraum von 8 Wochen. Die Ergebnisse für den primären Endpunkt (Abwesenheit der Erkrankung oder sehr leichte Erkrankung gemäß IGA in Woche 8) zeigten, dass Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel statistisch signifikant wirksamer war als Daivonex Lösung für die Kopfhaut.
|
% der Patienten ohne Erkrankung oder mit sehr leichter Erkrankung
|
Calcipotriol + Betamethasondipropionat-Gel (n=207)
|
Daivonex Lösung für die Kopfhaut (n=105)
| |
woche 8
|
68,6 %
|
31,4 %1
|
1 Statistisch weniger wirksam als Calcipotriol + Betamethasondipropionat-Gel (p < 0,001)
Eine randomisierte, doppelblinde Langzeitstudie mit 873 Patienten mit mindestens mittelschwerer Psoriasis der Kopfhaut (gemäß IGA) untersuchte die Anwendung von Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel im Vergleich zu Calcipotriol in Gelform. Beide Behandlungen wurden einmal täglich, je nach Bedarf, bis zu 52 Wochen lang intermittierend angewendet.
Mögliche Nebenwirkungen, die mit der langfristigen Anwendung von Kortikosteroiden auf der Kopfhaut in Zusammenhang stehen könnten, wurden in einer Blindstudie von einem unabhängigen Dermatologen-Gremium festgestellt. Es gab keinen Unterschied im Prozentsatz der Patienten mit solchen Nebenwirkungen zwischen den behandelten Gruppen (2,6 % in der Gruppe Calcipotriol + Betamethason 50 Mikrogramm/0,5 mg/g Gel und 3,0 % in der Calcipotriol-Gruppe; p = 0,73). Es wurden keine Fälle von Hautatrophie berichtet.
Die Wirksamkeit von Crysalis Leman 50 Mikrogramm/0,5 mg/g bei einmal täglicher Anwendung zur Behandlung von leichter bis mittelschwerer Plaque-Psoriasis wurde in einer 8-wöchigen randomisierten Doppelblindstudie mit 283 Probanden untersucht (0155/2018). Die Vergleichspräparate waren das Trägergel allein und das Kombinationsgel Calcipotriol + Betamethason 50 Mikrogramm/g + 0,5 mg/g (DAIVOBET-Gel). Die therapeutische Äquivalenz von Crysalis Leman mit dem Kombinationsgel Calcipotriol + Betamethason 50 Mikrogramm/g + 0,5 mg/g (DAIVOBET-Gel) konnte auf der Grundlage einer äquivalenten durchschnittlichen Veränderung in % gegenüber dem Ausgangswert des PASI in Woche 4/Tag 29 für beide Behandlungen festgestellt werden. Die Überlegenheit von Crysalis Leman 50 Mikrogramm/0,5 mg/g gegenüber dem Trägergel wurde anhand der durchschnittlichen prozentualen Veränderung der primären Wirksamkeitsvariable nachgewiesen.
|
Relative Veränderung gegenüber dem PASI-Ausgangswert [%] Woche 4 / Tag 29
|
Crysalis Leman (N=123)
|
DAIVOBET (N=121)
|
Trägergel (N=39)
| |
Durchschnitt ± SD
|
-58.1 ± 2.2
|
-59.6 ± 2.3
|
-21.8 ± 4.2
| |
95%-IC
|
-62.5, -53.7
|
-64.42, -55.3
|
-30.0 -13.5
| |
Durchschnittsunterschied 1 ± SE
|
|
1.7 ± 3.2
|
-36.6 ± 4.7
| |
Durchschnittsunterschied 1 95%-CI
|
|
-4.6, 7.9
|
-45.7, -27.0
| |
Schlussfolgerungen 2,3
|
|
Äquivalenz
|
Überlegenheit
|
1 Relative Differenz gegenüber Crysalis Leman, bestimmt als Crysalis Leman Gel minus DAIVOBET Gel bzw. Crysalis Leman Gel minus generisches Trägergel.
2 Die Äquivalenz von Crysalis Leman Gel und DAIVOBET Gel ist nachgewiesen, wenn das 95 %-Konfidenzintervall der mittleren Differenz vollständig innerhalb des Äquivalenzbereichs von -15 % bis + 15 % liegt.
3 Die Überlegenheit von Crysalis Leman Gel gegenüber dem generischen Trägergel ist nachgewiesen, wenn die obere Grenze des 95 %-Konfidenzintervalls der mittleren Differenz negativ ist, d. h. nicht den Wert Null enthält.
Pädiatrische Population
Kopfhaut
Die Auswirkungen auf den Kalziumstoffwechsel wurden in zwei offenen, unkontrollierten klinischen Studien über acht Wochen mit insgesamt 109 Jugendlichen im Alter von 12 bis 17 Jahren mit Psoriasis der Kopfhaut untersucht, die bis zu 69 g pro Woche Calcipotriol + Betamethason 50 Mikrogramm/g + 0,5 mg/g Gel angewendet hatten. Es wurden keine Fälle von Hyperkalzämie und keine klinisch relevanten Veränderungen der Kalziumausscheidung im Urin berichtet. Die Nebennierenreaktion auf die Verabreichung von ACTH wurde bei 30 Patienten gemessen; ein Patient zeigte nach vierwöchiger Behandlung unter ACTH eine leichte Abnahme des Cortisolspiegels, die jedoch ohne klinische Symptome und reversibel war.
Kopfhaut und Körper
Die Auswirkungen auf den Kalziumstoffwechsel wurden in einer 8-wöchigen offenen, unkontrollierten klinischen Studie an 107 Jugendlichen im Alter von 12 bis 17 Jahren mit Psoriasis der Kopfhaut und des Körpers untersucht, die bis zu 114,2 g pro Woche Calcipotriol + Betamethason 50 Mikrogramm/g + 0,5 mg/g Gel verwendeten. Es wurden keine Fälle von Hyperkalzämie und keine klinisch relevanten Veränderungen der Kalziumausscheidung im Urin berichtet. Die Nebennierenreaktion auf den ACTH-Test wurde bei 31 Patienten gemessen; die Cortisolreaktion war nach dem ACTH-Test bei 5 Patienten vermindert, von denen 2 Patienten nur eine begrenzte Abnahme zeigten. Diese Abnahme wurde nach 4-wöchiger Behandlung bei 4 Patienten und nach 8-wöchiger Behandlung bei 2 Patienten beobachtet, darunter 1 Patient, der nach 4 und 8 Wochen Behandlung eine Abnahme des Cortisolspiegels zeigte. Diese Ereignisse waren leicht, ohne klinische Manifestationen und reversibel.
PharmakokinetikDie systemische Exposition gegenüber Calcipotriol und Betamethasondipropionat aus der topischen Kombination Calcipotriol + Betamethason 50 Mikrogramm/g + 0,5 mg/g Gel ist vergleichbar mit der Kombination Calcipotriol + Betamethason 50 Mikrogramm/g + 0,5 mg/g Salbe bei Ratten und Minischweinen. Klinische Studien mit einer radioaktiv markierten Salbe zeigen, dass die systemische Resorption von Calcipotriol und Betamethason aus der Formulierung Calcipotriol + Betamethason 50 Mikrogramm/g + 0,5 mg/g Salbe weniger als 1 % der Dosis (2,5 g) beträgt, wenn sie 12 Stunden lang auf normale Haut (625 cm²) aufgetragen wird. Die Anwendung auf Psoriasis-Plaques und unter Okklusivverbänden kann die Resorption topischer Kortikosteroide erhöhen. Die Resorption durch verletzte Haut beträgt etwa 24 %.
Nach systemischer Exposition werden die beiden Wirkstoffe Calcipotriol und Betamethasondipropionat schnell und weitgehend metabolisiert. Die Proteinbindung beträgt etwa 64 %. Die Plasmahalbwertszeit nach intravenöser Verabreichung beträgt 5 bis 6 Stunden. Aufgrund der Bildung eines Reservoirs in der Haut beträgt die Ausscheidung nach topischer Anwendung einige Tage. Betamethason wird hauptsächlich in der Leber, aber auch in den Nieren zu Glucuroniden und Sulfatestern metabolisiert. Die Ausscheidung von Calcipotriol erfolgt über den Stuhl (Ratten und Zwergschweine) und die von Betamethasondipropionat über den Urin (Ratten und Mäuse).
Bei Ratten zeigten Studien zur Verteilung von radioaktiv markiertem Calcipotriol und Betamethasondipropionat im Gewebe, dass die Niere und die Leber die höchsten Radioaktivitätswerte aufwiesen.
Calcipotriol und Betamethasondipropionat lagen in allen Blutproben der 34 Patienten, die über einen Zeitraum von 4 bis 8 Wochen gleichzeitig mit Calcipotriol + Betamethason 50 Mikrogramm/g + 0,5 mg/g Gel und Calcipotriol + Betamethason 50 Mikrogramm/g + 0,5 mg/g Salbe behandelt wurden, unter der unteren Bestimmungsgrenze. 50 Mikrogramm/g + 0,5 mg/g zur Behandlung einer ausgedehnten Psoriasis am Körper und auf der Kopfhaut behandelt wurden. Ein Metabolit von Calcipotriol und ein Metabolit von Betamethasondipropionat waren bei einigen Patienten nachweisbar.
Präklinische DatenStudien mit Kortikosteroiden bei Tieren haben eine Embryotoxizität (Gaumenspalten, Skelettfehlbildungen) gezeigt. In Studien zur Fortpflanzungsfunktion bei Ratten nach langfristiger oraler Verabreichung von Kortikosteroiden wurden eine Verlängerung der Trächtigkeitsdauer sowie längere und schwerere Geburten beobachtet. Außerdem wurden eine Verringerung der Überlebensrate, des Körpergewichts und der Gewichtszunahme der Nachkommen beobachtet. Die Fruchtbarkeit war nicht beeinträchtigt. Die Relevanz dieser Daten für den Menschen ist nicht bekannt.
Eine Studie zur Karzinogenität bei topischer Anwendung bei Mäusen und eine Studie zur Karzinogenität bei oraler Anwendung bei Ratten ergaben keine besonderen Risiken von Calcipotriol für den Menschen.
Studien zur Photo(ko)karzinogenität bei Mäusen legen nahe, dass Calcipotriol die tumorauslösende Wirkung von UV-Strahlung auf die Haut verstärken könnte.
Eine Studie zur Karzinogenität bei topischer Anwendung bei Mäusen und eine Studie zur Karzinogenität bei oraler Anwendung bei Ratten ergaben keine besonderen Risiken von Betamethasondipropionat für den Menschen. Es wurden keine Photokarzinogenitätsstudien mit Betamethasondipropionat durchgeführt.
In lokalen Verträglichkeitsstudien an Kaninchen verursachte Calcipotriol + Betamethason 50 Mikrogramm/g + 0,5 mg/g Gel leichte bis mäßige Hautreizungen und leichte, vorübergehende Augenreizungen.
Umweltverträglichkeitsstudien haben gezeigt, dass Betamethason ein Risiko für die aquatische Umwelt darstellen kann.
Sonstige HinweiseInkompatibilitäten
Da keine Verträglichkeitsstudien vorliegen, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Crysalis Leman Gel darf nach Ablauf des auf der Verpackung angegebenen Verfallsdatums nicht mehr verwendet werden.
Stabilität nach dem Öffnen
Angebrochene Verpackungen können innerhalb von 6 Monaten nach dem Öffnen verwendet werden.
Besondere Lagerungshinweise
Außerhalb der Reichweite von Kindern aufbewahren. Behälter geschlossen bei Raumtemperatur (15-25 °C) und vor Licht geschützt aufbewahren.
Hinweise für die Handhabung
Dieses Arzneimittel kann eine Gefahr für die Umwelt darstellen (siehe Abschnitt „Präklinische Daten“).
Nicht verwendete Arzneimittel oder Arzneimittelabfälle sind gemäß den geltenden Vorschriften zu entsorgen.
Art und Inhalt der äußeren Verpackung
Weißer zylindrischer Behälter (HDPE) mit weißem Schraubverschluss (PP). Der Behälter ist in einem Karton verpackt.
Zulassungsnummer69482 (Swissmedic)
PackungenPackung mit 1 Tube à 30 g, [B]
Packung mit 1 Tube à 60 g [B]
Packung mit 2 Tuben à 60 g (120 g) [B]
ZulassungsinhaberinLeman SKL SA, Lancy
Stand der InformationAusländisches Vergleichsarzneimittel: Juni 2021
Keine für die Sicherheit relevanten Informationen von Swissmedic: Juni 2024
|

