ZusammensetzungWirkstoffe
OKA-Stamm des Varicella-Zoster-Virus
Hilfsstoffe
Pulver: Aminosäuren (enthält Phenylalanin 331 µg), Lactose, Mannitol (E 421), Sorbitol (E 420) 6 mg.
Lösungsmittel: Wasser für Injektionszwecke.
Rückstände
Neomycinsulfat.
Indikationen/AnwendungsmöglichkeitenVarilrix ist indiziert zur aktiven Immunisierung gegen Varizellen (Windpocken):
·von gesunden Kindern ab dem vollendeten 12. Lebensmonat, Jugendlichen und Erwachsenen.
Varilrix kann unter besonderen Umständen ab einem Alter von 9 Monaten verabreicht werden (z.B. in Übereinstimmung mit nationalen Impfempfehlungen, in epidemischen Situationen, oder wenn für das Kind ein hohes Risiko besteht, an einer schweren Varizella zu erkranken, oder wenn es in einem nahen Kontakt zu einem Risikopatienten steht).
·von Personen mit einem hohen Risiko für schwer verlaufende Varizellen (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»).
Bei empfänglichen gesunden Personen, die in engem Kontakt stehen zu Personen mit einem hohen Risiko einer schwer verlaufenden Varizellen-Infektion, wird die Impfung empfohlen, um das Risiko einer Übertragung des Wildtyp-Virus auf diese Personen zu verringern. Zu den engen Kontaktpersonen zählen Eltern und Geschwister von Hochrisikopersonen sowie medizinisches und paramedizinisches Personal.
Da nur begrenzte Daten aus klinischen Studien für Varilrix bei Patienten mit hohem Risiko für schwer verlaufende Varizellen vorliegen, wird folgendes empfohlen, sollte eine Impfung in Erwägung gezogen werden:
·Eine Erhaltungschemotherapie sollte während einer Woche vor und einer Woche nach der Immunisierung von Patienten in der akuten Phase der Leukämie unterbrochen werden. Patienten unter Strahlentherapie sollten normalerweise während der Behandlungsphase nicht geimpft werden. Generell werden Patienten geimpft, wenn sie sich in einer vollständigen hämatologischen Remission der Erkrankung befinden.
·Die Gesamtzahl der Lymphozyten sollte mindestens 1200 pro mm3 betragen bzw. es sollten keine sonstigen Hinweise auf eine mangelnde zelluläre Immunkompetenz vorliegen.
·Bei Patienten mit anstehender Organtransplantation (z.B. Nierentransplantation) sollte die Impfung einige Wochen vor Verabreichung der immunsuppressiven Behandlung erfolgen.
Varilrix sollte gemäss den offiziellen Impfempfehlungen angewendet werden.
Dosierung/AnwendungÜbliche Dosierung
Eine Impfdosis beträgt 0,5 mL des rekonstituierten Impfstoffes.
Gesunde Personen
Um den optimalen Schutz vor Varizellen zu gewährleisten, werden für Kinder ab dem Alter von 9 Monaten, Jugendliche und Erwachsene 2 Impfdosen empfohlen (siehe «Eigenschaften/Wirkungen»). Die beiden Dosen sollten in der Regel in einem Abstand von 6 Wochen verabreicht werden. Unter keinen Umständen darf der Abstand weniger als 4 Wochen betragen.
Um den Impfschutz zu gewährleisten, muss die ganze empfohlene Dosis verabreicht werden.
Personen mit einem hohen Risiko für schwer verlaufende Varizellen
Personen mit einem hohen Risiko für schwer verlaufende Varizellen profitieren möglicherweise von einer Wiederholungsimpfung nach dem 2-Dosen-Schema (siehe «Eigenschaften/Wirkungen»).
Eine periodische Bestimmung der Varizellen-Antikörper kann sinnvoll sein, um denjenigen Patienten, deren Antikörpertiter stark gesunken ist, eine Auffrischimpfung zu verabreichen.
Unter keinen Umständen sollte das Intervall zwischen den Impfdosen weniger als 4 Wochen betragen.
Austauschbarkeit der Impfstoffe
Eine Impfdosis Varilrix kann an Impflinge verabreicht werden, die bereits vorgängig eine Einzeldosis eines anderen Varizellen-Impfstoffes erhalten haben und umgekehrt.
Art der Anwendung
Varilrix ist bevorzugt subkutan (s.c.) oder intramuskulär (i.m.) in die Deltoid-Region des Oberarms oder in den anterolateralen Bereich des Oberschenkels zu injizieren.
Bei Personen mit Blutungsstörungen (z.B. Thrombozytopenie oder Gerinnungsstörungen) muss der Impfstoff subkutan verabreicht werden.
Hinweise zur Rekonstitution des Impfstoffes vor der Anwendung, siehe «Sonstige Hinweise».
KontraindikationenVarilrix ist kontraindiziert bei Personen mit schwerer humoraler oder zellulärer Immundefizienz (angeboren oder erworben), wie z. B.:
·Personen mit primären oder erworbenen Immunschwächezuständen mit einer totalen Lymphozytenzahl von weniger als 1'200 pro mm3, oder
·Personen mit anderen Symptomen einer zellulären Immuninkompetenz, beispielsweise bei Personen mit Leukämien, Lymphomen, Blutdyskrasie, klinischer Manifestation einer HIV-Infektion, oder
·Personen, die eine immunsuppressive Therapie erhalten, einschliesslich Kortikosteroide in hoher Dosierung (siehe auch «Warnhinweise und Vorsichtsmassnahmen»), oder
·schwere kombinierte Immundefizienz
·Agammaglobulinämie, oder
·AIDS oder symptomatische HIV-Infektion oder ein altersspezifischer CD4+-T-Lymphozyten-Anteil von < 25% (bei Säuglingen im Alter unter 12 Monaten), < 20% (bei Kindern im Alter von 12 bis 35 Monaten), < 15% (bei Kindern im Alter von 36 bis 59 Monaten).
Varilrix ist kontraindiziert bei Personen mit einer bekannten Überempfindlichkeit gegenüber Neomycin oder einem der sonstigen Bestandteile des Impfstoffs (siehe «Zusammensetzung»). Die positive Anamnese einer Kontaktdermatitis, welche auf Neomycin zurückzuführen ist, stellt hingegen keine Kontraindikation dar.
Varilrix ist kontraindiziert bei Personen, die nach früherer Verabreichung eines Varizellen-Impfstoffs Zeichen einer Überempfindlichkeit zeigten.
Varilrix ist bei schwangeren Frauen kontraindiziert. Drei Monate nach der Impfung sollte eine Schwangerschaft sicher vermieden werden (siehe «Schwangerschaft, Stillzeit»).
Warnhinweise und VorsichtsmassnahmenVarilrix soll nicht intradermal und darf unter keinen Umständen intravasal injiziert werden!
Vor der Impfung von Frauen im gebärfähigen Alter muss eine Schwangerschaft ausgeschlossen werden. Nach der Impfung muss über einen Zeitraum von 3 Monaten sicher verhütet werden (siehe «Schwangerschaft, Stillzeit»).
Wie auch bei anderen Impfstoffen sollte die Verabreichung von Varilrix an Personen mit akuter Erkrankung, die von hohem Fieber begleitet ist, auf einen späteren Zeitpunkt verschoben werden. Bei gesunden Personen stellt eine leichte Infektion hingegen keine Kontraindikation dar.
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Wie generell bei der Verabreichung von injizierbaren Impfstoffen ist es ratsam, für den seltenen Fall einer anaphylaktischen Reaktion eine angemessene medizinische Behandlung bereitzuhalten (z.B. Adrenalin-Lösung 1/1'000).
Alkohol oder andere Desinfektionsmittel müssen vollständig von der Hautoberfläche verdunstet sein, ehe der Impfstoff injiziert wird, da diese Mittel die attenuierten Viren im Impfstoff inaktivieren können.
Es gibt nur limitierte publizierte Daten zur Prävention von Varizellen nach Kontakt mit dem Varizella-Virus. Durch eine Impfung 3-5 Tage nach natürlicher Varizellen-Exposition kann eine begrenzte Schutzwirkung gegen Varizellen erzielt werden (siehe «Eigenschaften/Wirkungen»).
Wie bei jedem Impfstoff kann es sein, dass nicht bei allen Geimpften eine schützende Immunantwort aufgebaut wird.
Varizellenerkrankungen können auch bei Personen auftreten, die vorher mit einem Varizellen-Lebendimpfstoff geimpft worden sind. Diese sogenannten Durchbruchserkrankungen verliefen jedoch meist leicht. Im Vergleich zu ungeimpften Personen trat Fieber seltener auf, die Hauterscheinungen waren in Anzahl und Ausmass weniger ausgeprägt.
Übertragung
Es hat sich gezeigt, dass das OKA-Impfvirus von geimpften Personen, die nach der Impfung einen Hautausschlag entwickelt haben, mit einer sehr niedrigen Rate auf seronegative Kontaktpersonen übertragen wird. Eine Übertragung des OKA-Impfvirus von einer geimpften Person, die keinen Hautausschlag entwickelt hat, auf eine seronegative Kontaktperson kann nicht ausgeschlossen werden.
Im Gegensatz zu gesunden Geimpften kommt es bei Leukämiepatienten häufiger zum Auftreten eines papulo-vesikulären Exanthems (siehe auch «Unerwünschte Wirkungen»). Auch in diesen Fällen war der Verlauf der Erkrankung bei den Kontaktpersonen mild.
Geimpfte Personen sollten versuchen, bis zu 6 Wochen nach der Impfung, wenn immer möglich, engen Kontakt zu empfänglichen Personen mit einem hohen Risiko für Varizellen zu vermeiden, selbst wenn es zu keinem Varizellen-ähnlichen Ausschlag gekommen ist. Wenn der Kontakt zu empfänglichen Personen mit einem hohen Risiko für Varizellen nicht zu vermeiden ist, sollte das potentielle Risiko einer Übertragung des Varicella-Impfvirus gegen das Risiko einer Ansteckung und Übertragung des Varicella-Wildtyp-Virus abgewogen werden.
Empfängliche Personen mit einem hohen Risiko für Varizellen sind:
·Personen mit eingeschränkter Immunantwort (siehe «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»);
·Schwangere Frauen ohne dokumentierte positive Varizellen (Windpocken) in der Vorgeschichte oder ohne einen Labornachweis einer vorausgegangenen Infektion;
·Neugeborene von Müttern ohne dokumentierte positive Varizellen (Windpocken) in der Vorgeschichte oder ohne einen Labornachweis einer vorausgegangenen Infektion.
Der milde Verlauf des Hautausschlags bei Kontaktpersonen deutet darauf hin, dass das Varicella-Impfvirus nach Passage durch den menschlichen Wirt attenuiert bleibt.
Personen mit einem hohen Risiko für schwer verlaufende Varizellen
Es liegen nur begrenzte Daten zur Anwendung von Varilrix bei immungeschwächten Patienten vor, daher sollte die Impfung nur mit Vorsicht und nur dann in Betracht gezogen werden, wenn nach Ansicht des Arztes der Nutzen die Risiken überwiegt.
Immungeschwächte Patienten, die keine Kontraindikation für diese Impfung haben (siehe «Kontraindikationen»), sprechen möglicherweise nicht so gut auf die Impfung an wie immunkompetente Personen, so dass einige dieser Patienten trotzdem an Varizellen erkranken können. Immungeschwächte Patienten sollten sorgfältig auf Anzeichen von Varizellen insbesondere schwerwiegende und eventuell fatale Verläufe überwacht werden.
Sehr wenige Berichte liegen vor über disseminierte Varizellenerkrankungen mit Beteiligung innerer Organe nach Impfung mit dem OKA-Impfstamm; diese betrafen insbesondere, aber nicht nur, immungeschwächte Personen. In Einzelfällen wurden auch fatale Verläufe trotz Therapie mit Aciclovir berichtet.
Das Auftreten eines Herpes zoster, eine bekannte Späterscheinung nach natürlicher Varizellen-Infektion, kann auch nach der Impfung nicht ausgeschlossen werden (siehe «Unerwünschte Wirkungen»).
Langzeitdaten zur Inzidenz des Herpes zosters über mehrere Jahrzehnte liegen noch nicht vor, so dass die Häufigkeit von Herpes zoster nach Impfung im Vergleich zur natürlichen Infektion noch nicht beurteilt werden kann.
Enzephalitis
Nach der Markteinführung von Varizellen-Impfstoffen (lebend, abgeschwächt), einschliesslich Varilrix, wurden Fälle von Enzephalitis berichtet. Fatale Verläufe wurden beobachtet, insbesondere bei immungeschwächten Personen (siehe «Kontraindikationen»). Geimpfte bzw. Eltern/Erziehungsberechtigte sollen angewiesen werden, umgehend ärztliche Hilfe in Anspruch zu nehmen, wenn nach der Impfung Symptome auftreten, die auf eine Enzephalitis hindeuten, z.B. Bewusstseinsverlust oder -minderung, Konvulsionen oder Ataxie, insbesondere in Verbindung mit Fieber und Kopfschmerzen.
Sonstige Bestandteile mit bekannter Wirkung
Das Arzneimittel enthält 6 mg Sorbitol pro Impfdosis.
Dieses Arzneimittel enthält 331 µg Phenylalanin pro Dosis. Phenylalanin kann schädlich sein für Patienten mit Phenylketonurie.
InteraktionenEin eventuell erforderlicher Tuberkulintest muss entweder vor oder gleichzeitig mit der Impfung vorgenommen werden, da berichtet wurde, dass Lebendimpfstoffe die Tuberkulinempfindlichkeit der Haut zeitweise herabsetzen können. Da diese verminderte Reaktion bis zu maximal 6 Wochen anhalten kann, sollte zur Vermeidung falsch negativer Ergebnisse ein Tuberkulintest nicht innerhalb dieses Zeitraumes nach der Impfung durchgeführt werden. Die Verwendung alternativer und exakterer Methoden (z.B. Zytokin basiert) zum Tuberkulose Nachweis sollte überlegt werden.
Personen, welche Immunglobuline oder Bluttransfusionen erhalten haben, sollte die Impfung frühestens nach 3 Monaten verabreicht werden, da durch zugeführte Antikörper eine Immunisierung möglicherweise ausbleibt.
Die Einnahme von Salicylaten sollte während 6 Wochen nach der Varizellen-Impfung vermieden werden, da über Reye-Syndrome nach dem Gebrauch von Salicylaten während einer natürlichen Varizellen-Infektion berichtet wurde.
Gesunde Personen
Klinische Studien mit einem Varicella-haltigen Impfstoff (MMRV/Priorix-Tetra) zeigen, dass Varilrix gleichzeitig mit jedem der folgenden monovalenten oder kombinierten Impfstoffe verabreicht werden kann:
Mumps-Masern-Röteln-Impfstoff (MMR), Diphtherie-Tetanus-azellulärer Pertussis-Impfstoff (DTPa), Diphtherie-Tetanus-azellulärer Pertussis-Impfstoff mit reduziertem Antigengehalt (dTpa), Haemophilus influenzae Typ b-Impfstoff (Hib), inaktivierter Polio-Impfstoff (IPV), hexavalenter Impfstoff (DTPa-HBV-IPV+Hib), Meningokokken C-Konjugat-Impfstoff (MenC), Hepatitis B-Impfstoff (HBV).
Die kombinierte Gabe von MMRV mit einem Meningokokken B-Impfstoff (Bexsero) wurde auch untersucht. Die Nichtunterlegenheit der Serokonversionsrate nach kombinierter Gabe wurde für Varizellen mit dem Cut-off von ≥1,25 (Serokonversion) bei der Messung mit gpELISA nachgewiesen, konnte aber für den Cut-off von ≥5 gpELISA-Einheiten/mL (Seroprotektion) nicht nachgewiesen werden.
Verschiedene Impfstoffe sollten immer an unterschiedlichen Injektionsstellen appliziert werden. Inaktivierte Impfstoffe können unabhängig vom Zeitpunkt der Varizellen-Impfung appliziert werden.
Falls ein Masernimpfstoff nicht zur gleichen Zeit wie Varilrix gegeben wird, muss ein Intervall von mindestens einem Monat zwischen den beiden Impfungen eingehalten werden, da die Masernimpfung zu einer kurzdauernden Unterdrückung der zellulären Immunantwort führen kann.
Personen mit einem hohen Risiko für schwer verlaufende Varizellen
Varilrix sollte nicht gleichzeitig mit anderen abgeschwächten Lebendimpfstoffen verabreicht werden. Inaktivierte Impfstoffe können unter der Voraussetzung, dass keine spezifischen Kontraindikationen bestehen, unabhängig vom Zeitpunkt der Varizellen-Impfung appliziert werden.
Verschiedene Impfstoffe sollten immer an unterschiedlichen Injektionsstellen appliziert werden.
Schwangerschaft, StillzeitSchwangerschaft
Adäquate Daten zur Anwendung von Varilrix während der Schwangerschaft beim Menschen liegen nicht vor. Tierexperimentelle Studien zur Reproduktionstoxizität wurden nicht durchgeführt.
Schwangere dürfen nicht mit Varilrix geimpft werden (siehe «Kontraindikationen»). Vor der Impfung von Frauen im gebärfähigen Alter muss eine Schwangerschaft ausgeschlossen werden. Nach der Impfung mit Varilrix muss über einen Zeitraum von 3 Monaten sicher verhütet werden.
Stillzeit
Studien mit Daten über die Anwendung bei stillenden Müttern liegen nicht vor. Übertragungen des OKA Stammes von geimpften Müttern im Wochenbett auf das Neugeborene wurden in Einzelfällen publiziert (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Fertilität
Es liegen keine Daten vor.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien zu den Auswirkungen von Varilrix auf die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Nebenwirkungen wie Fieber, Kopfschmerzen oder Müdigkeit können einen negativen Einfluss bezüglich Fahrtüchtigkeit und das Bedienen von Maschinen haben (siehe auch «Unerwünschte Wirkungen»).
Unerwünschte WirkungenDaten aus klinischen Studien
Gesunde Personen
Mehr als 7'900 Personen haben an klinischen Studien teilgenommen, in denen das Reaktogenitätsprofil des subkutan verabreichten Impfstoffs entweder bei alleiniger Gabe oder bei gemeinsamer Verabreichung mit anderen Impfstoffen untersucht wurde.
Das nachfolgend dargestellte Sicherheitsprofil stützt sich auf die Erfahrungen mit der Verabreichung von insgesamt 5'369 Dosen Varilrix allein bei Kindern, Jugendlichen und Erwachsenen.
Häufigkeiten sind aufgeführt als: «sehr häufig» (≥1/10), «häufig» (< 1/10, ≥1/100), «gelegentlich» (< 1/100, ≥1/1000), «selten» (< 1/1000, ≥1/10'000), «sehr selten» (< 1/10'000).
Infektionen und parasitäre Erkrankungen
Gelegentlich: Infektion der oberen Atemwege, Pharyngitis.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Lymphadenopathie.
Psychiatrische Erkrankungen
Gelegentlich: Reizbarkeit.
Erkrankungen des Nervensystems
Gelegentlich: Kopfschmerz, Somnolenz.
Augenerkrankungen
Selten: Konjunktivitis.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Husten, Rhinitis.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Übelkeit, Erbrechen.
Selten: Bauchschmerzen, Durchfall.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Hautausschlag.
Gelegentlich: Hautausschlag wie bei Varizelleninfektion, Juckreiz.
Selten: Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Arthralgie, Myalgie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schmerz, Rötung (17,0% bei Kindern und 19,9% bei Jugendlichen und Erwachsenen), Fieber (10,1%) (Oral-/Achseltemperatur ≥37,5°C oder Rektaltemperatur ≥38,0°C)*.
Häufig: Schwellung an der Injektionsstelle*.
Gelegentlich: Fieber (Oral-/Achseltemperatur > 39,0°C oder Rektaltemperatur > 39,5°C), Müdigkeit, Unwohlsein.
* Schwellung an der Injektionsstelle und Fieber wurden in Studien mit Jugendlichen und Erwachsenen sehr häufig gemeldet. Schwellungen wurden ebenfalls sehr häufig nach der zweiten Dosis bei Kindern unter 13 Jahren beobachtet.
Es wurde ein Trend zu einer erhöhten Inzidenz an Schmerzen, Rötung und Schwellung nach der zweiten Impfdosis beobachtet verglichen mit der ersten Dosis.
Bezüglich Reaktogenität zwischen vorgängig seropositiven und seronegativen Personen wurde kein Unterschied festgestellt.
In einer klinischen Studie erhielten 328 Kinder im Alter von 11 bis 21 Monaten entweder subkutan (sc) oder intramuskulär (im) den Kombinationsimpfstoff von GSK gegen Masern, Mumps, Röteln und Varizellen (mit demselben Varizellenstamm wie in Varilrix). Für beide Verabreichungswege wurde ein vergleichbares Sicherheitsprofil beobachtet.
Personen mit einem hohen Risiko für schwer verlaufende Varizellen
Aus klinischen Studien mit Personen mit einem hohem Risiko, an schwerwiegender Varicella zu erkranken, sind nur limitierte Daten verfügbar. Impfstoff-bezogene Reaktionen, vorwiegend papulo-vesikuläre Hauteruptionen und Fieber, sind gewöhnlich mild. Im Gegensatz zu gesunden Geimpften kommt es bei Leukämiepatienten häufiger zum Auftreten eines papulo-vesikulären Exanthems. Diese Varizellen-ähnlichen Symptome wurden bei ca. einem Viertel der Leukämiepatienten beobachtet. Wie bei gesunden Personen sind Rötung, Schwellung und Schmerz an der Injektionsstelle mild und vorübergehend.
Unerwünschte Wirkungen nach Markteinführung
Nach der Markteinführung wurde über folgende zusätzliche Reaktionen nach einer Varizellen-Impfung berichtet:
Infektionen und parasitäre Erkrankungen
Selten: Herpes zoster.
Erkrankungen des Blutes und des Lymphsystems
Selten: Thrombozytopenie.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeit, anaphylaktische Reaktionen.
Erkrankungen des Nervensystems
Selten: Enzephalitis (siehe «Warnhinweise und Vorsichtsmassnahmen»), Schlaganfall (in Einzelfällen mit Impfvirusnachweis im betroffenen Gefäss), Zerebellitis, Zerebellitis-ähnliche Symptome (einschliesslich vorübergehende Gangstörung und vorübergehende Ataxie), Konvulsionen.
Gefässerkrankungen
Selten: Vaskulitis (einschliesslich Purpura Schönlein-Henoch und Kawasaki-Syndrom).
Erkrankungen der Haut und des Unterhautgewebes
Selten: Erythema exsudativum multiforme.
Bei unbeabsichtigter intravasaler Gabe können schwere Reaktionen bis zum Schock auftreten. Sofortmassnahmen in Abhängigkeit vom Schweregrad, siehe «Warnhinweise und Vorsichtsmassnahmen».
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs sind Fälle mit einer unbeabsichtigten Verabreichung einer grösseren als der empfohlenen Dosis Varilrix gemeldet worden. Im Rahmen dieser Fälle wurden die folgenden unerwünschten Wirkungen gemeldet: Lethargie und Konvulsionen. Keiner der anderen Überdosis-Meldefälle war mit unerwünschten Wirkungen verbunden.
Eigenschaften/WirkungenATC-Code
J07BK01
Varilrix ist ein Lyophilisat des abgeschwächten Varicella-zoster-Virus, Stamm OKA, hergestellt durch Vermehrung des Virus auf humanen, diploiden Zellkulturen (MRC-5). Varilrix erfüllt die Anforderungen der WHO für biologische Substanzen und für Varizellen-Impfstoffe.
Wirkungsmechanismus
Varilrix produziert eine abgeschwächte, klinisch inapparente Varizellen-Infektion in empfänglichen Personen.
Beschränkte publizierte Daten deuten auf eine gewisse Schutzwirkung bei Patienten hin, die kurz (innerhalb von 3-5 Tagen) nach dem Kontakt mit dem natürlichen Varizellenvirus den Impfstoff erhalten. Ein Schutz vor einer Varizellen-Infektion jeglichen Schweregrades konnte nicht gezeigt werden. Jedoch war das Risiko einer mittelschweren bis schweren Varizellenerkrankung (definiert nach Anzahl der Hautläsionen [> 50 bzw. > 100]) nach der Impfung niedriger.
Antikörper im Blut gelten als Nachweis für den Impfschutz, es gibt jedoch keinen etablierten serologischen Schwellenwert für den Schutz gegen eine Varizellenerkrankung.
Pharmakodynamik
Klinische Wirksamkeit
Gesunde Personen
Die Wirksamkeit der Oka-Varizellenimpfstoffe von GlaxoSmithKline (1 Dosis Varilrix bzw. 2 Dosen tetravalenter Masern-Mumps-Röteln-Varizellenimpfstoff Priorix-Tetra im Abstand von 42 Tagen) wurde in der grossen, in mehreren Ländern durchgeführten, verumkontrollierten klinischen Studie OKA-H-179 (Follow-up OKAH-182 EXT 179:Y4-Y6-Y8-Y10) im Vergleich zu 2 Dosen Masern-Mumps-Röteln-Impfstoff ohne Varizellenkomponente im Abstand von 42 Tagen untersucht. Dabei wurden verschiedene Wirksamkeitskriterien zur Diagnose einer manifesten Varizelleninfektion verwendet. In der Phase A (Impfung im Alter von 12-24 Monaten) nahmen 5803 Kinder teil. In den Langzeit Follow-up Phase B wurden 4580 Kinder eingeschlossen. 3298 Kinder (56,8%) schlossen die Studie OKAH-182 EXT 179:Y4-Y6-Y8-Y10 vollständig über 10 Jahre ab. Es gab für Phase B der Studie keine statistische Hypothese sondern nur deskriptive Beschreibungen. Die primäre Diagnose beruhte auf der Meldung einer Varizella artigen Erkrankung durch die Eltern, welche im Falle einer geplanten Bestätigung durch den Investigator mittels PCR weiter untersucht wurde. Telefonische Kontakte fanden alle 6 Monate statt. Es fand zuerst eine Beurteilung der aufgetretenen klinisch vermuteten Varizelleninfektionen durch den Prüfarzt statt. Vermutete Varizellenfälle wurden dann durch ein Expertenpanel weiter beurteilt. Ausserdem wurde ein direkter Virusnachweis durch PCR (Polymerasekettenreaktion) durchgeführt und es fand eine anamnestische Abklärung einer möglichen Windpockenexposition statt.
Bei der ersten Analyse (bestätigte Varizellenfälle) war ein definitiver Virusnachweis in der PCR und/oder eine sichere Exposition gegenüber Varizellen Bedingung für die Beurteilung des Impferfolgs gegen Varizellenerkrankungen aller Schweregrade und gegen mässiggradige bis schwere Varizellenerkrankungen. In einer zweiten weniger strengen Analyse (klinische Varizellenfälle) wurden für die Beurteilung des Impferfolgs alle bestätigten Varizellenfälle aber auch alle Varizellenfälle, die vom Expertenpanel identifiziert wurden, unabhängig von einer Bestätigung durch PCR oder Expositionsanamnese, berücksichtigt.
Die Wirksamkeit des Impfstoffs im Hinblick auf die Prävention bestätigter Varizellenfälle aller Schweregrade sowie mässiger bis schwerer bestätigter Varizellenfälle wurde nach einem Hauptbeobachtungszeitraum von 2 Jahren mit geimpften 5803 Kindern (mediane Dauer: 3,2 Jahre) belegt. In den Langzeit-Nachbeobachtungsphasen von 6 Jahren (mediane Dauer: 6,4 Jahre) und 10 Jahren (mediane Dauer: 9,8 Jahre, 3298 Kinder mit vollständiger Teilnahme in allen 3 Armen) derselben Studie OKAH-182 EXT 179:Y4-Y6-Y8-Y10 wurde eine anhaltende Wirksamkeit beobachtet. Die Ergebnisse sind in der nachfolgenden Tabelle dargestellt.
|
Gruppe
|
Zeitpunkt
|
Wirksamkeit gegen bestätigte Varizellenerkrankungen aller Schweregrade
|
Wirksamkeit gegen mässiggradige bis schwere, bestätigte Varizellenerkrankungen
| |
Monovalenter Varizellen (OKA)-Impfstoff (Varilrix)
(1 Dosis)
N=2'487
|
Jahr 2
|
65,4%
(97,5% KI: 57,2;72,1)
|
90,7%
(97,5% KI: 85,9;93,9)
| |
|
Jahr 6(1)
|
67,0%
(95% KI: 61,8;71,4)
|
90,3%
(95% KI: 86,9;92,8)
| |
Jahr 10(1)
|
67,2%
(95% KI: 62,3;71,5)
|
89,5%
(95% KI: 86,1;92,1)
| |
Kombinierter Impfstoff gegen Masern, Mumps, Röteln und Varizellen (OKA) (Priorix-Tetra)
(2 Dosen)
N=2'489
|
Jahr 2
|
94,9%
(97,5% KI: 92,4;96,6)
|
99,5%
(97,5% KI: 97,5;99,9)
| |
Jahr 6(1)
|
95,0%
(95% KI: 93,6;96,2)
|
99,0%
(95% KI: 97,7;99,6)
| |
Jahr 10(1)
|
95,4%
(95% KI: 94,0;96,4)
|
99,1%
(95% KI: 97,9;99,6)
|
N=Anzahl Probanden, die in die Studie eingeschlossen und geimpft wurden. Der Follow-up über 10 Jahre wurde bei insgesamt 3298 Kindern in allen 3 Armen zusammen (Priorix-Tetra, Varilrix, Priorix) durchgeführt.
(1) Deskriptive Analyse
In der nachfolgenden Tabelle sind die Wirksamkeitsdaten, bezogen auf klinische Varizellenfälle aller Schweregrade sowie auf mässige bis schwere klinische Varizellenfälle nach einem Hauptbeobachtungszeitraum von 2 Jahren sowie nach den Nachbeobachtungsphasen von 6 Jahren und 10 Jahren dargestellt.
|
Gruppe
|
Zeitpunkt
|
Wirksamkeit gegen klinische Varizellenerkrankungen aller Schweregrade
|
Wirksamkeit gegen mässiggradige bis schwere klinische Varizellenerkrankungen
| |
Monovalenter Varizellen (OKA)-Impfstoff (Varilrix)
(1 Dosis)
N=2'266
|
Jahr 2
|
64,6%
(95% KI: 57,5;70,5)
|
90,2%
(95%KI: 85,9;93,1)
| |
Jahr 6(1)
|
66,2%
(95% KI: 61,0;70,7)
|
89,8%
(95%KI: 86,4;92,4)
| |
Jahr 10(1)
|
66,3%
(95% KI: 61,4;70,6)
|
89,0%
(95% CI: 85,5;91,6)
| |
Kombinierter Impfstoff gegen Masern, Mumps, Röteln und Varizellen (OKA) (Priorix-Tetra)
(2 Dosen)
N=2'279
|
Jahr 2
|
92,5%
(95% KI: 89,9;94,4)
|
99,3%
(95% KI: 94,7;99,8)
| |
Jahr 6(1)
|
93,4%
(95% KI: 91,7;94,7)
|
98,7%
(95%KI: 97,4;99,4)
| |
Jahr 10(1)
|
93,6%
(95% KI: 92,1;94.9)
|
98,5%
(95% KI: 97,1;99,2)
|
N=Anzahl Probanden, die in jede Gruppe eingeschlossen wurden. Der Follow-up über 10 Jahre wurde bei insgesamt 3298 Kindern in allen 3 Armen zusammen (Priorix-Tetra, Varilrix, Priorix) durchgeführt.
(1) Deskriptive Analyse
Die Mehrheit der geimpften Personen in klinischen Studien war nach einer Exposition mit dem Varicella-Wildtyp-Virus entweder komplett vor klinischen Varizellen geschützt oder erkrankte an einer milden Form der Krankheit (z.B. geringe Anzahl an Vesikeln, kein Fieber). Die Effektivität einer Dosis Varilrix bzw. 2 Dosen MMR-Varizellen Kombinationsimpfstoff lag bei 20%-92% gegen Varizellenerkrankungen aller Art und bei 86%-100% gegen mässiggradige oder schwere Erkrankungen.
Es liegen keine hinreichenden Daten vor, um die Schutzrate in Bezug auf Komplikationen der Varizellen-Infektion, z.B. Enzephalitis, Hepatitis oder Pneumonie, bestimmen zu können.
Die Wirksamkeitsdaten während der breiten Anwendung aus der Beobachtung in verschiedenen Zusammenhängen (epidemische Ausbrüche, Fall-Kontroll-Studien, Beobachtungsstudien, Datenbanken, Modelle) deuten darauf hin, dass die Verabreichung von zwei Dosen des Impfstoffes im Vergleich zu einer Dosis zu einer höheren Schutzrate und einer Abnahme der Varizellen-Durchbruchserkrankungen führt.
In einer in Uruguay durchgeführten Studie betrug die Abnahme der Spitalaufenthalte bzw. der ambulanten Arztbesuche bei Kindern nach der Verabreichung einer Dosis Varilrix insgesamt 81% bzw. 87%.
Immunantwort nach subkutaner Verabreichung
Gesunde Personen
Bei Kindern von 11 bis 21 Monaten betrug die Serokonversionsrate gemessen mit dem Enzyme-linked Immunosorbent Assay (ELISA) (50 mIU/mL) 6 Wochen nach der ersten Impfung 89,6% und 6 Wochen nach der zweiten Impfung 100%.
Bei Kindern im Alter von 9 Monaten bis 12 Jahren betrug 6 Wochen nach der ersten Impfung die durchschnittliche Serokonversionsrate, gemessen mit Immunofluoreszenz Assay (IFA), mehr als 98%.
Die Serokonversionsrate gemessen mit IFA bei Jugendlichen von 13 Jahren und darüber betrug 6 Wochen nach der 2. Dosis 100%. Ein Jahr nach der Impfung waren alle getesteten Jugendlichen noch seropositiv.
Personen mit einem hohen Risiko für schwer verlaufende Varizellen
Bei Personen mit einem hohen Risiko für schwer verlaufende Varizellen wurde eine durchschnittliche Serokonversionsrate von 80% erreicht, wobei diese bei Leukämiepatienten etwa 90% betrug. Nach der Immunisierung können periodische Messungen der Varizellen-Antikörper angezeigt sein, um diejenigen Patienten zu erkennen, die von einer erneuten Immunisierung profitieren können.
In einer Studie war die Inzidenz von Herpes zoster bei immunsupprimierten Leukämiepatienten tiefer als bei natürlich infizierten Leukämiepatienten.
Bei stark immunsupprimierten Patienten sind nach der Impfung mit Varilrix klinisch bedeutsame Varizellen-Infektionen aufgetreten und es konnten Impfstoffviren aus den Bläschen isoliert werden.
Impfantwort nach intramuskulärer Verabreichung
Die Immunogenität von intramuskulär verabreichtem Varilrix basiert auf den Daten einer Vergleichsstudie, in der gesunde Kinder im Alter von 11 bis 21 Monaten entweder subkutan oder intramuskulär den Kombinationsimpfstoff von GSK gegen Masern, Mumps, Röteln und Varizellen (mit demselben Varizellenstamm wie in Varilrix) erhielten. Für beide Verabreichungswege wurde in der Per Protokoll Population bei Ausschluss von vorbestehend Varizella seropositiven Kindern (n=258) eine vergleichbare Immunogenität 6 Wochen nach der 2. Dosis nachgewiesen.
Klinische Wirksamkeit
Siehe unter «Pharmakodynamik».
PharmakokinetikEine Untersuchung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische DatenBasierend auf den allgemeinen Sicherheitsstudien bei Tieren lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Sonstige HinweiseInkompatibilitäten
Varilrix darf nicht mit anderen Impfstoffen in der gleichen Spritze gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren. Kühlkettenpflichtig.
Die Wirksamkeit von Varilrix (Pulver) wird durch Gefrieren nicht beeinflusst.
Hinweise für die Handhabung
Das Lösungsmittel und der rekonstituierte Impfstoff sind vor der Rekonstitution bzw. vor der Verabreichung visuell auf Fremdpartikel und/oder Veränderungen des Aussehens zu untersuchen.
Aufgrund von kleinen Unterschieden im pH-Wert kann die Farbe des rekonstituierten Impfstoffes von klar-pfirsichfarben bis pinkfarben variieren. Nach der Rekonstitution können durchsichtige, produktbezogene Partikel beobachtet werden. Dies ist normal und beeinträchtigt die Wirksamkeit des Impfstoffs nicht. Falls der Impfstoff eine andere Färbung aufweist oder andere Partikel enthält, darf der rekonstituierte Impfstoff nicht verwendet werden.
Hinweise für die Rekonstitution des Impfstoffes mit dem in der Fertigspritze befindlichen Lösungsmittel
Varilrix wird rekonstituiert, indem der gesamte Inhalt der Fertigspritze mit Lösungsmittel in die Durchstechflasche mit dem Pulver gegeben wird.
Für das Befestigen der Nadel an der Spritze folgen Sie der nachstehenden Anleitung. Allerdings kann sich die mit Varilrix mitgelieferte Spritze leicht von der abgebildeten Spritze unterscheiden (d.h. ohne Schraubgewinde). In diesem Fall muss die Nadel ohne zu schrauben angebracht werden.
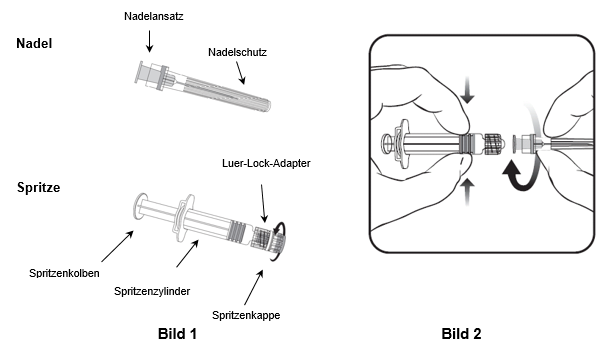
Halten Sie die Spritze immer am Spritzenzylinder fest. Die Spritze nicht am Spritzenkolben oder Luer-Lock-Adapter (LLA) festhalten.
1.Halten Sie die Spritze am Spritzenzylinder fest und drehen Sie die Spritzenkappe entgegen dem Uhrzeigersinn ab (wie in Bild 1 gezeigt).
2.Um die Nadel an der Spritze anzubringen, führen Sie den Nadelansatz vorsichtig in den LLA und drehen Sie die Nadel im Uhrzeigersinn, bis sie fest sitzt (wie in Bild 2 gezeigt). Achten Sie beim Anbringen darauf, dass sich die Nadel in der Achse der Spritze befindet (wie im Bild 2 gezeigt). Andernfalls könnte sich der LLA verbiegen und undicht werden. Falls sich während des Anbringens der Nadel der LLA löst, ist eine neue Impfstoffdosis (neue Spritze und Durchstechflasche) zu verwenden.
3.Entfernen Sie den Nadelschutz, der gelegentlich festsitzen kann.
4.Fügen Sie das Lösungsmittel dem Pulver zu. Schütteln Sie danach die Mischung gründlich, bis sich das Pulver vollständig im Lösungsmittel gelöst hat.Nach der Rekonstitution sollte der Impfstoff sofort verabreicht werden.
5.Ziehen Sie den gesamten Inhalt der Durchstechflasche in die Spritze auf.
6.Zur Verabreichung des Impfstoffs soll eine neue Nadel verwendet werden. Drehen Sie die Nadel von der Spritze ab und bringen Sie eine Injektionsnadel an, indem Sie Schritt 2 wiederholen.
Es wird empfohlen, den Impfstoff nach der Rekonstitution möglichst schnell für die Injektion zu verwenden. Allerdings konnte nachgewiesen werden, dass der rekonstituierte Impfstoff für bis zu 90 Minuten bei Raumtemperatur (25°C) und bis zu 8 Stunden im Kühlschrank (2°C-8°C) aufbewahrt werden kann. Bei Überschreitung dieser Fristen darf der rekonstituierte Impfstoff nicht mehr verwendet werden.
Alkohol und andere Desinfektionsmittel müssen vor der Injektion vollständig von der Haut verdunstet sein, da sie das Virus inaktivieren können.
Nicht verwendeter Impfstoff und Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer00585 (Swissmedic)
PackungenDurchstechflasche mit 1 Dosis des lyophilisierten Impfstoffs und Fertigspritze mit Lösungsmittel (B)
ZulassungsinhaberinGlaxoSmithKline AG, 6340 Baar
Stand der InformationOktober 2025
|

