ZusammensetzungWirkstoffe
Masernvirus (Stamm Schwarz) (lebend, attenuiert), Mumpsvirus (Stamm RIT 4385) (lebend, attenuiert), Rötelnvirus (Stamm Wistar RA 27/3) (lebend, attenuiert).
Hilfsstoffe
Pulver: Lactose, Sorbitol (E 420) 9 mg, Mannitol (E 421), Aminosäuren (enthält Phenylalanin 334 µg).
Lösungsmittel: Wasser für Injektionszwecke.
Rückstände aus dem Herstellungsprozess
Neomycinsulfat.
Indikationen/AnwendungsmöglichkeitenPriorix ist indiziert zur aktiven Immunisierung von Kindern ab 12 Monaten und Erwachsenen gegen Masern, Mumps und Röteln.
Priorix kann unter besonderen Umständen ab einem Alter von 9 Monaten verabreicht werden (z.B. in Übereinstimmung mit nationalen Impfempfehlungen, in epidemischen Situationen oder bei Reisen in eine Region mit hoher Masern-Prävalenz). Es ist dann jedoch zu berücksichtigen, dass Säuglinge im ersten Lebensjahr wegen möglichen Interferenzen mit den mütterlichen Antikörpern möglicherweise nicht genügend auf die Bestandteile des Impfstoffes (Masern, Mumps) ansprechen.
Wenn eine epidemiologische Situation die Impfung im ersten Lebensjahr notwendig macht, wird eine zweite Dosis Priorix vorzugsweise 3 Monate nach der ersten Dosis empfohlen.
Die Impfung mit Priorix wird ebenfalls für beruflich exponierte Personen, welche diese Infektionen auf Schwangere und andere Risikopatienten übertragen können (z.B. in Frauenspitälern, Kinderkliniken etc.), empfohlen.
Priorix sollte gemäss den offiziellen Impfempfehlungen angewendet werden.
Dosierung/AnwendungÜbliche Dosierung
Die empfohlene Dosis für Erwachsene und Kinder beträgt 0,5 ml des rekonstituierten Impfstoffes.
Personen ab einem Alter von 12 Monaten
Um einen optimalen Schutz zu gewährleisten, wird die Verabreichung einer zweiten Dosis empfohlen. Die zweite Dosis kann ab einem Monat nach der ersten Dosis verabreicht werden.
Kinder im Alter von 9 bis 12 Monaten
Es ist zu berücksichtigen, dass Säuglinge im ersten Lebensjahr wegen möglichen Interferenzen mit den mütterlichen Antikörpern möglicherweise nicht genügend auf die Bestandteile des Impfstoffes (Masern, Mumps) ansprechen. Eine zweite Dosis Priorix wird bei diesen Kindern vorzugsweise 3 Monate nach der ersten Dosis empfohlen.
Eine Nachholimpfung kann generell in jedem Alter durchgeführt werden.
Art der Anwendung
Priorix wird subkutan injiziert, kann aber auch intramuskulär in die Deltoid-Region des Oberarms oder in den anterolateralen Bereich des Oberschenkels injiziert werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei Personen mit Blutungsstörungen (z.B. Thrombozytopenie oder Blutgerinnungsstörung) soll der Impfstoff subkutan verabreicht werden.
Hinweise zur Rekonstitution des Impfstoffes vor der Anwendung, siehe «Sonstige Hinweise».
KontraindikationenPriorix ist kontraindiziert bei bekannter Überempfindlichkeit gegenüber einem der Bestandteile des Impfstoffes oder Neomycin. Eine früher durch Neomycin hervorgerufene Kontaktdermatitis stellt keine Kontraindikation dar. Zu Hühnereiweissallergie siehe «Warnhinweise und Vorsichtsmassnahmen».
Priorix ist kontraindiziert bei Personen, die nach einer früheren Verabreichung von Masern-, Mumps- und/oder Röteln-Impfstoffen Zeichen einer Überempfindlichkeit zeigten.
Wie bei allen anderen Impfstoffen sollte auch bei Priorix die Impfung im Falle einer akuten und mit hohem Fieber einhergehenden Erkrankung auf einen späteren Zeitpunkt verschoben werden. Leichte Infekte stellen hingegen keine Kontraindikation für die Impfung dar.
Priorix ist bei schwangeren Frauen kontraindiziert. Eine Schwangerschaft sollte zudem für 3 Monate nach der Impfung ausgeschlossen werden (siehe «Schwangerschaft, Stillzeit»).
Priorix sollte Personen mit geschwächtem Immunsystem nicht verabreicht werden, miteingeschlossen sind Patienten mit primärer oder sekundärer Immundefizienz. Bei HIV-infizierten Kindern liegt es im Ermessen des behandelnden Arztes, eine MMR-Impfung durchzuführen.
Warnhinweise und VorsichtsmassnahmenPriorix darf unter keinen Umständen intravasal injiziert werden!
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Wie bei allen injizierbaren Impfstoffen sollte für den Fall einer anaphylaktischen Reaktion nach der Impfung immer eine angemessene medizinische Behandlung zur Verfügung stehen (z.B. Adrenalin-Lösung 1/1000).
Alkohol sowie andere Desinfektionsmittel müssen auf der Haut vor der Injektion vollständig verdunstet sein, da sonst die abgeschwächten Viren im Impfstoff inaktiviert werden.
Die Immunantwort von Kindern kann im ersten Lebensjahr wegen einer möglichen Interferenz mit maternalen Antikörpern nicht ausreichend sein. Wenn eine epidemiologische Situation die Impfung im ersten Lebensjahr notwendig macht, wird eine zweite Dosis Priorix vorzugsweise 3 Monate nach der ersten Dosis empfohlen. Auf keinen Fall sollte der Abstand zwischen den Dosen jedoch weniger als 4 Wochen betragen.
Die Masern- und Mumpskomponenten des Impfstoffs werden in Kulturen embryonaler Hühnerzellen gezüchtet und können daher Spuren von Hühnereiweiss enthalten. Bei Personen mit anaphylaktischen, anaphylaktoiden oder anderen Reaktionen vom Soforttyp (z.B. generalisierte Urtikaria, Schwellung des Mundes und Rachens, Atembeschwerden, Hypotonie oder Schock) nach Verzehr von Eiern ist das Risiko für eine Überempfindlichkeitsreaktion vom Soforttyp nach der Impfung erhöht, obwohl diese Reaktionen nur sehr selten beobachtet wurden. Personen, die schon einmal eine anaphylaktische Reaktion nach dem Verzehr von Eiern gezeigt haben, sollten mit äusserster Vorsicht geimpft werden. Für den Fall einer anaphylaktischen Reaktion sollten geeignete Behandlungsmassnahmen zur Verfügung stehen.
Priorix sollte bei Personen mit einer Vorgeschichte von Allergien und Krämpfen oder bei solchen mit einer positiven Familienanamnese mit Vorsicht angewendet werden.
Bei Personen mit zerebralen Erkrankungen, Neigungen zu Fieberkrämpfen oder Krampfanfällen in der Familienanamnese sollte eine Fieberprophylaxe durchgeführt werden.
Es wird wahrscheinlich nur ein beschränkter Schutz gegen Masern erhalten, wenn innerhalb 72 Stunden nach einer natürlichen Masern-Exposition geimpft wird.
Über Übertragungen von Masern und Mumps vom Impfling auf anfällige Personen wurde nie berichtet. Vom Rötelnvirus ist bekannt, dass eine pharyngeale Exkretion ungefähr 7 - 28 Tage nach der Impfung, mit einer Exkretionsspitze um den 11. Tag, stattfindet. Dennoch gibt es keinen Beweis einer Übertragung von ausgeschiedenen Impfviren auf empfängliche Personen.
Es wurde über Fälle einer Verschlimmerung und das Wiederauftreten einer Thrombozytopenie nach einer Impfung mit Masern-, Mumps- und Röteln-Lebendimpfstoffen bei Personen berichtet, bei denen bereits nach der ersten Dosis eine Thrombozytopenie aufgetreten war. In diesen Fällen wird eine erneute Impfung mit Priorix nicht empfohlen.
Die aus den klinischen Studien vorliegenden Daten zur intramuskulären Injektion von Priorix zeigen, dass die Serokonversionsraten für die drei Antigene (Masern, Mumps und Röteln) gleich denen nach subkutaner Injektion waren. Die Antikörpertiter gegen Mumps und Röteln können dabei vergleichsweise niedriger liegen.
Wie bei jedem Impfstoff kann es sein, dass nicht bei allen Geimpften eine schützende Immunantwort aufgebaut wird.
Das Arzneimittel enthält 9 mg Sorbitol pro Impfdosis.
Dieses Arzneimittel enthält 334 µg Phenylalanin pro Dosis. Phenylalanin kann schädlich sein für Patienten mit Phenylketonurie.
InteraktionenFalls ein Tuberkulin-Test durchgeführt werden muss, sollte dieser vor oder gleichzeitig mit der Impfung gemacht werden, da der Masern-Lebendimpfstoff (möglicherweise auch Mumps) wahrscheinlich eine vorübergehende Unterdrückung der Tuberkulin-Hautreaktion bewirkt. Aus diesem Grund sollte nach der Impfung während 4-6 Wochen mit einem Tuberkulin-Test gewartet werden, um keine falsch negativen Resultate zu erhalten.
Studien haben gezeigt, dass Priorix gleichzeitig mit dem Varizellen-Lebendimpfstoff Varilrix verabreicht werden kann, wenn verschiedene Injektionsstellen benutzt werden.
Priorix kann gleichzeitig mit dem oralen (OPV) und dem inaktivierten Polio-Impfstoff (IPV), dem kombinierten Diphtherie-, Tetanus- und Pertussis-Impfstoff (DTPw/DTPa), dem Td- und Hepatitis-B-Impfstoff und Haemophilus influenzae Typ b (Hib)-Impfstoff verabreicht werden, wenn verschiedene Injektionsstellen benutzt werden.
Priorix kann ebenfalls gleichzeitig mit anderen attenuierten Lebendimpfstoffen wie BCG, Gelbfieber und oralem Typhus-Impfstoff verabreicht werden.
Kann Priorix nicht gleichzeitig mit anderen attenuierten Lebendimpfstoffen verabreicht werden, sollte ein Zeitabstand von mindestens einem Monat zwischen den Impfungen eingehalten werden.
Bei Personen, die humane Gammaglobuline oder eine Bluttransfusion erhalten haben, sollte eine Impfung mit Priorix erst nach 3 Monaten vorgenommen werden, da die Wahrscheinlichkeit eines Impfversagens besteht, verursacht durch passive Erwerbung von Masern-, Mumps- und Röteln-Antikörpern.
Priorix kann als Booster verabreicht werden, wenn vorgängig mit einem anderen Masern-, Mumps- und Röteln-Impfstoff geimpft wurde.
Schwangerschaft, StillzeitSchwangerschaft
Die Anwendung von Priorix ist in der Schwangerschaft kontraindiziert. Eine Schwangerschaft sollte zudem für 3 Monate nach der Impfung ausgeschlossen werden.
Tierexperimentelle Studien zur Reproduktionstoxizität wurden nicht durchgeführt.
Stillzeit
Es gibt nur wenige Daten über die Anwendung von Priorix bei stillenden Müttern. Wenn jedoch der Nutzen das Risiko übersteigt, kann geimpft werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenNicht zutreffend.
Unerwünschte WirkungenDaten aus klinischen Studien
Die möglicherweise nach der Anwendung eines MMR-Impfstoffes auftretenden Nebenwirkungen entsprechen denen nach alleiniger oder gemeinsamer Gabe der monovalenten Impfstoffe.
Im Rahmen kontrollierter klinischer Studien wurden während eines 42-tägigen Nachbeobachtungszeitraums Anzeichen und Symptome aktiv überwacht. Darüber hinaus wurden die Impflinge gebeten während der Studiendauer alle klinischen Vorkommnisse zu melden.
Das folgende Verträglichkeitsprofil basiert auf Daten von insgesamt ungefähr 12'000 Personen, bei denen Priorix in klinischen Studien verabreicht wurde.
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet: «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1'000, <1/100), «selten» (≥1/10'000, <1/1'000), «sehr selten» (<1/10'000).
Infektionen und parasitäre Erkrankungen
Häufig: Infektionen der oberen Atemwege.
Gelegentlich: Mittelohrentzündung.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Lymphadenopathie.
Erkrankungen des Immunsystems
Selten: Allergische Reaktionen.
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Appetitlosigkeit.
Psychiatrische Erkrankungen
Häufig: Nervosität.
Gelegentlich: abnormales Schreien, Schlaflosigkeit.
Erkrankungen des Nervensystems
Selten: Fieberkrämpfe.
Augenerkrankungen
Gelegentlich: Konjunktivitis.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Bronchitis, Husten.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Parotisschwellung, Durchfall, Erbrechen.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Hautausschlag.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Rötung an der Injektionsstelle (12,2%), Fieber ≥38°C (rektal) oder ≥37,5°C (axillar/oral) (22,7%).
Häufig: Schmerzen und Schwellung an der Injektionsstelle, Fieber > 39,5°C (rektal) oder ≥39,0°C (axillar/oral).
Normalerweise waren die Frequenzen der unerwünschten Wirkungen ähnlich für die erste und die zweite Impfdosis. Die Ausnahme waren Schmerzen an der Injektionsstelle, die nach der ersten Impfdosis «häufig», und nach der zweiten Impfdosis «sehr häufig» auftraten.
Unerwünschte Wirkungen aus der Postmarketingphase
Nach der Markteinführung wurden über folgende zusätzliche Reaktionen nach einer Priorix-Impfung berichtet:
Infektionen und parasitäre Erkrankungen
Selten: Meningitis, Masern-ähnliches Syndrom, Mumps-ähnliches Syndrom (einschliesslich Orchitis, Epididymitis und Parotitis).
Erkrankungen des Blutes und des Lymphsystems
Selten: Thrombozytopenie, thrombozytopenische Purpura.
Erkrankungen des Immunsystems
Selten: Allergische Reaktionen, einschliesslich anaphylaktische Reaktionen.
Erkrankungen des Nervensystems
Selten: Enzephalitis*, Zerebellitis, Zerebellitis-ähnliche Symptome (einschliesslich vorübergehende Gangstörung und vorübergehende Ataxie), Guillain-Barré-Syndrom, transverse Myelitis, periphere Neuritis.
Gefässerkrankungen
Selten: Vaskulitis (einschliesslich Purpura Schönlein-Henoch und Kawasaki-Syndrom).
Erkrankungen der Haut und des Unterhautgewebes
Selten: Erythema multiforme.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Selten: Arthralgie, Arthritis.
* Über Enzephalitis wurde mit einer Frequenz von weniger als 1 von 10 Millionen Dosen berichtet. Das Risiko einer Enzephalitis nach der Verabreichung der Impfung ist viel tiefer als das Risiko einer Enzephalitis nach einer natürlichen Erkrankung (Masern: 1 von 1000 bis 2000 Fälle; Röteln: ungefähr 1 von 6000 Fälle).
Bei unbeabsichtigter intravasaler Gabe können schwere Reaktionen bis zum Schock auftreten. Sofortmassnahmen müssen in Abhängigkeit vom Schweregrad ergriffen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungÜber Fälle von Überdosierung (bis zu 2-mal die empfohlene Dosierung) wurde nach der Markteinführung berichtet. Keine unerwünschten Wirkungen wurden mit der Überdosierung in Verbindung gebracht.
Eigenschaften/WirkungenATC-Code
J07BD52
Priorix ist ein Kombinationsimpfstoff und besteht aus einem Lyophilisat von abgeschwächten Schwarz-Masernviren, RIT 4385 Mumpsviren und Rötelnviren des Wistar RA 27/3-Stammes.
Priorix entspricht den Anforderungen der WHO zur Herstellung biologischer Substanzen und denen für lebende Masern-, Mumps- und Röteln-Kombinationsimpfstoffe.
Die Masern- und Mumpsviren werden getrennt auf Hühnerembryonen-Zellkulturen und die Rötelnviren in Kulturen humaner diploider MRC-5 Zellen gezüchtet, extrahiert und gereinigt.
Wirkungsmechanismus
Nicht zutreffend.
Pharmakodynamik
Priorix bewirkt eine aktive Immunisierung gegen Masern, Mumps und Röteln.
In klinischen Studien zeigte Priorix eine hohe Wirksamkeit. Antikörper gegen Masern wurden bei 98,0%, gegen Mumps bei 96,1% und gegen Röteln bei 99,3% der vorgängig seronegativen Impflinge festgestellt.
In einer Vergleichsstudie zeigten 98,7% vorgängig seronegativer Impflinge Antikörper gegen Masern, 95,5% gegen Mumps und 99,5% gegen Röteln bei Erhalt von Priorix im Vergleich zu 96,9% gegen Masern, 96,9% gegen Mumps und 99,5% gegen Röteln bei Erhalt eines anderen auf dem Markt erhältlichen MMR-Kombinationsimpfstoffes.
12 Monate nach der Impfung waren alle Impflinge bezüglich Antikörper gegen Masern und Röteln seropositiv. Mumps-Antikörper waren noch bei 88,4% nachweisbar. Diese Resultate wurden auch bei einem kommerziell erhältlichen Kombinationsimpfstoff beobachtet (87%).
Klinische Wirksamkeit
Siehe unter «Pharmakodynamik».
PharmakokinetikEine Untersuchung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische DatenNicht zutreffend.
Sonstige HinweiseInkompatibilitäten
Priorix darf nicht mit anderen Impfstoffen in derselben Spritze vermischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren. Kühlkettenpflichtig. Nicht einfrieren!
Während eines Transportes sollten die Lagerbedingungen berücksichtigt werden, vor allem in heissen Klimazonen.
Hinweise für die Handhabung
Der rekonstituierte Impfstoff kann, in Abhängigkeit kleiner pH-Verschiebungen, in der Farbe von pfirsichfarben zu fuchsienrosa variieren, ohne Einfluss auf die Wirksamkeit.
Das Lösungsmittel und der rekonstituierte Impfstoff sind vor der Rekonstitution bzw. vor der Verabreichung visuell auf Fremdpartikel und/oder Veränderungen des Aussehens zu untersuchen. Falls irgendwelche Veränderungen beobachtet werden, dürfen das Lösungsmittel bzw. der rekonstituierte Impfstoff nicht verwendet werden.
Hinweise für die Rekonstitution des Impfstoffes mit dem in der Fertigspritze befindlichen Lösungsmittel
Priorix wird rekonstituiert, indem der gesamte Inhalt der Fertigspritze mit Lösungsmittel in die Durchstechflasche mit dem Pulver gegeben wird.
Für das Befestigen der Nadel an der Spritze folgen Sie der nachstehenden Anleitung. Allerdings kann sich die mit Priorix mitgelieferte Spritze leicht von der abgebildeten Spritze unterscheiden (d.h. ohne Schraubgewinde). In diesem Fall muss die Nadel ohne zu schrauben angebracht werden.
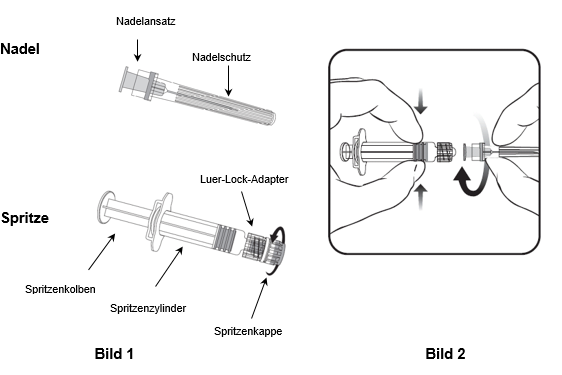
Halten Sie die Spritze immer am Spritzenzylinder fest. Die Spritze nicht am Spritzenkolben oder Luer-Lock-Adapter (LLA) festhalten.
1.Halten Sie die Spritze am Spritzenzylinder fest und drehen Sie die Spritzenkappe entgegen dem Uhrzeigersinn ab (wie in Bild 1 gezeigt).
2.Um die Nadel an der Spritze anzubringen, führen Sie den Nadelansatz vorsichtig in den LLA und drehen Sie die Nadel im Uhrzeigersinn, bis sie fest sitzt (wie in Bild 2 gezeigt). Achten Sie beim Anbringen darauf, dass sich die Nadel in der Achse der Spritze befindet (wie im Bild 2 gezeigt). Andernfalls könnte sich der LLA verbiegen und undicht werden. Falls sich während des Anbringens der Nadel der LLA löst, ist eine neue Impfstoffdosis (neue Spritze und Durchstechflasche) zu verwenden.
3.Entfernen Sie den Nadelschutz, der gelegentlich fest sitzen kann.
4.Fügen Sie das Lösungsmittel dem Pulver zu. Schütteln Sie danach die Mischung gründlich, bis sich das Pulver vollständig im Lösungsmittel gelöst hat.Nach der Rekonstitution sollte der Impfstoff sofort verabreicht werden.
5.Ziehen Sie den gesamten Inhalt der Durchstechflasche in die Spritze auf.
6.Zur Verabreichung des Impfstoffs soll eine neue Nadel verwendet werden. Drehen Sie die Nadel von der Spritze ab und bringen Sie eine Injektionsnadel an, indem Sie Schritt 2 wiederholen.
Nach Rekonstitution sollte der Impfstoff so bald als möglich, aber nicht später als nach 8 Stunden injiziert werden.
Nicht verwendeter Impfstoff und Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer00615 (Swissmedic)
PackungenDurchstechflasche mit lyophilisiertem Impfstoff und Fertigspritze mit Lösungsmittel (Nadeln separat): 1 und 10 [B].
ZulassungsinhaberinGlaxoSmithKline AG, 6340 Baar
Stand der InformationAugust 2025
|

