ZusammensetzungWirkstoffe
Diphtherie-Toxoid; Tetanus-Toxoid; Pertussis-Toxoid (PT); filamentöses Hämagglutinin (FHA) von Bordetella pertussis; Pertactin (PRN) von Bordetella pertussis.
Hilfsstoffe
Wasserhaltiges Aluminiumhydroxid, Aluminiumphosphat, Natriumchlorid corresp. Natrium 1,8 mg, Wasser für Injektionszwecke q.s. ad 0,5 mL.
Rückstände aus dem Herstellungsprozess: Formaldehyd, Polysorbat 80.
Indikationen/AnwendungsmöglichkeitenBoostrix ist indiziert für die Boosterimpfung gegen Diphtherie, Tetanus und Pertussis von Personen ab dem 4. Geburtstag (siehe «Dosierung/Anwendung»).
Boostrix sollte gemäss den offiziellen Impfempfehlungen angewendet werden.
Boostrix soll nicht zur Grundimmunisierung bei Kindern bis zum vollendeten 4. Lebensjahr verwendet werden.
Dosierung/AnwendungÜbliche Dosierung
Eine einmalige Dosis mit 0,5 mL des Impfstoffes ist empfohlen.
Die Impfung mit Boostrix kann ab einem Alter von 4 Jahren erfolgen.
Die Anwendung von Boostrix sollte gemäss den offiziellen Empfehlungen für Impfungen mit reduziertem Gehalt an Diphtherie-, Tetanus- und Pertussis-Antigenen erfolgen.
Boostrix kann schwangeren Frauen während des zweiten oder dritten Trimenons der Schwangerschaft gemäss offiziellen Empfehlungen verabreicht werden (siehe «Schwangerschaft, Stillzeit» und «Eigenschaften/Wirkungen»).
Boostrix kann ausserdem bei Jugendlichen und Erwachsenen mit unbekanntem Impfstatus oder unvollständiger Impfung gegen Diphtherie, Tetanus und Pertussis als Teil einer Impfserie gegen Diphtherie, Tetanus und Pertussis verabreicht werden (siehe «Eigenschaften/Wirkungen»).
Bei Verwendung von Boostrix zur Erstimpfung gegen Diphtherie, Tetanus und Pertussis bei bisher ungeimpften Jugendlichen und Erwachsenen sollten nach Verabreichung einer Dosis Boostrix zwei weitere Dosen eines altersentsprechenden Diphtherie- und Tetanus-Toxoid-haltigen Impfstoffes nach mindestens 1 und 6 Monaten zur Komplettierung der Impfserie verabreicht werden. Bei unbekannten Impfstatus gegen Diphtherie und Tetanus kann vor Impfung eventuell eine Antikörpertestung in Betracht gezogen werden. Bei einem Antikörpertiter > 0,1 IU/mL kann eine vorangegangene Impfung angenommen werden. In diesem Fall ist die Verabreichung einer Einmaldosis Boostrix indiziert.
Zur Aufrechterhaltung des Impfschutzes sollten Auffrischimpfungen gegen Diphtherie, Tetanus und Pertussis gemäss den Empfehlungen des offiziellen Schweizerischen Impfplans erfolgen. Altersabhängig unterschiedliche Boosterintervalle müssen beachtet werden.
Boostrix kann bei Personen mit früherer Grundimmunisierung gegen Tetanus zur Tetanus-Prophylaxe bei Verletzungen mit Tetanusrisiko verwendet werden. Gleichzeitig sollte Tetanus-Immunglobulin gemäss den offiziellen Empfehlungen angewendet werden.
Obwohl Boostrix 10 Jahre nach Grundimmunisierung in Studien bei Jugendlichen und Erwachsenen eine gute Immunantwort induzierte (siehe «Eigenschaften/Wirkungen»), ist die Verabreichung einer Pertussis Boosterimpfung bei Jugendlichen und Erwachsenen nicht durch klinische Wirksamkeitsstudien belegt.
Art der Anwendung
Boostrix soll tief intramuskulär injiziert werden, bevorzugt in den M. deltoideus (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
KontraindikationenWie bei anderen Impfstoffen soll die Impfung mit Boostrix bei Personen, die an akuter, schwerwiegender und fieberhafter Erkrankung leiden, verschoben werden. Eine leichte Infektion stellt keine Kontraindikation dar.
Boostrix sollte bei Personen mit bekannter Überempfindlichkeit auf irgendeine Komponente des Impfstoffes (siehe «Zusammensetzung») oder bei Personen, die nach einer früheren Verabreichung eines Diphtherie-, Tetanus- oder Pertussis-Impfstoffes Zeichen einer Überempfindlichkeit gezeigt haben, nicht angewendet werden.
Boostrix ist kontraindiziert bei Personen, die innert 7 Tagen nach einer vorgängigen Impfung mit einem Pertussis-Antigen enthaltenden Impfstoff eine Enzephalopathie unbekannter Ätiologie entwickelten. In diesen Fällen sollte die Impfung gegen Pertussis ausgesetzt werden und bei gegebener Indikation ein altersgerechter Diphtherie-Tetanus-Kombinations-Impfstoff verwendet werden.
Boostrix sollte nicht angewendet werden bei Personen, die nach einer vorgängigen Impfung gegen Diphtherie und/oder Tetanus eine vorübergehende Thrombozytopenie oder neurologische Komplikationen entwickelt haben (bezüglich Konvulsionen oder hypotonisch-hyporesponsiven Episoden, siehe «Warnhinweise und Vorsichtsmassnahmen»).
Warnhinweise und VorsichtsmassnahmenBoostrix darf unter keinen Umständen intravasal angewendet werden.
Der Impfung sollen eine Überprüfung der Krankengeschichte (vorwiegend bezüglich früherer Impfungen und eventuell aufgetretener unerwünschter Ereignisse) und eine klinische Untersuchung vorangehen.
Falls irgendeines der nachfolgend aufgeführten Ereignisse in zeitlichem Zusammenhang mit der Gabe eines Pertussis-Antigen enthaltenden Impfstoffes aufgetreten ist, sollte die Entscheidung zur Gabe eines Pertussis-enthaltenden Impfstoffes sorgfältig abgewogen werden:
·Temperatur ≥ 40,0°C innerhalb von 48 Stunden nach der Impfung ohne sonst erkennbare Ursache;
·Kollaps oder schockähnlicher Zustand (hypotonisch-hyporesponsive Episode) innerhalb von 48 Stunden nach der Impfung;
·Anhaltendes, untröstliches Schreien über mehr als 3 Stunden innerhalb von 48 Stunden nach der Impfung;
·Krampfanfälle mit oder ohne Fieber innerhalb von 3 Tagen nach der Impfung.
Wenn bei einem Säugling oder Kind eine ernsthafte neurologische Erkrankung zum ersten Mal auftritt oder eine progrediente schwerwiegende neurologische Erkrankung vorliegt, sollte – wie bei jeder Impfung – Nutzen und Risiko einer Impfung mit Boostrix gegenüber einem Aufschub dieser Impfung sorgfältig abgewogen werden.
Unter bestimmten Umständen, z.B. hohe Pertussis-Inzidenz, kann der mögliche Nutzen einer Impfung die möglichen Risiken überwiegen.
Fieberkrämpfe in der Anamnese, Krampfanfälle in der Eigen- oder Familienanamnese sowie unerwünschte Ereignisse nach DTP-Impfung in der Familienanamnese stellen keine Kontraindikationen dar.
Eine Infektion mit dem humanen Immundefizienz Virus (HIV-Infektion) wird nicht als Kontraindikation für eine Diphtherie-, Tetanus- und Pertussis-Impfung betrachtet. Die erwartete Immunantwort wird nach der Impfung von immunsupprimierten Patienten womöglich nicht erreicht werden.
Wie bei allen injizierbaren Impfstoffen sollte für den seltenen Fall einer anaphylaktischen Reaktion nach der Impfung stets eine angemessene medizinische Behandlung und Überwachung sofort zur Verfügung stehen.
Boostrix sollte bei Personen mit Thrombozytopenie oder einer Blutgerinnungsstörung mit Vorsicht angewendet werden, weil bei diesen Personen nach einer intramuskulären Injektion eine Blutung auftreten kann. Der Impfstoff kann diesen Personen tief subkutan verabreicht werden, wenn dies in Übereinstimmung mit offiziellen Empfehlungen erfolgt. Bei beiden Verabreichungswegen sollte mindestens 2 Minuten lang beständiger Druck (ohne Reiben) auf die Injektionsstelle ausgeübt werden.
In sehr seltenen Fällen ist über Kollaps oder schockähnliche Zustände (hypotonisch-hyporesponsive Episode) und Konvulsionen innerhalb von 2 bis 3 Tagen nach der Immunisierung von Kindern mit Produkten, die ein oder mehrere Antigene von Boostrix beinhalten, berichtet worden.
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Wie bei jedem Impfstoff kann es sein, dass nicht bei allen Geimpften eine schützende Immunantwort aufgebaut wird.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Impfdosis, d.h. es ist nahezu «natriumfrei».
InteraktionenDie gleichzeitige Anwendung von Boostrix mit einem trivalenten, inaktivierten, nicht-adjuvantierten saisonalen Grippeimpfstoff, Meningokokken-Konjugatimpfstoff gegen die Serogruppen A, C, W-135 und Y (MenACWY) und Herpes-zoster-Totimpfstoff wurde untersucht.
Klinische Daten zur gleichzeitigen Anwendung von Boostrix mit einem trivalenten, inaktivierten Grippeimpfstoff bei Personen im Alter zwischen 19 und 64 Jahren (N=1497) zeigten, dass die Immunantworten auf die Tetanus-, Diphtherie-, Pertussis Toxoid (PT)- und Influenza-Antigene nicht beeinflusst wurden. Für die Pertussis-Antigene filamentöses Hämagglutinin (FHA) und Pertactin (PRN) wurden niedrigere geometrische Mittelwertkonzentrationen (GMC) beobachtet. In einer vordefinierten explorativen Kohorte wurden bei Personen im Alter von 65 Jahren und älter (N=221) keine Unterschiede bei gleichzeitiger oder getrennter Verabreichung der Impfstoffe beobachtet.
Klinische Daten zur gleichzeitigen Anwendung von Boostrix mit einem Herpes-zoster-Totimpfstoff bei Personen im Alter von 50 Jahren und älter (N=830) zeigten, dass die Immunantworten auf die Tetanus-, Diphtherie-, PT-, FHA- und Herpes-zoster-Antigene nicht beeinflusst wurden. Für das PRN-Antigen wurden niedrigere GMCs beobachtet.
Klinische Daten zur gleichzeitigen Anwendung von Boostrix mit MenACWY-Konjugatimpfstoffen bei Personen im Alter von 9 bis 25 Jahren (für die beiden MenACWY-TT-Studien: N=691, davon 231 in der Gruppe der gemeinsamen Verabreichung, und N=1300, davon 260 in der Gruppe der gemeinsamen Verabreichung; für die MenACWY-CRM-Studie: N=1069, davon 359 in der Gruppe der gemeinsamen Verabreichung) zeigten, dass die Immunantworten auf die Tetanus-, Diphtherie- und Meningokokken-Antigene nicht beeinflusst wurden. Für die Pertussis-Antigene wurden niedrigere GMCs beobachtet.
Die klinische Relevanz der niedrigeren GMCs für spezifische Pertussis-Antigene, die in den oben beschriebenen Koadministrationsstudien beobachtet wurden, ist nicht bekannt.
Die gleichzeitige Verabreichung von Boostrix mit anderen Impfstoffen oder mit Immunglobulinen ist nicht untersucht worden. Es ist unwahrscheinlich, dass die gleichzeitige Anwendung mit anderen inaktivierten Impfstoffen und mit Immunglobulin eine klinisch relevante Interferenz mit den Immunantworten bewirkt.
Wenn Boostrix gleichzeitig mit einem anderen injizierbaren Impfstoff oder einem Immunglobulin angewendet wird, sollten die Produkte immer an unterschiedlichen Stellen verabreicht werden.
Wie bei anderen Impfstoffen kann bei Patienten, die eine immunsuppressive Therapie erhalten, oder bei Patienten, die eine Immundefizienz aufweisen, eine adäquate Immunantwort ausbleiben.
Schwangerschaft, StillzeitSchwangerschaft
Sicherheitsdaten aus einer randomisierten, kontrollierten klinischen Studie (341 Schwangerschaftsverläufe) sowie aus einer prospektiven Beobachtungsstudie (793 Schwangerschaftsverläufe), in denen Boostrix schwangeren Frauen im dritten Trimenon verabreicht wurde, zeigten keine mit den Impfungen in Zusammenhang stehenden, nachteiligen Auswirkungen auf die Schwangerschaft oder auf die Gesundheit des Fetus bzw. neugeborenen Kindes.
Es sind keine Daten zur Sicherheit aus prospektiven klinischen Studien zur Verabreichung von Boostrix oder Boostrix Polio während des ersten und zweiten Trimenons der Schwangerschaft verfügbar.
Post-Marketing Daten bei Schwangeren, die während des zweiten und dritten Trimenons mit Boostrix oder Boostrix Polio (dTpa-IPV-Impfstoff) geimpft wurden, haben keine impfstoffbedingten unerwünschten Wirkungen auf die Schwangerschaft oder die Gesundheit des Fötus bzw. des Neugeborenen ergeben.
Wie bei anderen inaktivierten Impfstoffen ist eine Schädigung des Fetus nach einer Impfung mit Boostrix in keinem Trimenon der Schwangerschaft zu erwarten.
Zu Daten zur Immunogenität und zur Vorbeugung einer Pertussis-Erkrankung bei Säuglingen von Müttern, die während der Schwangerschaft mit Boostrix geimpft wurden, siehe Abschnitt «Pharmakodynamik».
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte schädliche Wirkungen auf Gestation, embryofötale Entwicklung, Geburt oder postnatale Entwicklung (siehe «Präklinische Daten»).
Stillzeit
Die Sicherheit der Anwendung von Boostrix während der Stillzeit wurde nicht untersucht.
Es ist nicht bekannt, ob Boostrix in die Muttermilch übergeht.
Boostrix sollte während der Stillzeit nur angewendet werden, wenn die möglichen Vorteile die möglichen Risiken überwiegen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien zu den Auswirkungen von Boostrix auf die Fahrtüchtigkeit und die Fähigkeit, Maschinen zu bedienen, durchgeführt.
Einige der im Kapitel «Unerwünschte Wirkungen» beschriebenen Nebenwirkungen könnten jedoch Einfluss auf die Fahrtüchtigkeit oder das Bedienen von Maschinen haben.
Unerwünschte WirkungenKlinische Studien
Das Sicherheitsprofil basiert auf Daten von 14 klinischen Studien, bei denen Boostrix bei 839 Kindern im Alter von 4 bis 9 Jahren und bei 1931 Erwachsenen, Jugendlichen und Kindern über 10 Jahre angewendet wurde.
Häufigkeiten werden wie folgt angegeben: Sehr häufig: ≥1/10; häufig: ≥1/100 bis < 1/10; gelegentlich: ≥1/1'000 bis < 1/100; selten: ≥1/10'000 bis < 1/1'000; sehr selten: < 1/10'000.
|
Systemorganklasse
|
Häufigkeit
|
Kinder im Alter von 4 bis 9 Jahren
(n=839)
|
Personen im Alter von über 10 Jahren
(n=1931)
| |
Infektionen und parasitäre Erkrankungen
|
Gelegentlich
|
Infektionen des oberen Respirationstraktes
|
Infektionen des oberen Respirationstraktes, Pharyngitis
| |
Erkrankungen des Blutes und des Lymphsystems
|
Gelegentlich
|
|
Lymphadenopathie
| |
Stoffwechsel- und Ernährungsstörungen
|
Häufig
|
Anorexie
|
| |
Psychiatrische Erkrankungen
|
Sehr häufig
|
Reizbarkeit (10,3%)
|
| |
Erkrankungen des Nervensystems
|
Sehr häufig
|
Schläfrigkeit (11,4%)
|
Kopfschmerzen (17,7%)
| |
Häufig
|
Kopfschmerzen
|
Schwindel
| |
Gelegentlich
|
Aufmerksamkeitsstörungen
|
Synkope
| |
Augenerkrankungen
|
Gelegentlich
|
Konjunktivitis
|
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
|
Gelegentlich
|
|
Husten
| |
Erkrankungen des Gastrointestinaltrakts
|
Häufig
|
Diarrhöe, Erbrechen, gastrointestinale Störungen
|
Übelkeit, gastrointestinale Störungen
| |
Gelegentlich
|
|
Diarrhöe, Erbrechen
| |
Erkrankungen der Haut und des Unterhautgewebes
|
Gelegentlich
|
Hautausschlag
|
Hyperhydrosis (Fussschweiss), Juckreiz, Hautausschlag
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
Gelegentlich
|
|
Arthralgie, Myalgie, Gelenksteife, Muskel-Skelett-Steife
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Sehr häufig
|
Reaktionen an der Injektionsstelle (wie Schmerz (40,1%), Rötung (23,7%) und Schwellung (26,8%)), Müdigkeit (10,0%)
|
Reaktionen an der Injektionsstelle (wie Schmerz (80,6%), Rötung (31,8%) und Schwellung (28,9%)), Müdigkeit (20,0%), Unwohlsein (10,7%)
| |
Häufig
|
Fieber > 37,5°C (einschliesslich Fieber > 39°C)
|
Fieber > 37,5°C, Reaktionen an der Injektionsstelle wie Verhärtung und sterile Abszessbildung
| |
Gelegentlich
|
Andere Reaktionen an der Injektionsstelle wie Verhärtung, Schmerz
|
Fieber > 39°C, Grippe-ähnliche Erkrankung, Schmerz, Geschwür
|
Reaktogenität nach wiederholter Impfung
Daten von 146 Personen deuten darauf hin, dass es zu einem Anstieg der lokalen Reaktogenität (Schmerz, Rötung, Schwellung) bei wiederholter Impfung von Erwachsenen über 40 Jahren (entsprechend dem Impfschema von 0, 1, 6 Monaten) kommen kann (Studie dTpa-034).
Impflinge, die komplett mit 4 Dosen DTPw grundimmunisiert wurden und im Alter von 10 Jahren eine Dosis mit Boostrix erhielten, zeigten eine Erhöhung der lokalen Reaktogenität nach einer zusätzlichen Boostrix-Boosterdosis, die 10 Jahre später verabreicht wurde (Studien dTpa-039 und dTpa-040).
Inzidenz und Art der Symptome, über die während 4 Tagen (Tage 0 – 3) nach der Impfung mit einer Boosterdosis Boostrix berichtet wurde (totale Impfkohorte):
|
Studie
|
Alle Symptome
|
Allgemeine Symptome
|
Lokale Symptome
| |
N
|
n
|
%
|
N
|
n
|
%
|
N
|
n
|
%
| |
Alle Stärkegrade
| |
dTpa-039
|
203
|
166
|
81,8
|
203
|
74
|
36,5
|
203
|
154
|
75,9
| |
dTpa-040
|
82
|
78
|
95,1
|
82
|
51
|
62,2
|
82
|
77
|
93,9
| |
Grad 3* Symptome
| |
dTpa-039
|
203
|
28
|
13,8
|
203
|
3
|
1,5
|
203
|
25
|
12,3
| |
dTpa-040
|
82
|
26
|
31,7
|
82
|
4
|
4,9
|
82
|
26
|
31,7
|
N = Anzahl der Personen, die eine Boosterdosis erhielten.
n (%) = Anzahl (Prozentsatz) der Personen, die mindestens ein Symptom zeigten.
* = Grad 3 Reaktion: bezeichnet die Intensität eines Ereignisses, z.B. Fieber ≥39°C, Schwellung ≥50 mm
Unerwünschte Wirkungen aus der Postmarketingphase
Diese Daten basieren auf Spontanberichten nach der Markteinführung. Die Häufigkeit der Ereignisse kann daher nicht verlässlich angegeben werden.
Erkrankungen des Immunsystems
Allergische Reaktionen, einschliesslich anaphylaktischer und anaphylaktoider Reaktionen
Erkrankungen des Nervensystems
Konvulsionen (mit oder ohne Fieber), hypotonisch-hyporesponsive Episoden
Erkrankungen der Haut und des Unterhautgewebes
Urtikaria, Angioödem
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Extensive Schwellung des Gliedes, an dem geimpft wurde, Asthenie
Nach Anwendung von Tetanustoxoid-haltigen Impfstoffen ist sehr selten über unerwünschte Wirkungen am zentralen oder peripheren Nervensystem, einschliesslich aufsteigender Lähmung bis hin zur Atemlähmung (z.B. Guillain-Barré-Syndrom), berichtet worden.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungÜber Fälle von Überdosierung ist während der Post-Marketing Überwachung berichtet worden. Unerwünschte Wirkungen nach einer Überdosierung waren, wenn berichtet, ähnlich derjenigen, die nach üblicher Anwendung gemeldet wurden.
Eigenschaften/WirkungenATC-Code
J07AJ52
Boostrix erfüllt sowohl die WHO-Bestimmungen für die Herstellung biologischer Substanzen und für Diphtherie- und Tetanus-Impfstoffe als auch die Richtlinien für azelluläre Pertussis-Impfstoffe.
Wirkungsmechanismus
Nicht zutreffend.
Pharmakodynamik
Immunantwort
Die gepoolten Resultate zur Immunantwort auf die Diphtherie-, Tetanus- und Pertussis-Komponenten in 15 klinischen Studien sind in der untenstehenden Tabelle aufgeführt. Ca. einen Monat nach der Boosterimpfung mit Boostrix wurden die folgenden Seroprotektions-/Seropositivitäts-Raten beobachtet:
|
Antigen
|
Seroprotektion/ Seropositivität
|
Erwachsene und Jugendliche ab 10 Jahre
(N=1'694)1
|
Kinder von 4–9 Jahren
(N=415)2
| |
% Impflinge
(95% KI)
|
GMC
(95% KI)
|
% Impflinge
(95% KI)
|
GMC
(95% KI)
| |
Diphtherie-Toxoid
|
≥0,1 IU/mL*
|
97,2% (96,3-97,9)
|
3'382 (2'184-5'235)
|
99,8% (98,7-100)
|
5'705 (3'379-9'634)
| |
Tetanus-Toxoid
|
≥0,1 IU/mL*
|
99,0% (98,4-99,4)
|
8'491 (5'632-12'801)
|
100% (99,1-100)
|
14'449 (11'172-18'687)
| |
Pertussis
| |
Pertussis-Toxoid
|
≥5 EL.U/mL
|
97,8% (96,9-98,4)
|
85,2 (69,8-104,0)
|
99,0% (97,6-99,7)
|
72,3 (62,6-83,5)
| |
Filamentöses Hämagglutinin
|
≥5 EL.U/mL
|
99,9% (99,7-100)
|
830,9 (725,6-951,5)
|
100% (99,1-100)
|
536,1 (341,3-842,0)
| |
Pertactin
|
≥5 EL.U/mL
|
99,4% (98,9-99,7)
|
480,0 (342,8-672,1)
|
99,8% (98,7-100)
|
307,7 (82,1-1'152,8)
|
1 Studien bei Erwachsenen und Jugendlichen: dTpa-001, dTpa-002, dTpa-003, dTpa-004, dTpa-007, dTpa-009, dTpa-010, dTpa-019, dTpa-020, dTpa-029 und dTpa-028 (nur Antwort auf die Tetanus-Komponente)
2 Studien bei Kindern: APV-118, dTpa-008, dTpa-014 und dTpa-033
N = Gesamtzahl Probanden
* Cut-off, als indikativ für einen Schutz akzeptiert
GMC = Geometric Mean antibody concentration
In den 14 Studien, wo sowohl die Diphtherie- und Tetanus-Responder nach 1 Monat gemessen wurden, lagen die Diphtherie-Responder (≥0,1 IU/mL) zwischen 88,4% – 100% sowie die Tetanus-Responder (≥ 0,1 IU/mL) zwischen 96,7% – 100%.
Resultate von Vergleichsstudien mit kommerziellen dT-Impfstoffen zeigen, dass das Ausmass des Schutzes und die Schutzdauer nicht verschieden sind.
Schutzwirkung gegen Pertussis
Momentan ist keine Korrelation für den Schutz gegen Pertussis definiert.
Die in Boostrix enthaltenen Pertussisantigene sind integraler Bestandteil des azellulären Pertussis-Kombinationsimpfstoffs für Kinder (Infanrix), für den die Wirksamkeit nach einer Grundimmunisierung in einer Haushaltkontaktstudie nachgewiesen wurde. Nach der Impfung mit Boostrix sind die Antikörpertiter gegen alle drei Pertussiskomponenten höher als die während der Haushaltkontaktstudie beobachteten Titer. Obwohl das Ausmass und die Dauer des durch den Impfstoff erreichten Schutzes bisher nicht bestimmt wurden, ist ausgehend von diesen Vergleichen nach Impfung mit Boostrix von einer Schutzwirkung gegen Pertussis auszugehen.
Immunogenität gegen Pertussis bei Säuglingen (im Alter von unter 3 Monaten) von Müttern, die während der Schwangerschaft geimpft wurden
In einer randomisierten, Placebo-kontrollierten Crossover-Studie wurden bei der Entbindung im Nabelschnurblut von Säuglingen geboren von Müttern, die in der 27. bis 36. Schwangerschaftswoche mit Boostrix geimpft wurden (N=291), höhere Antikörperkonzentrationen gegen Pertussis nachgewiesen als bei Säuglingen von Müttern, die Placebo erhalten hatten (N=292). Die geometrischen mittleren Antikörperkonzentrationen im Nabelschnurblut gegen die Pertussis-Antigene PT, FHA und PRN betrugen 46,9, 366,1 und 301,8 IE/mL in der dTpa-Gruppe und 5,5, 22,7 und 14,6 IE/mL in der Kontrollgruppe. Dies entspricht 8-, 16- und 21-mal höhere Antikörpertiter im Nabelschnurblut von Säuglingen geboren von geimpften Müttern im Vergleich zur Kontrollgruppe. Diese Antikörpertiter können einen passiven Schutz gegen Pertussis bieten, wie durch Beobachtungsstudien zur Effektivität gezeigt wurde.
Immunogenität bei Säuglingen und Kleinkindern von Müttern, die während der Schwangerschaft geimpft wurden
In Folgestudien mit mehr als 500 Säuglingen und Kleinkindern geboren von geimpften Müttern ergaben sich aus den klinischen Daten keine klinisch relevanten Interferenzen zwischen der mütterlichen Impfung mit Boostrix und der Antwort von Säuglingen und Kleinkindern auf die Grundimmunisierung gegen Diphtherie-, Tetanus-, Hepatitis-B-, inaktivierten Poliomyelitis-, Haemophilus influenzae Typ b- oder Pneumokokken-Antigene, die bei der Mehrheit der Kinder (87,9%) als 3-Dosen-Grundimmunisierungsschema verabreicht wurde.
Es wurden niedrigere Antikörperkonzentrationen (Blunting) gegen Pertussis-Antigene nach der Grundimmunisierung (PT, FHA und PRN) und nach der Auffrischimpfung (PT, FHA) bei Säuglingen und Kleinkindern von Müttern, die während der Schwangerschaft mit dTpa geimpft wurden, beobachtet. Die Steigerung der Anti-Pertussis-Antikörperkonzentrationen vom Zeitpunkt vor der Auffrischimpfung bis 1 Monat nach der Auffrischimpfung lag bei Säuglingen und Kleinkindern sowohl von Müttern, die mit dTpa geimpft wurden, als auch von Müttern, die mit Placebo geimpft wurden, im gleichen Bereich.
In Ermangelung von Korrelaten für den Schutz gegen Pertussis muss die klinische Relevanz dieser Beobachtungen noch vollständig verstanden werden. Aktuelle epidemiologische Daten zur Pertussis-Erkrankung legen jedoch nahe, dass diese Immuninterferenz nicht von klinischer Relevanz ist.
Effektivität von Boostrix bezüglich Schutz gegen Pertussis bei Säuglingen von Müttern, die während der Schwangerschaft geimpft wurden
Die Effektivität des Impfstoffs Boostrix wurde in zwei prospektiv geplanten Beobachtungsstudien in Spanien und Australien untersucht. Der Impfstoff wurde im Rahmen eines maternalen Impfprogramms im dritten Trimenon der Schwangerschaft verabreicht, um Säuglinge im Alter von unter 3 bzw. unter 6 Monaten vor einer Pertussis-Erkrankung zu schützen.
Details zum jeweiligen Studiendesign und zu den Ergebnissen sind in der nachstehenden Tabelle aufgeführt.
Effektivität gegen Pertussis bei Säuglingen im Alter von unter 3 Monaten bzw. 6 Monaten von Müttern, die während des dritten Trimenons der Schwangerschaft mit Boostrix geimpft wurden:
|
Studienort
|
Impfstoff
|
Studiendesign
|
Primärer Endpunkt
|
Effektivität der Impfung
| |
Spanien
|
Boostrix
|
Gematchte Fall-Kontroll-Studie
|
Pertussis-Erkrankung bei Säuglingen unter 3 Monaten
|
90,9% (95%-KI: 56,6%-98,1%)1
| |
Australien
|
Boostrix
|
Gematchte Fall-Kontroll-Studie
|
Pertussis-Erkrankung bei Säuglingen unter 6 Monaten
|
39% (95%-KI: -12%-66%)2
|
KI: Konfidenzintervall
1 Bereinigt um das Stillen
2 Bereinigt um das Stillen (ausschliesslich gestillt vs. nicht ausschliesslich gestillt), Haushaltsgrösse, Schwangerschaftswoche (Vollzeit- vs. Frühgeburt)
Die in Australien durchgeführte Studie zeigte bei 2 sekundären Endpunkten eine Effektivität der Impfung gegen die Pertussis-Erkrankung von 69% (95%-KI: 13%-89%) bei Säuglingen unter 3 Monaten und eine Effektivität der Impfung gegen einen Krankenhausaufenthalt wegen Keuchhustens von 94% (95%-KI: 59%-99%) bei Säuglingen unter 6 Monaten. Es ist anzumerken, dass diese Zahlen die einzige Wirkung der mütterlichen Immunisierung darstellen (d.h. in Ergänzung zum Schutz, der durch die Grundimmunisierung des Säuglings gewährt wird).
Wenn die Impfung der Mutter innerhalb von zwei Wochen vor der Entbindung erfolgt, kann die Wirksamkeit des Impfstoffes beim Säugling niedriger sein als in der Tabelle angegeben.
Persistenz der Immunantwort
Drei bis dreieinhalb Jahre, 5 – 6 Jahre und 10 Jahre nach Impfung mit Boostrix wurden folgende Seropositivitätsraten beobachtet:
|
Antigen
|
Seroprotektion/ Seropositivität
|
Erwachsene und Jugendliche ab 10 Jahren
|
Kinder ab 4 Jahren3
| |
3–3,5 Jahre Persistenz
|
5 Jahre Persistenz
|
10 Jahre Persistenz
|
3–3,5 Jahre Persistenz
|
5-6 Jahre Persistenz
| |
|
|
Erwachsene1
|
Jugendliche2
|
Erwachsene1
|
Jugendliche2
|
Erwachsene1
|
Jugendliche2
|
|
| |
Diphtherie-Toxoid
|
≥0,1 IU/mL
|
71,2%
|
91,6%
|
84,1%
|
86,8%
|
64,6%
|
82,4%
|
97,5%
|
94,2%
| |
|
≥0,016 IU/mL*
|
97,4%
|
100%
|
94,4%
|
99,2%
|
89,9%
|
98,6%
|
100%
|
Nicht bestimmt
| |
Tetanus-Toxoid
|
≥0,1 IU/mL
|
94,8%
|
100%
|
96,2%
|
100%
|
95,0%
|
97,3%
|
98,4%
|
98,5%
| |
Pertussis:
| |
Pertussis-Toxoid
|
|
90,6%
|
81,6%
|
89,5%
|
76,8%
|
85,6%
|
61,3%
|
58,7%
|
51,5%
| |
Filamentöses
|
≥5 EL.U/mL
|
100%
|
100%
|
100%
|
100%
|
99,4%
|
100%
|
100%
|
100%
| |
Hämagglutinin
Pertactin
|
|
94,8%
|
99,2%
|
95,0%
|
98,1%
|
95,0%
|
96,0%
|
99,2%
|
100%
|
* Prozentanteil der Impflinge mit Antikörperkonzentrationen, die mit einer Schutzwirkung gegen die Krankheit assoziiert sind (≥ 0,1 IU/mL ELISA-Test oder ≥ 0,016 IU/mL in einem in-vitro-Vero-Zell-Neutralisations-Test).
1 Erwachsene: Personen der Grundimmunisierungs-Studie dTpa-002 (n = 428), die beobachtet wurden nach:
3 – 3,5 Jahren in Studie dTpa-021 (n = 310)
5 Jahren in Studie dTpa-027 (n = 240)
10 Jahren in Studie dTpa-039 (n = 160)
2 Jugendliche: Personen der Grundimmunisierungs-Studie dTpa-004 (n = 447), die beobachtet wurden nach:
3 – 3,5 Jahren in Studie dTpa-017 (n = 264)
5 Jahren in Studie dTpa-030 (n = 257)
10 Jahren in Studie dTpa-040 (n = 75)
3 Kinder: Personen der Grundimmunisierungs-Studie APV-118 (n = 211), die beobachtet wurden nach:
3 – 3,5 Jahren in Studie APV-124 (n = 122)
5 – 6 Jahren in Studie Tdap0.3-004 (n = 70)
Immunantwort nach einer wiederholten Impfung mit Boostrix
Die Immunogenität von Boostrix ist 10 Jahre nach einer vorgängigen Boosterdosis mit dTpa-Impfstoffen untersucht worden. Einen Monat nach der Impfung waren > 99% der Personen gegen Diphtherie und Tetanus geschützt und seropositiv gegen Pertussis (Studien dTpa-039 und dTpa-040).
Die folgende Tabelle fasst diese Daten zusammen:
|
Antigen
|
Seroprotektion/
Seropositivität
|
Adoleszente
(% Impflinge)1
|
Erwachsene
(% Impflinge)2
| |
|
|
Prä-Booster
(N = 75)
|
Post-Booster
(N = 73)
|
Prä-Booster
(N = 153)
|
Post-Booster
(N = 153)
| |
Diphtherie-Toxoid
|
≥ 0,1 IU/mL
|
82,4%
|
100%
|
62,9%
|
99,3%
| |
≥ 0,016 IU/mL*
|
98,6%
|
NA
|
89,9%
|
NA
| |
Tetanus-Toxoid
|
≥ 0,1 IU/mL
|
97,3%
|
100%
|
94,8%
|
100%
| |
Pertussis:
| |
Pertussis-Toxoid
|
|
61,3%
|
100%
|
85,6%
|
100%
| |
Filamentöses Hämagglutinin
|
≥ 5 EL.U/mL
|
100%
|
100%
|
99,3%
|
100%
| |
Pertactin
|
|
96,0%
|
100%
|
94,7%
|
100%
|
* Prozentanteil der Impflinge mit Antikörperkonzentrationen, die mit einer Schutzwirkung gegen die Krankheit assoziiert sind (≥ 0,1 IU/mL ELISA-Test oder ≥ 0,016 IU/mL in einem in-vitro-Vero-Zell-Neutralisations-Test).
1 Studie dTpa-040
2 Studie dTpa-039
NA = Not Applicable (nicht zutreffend)
Immunantwort bei Personen ohne vorherige Impfung oder mit unbekannter Impfhistorie
Nach Verabreichung einer Dosis Boostrix bei 83 Jugendlichen im Alter von 11 bis 18 Jahren ohne vorausgegangene Impfung gegen Pertussis und ohne Impfung gegen Diphtherie und Tetanus in den vorangegangenen 5 Jahren, wurde eine Immunantwort gegen Pertussis induziert und alle Probanden erreichten seroprotektive Antikörpertiter gegen Tetanus und Diphtherie. Die Seropositivitätsraten nach einer Dosis reichten von 87% bis 100% für die verschiedenen Pertussis-Antigene.
Bei Personen im Alter von ≥ 40 Jahren, die in den letzten 20 Jahren keine Diphtherie- bzw. Tetanus-Impfung erhalten hatten (einschliesslich derjenigen, die nie geimpft worden sind oder deren Impfstatus nicht bekannt war) induzierte eine Dosis von Boostrix eine Immunantwort gegen Pertussis und die Mehrheit in dieser Personengruppe war geschützt gegen Tetanus und Diphtherie. Zwei zusätzliche Dosen mit Diphterie- und Tetanus-Toxoid enthaltenden Impfstoffen maximierten die Impfantwort gegen Diphterie und Tetanus, wenn sie 1 und 6 Monate nach der 1. Dosis angewendet wurden (Studie dTpa 034).
Die folgende Tabelle fasst die Daten zusammen:
|
Antigen
|
Seroprotektion/
Seropositivität
|
Personen ≥40 Jahre1 (N = 139), 3 Dosen dTpa
(Monate 0-1-6)
| |
Vor der Impfung
|
Monat 1
|
Monat 2
|
Monat 7
| |
Diphtherie
|
≥ 0,1 IU/mL
|
53,6%
|
81,5%
|
92,6%
|
99,3%
| |
Tetanus
|
≥ 0,1 IU/mL
|
49,6%
|
93,4%
|
100%
|
100%
| |
Pertussis:
| |
Pertussis-Toxoid
|
|
68,9%
|
99,3%
|
99,3%
|
100%
| |
Filamentöses Hämagglutinin
|
≥ 5 EL.U/mL
|
99,3%
|
100%
|
100%
|
100%
| |
Pertactin
|
|
64,0%
|
98,5%
|
100%
|
100%
|
1 Studie dTpa-034
Immunantwort und Sicherheitsprofil bei erwachsenen Personen unter aktiver Behandlung gegen obstruktive Atemwegserkrankungen (Asthma/COPD )
Die Sicherheit und die Immunogenität von Boostrix wurden in einer retrospektiven Meta-Analyse (Verwendung von medizinischen Codes) von 222 Personen ab 18 Jahren, davon 211 Per Protokoll Probanden (95,0%), untersucht, die mit Boostrix in 5 verschiedenen Studien (dTpa-002, Tdap-007, Tdap-008, Tdap-011, ZOSTER-042) ohne weitere Impfstoffe geimpft wurden, während sie unter aktiver Behandlung gegen eine obstruktive Atemwegserkrankung wie Asthma oder chronisch obstruktive Lungenerkrankung (COPD) standen. Bei 19,4% wurden Kortikosteroide für die Behandlung von obstruktiven Atemwegserkrankungen eingesetzt, 40.1% der Patienten erhielten Kombinationspräparate von Adrenergika mit Kortikosteroiden oder anderen Wirkstoffen ausser Anticholinergika. Das Durchschnittsalter der Probanden zum Zeitpunkt der Impfung betrug 55,5 ± 17,6 Jahre. Der Anteil der Frauen betrug 63,5%.
Einen Monat nach der Boostrix-Impfung betrugen die Immunantworten gegen die Diphtherie- und Tetanus-Antigene, bezogen auf die Seroprotektionsraten (≥ 0,1 IE/mL), 89,0% bzw. 97,2% und gegen Pertussis, bezogen auf die Auffrischantworten, 78,3% gegen Pertussistoxin (PT), 96,1% gegen filamentöses Hämagglutinin (FHA) und 92,2% gegen Pertactin (PRN). Das Sicherheitsprofil war unverändert.
Klinische Wirksamkeit
Siehe unter «Pharmakodynamik».
PharmakokinetikEine Beurteilung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische DatenToxikologie bei wiederholter Gabe
Die Ergebnisse präklinischer Prüfungen zur Sicherheit, spezifischen Toxizität und Kompatibilität der Bestandteile deuten nicht auf eine besondere Gefährdung des Menschen hin.
Reproduktionstoxizität
Basierend auf den konventionellen Studien zur weiblichen Fertilität an Ratten und Kaninchen lassen die mit Boostrix erhaltenen präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Basierend auf den konventionellen Studien zur embryofötalen Entwicklung an Ratten und Kaninchen sowie zu Geburt und postnataler Toxizität bei Ratten (bis zum Ende der Laktation) lassen die präklinischen Daten zu Boostrix keine besonderen Gefahren für den Menschen erkennen.
Sonstige HinweiseInkompatibilitäten
Boostrix darf nicht mit anderen Impfstoffen in derselben Spritze gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren.
Nicht einfrieren. Einmal gefrorener Impfstoff ist zu verwerfen.
Stabilitätsdaten zeigen, dass der Impfstoff 7 Tage lang bei Temperaturen von bis zu 37°C stabil ist. Diese Daten sind nur dazu bestimmt, dem medizinischen Fachpersonal eine Anleitung bei vorübergehenden Temperaturabweichungen zu geben.
Hinweise für die Handhabung
Nach Lagerung können ein weisser Niederschlag und ein klarer Überstand beobachtet werden.
Der Impfstoff soll vor Gebrauch gut geschüttelt werden, um eine homogene weisslich-trübe Suspension zu erhalten. Zudem soll er vor Gebrauch visuell auf Fremdpartikel und/oder Veränderungen im Aussehen kontrolliert werden. Im Fall einer Veränderung darf der Impfstoff nicht verabreicht werden.
Gebrauchsanweisung für die Fertigspritze:
|
|
|
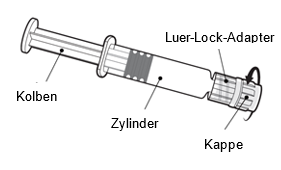
Halten Sie die Spritze am Zylinder, nicht am Kolben.
Schrauben Sie die Spritzenkappe ab, indem Sie sie gegen den Uhrzeigersinn drehen.
| |
|
|
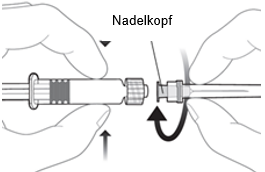
Um die Nadel an der Spritze anzubringen, verbinden Sie den Nadelkopf mit dem Luer-Lock-Adapter und drehen Sie die Nadel eine Vierteldrehung im Uhrzeigersinn, bis Sie spüren, dass sie einrastet.
Ziehen Sie den Spritzenkolben nicht aus dem Zylinder heraus. Sollte dies geschehen, verabreichen Sie den Impfstoff nicht.
|
Nicht verwendeter Impfstoff und Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer00637 (Swissmedic)
Packungen1 Impfdosis zu 0,5 mL Injektionssuspension in Fertigspritze mit separat beigelegter Nadel: Packungen zu 1 und 10 Fertigspritzen. (B)
ZulassungsinhaberinGlaxoSmithKline AG, 36340 Baar
Stand der InformationSeptember 2023
|


