ZusammensetzungWirkstoffe
Dexamethasoni natrii phosphas.
Hilfsstoffe
Dinatrii edetas, Natrii citras dihydricus, Natrii hydroxidum (E 524; pH-Einstellung), Glycerolum (E 422), Natrii metabisulfis (E 223) 1 mg, Alcohol benzylicus 10,5 mg, Aqua ad iniectabilia q.s. ad solutionem pro 1 ml.
Jede Ampulle zu 5 mg/ml enthält maximal 1.1 mg Natrium.
Indikationen/AnwendungsmöglichkeitenIntravenöse Injektion
Eine solche soll nur bei akuten lebensbedrohenden Situationen erfolgen wie:
·Schock nach schweren Traumata (bei substituierten Patienten bzw. Patientinnen),
·Status asthmaticus,
·anaphylaktischer Schock (nach [Nor-]Adrenalininjektion),
·Zwischenfällen bei Bluttransfusionen,
·Myokardinfarkt
Dexamethason Zentiva wird angewendet zur Behandlung der Coronavirus-Krankheit 2019 (COVID-19) bei Erwachsenen und Jugendlichen (im Alter von mindestens 12 Jahren und mit einem Körpergewicht von mindestens 40 kg), die eine zusätzliche Sauerstoffzufuhr erfordert.
Intramuskuläre und subkutane Injektion
Diese erfolgt in akuten, aber nicht lebensbedrohlichen Situationen, bei welchen der Arzt oder die Ärztin Gewissheit über die dem Patienten oder der Patientin verabreichte Kortikosteroid-Menge haben will. Sie ist selbstverständlich auch in all jenen Fällen angezeigt, bei denen die orale Verabreichung nicht möglich ist, wie z.B. bei Bewusstlosigkeit, bei gastrointestinalen Störungen oder während einer Narkose.
Die hauptsächlichen Indikationen sind:
Substitutionstherapie (zusätzlich zur Verabreichung eines Mineralokortikoids bei primärer oder sekundärer NNR-Insuffizienz und bei adrenogenitalem Syndrom), akute Erkrankungen des rheumatischen Formenkreises, Asthma bronchiale, schwere Agranulozytose, Thyreoiditis, Lupus erythematodes, Pemphigus, akute Dermatitis, Dermatomyositis, akute Blutkrankheiten, Prophylaxe und Therapie von zytostatika-induziertem Erbrechen.
Intraartikuläre Injektion
In alle grossen und kleinen Gelenke mit Ausnahme der intervertebralen: Arthrosen, Hydrarthrose, entzündliche Arthritiden.
Periartikuläre Injektion
Periarthritis humeroscapularis, Epicondylitis humeri, Tendovaginitis.
Infiltration des erkrankten Gebietes
Weichteilrheumatismus, Sehnen- und Muskelzerrung, Keloid, Dupuytren-Kontraktur, Clavi, Ganglien.
Dosierung/AnwendungDexamethason Zentiva kann intravenös, intramuskulär, subkutan oder lokal injiziert oder in das erkrankte Gebiet infiltriert werden.
Für den Fall, dass Dexamethason Zentiva eine Therapie mit einem anderen Glukokortikoid ersetzen soll, sind die Äquivalenzdosen zu berücksichtigen (siehe «Eigenschaften/Wirkungen»).
Intravenöse Injektion
Die intravenöse Injektion muss langsam über eine Zeitdauer von 4–5 Minuten pro 1 ml erfolgen.
Dosierung: Die übliche Dosis für den Notfall beträgt 4–20 mg, je nach Schweregrad des Krankheitsbildes. Diese Dosis kann wiederholt werden, bis der Patient / die Patientin genügend anspricht.
Die Dauer der Behandlung richtet sich nach dem klinischen Ansprechen und den individuellen Bedürfnissen des Patienten.
Behandlung von COVID-19
Erwachsene und Jugendliche erhalten zur Behandlung von COVID-19 einmal täglich 6 mg intravenös über einen Zeitraum von bis zu 10 Tagen.
Intramuskuläre und subkutane Injektion
4–8 mg täglich.
Intraartikuläre Injektion
Grosse Gelenke: 4–6 mg.
Kleine Gelenke: 0,8–2 mg.
In der Regel genügt eine einmalige Injektion.
Periartikuläre Injektion
2–4 mg. Wenn notwendig wiederholt man diese Injektion.
Infiltration des erkrankten Gebietes
1–4 mg.
Intraartikuläre und periartikuläre Injektionen müssen strikt aseptisch durchgeführt werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»).
Spezielle Dosierungsanweisungen
Kinder und Jugendliche
Für Patienten unter 18 Jahren stehen nur limitierte Daten zur Verfügung.
Bei Kleinkindern und Kindern sind im allgemeinen geringere Dosen als die oben angegebenen ausreichend, doch sollte die Dosierung mehr auf die Schwere der Erkrankung als auf Alter, Körpergewicht oder Körpergrösse abgestellt werden.
Ältere Patienten
Im Falle einer kurzzeitigen Therapie ist keine Dosisanpassung erforderlich.
Bei einer längerdauernden Kortikosteroid-Therapie ist bei älteren Patienten das Risiko für eine Osteoporose erhöht, und die Anwendung sollte unter entsprechender Vorsicht erfolgen.
Patienten mit Nieren- oder Leberinsuffizienz
Im Falle einer kurzzeitigen Therapie ist keine Dosisanpassung erforderlich.
Bei einer längerdauernden Kortikosteroid-Therapie kann bei schwerer Leberinsuffizienz die Metabolisierung des Steroids verzögert sein, sodass eine Dosisanpassung erforderlich werden kann.
Kontraindikationen·Bei systemischer Anwendung:
·Magen- und Darmulzera,
·systemische Pilzinfektionen,
·bestimmte virale Infektionen wie Varicella, Herpes genitalis, Herpes corneae;
·Glaukom.
·Bei lokaler Anwendung:
·Infektionen an der Injektionsstelle, z.B. infektiöse Arthritis infolge Gonorrhoe oder Tuberkulose, Bakteriämie oder systemische Pilzinfektionen;
·instabiles Gelenk.
·Für alle Verabreichungsarten:
·Asthma bronchiale,
·Anwendung bei Neu- und Frühgeborenen (siehe «Unerwünschte Wirkungen»).
·Überempfindlichkeit gegenüber sulfithaltigen Arznei-, Nahrungs- oder Genussmitteln;
·Überempfindlichkeit gegenüber Dexamethason,
Im Allgemeinen bestehen jedoch keine Kontraindikationen bei Zuständen, in denen die Verabreichung von Glukokortikoiden lebensrettend sein kann.
Dexamethason Zentiva darf wegen des Gehaltes an Benzylalkohol nicht intrathekal oder epidural angewendet werden.
Warnhinweise und VorsichtsmassnahmenDie möglichen Komplikationen einer Kortikosteroid-Therapie sind von der Höhe der Dosierung und der Dauer der Behandlung abhängig. Daher sollte für jeden Patienten hinsichtlich Dosierung und Therapiedauer eine individuelle Nutzen-Risiko-Abwägung erfolgen.
Überempfindlichkeitsreaktionen
In seltenen Fällen können nach Gabe von Kortikosteroiden allergische Reaktionen auftreten wie Hautreaktionen, Angioödem oder anaphylaktische / anaphylaktoide Reaktionen. Insbesondere wurde nach parenteraler Verabreichung von Glukokortikoiden über Glottisödem und Bronchospasmus berichtet, vor allem bei Patienten bzw. Patientinnen mit Allergien in der Anamnese. Daher sollten, insbesondere bei Patienten mit bekannter Arzneimittelallergie, vor der Anwendung entsprechende Vorsichtsmassnahmen getroffen werden. Falls es zu einer schweren Überempfindlichkeitsreaktion kommt, ist eine intensivmedizinische Versorgung des Patienten / der Patientin (langsame i.v. Injektion von 0,1–0,5 mg Adrenalin, künstliche Beatmung) erforderlich.
Immunsuppressive Effekte / erhöhte Empfindlichkeit gegenüber Infektionen
Kortikoide können die Symptome einer Infektion verschleiern oder latente Infektionen aktivieren; ausserdem können während der Kortikoidtherapie neue Infektionen auftreten. Bei schweren Infektionskrankheiten ist für einen ausreichenden antibiotischen bzw. chemotherapeutischen Schutz zu sorgen.
Falls Kortikosteroide bei Patienten mit latenter Tuberkulose oder Tuberkulinreaktivität eingesetzt werden, ist eine engmaschige Kontrolle erforderlich, da eine Reaktivierung der Infektion erfolgen kann. Im Falle einer Langzeittherapie mit einem Kortikosteroid müssen solche Patienten eine tuberkulostatische Prophylaxe erhalten.
Varizellen, die während einer systemischen Behandlung mit Kortikosteroiden auftreten, können eine schwere Verlaufsform annehmen und insbesondere bei Kindern letal enden. Sie erfordern eine sofortige Behandlung, z.B. mit Aciclovir i.v. Bei Risikopatienten bzw. -patientinnen ist eine Prophylaxe mit Aciclovir oder eine passive Immunprophylaxe mit Varizella-zoster-Immunglobulin angezeigt.
Die intraartikuläre Anwendung von Kortikosteroiden erhöht das Risiko für Gelenkinfektionen. Zur Vermeidung von Infektionen ist eine aseptische Arbeitsweise unabdingbar. Lokale Injektionen in bereits infizierte Gelenke sind zu vermeiden. Deutlich vermehrte Schmerzen mit lokaler Schwellung, zunehmender Einschränkung der Gelenkbeweglichkeit, Fieber und allgemeines Unwohlsein deuten auf eine septische Arthritis hin.
Die gleichzeitige Gabe von Dexamethason Zentiva mit starken CYP3A4-Inhibitoren sollte wegen der möglichen vermehrten Kortikosteroid-Toxizität vermieden werden (siehe «Interaktionen»). Unter gleichzeitiger Anwendung des in der Therapie von HIV-Infektionen eingesetzten Wirkstoffes Cobicistat, einem starken CYP3A-Inhibitor sowie Inhibitor mehrerer Transportproteine, zusammen mit Kortikosteroiden wurde über eine vermehrte Steroid-Toxizität bis hin zu Fällen eines Cushing-Syndroms berichtet. Falls Dexamethason Zentiva zusammen mit Cobicistat angewendet wird, ist der Patient sorgfältig auf mögliche unerwünschte Steroid-Wirkungen zu überwachen. Die Wahl eines alternativen Steroids mit CYP3A-unabhängigem Metabolismus sollte in Erwägung gezogen werden.
Verabreichung von Impfstoffen
Zur Durchführung von Impfungen bei Patienten, die mit Glukokortikoiden behandelt werden, sollten auch die jeweils geltenden Leitlinien konsultiert werden.
Lebendimpfstoffe: Bei Patienten unter immunsuppressiven Dosen von Dexamethason sollten Impfungen mit Lebendimpfstoffen frühestens einen Monat nach Absetzen des Kortikosteroids verabreicht werden.
Bei lokaler Anwendung von Dexamethason (einschliesslich intraartikulärer Injektion) ist eine Impfung mit Lebendimpfstoffen möglich, sofern keine anderen Kontraindikationen vorliegen.
Attenuierte oder Totimpfstoffe: Bei Patienten unter immunsuppressiven Glukokortikoiddosen (im Falle von Dexamethason ≥3 mg/Tag bei Patienten mit einem Körpergewicht >10 kg bzw. 0,3 mg/kg Körpergewicht, bei Anwendung über mehr als 2 Wochen) sollten attenuierte oder Totimpfstoffe erst dann verabreicht werden, nachdem die Dosis reduziert oder die Therapie vollständig abgesetzt wurde.
Nach Verabreichung eines attenuierten oder Totimpfstoffes wird empfohlen, eine nicht unbedingt erforderliche Dexamethason-Therapie frühestens nach 2 Wochen einzuleiten.
Bei nicht-immunsuppressiven Dosen sowie bei lokaler Anwendung von Glukokortikoiden (einschliesslich intraartikulärer Dexamethason-Injektionen) sind Impfungen mit attenuierten oder Totimpfstoffen ohne Einschränkungen möglich.
Endokrine Effekte
Pharmakologische Dosierungen von Kortikosteroiden, die über einen längeren Zeitraum verabreicht werden, können zu einer hypothalamisch-hypophysär-adrenalen Suppression (sekundäre Nebennierenrinden(NNR)-Insuffizienz) führen. Das Ausmass und die Dauer einer adrenokortikalen Insuffizienz variiert von Patient zu Patient und ist abhängig von Dosis, Frequenz und Tageszeit der Verabreichung sowie von der Dauer einer Kortikosteroidtherapie. Dieser Effekt kann durch eine alternierende Therapie abgeschwächt werden.
Bei ungewöhnlichen Belastungen (z.B. schwerer Erkrankung, grösseren Operationen, schwerem Trauma, etc.) muss bei Patienten, welche unter einer längerfristigen Therapie mit Kortikosteroiden stehen, kurzfristig vor, während und nach der Belastungssituation die Dosis schnell wirksamer Kortikosteroide erhöht werden.
Bei abruptem Absetzen von Kortikosteroiden kann es zu einer NNR-Insuffizienz (unter Umständen mit letalem Ausgang) kommen. Daher sollten Steroide nicht abrupt abgesetzt, sondern die Dosis allmählich reduziert werden.
Eine relative NNR-Insuffizienz kann noch Monate nach Absetzen der Therapie persistieren. Kommt es in diesem Zeitraum zu besonderen Belastungssituationen (siehe oben), so sollte die Steroidtherapie wiederaufgenommen werden. Da auch die Mineralokortikoidsekretion eingeschränkt sein kann, sollten zusätzlich auch Salz und/oder ein Mineralokortikoid begleitend verabreicht werden.
Bei abruptem Absetzen von Kortikosteroiden kann ausserdem ein «Steroid-Absetzsyndrom» auftreten, welches unabhängig von einer NNR-Insuffizienz zu sein scheint. Dieses Syndrom beinhaltet Symptome wie Kopfschmerzen, Anorexie, Nausea, Erbrechen, Gewichtsverlust, Hypotonie, Hautschuppung, Arthralgien, Myalgien, Lethargie und/oder Fieber.
Bei Patienten mit Hypothyreose ist die Wirkung extern zugeführter Kortikosteroide verstärkt.
Da Kortikosteroide ein Cushing-Syndrom hervorrufen oder verschlechtern können, sollten sie bei Patienten mit Morbus Cushing vermieden werden.
Bei COVID-19 Patienten, die bereits aus anderen Gründen mit systemischen (oralen) Kortikosteroiden behandelt werden (z.B. Patienten mit chronisch obstruktiver Lungenerkrankung), die aber keinen zusätzlichen Sauerstoff benötigen, sollten die systemischen Kortikosteroide nicht abgesetzt werden.
Phäochromozytom-Krise
Nach systemischer Anwendung von Kortikosteroiden wurde über das Auftreten einer Phäochromozytom-Krise berichtet, teilweise mit letalem Ausgang. Bei Patienten mit bekanntem oder vermuteten Phäochromozytom sollten Kortikosteroide daher nur nach sorgfältiger Nutzen-Risiko-Abwägung angewendet werden. Treten bei einem Patienten unter Behandlung mit Kortikosteroiden potentielle Symptome einer Phäochromozytom-Krise auf, wie hypertensive Krise, Herzversagen, Tachykardie, Kopf-, Abdominal- und/oder Thoraxschmerzen, sollte an die Möglichkeit eines bisher unbekannten Phäochromozytoms gedacht werden.
Effekte auf die Psyche
Unter Kortikosteroidbehandlung kann es zu potentiell schweren psychischen Störungen kommen, die von Euphorie über Insomnie, Stimmungsschwankungen und Persönlichkeitsveränderungen bis zu schweren Depressionen oder manifesten Psychosen reichen. Auch können sich bereits bestehende affektive Störungen oder psychotische Tendenzen unter Kortikosteroiden verschlimmern. Die Symptome treten meist innerhalb von Tagen oder Wochen nach Behandlungsbeginn auf und klingen im Allgemeinen nach Dosisreduktion oder Absetzen des Kortikosteroids ab. Eine spezifische Behandlung kann jedoch erforderlich sein.
Unerwünschte psychische Effekte wurden auch nach Absetzen von Kortikosteroiden berichtet.
Der Patient und seine Angehörigen sollten aufgefordert werden, bei Auftreten psychischer Symptome unter der Therapie bzw. während oder nach dem Ausschleichen/Absetzen den Arzt / die Ärztin zu kontaktieren, vor allem dann, wenn depressive Stimmung oder suizidale Absichten vermutet werden.
Effekte auf das Nervensystem
Bei Patienten mit Anfallsleiden sollten Kortikosteroide nur mit Vorsicht eingesetzt werden.
In Zusammenhang mit der Anwendung von Kortikosteroiden, insbesondere bei langfristiger Anwendung in hohen Dosen, wurde über Fälle einer epiduralen Lipomatose berichtet.
Muskuloskelettale Effekte
Bei Behandlung der Myasthenia gravis mit Cholinesterase-Inhibitoren kann durch Kortikosteroide die Wirkung des Cholinesterase-Inhibitors reduziert und das Risiko einer Myastheniekrise erhöht werden. Cholinesterase-Inhibitoren sollten daher möglichst 24 Stunden vor der Verabreichung eines Kortikosteroids abgesetzt werden (siehe «Interaktionen»).
Im Zusammenhang mit der Anwendung hoher Kortikosteroid-Dosen wurde über akute Myopathien berichtet, insbesondere bei Patienten mit Störungen der neuromuskulären Transmission (z.B. Myasthenia gravis) oder bei Patienten, die gleichzeitig neuromuskuläre Blocker (wie z.B. Pancuronium) erhielten. Solche akuten Myopathien verlaufen generalisiert, können die Augen- und die Atemmuskulatur einbeziehen und zu einer Tetraparese führen. Die Kreatinkinase-Werte können ansteigen.
Eine Langzeitanwendung von Kortikosteroiden kann zu einer Osteoporose führen, insbesondere bei postmenopausalen und geriatrischen Patienten bzw. Patientinnen. In dieser Population sollte eine Kortikosteroidtherapie nur unter strenger Indikationsstellung und sorgfältiger Nutzen-Risiko-Abwägung durchgeführt werden. Im Falle des Auftretens einer Osteoporose sollte die Steroidtherapie (ausser bei vitalen Indikationen) abgesetzt werden.
Okuläre Effekte
Mögliche unerwünschte Wirkungen bei längerdauernder Anwendung von Corticosteroiden sind Exophthalmus, Katarakt (auch bei Kindern) und erhöhter intraokulärer Druck. Letzterer kann zu einem manifesten Glaukom mit Schädigung des Sehnervs bis hin zur Erblindung führen. Der Augeninnendruck sollte deshalb unter einer Langzeit-Kortikoidtherapie regelmässig gemessen werden.
Eine Kortikosteroidtherapie wurde auch mit dem Auftreten einer zentralen serösen Chorioretinitis in Verbindung gebracht, die zur Netzhautablösung führen kann.
Ausserdem kann eine Behandlung mit Kortikosteroiden Sekundärinfektionen des Auges mit Viren oder Pilzen begünstigen.
Kardiovaskuläre Effekte
Bei Patienten mit Herzinsuffizienz sollten Kortikosteroide nur mit Vorsicht angewendet werden und nur dann, wenn sie absolut notwendig sind.
Unter hohen Kortikosteroid-Dosen kann eine Bradykardie auftreten.
Gastrointestinale Effekte
Kortikosteroide können die Symptome peptischer Ulzera maskieren, sodass es zu einer weitgehend asymptomatischen Perforation oder zu akuten gastrointestinalen Blutungen kommen kann. Das Risiko für peptische Ulzera steigt bei Kombination von Kortikosteroiden mit nicht-steroidalen Antirheumatika (NSAID). Vorsicht ist daher geboten bei Patienten mit vorbestehender Gastritis, Ösophagitis oder Divertikulitis sowie bei Colitis ulcerosa mit erhöhter Gefahr einer Perforation oder einer pyogenen Infektion.
Hohe Kortikosteroid-Dosierungen können ausserdem eine akute Pankreatitis auslösen.
Tumorlyse-Syndrom
Nach Anwendung von Dexamethason allein oder in Kombination mit Chemotherapeutika wurde bei Patienten mit malignen hämatologischen Erkrankungen über ein Tumorlyse-Syndrom (TLS) berichtet. Ein Tumorlyse-Syndrom führt zu einer Erhöhung der Harnsäure-, Kalium- und/oder Phosphatkonzentrationen und zu einer Reduktion der Kaliumkonzentration im Serum sowie zu Arrhythmien. Mögliche Manifestationsformen sind unter anderem Krampfanfälle und Niereninsuffizienz.
Patienten mit schnell proliferierenden Tumoren oder hoher Tumorlast sowie solche mit erhöhter Empfindlichkeit gegenüber zytotoxischen Wirkstoffen weisen ein erhöhtes Risiko für ein TLS auf und sollten daher engmaschig überwacht werden. Zudem sollten geeignete Vorsichtsmassnahmen getroffen werden.
Weitere Erkrankungen, bei welchen die Gabe von Kortikosteroiden besondere Vorsicht erfordert:
·Bei akutem Hirnödem und bei Status asthmaticus ist Dexamethason Zentiva nicht als Ersatz der konventionellen Behandlung, sondern zusätzlich zu dieser zu verabreichen.
·Glukosestoffwechsel: Bei einer Langzeittherapie und insbesondere bei Patienten mit Diabetes mellitus sollte der Glukosemetabolismus regelmässig kontrolliert werden, da die Glukosetoleranz herabgesetzt werden kann. Eine Dosisanpassung der Antidiabetika kann erforderlich sein.
·Erkrankungen der Leber: Bei Leberzirrhose können die Wirkungen der Kortikosteroide verstärkt sein.
·Wasser- und Elektrolythaushalt: Kortikosteroide können, insbesondere in mittleren und hohen Dosen, zu einer Salz- und Flüssigkeitsretention sowie zu einer erhöhten Kaliumausscheidung führen. Eine Kochsalz-Restriktion bzw. eine Kaliumsubstitution kann notwendig werden.
·Niereninsuffizienz: Bei Patienten mit Niereninsuffizienz sollten Kortikosteroide mit Vorsicht eingesetzt werden.
·Gleichzeitige Behandlung mit nicht-steroidalen Antiphlogistika: Acetylsalicylsäure und andere nicht-steroidale Antiphlogistika sollten nur mit Vorsicht zusammen mit Kortikosteroiden angewendet werden. Insbesondere ist im Falle eine Hypoprothrombinämie bei der gleichzeitigen Gabe von Acetylsalicylsäure Vorsicht geboten.
Eine über die Notfalltherapie hinausgehende, längerdauernde Anwendung von Dexamethason darf nicht erfolgen bei:
·Herpes simplex (siehe oben unter «Immunsuppressive Effekte / erhöhte Empfindlichkeit gegenüber Infektionen»)
·während der virämischen Phase eines Herpes zoster
·Varizellen
·Poliomyelitis (mit Ausnahme der bulbärenzephalitischen Form)
·systemischen Mykosen
·Lymphomen nach BCG-Impfung
·Amöbeninfektion
·Diabetes mellitus
·psychiatrischen Erkrankungen in der Anamnese (siehe oben unter «Effekte auf die Psyche»)
·schwerer Osteoporose (siehe oben unter «Muskuloskelettale Effekte»)
·Eng- oder Weitwinkelglaukom (siehe oben unter «okuläre Effekte»)
·schwerer Herzinsuffizienz (siehe oben unter «kardiovaskuläre Effekte»)
·schwerer Hypertonie
·vorbestehenden gastrointestinalen Ulzera (siehe oben unter «gastrointestinale Effekte»)
·Schwangerschaft
In solchen Fällen sollte der Nutzen der Dexamethason-Therapie besonders sorgfältig gegen die möglichen Risiken abgewogen werden.
Anwendung in der Pädiatrie
Kinder und Jugendliche unter Dexamethason-Langzeittherapie müssen wegen des Risikos einer Wachstumsverzögerung und eines vorzeitigen Epiphysenschlusses sorgfältig auf Wachstum und Entwicklung überwacht werden, und die Therapie erfordert in dieser Altersgruppe eine strenge Indikationsstellung. Das Risiko für diese unerwünschten Wirkungen kann durch eine alternierende Therapie reduziert werden.
Bei Frühgeborenen wurde nach systemischer Anwendung von Kortikosteroiden einschliesslich Dexamethason über eine hypertrophe Kardiomyopathie berichtet. In den meisten berichteten Fällen war diese nach Absetzen der Behandlung reversibel. Bei Frühgeborenen, die mit systemisch verabreichtem Dexamethason behandelt werden, wird eine echokardiographische Kontrolle von Struktur und Funktion des Herzmuskels empfohlen.
Lokale Effekte
Die wiederholte intramuskuläre, intraartikuläre oder subläsionale Verabreichung von Dexamethason (oder einem anderen Glukokortikoid) kann zu schweren lokalen Gewebeschädigungen (bis hin zu Atrophien und Nekrosen) führen.
Besondere Hilfsstoffe
Dexamethason Zentiva enthält als Hilfsstoffe Benzylalkohol und Natriumdisulfit (E 223).
Benzylalkohol
Dieses Arzneimittel enthält 10.5 mg Benzylalkohol pro Ampulle zu 5 mg/ml entsprechend 10.5 mg/ml. Benzylalkohol kann allergische Reaktionen hervorrufen.
Die intravenöse Anwendung von Benzylalkohol war mit schwerwiegenden Nebenwirkungen und Todesfällen bei Neugeborenen («Gasping Syndrom») verbunden (siehe «Kontraindikationen»). Die minimale Menge Benzylalkohol, bei der Toxizität auftritt, ist nicht bekannt.
Bei Kleinkindern besteht aufgrund von Akkumulation ein erhöhtes Risiko.
Das Toxizitätsrisiko hängt dabei von der verabreichten Menge und von der Entgiftungskapazität von Leber und Nieren ab. Grosse Mengen sollten daher wegen des Risikos der Akkumulation und Toxizität («metabolische Azidose») nur mit Vorsicht und wenn absolut nötig angewendet werden, insbesondere bei Patienten mit eingeschränkter Leber- oder Nierenfunktion. Die minimale Menge Benzylalkohol, bei der Toxizität auftritt, ist dabei nicht bekannt, bei hohen Dosen ist jedoch eine Toxizität wahrscheinlicher. Bei der Anwendung Benzylalkohol-haltiger Arzneimittel sollte die Summe der täglichen Menge Benzylalkohol aus allen Quellen berücksichtigt werden.
Aufgrund des Gehaltes an Benzylalkohol darf das Präparat nicht an Neu- und Frühgeborene verabreicht werden (siehe «Kontraindikationen»).
Natriumdisulfit
Natriumdisulfit kann bei empfindlichen Patienten bzw. Patientinnen allergische Reaktionen einschliesslich anaphylaktischem Schock und lebensbedrohlichen Asthma-Anfällen, Brechreiz und Diarrhoe auslösen. Die Prävalenz in der Bevölkerung ist unbekannt. Eine Sulfit-Überempfindlichkeit ist bei Asthmatikern häufiger als bei Nicht-Asthmatikern. Dexamethason Zentiva sollte daher bei Patienten bzw. Patientinnen mit Asthma oder einer Überempfindlichkeit gegenüber sulfithaltigen Produkten (Nahrungs- und Genussmittel, andere Arzneimittel) nicht verabreicht werden.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Ampulle zu 5 mg/ml, d.h. es ist nahezu «natriumfrei».
InteraktionenPharmakokinetische Interaktionen
Dexamethason wird unter Beteiligung von CYP3A4 metabolisiert.
Kortikosteroide können ausserdem die Aktivität von CYP3A4 und dadurch die Metabolisierung anderer Arzneimittel beeinflussen.
Einfluss anderer Arzneimittel auf die Pharmakokinetik von Dexamethason
Enzyminhibitoren
Die gleichzeitige Verabreichung mit starken CYP3A4-Inhibitoren (z.B. Itraconazol, Voriconazol, Clarithromycin, Ritonavir, Cobicistat) kann zu einer erhöhten Kortikosteroid-Exposition und dadurch zu einem erhöhten Risiko für unerwünschte Steroidwirkungen führen. Der Nutzen einer gleichzeitigen Verabreichung ist versus das potentielle Risiko sorgfältig zu prüfen. Im Falle der gleichzeitigen Anwendung eines starken CYP3A4-Inhibitors muss der Patient hinsichtlich der unerwünschten Wirkungen systemischer Kortikosteroide sorgfältig überwacht werden.
Enzyminduktoren
Substanzen, die Leberenzyme induzieren, können den metabolischen Abbau von Kortikosteroiden beschleunigen und so zu erniedrigten Plasmaspiegeln und einer reduzierten Wirksamkeit führen. Hierzu gehören z.B. Barbiturate, Carbamazepin, Efavirenz, Phenytoin, Primidon und Rifampicin sowie Präparate, welche Johanniskraut (Hypericum perforatum) enthalten.
Auch Ephedrin erhöht die Dexamethason-Clearance im Blut und die Harnausscheidung seines Metaboliten.
CYP3A4-Substrate
Auch durch gleichzeitige Anwendung anderer CYP3A4-Substrate (z.B. Aprepitant, Benzodiazepine, Diltiazem, Tacrolimus) kann die hepatische Clearance von Kortikosteroiden beeinflusst und ggf. eine Dosisanpassung erforderlich werden.
Auch Ciclosporin reduziert die Clearance von Kortikosteroiden, vermutlich über eine kompetetive Hemmung der hepatischen mikrosomalen Enzyme.
Auch Sexualhormone können die Clearance von Kortikosteroiden beeinflussen. Insbesondere können Östrogene die Wirkung von Kortikosteroiden verstärken.
Einfluss von Kortikosteroiden auf die Pharmakokinetik anderer Arzneimittel
Kortikosteroide können in hohen Dosen die Plasmakonzentrationen von Ciclosporin erhöhen. Dadurch können die unerwünschten Wirkungen von Ciclosporin verstärkt werden.
Kortikosteroide können bei längerdauernder hoher Dosierung die Elimination von Salicylaten beschleunigen und dadurch deren Wirksamkeit reduzieren. Umgekehrt kann bei Reduktion der Corticosteroid-Dosis die Toxizität von Salicylaten verstärkt werden. Wenn während einer Langzeitbehandlung mit Glukokortikoiden gleichzeitig Salizylate verabreicht werden, sollte daher jede Dosisreduktion des Glukokortikoids vorsichtig vorgenommen werden.
Bei Patienten oder Patientinnen mit Hypoprothrombinämie sollte Acetylsalicylsäure in Kombination mit Kortikosteroiden nur unter Vorsicht angewendet werden.
Pharmakodynamische Interaktionen
NSAIDs: Bei gleichzeitiger Gabe von Kortikosteroiden und NSAIDs ist das Risiko für Ulzera und Blutungen im Gastrointestinaltrakt erhöht.
Arzneimittel mit Einfluss auf den Kaliumhaushalt: Bei gleichzeitiger Gabe von Kortikosteroiden zusammen mit Arzneimitteln, welche die Kaliumausscheidung steigern (insbesondere Diuretika wie Furosemid oder Hydrochlorothiazid, aber auch z.B. Amphothericin B sowie Xanthin-Derivate wie Theophyllin), besteht ein erhöhtes Risiko für eine Hypokaliämie. Bei Patienten, welche eine solche Komedikation erhalten, sollten daher die Kaliumspiegel überwacht werden.
Herzglykoside: Durch die Kortikosteroid-induzierte Hypokaliämie kann die Toxizität von Herzglykosiden verstärkt werden.
Antidiabetika: Die blutzuckersenkende Wirkung von Antidiabetika kann bei gleichzeitiger Behandlung mit Kortikosteroiden reduziert sein, so dass eine Dosisteigerung des Antidiabetikums erforderlich werden kann.
Cholinesterasehemmer: Kortikosteroide können die Wirksamkeit von Cholinesterasehemmern reduzieren.
Anticholinergika: Atropin und andere Anticholinergika können zu einer weiteren Steigerung eines bereits erhöhten Augeninnendrucks führen.
Sympathomimetika: Kortikosteroide können die erwünschten und unerwünschten Wirkungen von Sympathomimetika verstärken.
Immunsuppressiva: Kortikosteroide wirken synergistisch mit anderen Immunsuppressiva (wie z.B. Methotrexat). Unter Umständen kann bei gleichzeitiger Anwendung eine niedrigere Steroiddosis ausreichend sein.
Antikoagulantien: Die Wirksamkeit von Antikoagulantien kann bei gleichzeitiger Gabe von Kortikosteroiden reduziert oder gesteigert sein. Die Gerinnungsparameter müssen daher überwacht und ggf. die Antikoagulantien-Dosis angepasst werden.
Nicht-depolarisierende Muskelrelaxantien: Bei mit Kortikosteroiden behandelten Patienten kann die Muskelrelaxation verlängert sein. Ausserdem wurde über akute Myopathien berichtet.
Psychopharmaka: Die Wirkung von Anxiolytika und Antipsychotika kann bei gleichzeitiger Behandlung mit Kortikosteroiden vermindert werden.
Impfstoffe: Die Impfantwort kann reduziert sein. Bei Lebendvirus-Impfstoffen (z.B. Mumps, Masern, Röteln, Poliomyelitis, Varizellen) ist aufgrund der immunsuppressiven Wirkung der Kortikosteroide das Risiko für eine Toxizität mit disseminierten viralen Infektionen erhöht.
Schwangerschaft, StillzeitSchwangerschaft
Tierstudien haben unerwünschte Effekte auf den Foetus gezeigt. Dexamethason passiert die Plazentaschranke (ebenso der Hilfsstoff Benzylalkohol, siehe «Warnhinweise und Vorsichtsmassnahmen», Abschnitt «besondere Hilfsstoffe»).
Bei Langzeittherapie während der Schwangerschaft sind intrauterine Wachstumsstörungen nicht auszuschliessen, und bei einer Behandlung zum Ende der Schwangerschaft besteht für den Foetus die Gefahr einer Atrophie der Nebennierenrinde, die eine ausschleichende Substitutionstherapie beim Neugeborenen erforderlich machen kann. Deshalb sollte Dexamethason Zentiva, wie alle Kortikosteroide, während der Schwangerschaft, insbesondere in den ersten drei Monaten, nur unter strenger Abwägung des Nutzen/Risiko-Verhältnisses angewendet werden. Dabei sollte bei bestehender Indikation Prednisolon (oder Prednison) allen anderen – insbesondere den fluorierten – Glukokortikoiden vorgezogen werden, da dessen Plazentagängigkeit am geringsten ist.
Die Patientinnen sollten dazu angehalten werden, bei einer vermuteten oder eingetretenen Schwangerschaft unbedingt den Arzt oder die Ärztin zu verständigen.
Nach kurzzeitiger pränataler Anwendung von Kortikosteroiden (einschliesslich Dexamethason) bei Schwangeren mit drohender später Frühgeburt (d.h. nach der 33. Schwangerschaftswoche) zeigten Studien ein erhöhtes Risiko für eine neonatale Hypoglykämie.
Stillzeit
Kortikosteroide treten in die Muttermilch über und können das Wachstum und die NNR-Funktion des Säuglings beeinträchtigen oder andere unerwünschte Wirkungen zeigen. Patientinnen, welche therapeutische Kortikoiddosen erhalten, sollten deshalb abstillen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenMit Dexamethason Zentiva wurden keine entsprechenden Studien durchgeführt.
Unerwünschte WirkungenHäufigkeit und Schweregrad unerwünschter Kortikoidwirkungen sind von Behandlungsdauer und Dosierung sowie von Alter, Geschlecht und Grunderkrankung des Patienten / der Patientin abhängig. Eine kurzfristige Anwendung von Glukokortikoiden, selbst in hoher Dosierung, verursacht kaum unerwünschte Wirkungen. Bei längerer Anwendung, insbesondere in höheren Dosen (d.h. wenn die Cushing-Schwellendosis von 1,5 mg Dexamethason pro Tag überschritten wird), können jedoch unerwünschte Wirkungen auftreten. Nachfolgend sind die unerwünschten Wirkungen, welche unter einer systemischen Steroidtherapie beschrieben wurden, nach Organsystem (MedDRA) aufgelistet. Aufgrund der Art der zugrunde liegenden Daten kann die Häufigkeit der einzelnen unerwünschten Wirkungen dabei nicht zuverlässig abgeschätzt werden.
Infektionen und parasitäre Erkrankungen:
erhöhte Anfälligkeit für Infektionen.
Erkrankungen des Blutes und des Lymphsystems:
Leukozytose.
Erkrankungen des Immunsystems:
vermindertes Ansprechen auf Impfungen und Hauttests, Überempfindlichkeitsreaktionen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Endokrine Erkrankungen:
Cushing-Syndrom (z.B. Stammfettsucht, Vollmondgesicht), Funktionsausfall der Hypothalamus-Hypophysen-NNR-Achse bis zur NNR-Atrophie (welche über ein Jahr und länger anhalten kann und für den Patienten / die Patientin ein lebensbedrohliches Risiko in Stress- und Belastungssituationen bedeutet), Auslösung einer Phäochromozytom-Krise bei Patienten mit vorbestehendem (auch latentem) Phäochromozytom.
Stoffwechsel- und Ernährungsstörungen:
negative Stickstoff- und Kalziumbilanz, reduzierte Glucosetoleranz (insbesondere bei Diabetes mellitus), Natrium- und Wasserretention, Gewichtszunahme, Kalium- und Phosphatverlust, hypokaliämische Alkalose, gesteigerter Appetit.
Psychiatrische Erkrankungen:
Nervosität, Reizbarkeit, Unruhe, Schlafstörungen, affektive Störungen (sowohl depressive als auch euphorische Stimmung), Stimmungsschwankungen, Affektlabilität, Ängstlichkeit, Verwirrtheitszustände, Halluzinationen, Suizidgedanken, Verwirrtheit.
Erkrankungen des Nervensystems:
Konvulsionen.
Augenerkrankungen:
erhöhter intraokulärer Druck, subkapsuläre Katarakt, Chorioretinopathie.
Gefässerkrankungen:
Hypertonie, thromboembolische Ereignisse.
Erkrankungen des Gastrointestinaltrakts:
peptische Ulzera mit der Möglichkeit einer Hämorrhagie oder Perforation, Pankreatitis, Ösophagitis, Übelkeit, Erbrechen.
Erkrankungen der Haut und des Unterhautgewebes:
Hirsutismus, verzögerte Wundheilung, Erytheme, Striae, Petechien, Ekchymosen, Akne, Pigmentierungsstörungen, Hautatrophie, Hyperhidrosis.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen:
Osteoporose, aseptische Knochennekrose, Muskelschwäche, Muskelatrophie, Myopathie, Sehnenrisse (insbesondere Achillessehne), vertebrale Frakturen, pathologische Frakturen.
Erkrankungen der Geschlechtsorgane und der Brustdruese:
Menstruationsstörungen, Potenzstörungen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Ödeme, erythematöse Reaktionen an der Injektionsstelle, schmerzlose Gelenkdestruktion (ähnlich einer Charcot-Arthropathie) vor allem bei wiederholten intraartikulären Injektionen.
Bei lokaler Infiltration (Epicondylitisbehandlung) sind Atrophien des subkutanen Fettgewebes möglich.
Sicherheit in der pädiatrischen Population
Das Sicherheitsprofil der Kortikosteroide bei Kindern und Jugendlichen entspricht im Wesentlichen jenem bei Erwachsenen. Darüber hinaus wurde bei Kindern und Jugendlichen über folgende unerwünschte Wirkungen berichtet:
Erkrankungen des Nervensystems:
Pseudotumor cerebri (benigne intrakranielle Hypertonie) mit Erbrechen und Stauungspapille.
Herzerkrankungen:
hypertrophe Kardiomyopathie bei Frühgeborenen.
Erkrankungen des Muskelskelettsystems:
vorzeitiger Epiphysenschluss (siehe «Warnhinweise und Vorsichtsmassnahmen»), Wachstumsstörungen.
Bis auf Osteoporose, aseptische Knochennekrose und Wachstumsstörungen im Kindesalter sind (abhängig von Dosis und Therapiedauer) die unerwünschten Wirkungen nach Absetzen von Dexamethason meist reversibel.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungIntoxikationen durch akute Überdosierung mit Kortikosteroiden sind ungewöhnlich, und die Wahrscheinlichkeit, dass es zu schwerwiegenden Effekten kommt, ist gering. Es gibt kein spezifisches Antidot, die Behandlung ist symptomatisch.
Bei einer chronischen Überdosierung ist mit einer Zunahme der unerwünschten Wirkungen und der unter «Warnhinweise und Vorsichtsmassnahmen» beschriebenen Risiken zu rechnen.
Eigenschaften/WirkungenATC-Code
H02AB02
Dexamethason Zentiva Ampullen enthalten das gut lösliche und mit Lokalanästhetika mischbare Dexamethason-21-phosphat-Natrium. Dexamethason Zentiva Ampullen sind für alle Arten der parenteralen Verabreichung geeignet. Dexamethason ist ein synthetisches Glukokortikoid mit einer etwa 7mal stärkeren entzündungshemmenden Wirkung als Prednisolon und einer etwa 30mal stärkeren Wirkung als das natürliche Nebennierenrindenhormon Kortison. Es zeichnet sich insbesondere durch seine geringe Mineralokortikoidwirkung und seine geringe wasser- und salzretinierende Wirkung aus und ist deshalb besonders für die Anwendung bei Patienten bzw. Patientinnen mit Herzinsuffizienz oder Hypertonie geeignet. Da sich Dexamethason des weiteren durch eine lange biologische Halbwertszeit auszeichnet (36–54 Stunden), ist es speziell für jene Indikationen geeignet, bei denen eine kontinuierliche Glukokortikoidwirkung erwünscht ist. Therapeutisch von Bedeutung ist vor allem die starke antiphlogistische und immunsuppressive (anti-allergische) Wirkung.
Die relative Äquivalenzdosis von Dexamethason im Vergleich zu anderen Glukokortikoiden beträgt: 1 mg Dexamethason = 6 mg Triamcinolon bzw. Methylprednisolon = 7,5 mg Prednison bzw. Prednisolon = 30 mg Hydrocortison = 35 mg Cortison.
Wirkungsmechanismus
s.o.
Pharmakodynamik
s.o.
Klinische Wirksamkeit
s.o.
Zur Behandlung von COVID-19
Die RECOVERY-Studie (Randomised Evaluation of COVid-19 thERapY,)1 ist eine forschungs-initiierte, individuell randomisierte, kontrollierte, offene, adaptive Plattform-Studie zur Bewertung der Wirkung möglicher Behandlungen von Patienten, die wegen COVID-19 im Krankenhaus behandelt werden. Die Studie wurde in 176 Krankenhäusern im Vereinigten Königreich durchgeführt.
6425 Patienten erhielten randomisiert entweder Dexamethason (n=2104) oder die übliche Standardtherapie (n=4321). Bei 89% der Patienten war eine SARS-CoV-2-Infektion im Labor bestätigt worden.
Bei Randomisierung erhielten 16% der Patienten bereits eine invasive mechanische Beatmung oder extrakorporale Membranoxygenierung, 60% erhielten nur Sauerstoff (mit oder ohne nicht-invasive Beatmung) und 24% erhielten keine respiratorische Unterstützung.
Die Patienten waren im Mittel 66,1+/-15,7 Jahre alt. 36% der Patienten waren weiblich. 24% der Patienten wiesen in der Anamnese einen Diabetes auf, 27% hatten Herz-Kreislauferkrankungen und 21% eine chronische Lungenerkrankung.
Als Primärendpunkt war die Mortalität nach 28 Tagen definiert.
Primärer Endpunkt
Die 28-Tage-Mortalitätsrate war mit 22.9% versus 25.7% in der Dexamethason-Gruppe signifikant niedriger als in der Standardtherapie-Gruppe (Ratenverhältnis [rate ratio, RR]: 0,83; 95%-Konfidenzintervall [KI]: 0,75-0,93; P<0,001).
In der Dexamethason-Gruppe war die Mortalität bei den Patienten, die eine invasive mechanische Beatmung erhielten (29,3% vs. 41,4%; RR: 0,64; 95%-KI: 0,51-0,81) sowie bei den Patienten, die nur zusätzlichen Sauerstoff ohne invasive mechanische Beatmung erhielten (23,3% vs. 26,2%; RR: 0,82; 95%-KI: 0,72-0,94), jeweils niedriger als in der Standardtherapiegruppe.
Bei Patienten, die bei der Randomisierung keine respiratorische Unterstützung erhielten, gab es keinen eindeutigen Effekt von Dexamethason (17,8% vs. 14,0%; RR: 1,19; 95%-KI: 0,91-1,55).
Sekundäre Endpunkte
Die Patienten in der Dexamethasongruppe hatten einen kürzeren Aufenthalt im Krankenhaus als jene in der Standardtherapiegruppe (median 12 Tage vs. 13 Tage) und eine höhere Wahrscheinlichkeit, innerhalb von 28 Tagen aus dem Krankenhaus entlassen zu werden (RR: 1,10; 95%-KI: 1,03-1,17).
In Übereinstimmung mit dem primären Endpunkt zeigte sich der grösste Effekt hinsichtlich der Krankenhausentlassung innerhalb von 28 Tagen bei Patienten, die eine invasive mechanische Beatmung nach Randomisierung erhielten (RR: 1,48; 95%-KI: 1,16-1,90), gefolgt von der Gruppe, die nur Sauerstoff erhielt (RR: 1,15;95%-KI: 1,06-1,24). Bei Patienten, die keinen Sauerstoff erhielten, zeigte sich kein positiver Effekt (RR: 0,96; 95%-KI: 0,85-1,08).
1) www.recoverytrial.net
Tabelle 1:
|
Ergebnis
|
Dexamethason
(N=2104)
|
Standard-therapie
(N=4321)
|
Raten-/Risiko-Verhältnis (RR)
(95% CI)2
| |
Anzahl/Gesamtzahl der Patienten (%)
| |
Primärergebnis
| |
28-Tages-Mortalität
|
482/2104 (22.9)
|
1110/4321 (25.7)
|
0.83 (0.75-0.93)
| |
Sekundärergebnisse
| |
Entlassung aus dem Krankenhaus innerhalb von 28 Tagen
|
143/2104 (67.2)
|
2745/4321 (63.5)
|
1.10 (1.03-1.17)
| |
Invasive mechanische Beatmung oder Tod3
|
456/1780 (25.6)
|
994/3638 (27.3)
|
0.92 (0.84-1.01)
| |
Invasive mechanische Beatmung
|
102/1780 (5.7)
|
285/3638 (7.8)
|
0.77 (0.62-0.95)
| |
Tod
|
387/1780 (21.7)
|
827/3638 (22.7)
|
0.93 (0.84-1.03)
|
2) RR wurden altersadjustiert im Hinblick auf die Ergebnisse der 28-Tages-Mortalität und der Krankenhausentlassung. RR wurden altersadjustiert im Hinblick auf das Ergebnis des Erhalts einer invasiven mechanischen Beatmung oder des Todes und ihrer Unterkomponenten.
3) Patienten, die bei Randomisierung bereits eine invasive mechanische Beatmung erhielten, wurden aus dieser Kategorie ausgeschlossen.
Sicherheit
Es gab vier schwerwiegende unerwünschte Ereignisse (SAEs) im Zusammenhang mit der Studienbehandlung: zwei SAEs einer Hyperglykämie, ein SAE einer steroidinduzierten Psychose und ein SAE einer oberen gastrointestinalen Blutung. Alle Ereignisse klangen ab.
Subgruppenanalysen
Tabelle 2
Auswirkungen der Zuordnung zur DEXAMETHASON-Gruppe auf die 28−Tage-Mortalität, nach Alter und der randomisiert erhaltenen respiratorischen Unterstützung4
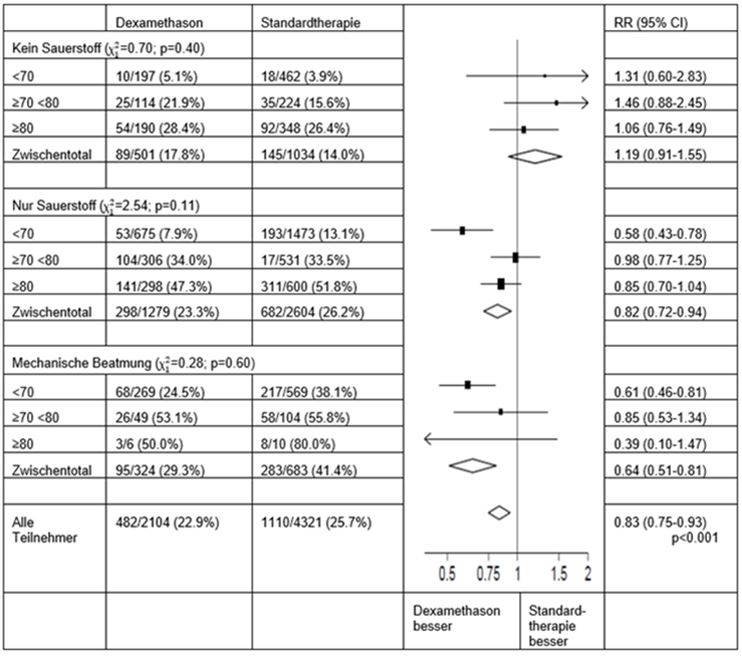
4) (Quelle: Horby P. et al., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1; doi: https://doi.org/10.1101/2020.06.22.20137273)
Tabelle 3
Auswirkungen der Zuordnung zur DEXAMETHASON-Gruppe auf die 28−Tage-Mortalität, nach der randomisiert erhaltenen respiratorischen Unterstützung und Vorgeschichte einer chronischen Erkrankung5
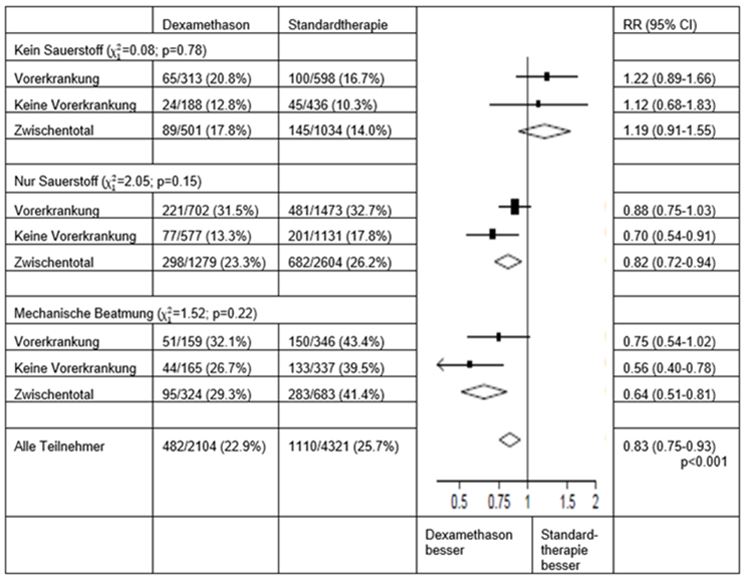
5) (Quelle: Horby P. et al., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1; doi: https://doi.org/10.1101/2020.06.22.20137273)
PharmakokinetikAbsorption
Dexamethason-Phosphat wird nach intramuskulärer Injektion rasch resorbiert und fast vollständig zu Dexamethason hydrolysiert.
Nach i.v.-Injektion werden maximale Plasmakonzentrationen innerhalb weniger Minuten erreicht. Die maximale pharmakologische Wirkung tritt jedoch verzögert (etwa 2 Stunden nach der Injektion) ein und hält länger an, als es der Plasmahalbwertszeit entspricht.
Distribution
Das totale Verteilungsvolumen von Dexamethason beträgt etwa 0,58 l/kg. Der Wirkstoff wird in Abhängigkeit von der Dosis bis zu 77% an Plasmaproteine, speziell an die Albuminfraktion gebunden. Im Liquor werden 4 Stunden nach intravenöser Applikation maximale Dexamethasonkonzentrationen erreicht (etwa 15–20% der Plasmakonzentration). Der Abfall der Dexamethasonkonzentration im Liquor erfolgt sehr langsam; etwa 2⁄3 der maximalen Konzentration sind noch nach 24 Stunden zu finden.
Dexamethason passiert die Plazenta, wobei es teilweise zu einem pharmakologisch inaktiven Ketosteroid-Derivat metabolisiert wird. Es tritt auch in die Muttermilch über.
Metabolismus
Dexamethason wird unter Beteiligung von CYP3A4 zu hydroxylierten und Ketosteroid-Derivaten metabolisiert, wobei der Hauptmetabolit Hydroxy-6-Dexamethason ist. Andere Cytochrom-P450-Isoenzyme können ebenfalls eine Rolle spielen. Ein Teil der Metaboliten wird anschliessend in der Leber zu Glucuroniden und Sulfaten konjugiert.
Elimination
Dexamethason und seine Metaboliten werden, hauptsächlich in konjugierter Form, überwiegend durch die Nieren ausgeschieden. 60% einer Dosis erscheinen innerhalb von 24 Stunden in glukuronisierter Form und weniger als 10% als freies Dexamethason im Urin. Die totale Plasmaclearance beträgt 2–5 ml/min/kg. Die Eliminations-Halbwertszeit liegt zwischen 3 und 4,5 Stunden.
Kinetik spezieller Patientengruppen
Bei schweren Lebererkrankungen (z.B. Hepatitis, Leberzirrhose) und Hypothyreose ist die Eliminationshalbwertszeit von Dexamethason verlängert.
Bei Neugeborenen ist die Plasmaclearance geringer als bei Kindern und Erwachsenen.
Präklinische DatenLangzeituntersuchungen am Tier auf ein tumorerzeugendes Potential liegen nicht vor.
Dexamethason ist unzureichend auf mutagene Wirkungen untersucht.
Reproduktionstoxizität
Dexamethason ruft im Tierexperiment bei Mäusen, Ratten, Hamstern, Kaninchen und Hunden Gaumenspalten und in geringem Umfang andere Fehlbildungen hervor.
Sonstige HinweiseInkompatibilitäten
Keine. Der Inhalt ist mit Lokalanästhetika mischbar.
Beeinflussung diagnostischer Methoden
Erhöhte Serum-Digoxin-Werte beim Immunoassay.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15–25 °C), vor Licht und Feuchtigkeit geschützt und ausser Reichweite von Kindern aufbewahren. Einmal geöffnete Ampullen aus Sterilitätsgründen nicht wiederverwenden.
Zulassungsnummer41074 (Swissmedic).
PackungenDexamethason Zentiva Inj Lös 5 mg Amp 1 ml. (B)
Dexamethason Zentiva Inj Lös 5 mg Amp 3× 1 ml. (B)
Dexamethason Zentiva Inj Lös 5 mg Amp 25 × 1 ml (Klinikpackung). (B)
ZulassungsinhaberinHelvepharm AG, Frauenfeld.
Stand der InformationAugust 2024.
|


