ZusammensetzungWirkstoffe
FEIBA (Factor Eight Inhibitor Bypassing Activity).
Hilfsstoffe
Natrii citras, Natrii chloridum, Natrii hydroxidum (zur pH Einstellung).
Gesamtnatriumgehalt ca. 4,09 mg/ml.
Lösungsmittel: Aqua ad iniectabile.
Indikationen/AnwendungsmöglichkeitenTherapie und Prophylaxe von Blutungen bei Hämophilie A-Patienten mit Faktor VIII-Inhibitor,
Therapie und Prophylaxe von Blutungen bei Hämophilie B-Patienten mit Faktor IX-Inhibitor;
Bei schweren Blutungen kann Feiba NF auch zur Behandlung von nichthämophilen Patienten mit erworbenen Inhibitoren gegen die Faktoren VIII, IX oder XI eingesetzt werden.
Dosierung/AnwendungEmpfehlung zur Behandlung von Inhibitorpatienten: Die Behandlung mit Feiba NF sollte grundsätzlich nur in Zusammenarbeit mit einem Behandlungszentrum für Hämophilie durchgeführt werden.
Die Dosierung und die Therapiedauer richten sich nach dem Schweregrad der Gerinnungsstörung, Ort und Ausmass der Blutung sowie nach dem klinischen Zustand des Patienten. Die Dosierung und Frequenz der Verabreichung sollte sich immer nach der klinischen Wirksamkeit im Einzelfall ausrichten.
Als allgemeine Richtlinie wird eine Dosis von 50 – 100 E/kg Körpergewicht (KG) empfohlen. Eine Einzeldosis von 100 E/kg KG und eine Tagesdosis von 200 E/kg KG sollte jedoch nicht überschritten werden, es sei denn, die Anwendung von höheren Dosen ist durch die Schwere der Blutung erforderlich und gerechtfertigt (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Spontane Blutungen
Gelenk-, Muskel- und Weichteilblutungen:
Bei leichten bis mittelschweren Blutungen sollte eine Dosis von 50 – 75 E/kg KG alle 12 Stunden verabreicht werden. Die Behandlung sollte bis zum Eintreten einer eindeutigen Besserung der klinischen Symptome, wie Nachlassen der Schmerzen, Abnahme der Schwellung oder Mobilisierung des Gelenkes, fortgesetzt werden.
Bei schweren Muskel- und Weichteilblutungen, wie retroperitonealen Blutungen, wird eine Dosis von 100 E/kg KG alle 12 Stunden empfohlen.
Schleimhautblutungen
Es wird eine Dosis von 50 E/kg KG alle 6 Stunden unter sorgfältiger Überwachung des Patienten (Sichtkontrolle der Blutungsstelle, wiederholte Hämatokritbestimmung) empfohlen. Falls die Blutung nicht aufhört, kann die Dosis auf 100 E/kg KG erhöht werden. (Die Tageshöchstdosis von 200 E/kg KG darf nicht überschritten werden.)
Andere schwere Blutungen
Schwere Blutungen, wie ZNS-Blutungen, wurden erfolgreich mit Dosen von 100 E/kg KG alle 12 Stunden behandelt. In Einzelfällen kann eine Verkürzung der Verabreichungsintervalle auf 6 Stunden erforderlich sein, bis eine eindeutige klinische Besserung erreicht wird. Die Tageshöchstdosis von 200 E/kg KG darf dabei nicht überschritten werden.
Chirurgische Eingriffe
Bei chirurgischen Eingriffen wird – unter Berücksichtigung der Tageshöchstdosis – eine Dosis von 50 – 100 E/kg KG in bis zu 6-stündigen Abständen empfohlen.
Prophylaxe
·Prophylaxe von Blutungen bei Patienten mit hohen Inhibitortitern und häufigen Blutungen, bei welchen die Immuntoleranztherapie (ITT) gescheitert ist oder nicht in Betracht gezogen wird:Es wird eine Dosis von 70 – 100 E/kg KG alle 2 Tage empfohlen. Diese Dosis kann bis auf 100 E/kg KG täglich erhöht werden, wenn die Blutungen des Patienten anhalten, oder kann schrittweise vermindert werden.
·Prophylaxe von Blutungen bei Patienten mit hohen Inhibitortitern während der Immuntoleranztherapie (ITT)Feiba NF kann gleichzeitig mit Faktor VIII Konzentraten bei Dosierungen von 50 – 100 E/kg KG zweimal täglich verabreicht werden, bis der Faktor-VIII-Inhibitor auf < 2 B.E.** reduziert wurde.**1 Bethesda-Einheit (B.E.) ist definiert als die Menge an Antikörpern, die 50 % der FVIII-Aktivität von frischem durchschnittlichem Humanplasma nach einer zweistündigen Inkubation bei 37 °C hemmt.
Anwendung
Das Auflösen erfolgt wie im Abschnitt Auflösung des Lyophilisates beschrieben (siehe «Hinweise für die Handhabung»). Feiba NF muss langsam intravenös verabreicht werden. Die Verabreichungsgeschwindigkeit sollte nicht mehr als 2 E/kg KG/min betragen. Bei einem Patienten mit 75 kg Körpergewicht entspricht dies einer maximalen Infusionsrate von 3 ml/min.
Spezielle Dosierungsanweisungen
Zur Anwendung bei Jugendlichen und Kindern liegen keine systematischen Untersuchungen vor, wohl aber zahlreiche Fallstudien. Es sei darauf hingewiesen, dass Patienten mit schwerer Hämophilie und high-responder Status typischerweise bereits ab dem Kindesalter mit aktivierten Faktorkonzentraten behandelt werden.
Wegen des komplexen Wirkmechanismus ist eine unmittelbare Überwachung der Wirkstoffe nicht möglich. Gerinnungstests wie die Vollblutgerinnungszeit (WBCT), das Thromboelastogramm (TEG, r-Wert) und die aktivierte partielle Thromboplastinzeit (aPTT) zeigen meist nur eine geringe Verkürzung und korrelieren häufig nicht mit der klinischen Wirksamkeit. Sie können daher nur in beschränktem Umfang zur Überwachung der Feiba NF-Therapie verwendet werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
KontraindikationenIn folgenden Situationen darf Feiba NF nicht angewendet werden, falls therapeutische Alternativen zu FEIBA vorhanden sind:
·Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
·Disseminierte intravaskuläre Gerinnung (DIC).
·Myokardinfarkt, akute Thrombose und/oder Embolie.
Warnhinweise und VorsichtsmassnahmenWarnhinweise
Thromboembolische Ereignisse
Thromboembolische Ereignisse, einschliesslich DIC, Venenthrombose, Lungenembolie, Myokardinfarkt und Schlaganfall, sind im Verlauf der Behandlung mit FEIBA aufgetreten.
Einige dieser Ereignisse traten bei Dosen über 200 E/kg pro Tag oder bei Patienten mit anderen Risikofaktoren (einschliesslich DIC, fortgeschrittene atherosklerotische Erkrankung, Quetschung, Septikaemie) für thromboembolische Ereignisse auf. Gleichzeitige Behandlung mit rekombinantem Faktor VIIa kann das Risiko zur Entwicklung von thromboembolischen Ereignissen erhöhen. Bei Patienten mit angeborener oder erworbener Hämophilie sollte stets in Betracht gezogen werden, dass möglicherweise solche Risikofaktoren bestehen.
In klinischen Studien traten keine Fälle thrombotischer Mikroangiopathie (TMA) mit FEIBA auf. In einer klinischen Studie mit Emicizumab, in welcher die Patienten FEIBA als Teil der Behandlung von Zwischenblutungen erhielten, wurden Fälle von TMA beobachtet (Arzneimittel-Fachinformation Emicizumab). Die Sicherheit und Wirksamkeit von FEIBA zur Behandlung von Zwischenblutungen in Patienten, welche Emicizumab erhalten, wurde nicht untersucht. Falls FEIBA in Patienten, die eine Prophylaxe mit Emicizumab erhalten, verabreicht werden muss, sind Nutzen und Risiko abzuwägen.
Wenn die Verabreichung von FEIBA als notwendig angesehen wird, ist in Patienten, welche Emicizumab erhalten, eine engmaschige Überwachung durch den Arzt erforderlich.
Patienten, die mehr als 100 E/kg KG erhalten, müssen bezüglich der Entwicklung von DIC und/oder akuter koronarer Ischämie überwacht werden. Wenn zur Blutstillung eingesetzt, sollte das Präparat nur solang als absolut nötig verabreicht werden, um das therapeutische Ziel zu erreichen.
In den folgenden Situationen darf Feiba NF nur gegeben werden, wenn keine Reaktion auf eine Behandlung mit geeigneten Gerinnungsfaktor-Konzentraten zu erwarten ist, z.B. bei einem hohen Hemmkörper-Titer oder bei einer Blutung oder einem Blutungsrisiko mit Lebensgefahr (z.B. posttraumatisch oder postoperativ):
·DIC: Laborbefunde und/oder klinische Symptome.
·Leberschädigung: Wegen der verzögerten Clearance der aktivierten Gerinnungsfaktoren besteht für Patienten mit Leberfunktionsstörungen ein erhöhtes Risiko einer DIC.
·Koronare Herzkrankheit.
Allergische Überempfindlichkeitsreaktionen
Wie bei allen intravenös verabreichten Plasmapräparaten können allergische Überempfindlichkeitsreaktionen auftreten. Die Patienten sollten über erste Anzeichen einer Überempfindlichkeitsreaktion wie Quaddeln, generalisierte Urtikaria, Engegefühl in der Brust, Giemen, Blutdruckabfall und anaphylaktischer Schock aufgeklärt werden. Wenn diese Symptome auftreten, sollen die Patienten aufgefordert werden, die Behandlung abzubrechen und unverzüglich ihren Arzt zu kontaktieren.
Leichtere Reaktionen können mit Antihistaminika beherrscht werden. Bei Schock muss die Behandlung den Regeln der modernen Schocktherapie folgen.
Wenn bei Patienten mit Verdacht auf Überempfindlichkeit gegen das Produkt eine Re-Exposition gegenüber Feiba NF in Betracht gezogen wird, ist eine sorgfältige Abwägung des erwarteten Nutzens einer Re-Exposition gegenüber den Risiken erforderlich. In diese Überlegungen muss die Art der bekannten oder vermuteten Überempfindlichkeit des Patienten (allergisch oder nicht-allergisch) ebenso einfliessen wie die potenziellen Massnahmen zur Behandlung und/oder Prävention sowie alternative Therapeutika.
Überwachung der Therapie
Einzeldosen von 100 E/kg KG und Tagesdosen von 200 E/kg KG sollten nicht überschritten werden. Patienten, denen Einzeldosen von 100 E/kg KG verabreicht werden, sollten hinsichtlich der Entwicklung einer Verbrauchskoagulopathie sowie auf Symptome einer akuten koronaren Ischämie überwacht werden. Hohe Dosen von Feiba NF sollten nur so lange verabreicht werden, wie dies zur Blutstillung unbedingt erforderlich ist.
Bei Auftreten von klinischen Anzeichen, wie Blutdruck- und Pulsschwankungen, Atemnot, Schmerzen im Thoraxbereich oder Husten, sollte die Verabreichung von Feiba NF sofort gestoppt sowie entsprechende diagnostische und therapeutische Massnahmen eingeleitet werden.
Auf eine Verbrauchskoagulopathie hinweisende Laborparameter sind erniedrigte Fibrinogenwerte, Thrombozytenabfall und/oder der Nachweis von Fibrin/Fibrinogen-Spaltprodukten. Andere Anzeichen einer Verbrauchskoagulopathie schliessen deutlich verlängerte Thrombinzeit, Prothrombinzeit oder aktivierte partielle Thromboplastinzeit (aPTT) ein.
Erworbene Hämophilie
Nicht-hämophile Patienten mit erworbenen Inhibitoren gegen die Faktoren VIII, IX oder XI, können gleichzeitig eine Blutungstendenz und ein erhöhtes Thromboserisiko aufweisen.
Labortests und klinische Wirksamkeit
In vitro-Gerinnungstests zur Kontrolle der Wirksamkeit wie die aktivierte partielle Thromboplastinzeit (aPTT), die Vollblutgerinnungszeit (WBCT) und das Thromboelastogramm (TEG) müssen nicht mit der klinischen Besserung korrelieren. Versuche, diese Werte durch Erhöhen der Feiba NF-Dosis zu normalisieren, können daher nicht erfolgreich sein und es wird dringend davon abgeraten, aufgrund des potentiellen Risikos durch Überdosierung eine DIC zu induzieren.
Im Falle einer inadäquaten Wirkung einer Behandlung mit Feiba NF wird eine Thrombozytenzählung empfohlen, da eine ausreichende Zahl von funktionell intakten Thrombozyten für die Wirksamkeit von Feiba NF als nötig erachtet wird.
Virale Sicherheit
Feiba NF wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen, die sich durch den Einsatz von Arzneimitteln ergeben, die aus Blut oder Blutplasma hergestellt werden, schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie den Einsatz effektiver Schritte zur Inaktivierung/Entfernung von Viren im Herstellungsverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu aufgetretene Viren und andere Pathogene.
Die ergriffenen Sicherheitsmassnahmen werden als wirksam gegen umhüllte Viren wie z.B. HIV, HBV und HCV sowie gegen das unbehüllte Hepatitis A Virus (HAV) betrachtet. Für nicht umhüllte Viren wie Parvovirus B19 können die getroffenen Massnahmen von eingeschränktem Wert sein.
Parvovirus B19 Infektionen können schwerwiegende Folgen für schwangere Frauen (fötale Infektion) und für Personen mit Immunmangelkrankheiten oder gesteigerter Erythropoese (z.B. hämolytische Anämie) haben.
Für Patienten, die regelmässig Präparate aus menschlichem Blut oder Plasma erhalten, wird grundsätzlich eine Impfung gegen Hepatitis A und Hepatitis B empfohlen.
Es wird empfohlen, bei jeder Verabreichung von Feiba NF an einen Patienten den Namen und die Chargennummer des Präparates zu dokumentieren, um einen Zusammenhang zwischen Patient und Produktcharge herzustellen.
Vorsichtsmassnahmen
Wegen patientenspezifischer Faktoren können die Reaktionen auf ein Bypassing-Präparat unterschiedlich ausfallen. Patienten, die in einer Blutungssituation keine ausreichende Reaktion auf ein bestimmtes Präparat zeigen, können eventuell auf ein anderes Präparat ansprechen. Spricht ein Patient nicht ausreichend auf ein Bypassing-Präparat an, sollte ein anderes Präparat in Betracht gezogen werden.
Die Gabe von Feiba NF an Hemmkörper-Patienten kann zu einem vorübergehenden anamnestischen Anstieg des Hemmkörper-Titers führen. Im Verlauf der fortgesetzten Feiba NF-Gabe kann der Hemmkörper-Titer wieder sinken. Die klinischen und publizierten Daten lassen darauf schliessen, dass die Wirksamkeit von Feiba NF dadurch nicht beeinträchtigt wird.
Beeinflussung von Labortests
Feiba NF enthält Blutgruppen Isohämagglutinine (Anti-A und Anti-B). Passiv übertragene Antikörper gegen Erythrozytenantigene (z.B. A, B, D) können einige serologische Tests für Erythrozytenantikörper, wie zum Beispiel den Antihumanglobulin Test (Coombs Test), stören.
Natrium
1000 E Durchstechflasche:
Feiba NF 1000 E enthält ca. 81.7 mg Natrium (berechnet) per Durchstechflasche.
Dies entspricht 4.1 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
2500 E Durchstechflasche:
Feiba NF 2500 E enthält ca. 204.3 mg Natrium (berechnet) per Durchstechflasche.
Dies entspricht 10.2 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
Dies muss bei Patienten mit einer niedrigen Natriumdiät berücksichtigt werden.
InteraktionenEs wurden keine hinreichenden und gut-kontrollierten Studien mit kombinierter oder sequenzieller Anwendung von FEIBA und rekombinantem Faktor VIIa (rFVIIa), Antifibrinolitika oder Emicizumab durchgeführt.
Antifibrinolytika wie Tranexamsäure oder ε-Aminocapronsäure sollten nicht gleichzeitig mit Feiba NF angewendet werden.
Ist eine Behandlung mit Antifibrinolytika und Feiba NF dennoch indiziert, sollten zwischen der Verabreichung beider Präparate mindesten 6 Stunden liegen.
Im Fall einer gleichzeitigen Verabreichung von rFVIIa kann gemäss verfügbaren in vitro Daten und klinischen Beobachtungen eine poteintielle medikamentöse Interaktion auftreten (potentiell resultierend in einer Nebenwirkung wie einem thromboembolischen Ereignis).
Erfahrungen aus einer klinischen Studie mit Emicizumab weisen auf eine potenzielle Arzneimittelinteraktion mit Emicizumab hin, wenn FEIBA als Teil der Behandlung von Zwischenblutungen eingesetzt worden ist (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft, StillzeitEs liegen keine klinischen Daten zur Sicherheit von Feiba NF bei Schwangeren und während der Stillzeit vor. Tierexperimentelle Studien sind nicht geeignet, um die Sicherheit in Bezug auf Schwangerschaft, Embryonalentwicklung, Entwicklung des Föten und/oder die postnatale Entwicklung abzuklären. Daher wurden keine Reproduktionsstudien am Tier mit FEIBA durchgeführt.
Das potentielle Risiko für Menschen ist nicht bekannt.
Während der Schwangerschaft und der postpartalen Phase besteht ein erhöhtes Thromboserisiko, und einige Komplikationen der Schwangerschaft sind mit einem erhöhten DIC-Risiko verbunden.
Der Arzt muss vor Verordnung von Feiba NF die möglichen Risiken und Vorteile für die jeweilige Patientin sorgfältig gegeneinander abwägen.
Bezüglich einer Parvovirus B19 Infektion, siehe unter «Warnhinweise und Vorsichtsmassnahmen».
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs gibt keinen Hinweis darauf, dass Feiba NF einen Einfluss auf die Verkehrstüchtigkeit oder die Fähigkeit, Maschinen zu bedienen, haben könnte.
Unerwünschte WirkungenFEIBA kann allergische Überempfindlichkeitsreaktionen hervorrufen, welche Urtikaria, Angiooedem, gastrointestinale Erscheinungen, Bronchspasmus und einen Abfall des Blutdruckes einschliessen. Diese Reaktionen können schwerwiegend und systemisch (z.B. Anaphylaxis mit Urtikaria und Angiooedem, Bronchospasmus, Kreislaufschock) sein. Über andere Reaktionen auf die Infusion, wie Schüttelfrost, Fieber und Hypertonie, wurde ebenfalls berichtet.
Die Nebenwirkungen, welche in dieser Rubrik aufgeführt sind, wurden im Rahmen der Spontanmeldungen nach der Zulassung (Pharmacovigilance) und von 2 klinischen Studien mit FEIBA zur Behandlung von Blutungen in mindestens 9 pädiatrischen und 55 erwachsenen Patienten mit Hämophilie A oder B und Faktor VIII- oder Faktor IX-Inhibitoren berichtet. Eine Studie schloss auch Patienten mit erworbener Hämophilie und Faktor VIII-Inhibitoren ein (2 von 49 Patienten). Die Nebenwirkungen einer dritten Studie, welche Prophylaxe mit einer «On-demand» Behandlung in 9 pädiatrischen und 27 erwachsenen Patienten verglich, wurden hier aufgenommen.
Ihre Häufigkeit wurde unter Verwendung folgender Kriterien bestimmt: sehr häufig (≥ 10 %), häufig (≥ 1 %, < 10 %), gelegentlich (≥ 0,1 %, < 1 %), selten (≥ 0,01 %, < 0,1 %) und sehr selten (< 0,01 %).
Erkrankungen des Blutes und des Lymphsystems
Häufig: Anstieg des Hemmkörper-Titers (anamnestische Reaktion)*
* Unter einem Anstieg des Hemmkörper-Titers (anamnestische Reaktion) [keine von MedDRA bevorzugte Bezeichnung] versteht man den Anstieg eines vorbestehenden Hemmkörper-Titers im Anschluss an die Gabe von FEIBA. Siehe «Warnhinweise und Vorsichtsmassnahmen».
Einzelfälle: DIC
Erkrankungen des Immunsystems
Häufig: Überempfindlichkeitsreaktionen
Einzelfälle: Urtikaria, anaphylaktische Reaktion
Erkrankungen des Nervensystems
Häufig: Kopfschmerz, Schwindelgefühl, Somnolenz, Geschmackstörung
Einzelfälle: Taubheitsgefühl in Gesicht und Extremitäten (Hypoästhesie), Parästhesie, thrombotischer Schlaganfall, embolischer Schlaganfall
Herzerkrankungen
Einzelfälle: Myokardinfarkt, Tachykardie
Gefässerkrankungen
Häufig: Hypotonie
Einzelfälle: Thrombose, Venenthrombose, Arterienthrombose, Hypertonie, Hitzegefühl
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Dyspnoe
Einzelfälle: Lungenembolie, Bronchospasmus, Giemen, Husten
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit
Einzelfälle: Erbrechen, Diarrhoe, abdominale Beschwerden
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Ausschlag
Einzelfälle: Gesichtshypaesthesie, Angiooedem, Urtikaria, Pruritus
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Schüttelfrost, Fieber, Brustkorbschmerz, Brustkorbbeschwerden
Einzelfälle: Schmerzen an der Injektionsstelle, Unwohlsein, Wärmegefühl
Untersuchungen
Häufig: Hepatitis-Oberflächen-Antikörper positiv
Einzelfälle: Blutdruck erniedrigt, Fibrin D-Dimer erhöht
Klasseneffekte
Häufigkeit nicht bekannt: Andere Symptome von Überempfindlichkeitsreaktionen auf plasmatische Präparate schliessen Lethargie und Unruhe ein.
Für Informationen zur Virussicherheit siehe «Warnhinweise und Vorsichtsmassnahmen».
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEinige der gemeldeten thromboembolischen Ereignisse traten bei Dosen über 200 E/kg auf. Bei Anzeichen oder Symptomen eines thromboembolischen Ereignisses müssen sofort die Infusion abgebrochen und entsprechende diagnostische und therapeutische Massnahmen eingeleitet werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Eigenschaften/WirkungenATC-Code
B02BD03
Wirkungsmechanismus
Obwohl Feiba NF in den frühen 1970er Jahren entwickelt und seine Faktor VIII-Inhibitor-Bypass-Aktivität in vitro und in vivo nachgewiesen wurde, sind seine Wirkkomponenten immer noch Thema wissenschaftlicher Debatten. Eine vor kurzem erschienene wissenschaftliche Arbeit zeigt jedoch, dass spezifische Komponenten des aktivierten Prothrombinkomplexes, das Zymogen Prothrombin (Faktor II) und der aktivierte Faktor X (Faktor Xa), im Wirkungsmechanismus von Feiba NF eine Rolle spielen.
Klinische Wirksamkeit
In einem Fall wurde Feiba NF erfolgreich bei einem Patienten mit einem Inhibitor eingesetzt, der an von Willebrand-Jürgens-Syndrom litt.
Feiba NF wurde auch in Kombination mit Faktor VIII-Konzentrat zur Langzeittherapie angewendet, mit dem Ziel eine komplette und permanente Elimination des Faktor VIII-Inhibitors zu erreichen, um eine reguläre Behandlung mit FVIII-Konzentrat zu ermöglichen, wie bei Patienten ohne Inhibitor.
PharmakokinetikDa die Wirkkomponenten immer noch diskutiert werden, ist eine definitive Aussage zu den pharmakokinetischen Eigenschaften von Feiba NF nicht möglich.
Präklinische DatenAufgrund akuter Toxizitätsstudien bei Faktor VIII knock-out Mäusen, normalen Mäusen und Ratten mit Dosen, die die Tageshöchstdosis für den Menschen überschreiten (d.h. > 200 E/kg KG), kann der Schluss gezogen werden, dass die unerwünschten Wirkungen in Zusammenhang mit Feiba NF primär die Folge einer Hyperkoagulation sind, die durch die pharmakologischen Eigenschaften des Präparates hervorgerufen wird.
Toxizitätsstudien bei Tieren mit mehrmaliger Verabreichung sind wegen der Interferenz mit sich entwickelnden Antikörpern gegen heterologes Protein nicht durchführbar.
Da es keinen Hinweis auf tumorigene und mutagene Wirkungen von humanen Plasmaproteinen gibt, wurden experimentelle Untersuchungen, insbesondere bei heterologen Spezies, nicht als notwendig angesehen.
Sonstige HinweiseInkompatibilitäten
Um die Wirksamkeit und Verträglichkeit dieses Präparates nicht zu beeinträchtigen, darf Feiba NF, wie alle anderen Faktorkonzentrate, vor der Verabreichung nicht mit anderen Arzneimitteln gemischt bzw. mit Infusionslösungen verdünnt werden. Gegebenenfalls empfiehlt es sich, einen gemeinsamen venösen Zugang vor und nach der Anwendung von Feiba NF mit physiologischer Kochsalzlösung zu spülen.
Gerinnungsfaktoren aus Humanplasma können von den inneren Oberflächen bestimmter Arten von Injektions-/Infusionssets adsorbiert werden. In diesem Fall könnte es zu einem Versagen der Therapie kommen. Aus diesem Grund dürfen für Feiba NF nur zugelassene Infusionssets aus Kunststoff verwendet werden.
Beeinflussung diagnostischer Methoden
Nach der Verabreichung hoher Dosen von Feiba NF kann ein vorübergehender Anstieg von passiv übertragbarer Hepatitis B Oberflächenantikörper zu einer irreführenden Interpretation von positiven Resultaten in serologischen Tests führen.
Haltbarkeit
Das Medikament darf nur bis zu dem auf dem Behälter mit «Exp.» bezeichneten Datum verwendet werden.
Für das rekonstituierte Feiba NF wurde eine chemische und physikalische Stabilität von 3 Stunden bei 20–25 °C nachgewiesen. Aus mikrobiologischen Gründen sollte das Präparat sofort nach der Rekonstitution verwendet werden.
Rekonstituierte Lösungen nicht im Kühlschrank lagern und nicht einfrieren.
Besondere Lagerungshinweise
Nicht über +25 °C lagern. Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Arzneimittel für Kinder unerreichbar aufbewahren.
Hinweise für die Handhabung
Feiba NF erst unmittelbar vor der Verabreichung auflösen. Danach ist die Lösung sofort zu verwenden (die Lösung enthält kein Konservierungsmittel). Lösungen, die trübe sind oder einen Niederschlag aufweisen, dürfen nicht verwendet werden.
Vorsichtig schwenken, bis das gesamte Pulver gelöst ist. Sicherstellen, dass Feiba NF vollständig gelöst ist, da sonst ein Teil des FEIBA-Wirkstoffs im Filter des Transfersystems zurückgehalten wird.
Die Lösung vor der Anwendung auf sichtbare Partikel und Verfärbung prüfen. Lösungen, die trüb sind oder Ablagerungen aufweisen, nicht verwenden.
Nicht verwenden, wenn das Transfersystem, die Transfernadel, deren steriles Barrieresystem oder deren Verpackung beschädigt ist. Nicht verwendete Lösung sowie Abfallmaterial sachgemäss entsorgen.
Der Gerätesatz kann entweder BAXJECT II Hi-Flow oder eine doppelseitige Kanüle und einen Filterdorn enthalten.
Für das Auflösen und Verabreichen mit BAXJECT II Hi-Flow siehe unter «Variante A».
Für das Auflösen und Verabreichen mit doppelseitiger Kanüle und Filterdorn siehe unten unter «Variante B».
Variante A (wenn das Produkt mit BAXJECT II Hi-Flow geliefert wird)
Auflösung des Lyophilisates:
1.Falls erforderlich, ungeöffnete Durchstechflasche mit Lösungsmittel (Wasser für Injektionszwecke) auf Raumtemperatur (15 °C – 25 °C) erwärmen, z.B. durch Benützung eines Wasserbades während einiger Minuten (max. 37 °C).
2.Schutzkappen von Lyophilisat- und Lösungsmittel-Durchstechflaschen entfernen und die Gummistopfen beider Flaschen desinfizieren. Beide Durchstechflaschen auf eine flache Unterlage stellen.
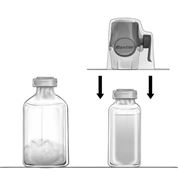
3.Die Verpackung des BAXJECTs II Hi-Flow öffnen, indem die Schutzfolie abgezogen wird, ohne dabei den Packungsinhalt zu berühren (Fig. a). Das Transfersystem nicht aus der Verpackung nehmen.
4.Die Packung nach unten drehen und den klaren Plastikdorn durch den Gummistopfen des Lösungsmittelfläschchens drücken (Fig. b). Nun die Verpackung vom BAXJECT II Hi-Flow durch Ergreifen der Verpackung an den Ecken abnehmen (Fig. c). Die blaue Schutzkappe nicht vom BAXJECT II Hi-Flow entfernen.
5.Das System, bestehend aus dem BAXJECT II Hi-Flow und dem Lösungsmittelfläschchen, nun wenden, so dass sich das Lösungsmittelfläschchen oben befindet. Den anderen, violetten Dorn des BAXJECTs II Hi-Flow durch den Gummistopfen des Feiba NF-Fläschchens drücken. Durch das Vakuum wird das Lösungsmittel in das Feiba NF-Fläschchen gezogen (Fig. d).
6.Vorsichtiges Schwenken (nicht schütteln) des ganzen Systems, bis Feiba NF gelöst ist. Vergewissern, dass Feiba NF vollständig gelöst ist, da sonst wirksame Substanz durch den Filter im BAXJECT II Hi-Flow zurückgehalten wird.
Verabreichung:
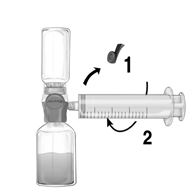
1.Die blaue Schutzkappe des BAXJECTs II Hi-Flow entfernen. Die Spritze fest an den BAXJECT II Hi-Flow anschliessen (KEINE LUFT IN DIE SPRITZE AUFZIEHEN) (Fig. e). Der Gebrauch einer Luer-Lock Spritze wird sehr empfohlen, um eine feste Verbindung zwischen der Spritze und dem BAXJECT II Hi-Flow zu gewährleisten (bei der Befestigung, Spritze im Uhrzeigersinn drehen bis zur Stopp Position).
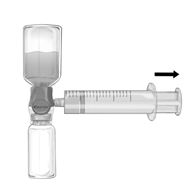
2.Das System umdrehen, so dass das aufgelöste Feiba NF-Fläschchen oben ist). Die Feiba NF-Lösung durch langsames Zurückziehen des Kolbens in die Spritze aufziehen und sicherstellen, dass die feste Verbindung zwischen dem Baxject II Hi-Flow und der Spritze während dem ganzen Prozess aufrechterhalten wird. (Fig. f).
3.Die Spritze entfernen.
4.Falls ein Schäumen des Produktes erfolgt, soll solange gewartet werden, bis der Schaum zusammengefallen ist. Mit einem Flügel-Injektionssystem die Lösung mit dem beigepackten Infusionsset (oder einer Einmalnadel) langsam intravenös injizieren
Eine Verabreichungsgeschwindigkeit von 2 E Feiba NF/kg KG/min darf nicht überschritten werden.
|
Figure a
|
Figure b
|
Figure c
| |
|

|
|
|
|

| |
Figure d
|
Figure e
|
Figure f
| |
|

|
|
|
|
|
Variante B (wenn das Produkt mit Filter-, Transfer- und Belüftungsnadel geliefert wird anstelle des BAXJECT II Hi-Flow)
Auflösen des Lyophilisates:
1.Falls erforderlich, ungeöffnete Durchstechflasche mit Lösungsmittel (Wasser für Injektionszwecke) auf Raumtemperatur (max. 37 °C) erwärmen.
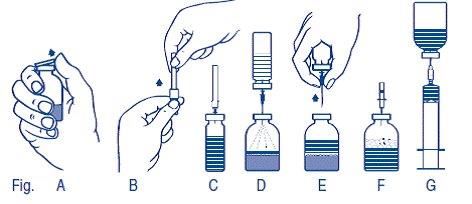
2.Schutzkappen von Lyophilisat- und Lösungsmittel-Durchstechflaschen entfernen (Abb. A) und die Gummistopfen beider Flaschen desinfizieren.
3.Schutzkappe von einem Ende der beigepackten Transfernadel durch Drehen und Ziehen entfernen und mit der Nadel in den Gummistopfen der Lösungsmittel-Durchstechflasche einstechen (Abb. B und C).
4.Schutzkappe vom anderen Ende der Transfernadel entfernen. Freies Nadelende nicht berühren!
5.Lösungsmittel-Durchstechflasche umdrehen und mit der aufgesetzten Transfernadel durch das Zentrum des Gummistopfens der Lyophilisat-Durchstechflasche einstechen (Abb. D). Durch das Vakuum in der Lyophilisat-Durchstechflasche wird das Lösungsmittel angesaugt.
6.Lösungsmittel-Durchstechflasche samt Transfernadel von der Lyophilisat-Durchstechflasche abziehen (Abb. E). Lösungsvorgang durch leichtes Schwenken der Lyophilisat-Durchstechflasche beschleunigen.
7.Nach vollständiger Auflösung des Lyophilisats die beigepackte Belüftungsnadel einstechen (Abb. F), wodurch eventuell entstandener Schaum zusammenfällt. Belüftungsnadel entfernen.
Verabreichung:
1.Ein Ende der Schutzkappe der beigepackten Filternadel durch Drehen und Ziehen entfernen, die Nadel auf die sterile Einmalspritze setzen und die Lösung in die Spritze aufziehen (Abb. G).
2.Spritze von der Filternadel trennen und die Lösung mit dem beigepackten Infusionsset bzw. Einmalnadel langsam intravenös injizieren.
Eine Verabreichungsgeschwindigkeit von 2 E Feiba NF/kg KG/min darf nicht überschritten werden.
Falls andere Geräte verwendet werden als solche, die mit Feiba NF mitgeliefert werden, soll eine Porengrösse von mindestens 149 μm gewährleistet werden.
Zulassungsnummer41352 (Swissmedic)
Packungen1 Packung Feiba NF enthält: 1 Durchstechflasche mit Pulver zur Herstellung einer Injektionslösung (i.v.), 1 Durchstechflasche mit Wasser für Injektionszwecke und 1 Gerätesatz zur Auflösung und Injektion
Feiba NF 1000 E
Pulver mit 1000 E FEIBA und 20 ml Wasser für Injektionszwecke
Feiba NF 2500 E
Pulver mit 2500 E FEIBA und 50 ml Wasser für Injektionszwecke
Abgabekategorie: B
ZulassungsinhaberinTakeda Pharma AG, 8152 Opfikon
Stand der InformationMai 2024
|







