ZusammensetzungWirkstoffe
Insulin Detemir 100 E/ml (gentechnisch hergestellt aus rekombinanter DNS in Saccharomyces cerevisiae).
Hilfsstoffe
Glycerol, Zinkacetat, Natriumchlorid, Natriumphosphat, Wasser für Injektionszwecke 1 ml. Conserv.: Phenol 1,80 mg/ml, Metacresol 2,06 mg/ml.
Indikationen/AnwendungsmöglichkeitenDiabetes mellitus bei Erwachsenen, Jugendlichen und Kindern ab 2 Jahren sofern eine Insulinbehandlung notwendig ist.
Dosierung/AnwendungLevemir ist ein lösliches, lang wirkendes Insulinanalogon zur Anwendung als Basalinsulin.
Levemir kann alleine als Basalinsulin oder in Kombination mit Bolus-Insulin verwendet werden. Levemir kann auch mit oralen Antidiabetika kombiniert werden. Bei Patienten mit unzureichender Blutzuckerkontrolle unter Victoza® (ein Glucagon-like Peptide-1 [GLP-1] Rezeptor-Agonist) und Metformin kann Levemir auch mit Victoza kombiniert werden.
In Kombination mit oralen Antidiabetika und mit GLP-1 Rezeptor-Agonisten wird empfohlen, Levemir einmal täglich anzuwenden. Die Anfangsdosis beträgt 10 Einheiten oder 0.1–0.2 E/kg. Die Injektion kann morgens oder abends erfolgen, soll aber jeden Tag um die gleiche Zeit stattfinden. Die Dosierung von Levemir muss entsprechend dem Bedarf des Patienten individuell angepasst werden.
In klinischen Studien erfolgte die Dosisanpassung teilweise nach folgendem Algorithmus:
|
Durchschnittliche Plasmaglukose vor dem Frühstück
|
Anpassung der Levemir Dosis
| |
>10,0 mmol/l (180 mg/dl)
|
+ 8 E
| |
9,1–10,0 mmol/l (163–180 mg/dl)
|
+ 6 E
| |
8,1–9,0 mmol/l (145–162 mg/dl)
|
+ 4 E
| |
7,1–8,0 mmol/l (127–144 mg/dl)
|
+ 2 E
| |
6,1–7,0 mmol/l (109–126 mg/dl)
|
+ 2 E
| |
Bei einem Einzelwert der Plasmaglukose von
|
| |
3,1–4,0 mmol/l (56–72 mg/dl)
|
– 2 E
| |
<3,1 mmol/l (<56 mg/dl)
|
– 4 E
|
Als Bestandteil einer Basis-Bolus-Therapie soll Levemir, je nach Bedarf des Patienten, ein- oder zweimal täglich verabreicht werden. Die Dosierung von Levemir muss individuell angepasst werden.
Bei Patienten, die zur Optimierung der Blutzuckereinstellung eine 2× tägliche Verabreichung benötigen, kann die Abenddosis abends oder vor dem Zubettgehen verabreicht werden.
Eine Anpassung der Dosierung kann bei verstärkter körperlicher Aktivität, Änderung der Ernährungsgewohnheiten oder während Begleiterkrankungen notwendig sein.
Umstellung von anderen Insulinpräparaten auf Levemir
Der Wechsel von intermediär oder lang wirkenden Insulinen auf Levemir kann eine Anpassung von Dosis und Zeitpunkt der Applikation erforderlich machen (siehe unter «Warnhinweise und Vorsichtsmassnahmen»).
Während des Übergangs und in den ersten Wochen danach wird, wie bei allen Insulinen, eine engmaschige Blutzuckerkontrolle empfohlen.
Eine begleitende antidiabetische Behandlung muss eventuell angepasst werden (Dosis und Zeitpunkt des zusätzlichen kurz wirkenden Insulins oder die Dosis oraler Antidiabetika).
Spezielle Dosierungsanweisungen
Bei älteren Patienten und bei Patienten mit Nieren- oder Leberfunktionsstörungen sowie bei Patienten mit Hypoalbuminämie soll, wie bei allen Insulinen, die Kontrolle des Blutzuckers intensiviert und die Dosierung von Levemir individuell angepasst werden.
Anwendung bei Kindern und Jugendlichen
Bei Kindern und Jugendlichen sollte die Therapie durch einen pädiatrischen Diabetologen betreut werden. Insbesondere im frühen Lebensalter steht neben einer Senkung der postprandialen Blutzuckerspitzen eine Reduktion des Risikos hypoglykämischer Episoden im Vordergrund der Behandlung. Je nach Alter sind verschiedene Insulinkombinationen empfohlen. Bei Kindern sollten die Glukosespiegel in kurzen Intervallen (4- bis 6-mal pro Tag) bestimmt werden.
Die Wirksamkeit und Sicherheit von Levemir wurde bei Kindern und Jugendlichen im Alter von 2 bis 17 Jahren in Studien von bis zu 1 Jahr geprüft (siehe unter «Eigenschaften/Wirkungen»).
Bei Kindern von 2 bis 5 Jahren bestehen begrenzte Erfahrungen.
Die Wirksamkeit und Sicherheit wurde bei Kindern unter 2 Jahren nicht untersucht.
Anwendungshinweise
Levemir darf nur subkutan verabreicht werden. Levemir darf nicht intravenös angewendet werden, da dies zu einer schweren Hypoglykämie führen kann. Eine intramuskuläre Injektion ist ebenfalls zu vermeiden. Levemir ist nicht zur Anwendung in Insulinpumpen geeignet.
Levemir wird subkutan in den Oberschenkel, in die Bauchdecke oder den Oberarm verabreicht. Die Einstichstelle sollte bei jeder Injektion innerhalb derselben Körperregion gewechselt werden, um das Risiko einer Lipodystrophie und einer kutanen Amyloidose zu vermindern. Die Wirkdauer von Levemir wird, wie bei allen Insulinen, durch den Injektionsort, die Durchblutung, die Temperatur und das Ausmass der sportlichen Betätigung beeinflusst.
Levemir Penfill und FlexPen ist eine Packungsbeilage mit detaillierten Anwendungshinweisen beigefügt, die unbedingt befolgt werden müssen.
Levemir Penfill ist für die Anwendung mit Injektionssystemen von Novo Nordisk und mit NovoFine®- oder NovoTwist® Injektionsnadeln vorgesehen. Die dem Injektionssystem beiliegende detaillierte Bedienungsanleitung muss befolgt werden.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenBeim insulinbehandelten Diabetiker besteht grundsätzlich das Risiko leichter oder schwerer Hypoglykämien. Dies kann die Aufmerksamkeit und insbesondere die Sicherheit beim Autofahren oder beim Bedienen von Maschinen beeinträchtigen. Dies gilt besonders zu Beginn der Behandlung, bei Präparatewechsel, unregelmässigen Injektionen oder unregelmässiger Nahrungsaufnahme sowie allgemein bei nicht optimaler Stoffwechseleinstellung, wo es zu starken Blutzuckerschwankungen, unter anderem auch zu Hypoglykämien, kommen kann. Es muss darauf aufmerksam gemacht werden, dass Alkoholeinnahme diese Gefährdung zusätzlich erhöht (Hemmung der hepatischen Glukoneogenese). Ebenso ist bei früher durchgemachten schweren Hypoglykämien das Risiko grösser, dass sich solche wiederholen. Um einer Hypoglykämie frühzeitig begegnen zu können, ist der Patient zu instruieren, immer Traubenzucker, Würfelzucker o.ä. mit sich zu führen. Er soll auch seinen Diabetikerausweis bei sich haben.
Bei Patienten mit deutlich gebesserter Stoffwechsellage (z.B. aufgrund einer intensivierten Insulintherapie) oder nach Umstellung von tierischem auf humanes Insulin, sowie auch sonst gelegentlich bei Präparatewechsel, können unter Umständen einige oder sämtliche Warnsymptome entfallen, mit denen sich eine Hypoglykämie ankündigt. Diese Patienten sind entsprechend vorzuwarnen (siehe auch unter «Unerwünschte Wirkungen»).
Bei schon lange von Diabetes betroffenen Patienten verschwinden möglicherweise die üblichen Warnsymptome. β-Blocker können die üblichen Hypoglykämie-Warnsymptome abschwächen bzw. maskieren. Marihuana-Konsum kann möglicherweise eine Verschlechterung der Glukosetoleranz bewirken (andere illegale Substanzen wurden nicht getestet; andere Interaktionen s. Rubrik «Interaktionen»).
Umstellung von anderen Insulinen
Die Umstellung auf ein anderes Insulinpräparat oder Änderungen des Dosierungsschemas sollen nur unter sorgfältiger ärztlicher Kontrolle und Instruktion erfolgen.
Jede Änderung hinsichtlich Stärke, Marke (Hersteller), Insulintyp, Insulinspezies (tierisches Insulin, Humaninsulin, Humaninsulin-Analogon) und/oder Herstellungsmethode kann eine Veränderung der Dosierung erforderlich machen.
So kann auch beim Wechsel auf Levemir eine Anpassung der Dosis gegenüber dem bisherigen Insulin erforderlich sein.
Falls beim Wechsel auf Levemir eine Dosisanpassung erforderlich ist, kann diese bei der ersten Dosis oder in den ersten Wochen oder Monaten nach der Umstellung notwendig sein.
Hyperglykämisches/Ketoazidotisches Koma
Eine nicht ausreichende Dosierung oder Unterbrechung der Behandlung kann, speziell beim Typ-1-Diabetiker, zu Hyperglykämie und diabetischer Ketoazidose führen. Dies entwickelt sich als Folge eines überhöhten Blutzuckers langsam über Stunden und Tage. Erste Anzeichen können Durst, grosse Urinmengen, Appetitlosigkeit, Müdigkeit, Benommenheit, Übelkeit, Erbrechen, Mundtrockenheit, gerötete trockene Haut, Plasmaglukose über 20 mmol/l sowie hohe Glukose- und (meist) Acetonwerte im Urin sein. Als Ursachen kommen in Frage: Diätfehler, Auslassen resp. Verringern von Insulininjektionen oder erhöhter Insulinbedarf wegen Infektionen oder anderer Krankheiten. Der Patient soll angewiesen werden, bei den ersten Anzeichen einer Überzuckerung sofort den Arzt aufzusuchen.
Unbehandelte hypoglykämische und hyperglykämische Reaktionen können zu Bewusstlosigkeit, Koma oder Tod führen.
Begleiterkrankungen, insbesondere Infektionen und fiebrige Zustände, erhöhen in der Regel den Insulinbedarf des Patienten.
Wie bei jeder Insulintherapie können Reaktionen an der Injektionsstelle auftreten, wie z.B. Schmerzen, Rötungen, Hämatome, Juckreiz, Urtikaria, Schwellungen und Entzündungen. Das kontinuierliche Wechseln der Injektionsstelle innerhalb eines bestimmten Bereiches kann dabei helfen, diese Reaktionen zu reduzieren oder zu vermeiden. Die Reaktionen verschwinden gewöhnlich nach einigen Tagen oder Wochen. In seltenen Fällen können Reaktionen an der Injektionsstelle das Absetzen von Levemir erforderlich machen.
Levemir darf nicht intravenös verabreicht werden, da dies zu schweren Hypoglykämien führen kann.
Die Absorption nach intramuskulärer Verabreichung ist rascher und ausgeprägter als bei subkutaner Verabreichung. Eine intramuskuläre Gabe ist zu vermeiden.
Levemir soll nicht mit anderen Insulinen gemischt werden. Wenn Levemir mit anderen Insulinpräparaten gemischt wird, kann sich das Wirkprofil einer oder beider beteiligten Komponenten verändern. Mischen von Levemir mit einem rasch wirkenden Insulinanalogon wie Insulin Aspart resultiert in einem Wirkprofil mit niedrigerer und verspäteter Maximalwirkung verglichen mit separater Injektion beider Komponenten.
Levemir darf nicht in Insulinpumpen verwendet werden.
Es existieren nur sehr beschränkte Daten bei Patienten mit Hypoalbuminämie. Bei diesen Patienten ist eine sorgfältige Überwachung empfehlenswert.
Erkrankung der Haut und des Unterhautgewebes
Patienten müssen angewiesen werden, die Injektionsstelle regelmässig zu wechseln, um das Risiko einer Lipodystrophie und einer kutanen Amyloidose zu reduzieren. Es besteht das potenzielle Risiko einer verzögerten Insulinresorption und einer schlechteren Blutzuckerkontrolle nach Insulininjektionen an Stellen mit diesen Reaktionen. Bei einem plötzlichen Wechsel der Injektionsstelle zu einem nicht betroffenen Bereich wurde darüber berichtet, dass dies zu Hypoglykämie führte. Nach einem Wechsel des Injektionsbereichs wird eine Überwachung des Blutzuckers empfohlen und eine Dosisanpassung der Antidiabetika kann in Erwägung gezogen werden.
Kombination von Levemir mit Pioglitazon
Es gibt Spontanmeldungen über Herzinsuffizienzereignisse, wenn Pioglitazon in Kombination mit Insulin, insbesondere bei Patienten mit Risikofaktoren für die Entwicklung von Herzinsuffizienz, verabreicht wurde. Dies sollte beachtet werden, falls eine Behandlung mit der Kombination von Pioglitazon und Levemir erwogen wird. Falls die Kombination angewendet wird, sollten die Patienten hinsichtlich Anzeichen und Symptomen von Herzinsuffizienz, Gewichtszunahme und Ödemen beobachtet werden. Pioglitazon muss beim Auftreten jeder Verschlechterung kardialer Symptome abgesetzt werden.
Bevor der Patient in andere Zeitzonen reist, muss er sich mit seinem Arzt beraten, da dies bedeuten kann, dass er das Insulin und die Mahlzeiten zu anderen Uhrzeiten anwenden bzw. einnehmen muss.
Vermeidung von versehentlichen Verwechslungen/Medikationsfehlern
Die Patienten müssen angewiesen werden, vor jeder Injektion immer die insulin-Etikette zu überprüfen, um versehentliche Verwechslungen zwischen Levemir und anderen Insulin-Arzneimitteln zu vermeiden.
InteraktionenDer Glukosestoffwechsel wird von einigen Arzneimitteln beeinflusst.
1. Der Insulinbedarf kann vermindert sein in Gegenwart von Substanzen, welche die Insulinwirkung verbessern (Insulinsensitivität erhöhen), die Insulinsekretion steigern, die hepatische Gluconeogenese hemmen oder die intestinale Glukoseaufnahme beeinflussen. Bei gleichbleibender Insulinmenge besteht somit erhöhte Hypoglykämie-Gefahr durch gleichzeitige Einnahme von:
oralen Antidiabetika; Alkohol; ACE-Hemmern (z.B. Captopril und Enalapril); antiarrhythmischen Substanzen wie Disopyramid; β-Blockern und Clonidin; SSRI (insbesondere Fenfluramine); MAO-Hemmern; trizyklischen Antidepressiva; Salicylaten und (selten) anderen NSAIDs; Fibraten; Tetracyclinen; Pentamidin (Hypoglykämie; gelegentlich mit nachfolgender Hyperglykämie); Anti-Malariamitteln (Chinin, Chloroquin, Mefloquin); Sulfonamiden (z.B. Cotrimoxazol); Cimetidin und Ranitidin.
2. Der Insulinbedarf kann erhöht sein bei gleichzeitiger Einnahme der folgenden Substanzen bzw. Substanzgruppen:
orale Kontrazeptiva und andere Östrogen- oder Progestagen-Präparate, Kortikosteroide und ACTH; GH (Somatotropin); Danazol; Schilddrüsenhormone; Sympathikomimetika (vor allem β2-Sympathikomimetika wie Ritodrin, Salbutamol, Terbutalin, aber auch α-selektive Sympathikomimetika, sowie nicht selektive wie Epinephrin); Diazoxid; Nikotinsäure und -derivate; Chlorpromazin (vor allem in hohen Dosen) und andere Phenothiazin-Derivate; Diuretika (z.B. Thiazid-Diuretika, Indapamid und Furosemid); antiretrovirale Substanzen; Immunsuppressive Substanzen (Ciclosporin, Tacrolimus, Sirolimus), atypische Antipsychotika.
3. Bei Anwendung der folgenden Substanzen kann die Insulinwirkung je nach Dosis verstärkt bzw. abgeschwächt werden:
Lanreotid-, Octreotid-, Salicylsäure-Derivate, Lithium-Salze (selten).
β-Blocker können zu einer Verstärkung der Insulinresistenz, aber auch in gewissen Fällen zu einer Hypoglykämie führen. Ausserdem können die Hypoglykämie-Warnsymptome abgeschwächt bzw. maskiert werden.
Schwangerschaft, StillzeitEine Behandlung mit Levemir während der Schwangerschaft kann in Betracht gezogen werden. Der Nutzen soll gegenüber einem möglicherweise erhöhten Risko für einen ungünstigen Schwangerschaftsausgang abgewogen werden.
Eine randomisierte, kontrollierte klinische Studie mit schwangeren Frauen mit Typ 1 Diabetes verglich Levemir (n= 152) mit NPH Insulin (n= 158), beide in Kombination mit Insulin Aspart. Die Ergebnisse zeigten eine vergleichbare Wirksamkeit von Levemir und NPH Insulin und ein ähnliches Gesamtsicherheitsprofil während der Schwangerschaft, auf den Schwangerschaftsausgang und auch bezüglich des Fötus und der Neugeborenen (siehe Kapitel «Eigenschaften/Wirkungen»).
Daten nach Markteinführung von zusätzlichen 250 Schwangerschaftsausgängen bei Frauen, bei denen Levemir angewendet wurde, deuten nicht auf unerwünschte Arzneimittelwirkungen von Insulin Detemir auf die Schwangerschaft und nicht auf ein Fehlbildungsrisiko oder eine fötale/neonatale Toxizität von Insulin Detemir hin.
Tierstudien gaben keinen Hinweis auf eine reproduktive Toxizität.
Sowohl Hypoglykämie als auch Hyperglykämie, die bei einer nicht ausreichend kontrollierten Diabetestherapie auftreten können, erhöhen das Risiko von Missbildungen und Fruchttod in utero. Daher sollten Frauen, die an Diabetes erkrankt sind und eine Schwangerschaft planen bzw. bereits schwanger sind, intensiver überwacht werden.
Generell wird Diabetikerinnen, die eine Schwangerschaft planen, während der ganzen Schwangerschaft eine intensivierte Insulintherapie und Blutzuckerkontrolle empfohlen. Im ersten Trimenon fällt gewöhnlich der Insulinbedarf, steigt aber anschliessend im Verlauf des zweiten und dritten Trimenons wieder an. Nach der Entbindung geht der Insulinbedarf normalerweise innerhalb kurzer Zeit auf Werte wie vor der Schwangerschaft zurück.
In der Milch von Labortieren war Insulin Detemir nachweisbar.
Es ist nicht bekannt, ob Insulin Detemir in die menschliche Muttermilch übergeht. Es werden jedoch keine metabolischen Auswirkungen von Levemir auf Neugeborene/Säuglinge, die gestillt werden, vermutet, da Insulin Detemir ein Peptid ist und im menschlichen Gastrointestinaltrakt in Aminosäuren zerfällt.
Bei stillenden Müttern kann eine Anpassung der Insulindosis und der Ernährung erforderlich sein.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEine Hypoglykämie setzt die Konzentrations- und Reaktionsfähigkeit eines Patienten herab. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z.B. beim Fahren eines Autos oder beim Bedienen von Maschinen) ein Risiko darstellen.
Dem Patienten soll geraten werden, Vorsichtsmassnahmen zur Vermeidung von Hypoglykämien beim Führen von Fahrzeugen zu treffen. Dies ist bei Patienten mit häufigen Hypoglykämie-Episoden oder verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnsymptomen besonders wichtig. In diesen Fällen sollte überlegt werden, ob das Führen eines Fahrzeuges ratsam ist.
Unerwünschte WirkungenEs wurde über Medikationsfehler oder Verwechslungen mit anderen Insulinen berichtet. Insbesondere wurden versehentlich schnell wirksame Insuline anstelle des Insulins Detemir verabreicht.
Die beobachteten Nebenwirkungen bei mit Levemir behandelten Patienten sind hauptsächlich dosisabhängig und werden durch die pharmakologische Wirkung des Insulins verursacht. Der Gesamtanteil der behandelten Patienten, bei denen mit unerwünschten Arzneimittelwirkungen zu rechnen ist, wird auf 12% geschätzt.
Wie bei allen Insulinen ist auch bei Levemir die Hypoglykämie generell die häufigste unerwünschte Wirkung (häufig bis sehr häufig). Eine solche kann auftreten, wenn die Insulindosis zu hoch im Vergleich zum Insulinbedarf ist.
Aus klinischen Studien ist bekannt, dass schwere Hypoglykämien, bei denen eine Intervention von einer Drittperson notwendig ist, häufig bei den mit Levemir behandelten Patienten auftreten.
Während einer Behandlung mit Levemir kommt es häufiger zu Reaktionen an der Injektionsstelle als bei der Behandlung mit Humaninsulin Präparaten. Zu diesen Reaktionen zählen Schmerzen, Rötungen, Entzündungen, blaue Flecken, Schwellungen, Urtikaria und Juckreiz. Die meisten dieser Reaktionen an der Injektionsstelle sind leicht und von vorübergehender Natur und verschwinden normalerweise im Laufe einer kontinuierlichen Behandlung nach einigen Tagen oder Wochen.
Die unten dargestellten Nebenwirkungen sind nach Häufigkeiten und Systemorganklassen aufgeführt. Die Häufigkeiten sind definiert als: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000), sehr selten (<1/10'000).
Erkrankungen des Immunsystems
Allergische Reaktionen, Urtikaria, Rötungen und Ausschlag – Erwachsene gelegentlich, Kinder häufig
In drei klinischen Studien mit Patienten, die eine Kombinationstherapie mit oralen Antidiabetika erhielten, traten allergische oder potenziell allergische Reaktionen häufig auf (in 2,2% der Patienten).
Derartige Symptome sind möglicherweise auf generalisierte Überempfindlichkeitsreaktionen zurückzuführen. Weitere Symptome einer generalisierten Überempfindlichkeitsreaktion sind Juckreiz, Schweissausbrüche, Magenbeschwerden, angioneurotische Ödeme, Atembeschwerden, Herzklopfen und arterielle Hypertonie. Generalisierte Überempfindlichkeitsreaktionen sind potentiell lebensgefährlich (anaphylaktische Reaktionen).
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Hypoglykämie.
Neurovegetative Zeichen: Schwitzen, Hungergefühle, Blässe, Herzklopfen, Kopfschmerzen.
Neuroglykopenische Zeichen: Konzentrationsstörungen, Verhaltensauffälligkeiten (Unruhe, Reizbarkeit, Aggressivität, Verwirrtheit, u.a.), Bewusstseinsstörungen, Koordinations-, Seh- und Sprachstörungen. Diese können über Benommenheit und Somnolenz bis zum Koma fortschreiten. Die Hypoglykämie kann auch zu epileptischen Anfällen führen oder als zerebraler Insult, z.B. mit Hemiparese, Aphasie, positivem Babinskizeichen, imponieren.
Schwere Hypoglykämien können zur Bewusstlosigkeit und/oder Krämpfen mit vorübergehenden oder dauerhaften Störungen der Gehirnfunktion oder sogar zum Tod führen.
Abgeschwächte/veränderte Warnsymptome
Besonders bei Einstellung auf tiefe Blutzuckerwerte (z.B. bei Mehrfachinjektionen nach dem Basis-Bolus-Prinzip: Injektion von kurz wirkendem Insulin vor den drei Hauptmahlzeiten, eine Injektion von Depotinsulin am Abend), aber auch bei lang bestehendem Diabetes (u.U. mit Neuropathie), bei Präparatewechsel u.a. können die Warnsymptome der Hypoglykämie verändert und die neurovegetativen Symptome abgeschwächt sein oder erst spät auftreten. Dies wurde von einigen Patienten auch nach Umstellung von tierischem auf humanes Insulin, aber auch sonst gelegentlich bei Präparatewechsel beobachtet.
Der insulinbehandelte Diabetiker und seine Umgebung sind deshalb zu instruieren, dass sich eine Hypoglykämie auch überraschend und primär durch neuroglykopenische Zeichen wie Konzentrationsstörungen, Unruhe, Verhaltensauffälligkeiten und Bewusstseinsstörungen anzeigen kann, so dass er eventuell nicht früh genug mit Einnahme von Zucker reagiert.
Die Umstellung auf ein anderes Insulinpräparat soll nur unter sorgfältiger ärztlicher Kontrolle und nach genauer Instruktion erfolgen. Auch Dosis und Zeitpunkt der Injektion sollen nur nach Absprache mit dem Arzt oder auf seine Anweisung hin geändert werden.
Als Ursachen einer Hypoglykämie kommen in Frage: Auslassen einer Mahlzeit, Erbrechen, Durchfall, aussergewöhnliche körperliche Anstrengung, Insulinüberdosierung, endokrine Krankheiten wie Nebennierenrindeninsuffizienz, Hypothyreose u.a. Alkoholgenuss kann eine Hypoglykämie verstärken (siehe unter «Interaktionen»).
Therapie der Hypoglykämie siehe unter «Überdosierung».
Nach jeder schweren Hypoglykämie ist die Diabeteseinstellung zu überprüfen, der Patient ist anzuweisen, den Arzt über jede durchgemachte schwere Hypoglykämie zu orientieren.
Dem Patienten ist zu empfehlen, seine nähere Umgebung (Freunde, Arbeitskollegen) über seine Zuckerkrankheit zu informieren sowie über die entsprechenden Verhaltensregeln; unter anderem auch, wie man Glucagon subkutan injiziert.
Erkrankungen des Nervensystems
Periphere Neuropathie – selten
Eine rasche Besserung der Blutzuckereinstellung kann zum Zustand einer «akuten, schmerzhaften Neuropathie» führen, der aber in der Regel vorübergehend ist.
Augenerkrankungen
Refraktionsanomalien – gelegentlich
Zu Beginn einer Insulintherapie können Refraktionsanomalien auftreten, die aber in der Regel vorübergehend sind.
Diabetische Retinopathie – gelegentlich
Langfristige verbesserte Blutzuckereinstellung vermindert das Risiko der Progression einer diabetischen Retinopathie. Jedoch kann eine Intensivierung der Insulintherapie mit einer abrupten Verbesserung der Blutzuckereinstellung zu einer vorübergehenden Verschlechterung einer diabetischen Retinopathie führen.
Erkrankungen der Haut und des Unterhautgewebes
Lipodystrophie – gelegentlich
Kutane Amyloidose – nicht bekannt
Lipodystrophie (einschliesslich Lipohypertrophie, Lipoatrophie) und kutane Amyloidose können an der Injektionsstelle auftreten und die lokale Insulinresorption verzögern. Durch einen regelmässigen Wechsel der Injektionsstelle innerhalb des jeweiligen Injektionsbereichs können diese Reaktionen reduziert oder verhindert werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Überempfindlichkeitsreaktionen an der Injektionsstelle – häufig
Während der Insulintherapie können Überempfindlichkeitsreaktionen an der Injektionsstelle (Rötung, Schwellung und Juckreiz) auftreten. Diese Reaktionen sind jedoch in der Regel vorübergehend und verschwinden im Laufe einer kontinuierlichen Behandlung.
Ödeme – gelegentlich
Zu Beginn einer Insulintherapie können Ödeme auftreten, die aber in der Regel vorübergehend sind.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungFür Insuline kann keine spezifische Überdosierung definiert werden. Eine Hypoglykämie kann sich jedoch stufenweise entwickeln, wenn zu hohe Insulindosen im Verhältnis zum Insulinbedarf verabreicht werden:
Milde hypoglykämische Vorfälle können durch orale Verabreichung von Glukose oder anderer zuckerhaltiger Lebensmittel behandelt werden. Es wird empfohlen, dass der Diabetiker immer einige Würfelzucker oder andere zuckerhaltige Lebensmittel (z.B. einige Biskuits) bei sich hat.
Bei schweren hypoglykämischen Vorfällen, bei welchen der Patient bewusstlos ist, kann 0,5 bis 1,0 mg Glucagon intramuskulär oder subkutan durch eine geübte Person oder Glukose intravenös durch einen Arzt verabreicht werden. Falls der Patient nach 10 bis 15 Minuten auf eine Glucagon Verabreichung nicht reagiert, muss ebenfalls Glukose intravenös appliziert werden.
Sobald der Patient wieder bei Bewusstsein ist, ist die Gabe von Kohlenhydraten erforderlich, um einen Rückfall zu vermeiden.
Eigenschaften/WirkungenATC-Code
A10AE05
Wirkungsmechanismus
Levemir ist ein lösliches, lang wirkendes, basales Insulinanalogon mit einem flachen Wirkprofil und einer verlängerten Wirkdauer.
Das Zeit-Wirkprofil von Levemir ist statistisch signifikant weniger variabel als das von NPH Insulin (Tabelle 1), wie dies aus der intraindividuellen Varianz für den gesamten maximalen pharmakodynamischen Effekt (Tabelle 1) ersichtlich ist (Typ-1-Diabetes Patienten).
Tabelle 1. Intra-individuelle Variabilität des Zeit-Wirkprofils von Levemir und NPH-Insulin (Typ-1-Diabetes)
|
Pharmakodynamischer Endpunkt
|
Insulin Detemir Varianz
|
NPH Insulin Varianz
| |
AUCGIR, 0–24 h*
|
0,074
|
0,466
| |
GIRmax**
|
0,053
|
0,209
|
* Fläche unter der Kurve (Area under the curve).
** Glukose-Infusionsrate p-Wert <0,001 für alle Vergleiche mit Levemir.
Dies resultiert in einer besser vorhersagbaren Blutzuckerwirkung für den Einzelnen.
Die verlängerte Wirkung von Levemir resultiert durch die starke Selbstassoziation von Insulin Detemir-Molekülen am Injektionsort und die Albuminbindung über die Fettsäure-Seitenkette. Die Verteilung von Levemir in die peripheren Zielgewebe ist langsamer als bei NPH-Insulin. Diese kombinierten Verzögerungsmechanismen bewirken eine reproduzierbarere Absorption und ein reproduzierbareres Wirkprofil für Levemir verglichen mit NPH-Insulin.
Wirkprofil von Levemir bei Typ-1-Diabetikern
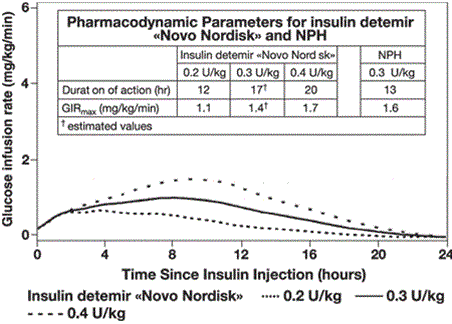
Basis-Bolus-Therapie
Die Wirkdauer von Levemir beträgt in Abhängigkeit der Dosis bis zu 24 Stunden. Daraus ergibt sich eine 1× oder 2× tägliche Verabreichung. Bei einer 2× täglichen Verabreichung stellt sich der Steady State nach Verabreichung von 2–3 Dosen ein. Bei einer Dosis von 0,2–0,4 E/kg tritt nach 3–4 Stunden mehr als 50% der Wirkung ein, die bis zu ca. 14 Stunden andauert.
Nach subkutaner Verabreichung wird eine zur Dosis proportionale Pharmakodynamik (maximale Wirkung, Wirkdauer, totale Wirkung) beobachtet.
Kombinationstherapie mit oralen Antidiabetika
Studien bei Patienten mit Typ-2-Diabetes, die mit Basalinsulin in Kombination mit oralen Antidiabetika behandelt wurden, zeigten, dass die Blutzuckereinstellung (HbA1c) mit Levemir mit der unter NPH-Insulin vergleichbar und mit weniger Gewichtszunahme verbunden ist.
In Studien zur Kombinationstherapie von oralen Antidiabetika mit Insulin führte die Therapie mit Levemir, verglichen mit NPH Insulin, zu einem 61–65% niedrigeren Risiko für leichte nächtliche Hypoglykämien.
Kombinationstherapie mit GLP-1 Rezeptor Agonisten (Liraglutide)
Eine offene Studie mit Patienten mit Typ 2 Diabetes zeigte, dass die Kombinationstherapie mit Levemir und einem GLP-1 Rezeptor Agonisten plus Metformin wirksam und gut verträglich ist. In dieser 26-wöchigen klinischen Studie mit 162 Patienten traten unter der Behandlung mit 1× täglich Levemir und Liraglutide in Kombination mit Metformin keine schweren Hypoglykämien auf und statistisch signifikant mehr Patienten erreichten mit dieser Kombination den HbA1c-Zielwert von <7% im Vergleich zu den Patienten, die mit Liraglutide und Metformin alleine behandelt wurden (43,1% vs 16,8%).
Bei Hinzugaben von Levemir zu Liraglutide 1,8 mg und Metformin wurden keine schweren Hypoglykämien beobachtet. Die Häufigkeit leichter Hypoglykämien lag bei einer Behandlung mit Liraglutide 1,8 mg, Metformin und Levemir bei 0,228 Fällen pro Patientenjahr. In den Vergleichsgruppen, die beide mit Liraglutide 1,8 mg und Metformin behandelt wurden, lag die Rate der leichten Hypoglykämien in der randomisierten Gruppe bei 0,034 und in der nicht-randomisierten Gruppe bei 0,115 Fällen pro Patientenjahr.
Der Gewichtsverlust, der bei Patienten beobachtet wurde, die mit Liraglutide in Kombination mit Metformin behandelt wurden, blieb nach Hinzugabe von Levemir erhalten.
Wirksamkeits- und Sicherheitsstudien mit Typ-1- und Typ-2-Diabetikern
Die Wirksamkeit und Sicherheit von Levemir wurden in fünf multizentrischen, offenen, randomisierten Parallelgruppenvergleichen (4–6 Monate) und zwei Verlängerungsstudien (12 Monate) bei Erwachsenen mit Typ-1-Diabetes und einem HbA1c ≤12,0% mit NPH-Insulin verglichen. Die Wirksamkeit und Sicherheit von Levemir bei Typ-2-Diabetikern wurden in zwei offenen Parallelgruppenvergleichen (6 Monate) nachgewiesen. Die Insulindosis wurde in allen Studien individuell titriert. Endpunkte waren HbA1c, Nüchternblutzuckerwerte, intraindividuelle Tag-zu-Tag Variabilität der Nüchternblutzuckerwerte, 9-Punkt-Blutzuckerprofil, Hypoglykämien, Nebenwirkungen, Laborsicherheitsparameter und Körpergewicht. Es wurden total 1575 Typ-1- und 871 Typ-2-Diabetiker mit Levemir und 887 Typ-1- und 540 Typ-2-Diabetiker mit NPH-Insulin mit einer Basis-Bolus-Therapie (Bolustherapie war Insulin Aspart oder Humaninsulin) behandelt.
Die Blutzuckerkontrolle von Levemir gemessen anhand des HbA1c war in allen Studien mit Typ-1-Diabetikern und in einer von zwei Studien mit Typ-2-Diabetikern mit NPH Insulin vergleichbar. Der Nüchternblutzucker war bei Typ-1-Diabetikern mit Levemir im Vergleich zu NPH-Insulin besser, wobei in drei Studien mit signifikantem Unterschied, während bei Typ-2-Diabetikern der Nüchternblutzucker mit Levemir vergleichbar mit NPH-Insulin war.
Das nächtliche Blutzuckerprofil war mit Levemir flacher und gleichförmiger als mit NPH-Insulin, was in allen Behandlungsstudien mit Typ-1- und Typ-2-Diabetikern zu einem geringeren nächtlichen Hypoglykämierisiko mit Levemir als mit NPH-Insulin führte, davon in zwei Studien signifikant. Die Gesamtrate an Hypoglykämien war im Vergleich zu NPH Insulin ähnlich.
Die mit Levemir behandelten Diabetiker konnten ihr Gewicht halten im Vergleich zu den mit NPH-Insulin behandelten, bei denen das Gewicht durchschnittlich zunahm. Der Unterschied war in allen Studien mit Typ-1- und Typ-2-Diabetikern signifikant. Es wurde eine konstant niedrigere Tag-zu-Tag Variablität des Nüchternblutzuckers mit Levemir im Vergleich zu NPH-Insulin sowohl bei Typ-1- als auch Typ-2-Diabetikern erreicht.
Pharmakodynamik
Siehe unter «Wirkungsmechanismus».
Klinische Wirksamkeit
Siehe unter «Wirkungsmechanismus».
Kinder und Jugendliche
Zwei randomisierte, kontrollierte klinische Studien mit einer Dauer von bis zu 12 Monaten untersuchten die Wirksamkeit und Sicherheit von Levemir bei Kindern ab 2 Jahren mit Typ 1 Diabetes (n= 694). In beiden Studien war die Blutzuckerkontrolle (HbA1c) bei einer Basis-Bolus-Therapie mit Levemir und NPH-Insulin vergleichbar. Ferner wurde unter der Levemir Behandlung eine niedrigere Rate nächtlicher Hypoglykämien und eine geringere Gewichtszunahme (SD Score, Gewichtskorrektur nach Geschlecht und Alter) im Vergleich zu NPH-Insulin beobachtet.
Der Anstieg an Insulin Detemir spezifischen Antikörpern und kreuzreagierenden Antikörpern in der 26-wöchigen Wirksamkeits- und Sicherheitsstudie mit Kindern und Jugendlichen korrelierte nur mit der Dosis. Die Antikörper Entwicklung und deren klinische Relevanz nach 26 Wochen waren nicht bekannt. Um die Antikörperbildung bei einer Langzeitbehandlung unter Levemir zu untersuchen, wurde die Studie um zusätzliche 12 Monate verlängert (Daten über insgesamt 24 Monate). Nach einer Zunahme der Antikörper während des ersten Jahres nahmen die Antikörper im zweiten Behandlungsjahr wieder ab und sanken auf einen Level, der leicht über dem Level vor der Behandlung lag. Die Ergebnisse zeigen, dass die Antikörperentwicklung keine negative Wirkung auf die Blutzuckerkontrolle und die Levemir® Dosis hat.
Schwangerschaft
Eine randomisierte, kontrollierte klinische Studie, in der schwangere Frauen mit Typ 1 Diabetes (n= 310) mit einer Basis-Bolus Therapie mit Insulin Aspart als Mahlzeiteninsulin behandelt wurden, verglich Levemir (n= 152) mit NPH Insulin (n= 158).
Levemir war dem NPH Insulin in Bezug auf das HbA1c, gemessen in der 36. Schwangerschaftswoche, nicht unterlegen. Der Verlauf des durchschnittlichen HbA1c während der Schwangerschaft war in der Levemir Gruppe ähnlich wie in der NPH Insulin Gruppe.
41% der mit Levemir behandelten und 32% der mit NPH Insulin behandelten Patienten erreichten den HbA1c Zielwert von ≤6,0% sowohl in der 24. als auch in der 36. Schwangerschaftswoche.
In der 24. und 36. Schwangerschaftswoche war der durchschnittliche Nüchternblutzuckerspiegel statistisch signifikant tiefer in der Levemir Gruppe als in der NPH Insulin Gruppe.
Es gab keinen statistisch signifikanten Unterschied zwischen der mit Levemir und der mit NPH Insulin behandelten Gruppe in Bezug auf die Rate an hypoglykämischen Ereignissen während der Schwangerschaft.
Die Gesamtrate der Nebenwirkungen der Mutter während der Schwangerschaft war für die Behandlungsgruppen mit Levemir und NPH Insulin ähnlich. Es zeigte sich jedoch eine numerisch höhere Häufigkeit von schwerwiegenden Nebenwirkungen bei der Mutter (n= 61 [40%] gegenüber n= 49 [31%]) und beim Neugeborenen (n= 36 [24%] gegenüber n= 32 [20%]) unter Levemir verglichen mit NPH Insulin. Die Häufigkeit der angeborenen Fehlbildungen lag bei 4 (5%) für Levemir und 11 (7%) für NPH mit 3 (4%) schweren Fehlbildungen für Levemir und 3 (2%) für NPH. Die Anzahl an lebendgeborenen Kindern von Frauen, die nach der Randomisierung schwanger wurden, lag bei 50 (83%) für Levemir und 55 (89%) für NPH.
PharmakokinetikAbsorption
Nach subkutaner Verabreichung wird eine zur Dosis proportionale Serumkonzentration (maximale Konzentration, Fläche unter der Konzentrationskurve) beobachtet. Bei einer 2× täglichen Verabreichung stellt sich die Steady State Serumkonzentration nach Verabreichung von 2–3 Dosen ein. Die terminale Halbwertszeit nach subkutaner Verabreichung ist abhängig von der Absorptionsrate aus dem subkutanen Hautgewebe. Diese beträgt dosisabhängig 5 bis 7 Stunden. Die maximale Serumkonzentration wird 6 bis 8 Stunden nach Applikation erreicht.
Die intraindividuelle Absorptionsvariabilität ist bei Levemir geringer als bei anderen Basalinsulinen.
Distribution
Es gibt keine klinisch relevanten Unterschiede der pharmakokinetischen Parameter von Levemir zwischen den Geschlechtern.
Ein apparentes Verteilungsvolumen von Levemir von ca. 0,1 l/kg weist darauf hin, dass ein hoher Anteil von Insulin Detemir im Blut zirkuliert.
Metabolismus
Die Degradierung von Levemir ist ähnlich wie bei Humaninsulin; alle sich bildenden Metaboliten sind inaktiv.
Die Resultate der in-vitro-Proteinbindungsstudien zeigen, dass keine klinisch relevanten Interaktionen zwischen Insulin Detemir und Fettsäuren oder anderen proteinbindenden Arzneimitteln bestehen.
Bei Verabreichung einer Einzeldosis von 0,5 E/kg Levemir und 1,8 mg Liraglutide im Steady State bei Patienten mit Typ 2 Diabetes wurden keine pharmakokinetischen oder pharmakodynamischen Interaktionen zwischen Liraglutide und Levemir beobachtet.
Elimination
Keine Angaben vorhanden.
Kinetik spezieller Patientengruppen
Kinder und Jugendliche
Die pharmakokinetischen Eigenschaften von Levemir wurden bei Kindern (im Alter zwischen 6 und 12 Jahren) und Jugendlichen (im Alter zwischen 13 und 17 Jahren) untersucht und mit denjenigen bei Erwachsenen mit Typ-1-Diabetes verglichen. Es zeigten sich keine Unterschiede in den pharmakokinetischen Eigenschaften von Insulin Detemir bei Erwachsenen und bei Kindern/Jugendlichen.
Ältere Patienten und Patienten mit eingeschränkter Nieren- oder Leberfunktion
Es besteht kein klinisch signifikanter Unterschied zwischen der Pharmakokinetik von Levemir bei älteren und jüngeren Personen oder zwischen Personen mit eingeschränkter Nieren- oder Leberfunktion und gesunden Personen.
Präklinische DatenIn-vitro-Untersuchungen an humanen Zelllinien, bei denen die Bindung an die Insulin- und IGF-1-Rezeptoren untersucht wurde, haben gezeigt, dass Insulin Detemir verglichen mit Humaninsulin eine verminderte Affinität für beide Rezeptoren hat und auch die Wirkung auf das Zellwachstum vermindert ist.
Präklinische Daten, basierend auf konventionellen Studien zur Sicherheitspharmakologie, zur wiederholten chronischen Toxizität, zur Genotoxizität, zum kanzerogenen Potential und zur Reproduktionstoxizität, lassen keine besonderen Gefahren für den Menschen erkennen.
Es existieren nur sehr beschränkte Daten bei Patienten mit Hypoalbuminämie.
Sonstige HinweiseInkompatibilitäten
Wenn andere Arzneimittel zu Levemir hinzugefügt werden, kann dies zur Degradierung von Insulin Detemir führen, z.B. wenn diese Arzneimittel Thiole oder Sulfite enthalten. Levemir darf nicht Infusionslösungen hinzugefügt werden.
Levemir sollte nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Nach Anbruch: maximal 6 Wochen bei Aufbewahrung unter 30 °C.
Levemir soll nach Ablauf des unter «Exp» aufgedruckten Datums nicht mehr verwendet werden.
Besondere Lagerungshinweise
Vorrat: Im Kühlschrank (2 °C – 8 °C) lagern. Vom Kühlelement fernhalten. Nicht einfrieren.
Nach Anbruch: Nicht im Kühlschrank, unter 30 °C lagern.
Levemir muss vor übermässiger Hitze und Licht geschützt werden.
Levemir Penfill: Patronen lichtgeschützt in der Originalpackung aufbewahren.
Levemir FlexPen: Als Lichtschutz die Verschlusskappe aufgesetzt lassen.
Hinweise für die Handhabung
Penfill und FlexPen dürfen nur zusammen mit Produkten verwendet werden, die mit ihnen kompatibel sind und eine sichere Funktion des Pens gewährleisten.
Levemir Penfill und Levemir FlexPen dürfen jeweils nur von einer einzigen Person benützt werden; nicht nachfüllen.
Levemir darf nicht verwendet werden, wenn es nicht klar und farblos aussieht.
Levemir Penfill und Levemir FlexPen dürfen nicht verwendet werden, wenn sie gefroren waren.
Der Patient sollte angewiesen werden, die Nadel nach jeder Injektion zu entsorgen.
Zulassungsnummer56370, 56371 (Swissmedic).
PackungenLevemir Penfill Patronen 5 × 3 ml. (B)
Levemir FlexPen Fertigpen 5 × 3 ml. (B)
ZulassungsinhaberinNovo Nordisk Pharma AG, Kloten
Domizil: Zürich
Stand der InformationApril 2021.
|

