Eigenschaften/WirkungenATC-Code
A10AE05
Wirkungsmechanismus
Levemir ist ein lösliches, lang wirkendes, basales Insulinanalogon mit einem flachen Wirkprofil und einer verlängerten Wirkdauer.
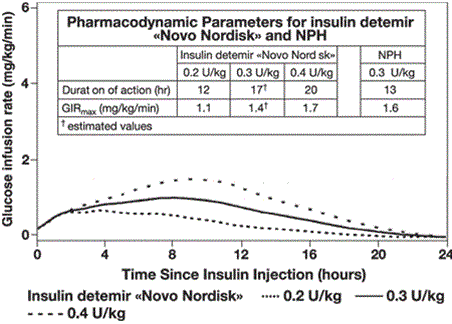
Das Zeit-Wirkprofil von Levemir ist statistisch signifikant weniger variabel als das von NPH Insulin (Tabelle 1), wie dies aus der intraindividuellen Varianz für den gesamten maximalen pharmakodynamischen Effekt (Tabelle 1) ersichtlich ist (Typ-1-Diabetes Patienten).
Tabelle 1. Intra-individuelle Variabilität des Zeit-Wirkprofils von Levemir und NPH-Insulin (Typ-1-Diabetes)
|
Pharmakodynamischer Endpunkt
|
Insulin Detemir Varianz
|
NPH Insulin Varianz
| |
AUCGIR, 0–24 h*
|
0,074
|
0,466
| |
GIRmax**
|
0,053
|
0,209
|
* Fläche unter der Kurve (Area under the curve).
** Glukose-Infusionsrate p-Wert <0,001 für alle Vergleiche mit Levemir.
Dies resultiert in einer besser vorhersagbaren Blutzuckerwirkung für den Einzelnen.
Die verlängerte Wirkung von Levemir resultiert durch die starke Selbstassoziation von Insulin Detemir-Molekülen am Injektionsort und die Albuminbindung über die Fettsäure-Seitenkette. Die Verteilung von Levemir in die peripheren Zielgewebe ist langsamer als bei NPH-Insulin. Diese kombinierten Verzögerungsmechanismen bewirken eine reproduzierbarere Absorption und ein reproduzierbareres Wirkprofil für Levemir verglichen mit NPH-Insulin.
Wirkprofil von Levemir bei Typ-1-Diabetikern
Basis-Bolus-Therapie
Die Wirkdauer von Levemir beträgt in Abhängigkeit der Dosis bis zu 24 Stunden. Daraus ergibt sich eine 1× oder 2× tägliche Verabreichung. Bei einer 2× täglichen Verabreichung stellt sich der Steady State nach Verabreichung von 2–3 Dosen ein. Bei einer Dosis von 0,2–0,4 E/kg tritt nach 3–4 Stunden mehr als 50% der Wirkung ein, die bis zu ca. 14 Stunden andauert.
Nach subkutaner Verabreichung wird eine zur Dosis proportionale Pharmakodynamik (maximale Wirkung, Wirkdauer, totale Wirkung) beobachtet.
Kombinationstherapie mit oralen Antidiabetika
Studien bei Patienten mit Typ-2-Diabetes, die mit Basalinsulin in Kombination mit oralen Antidiabetika behandelt wurden, zeigten, dass die Blutzuckereinstellung (HbA1c) mit Levemir mit der unter NPH-Insulin vergleichbar und mit weniger Gewichtszunahme verbunden ist.
In Studien zur Kombinationstherapie von oralen Antidiabetika mit Insulin führte die Therapie mit Levemir, verglichen mit NPH Insulin, zu einem 61–65% niedrigeren Risiko für leichte nächtliche Hypoglykämien.
Kombinationstherapie mit GLP-1 Rezeptor Agonisten (Liraglutide)
Eine offene Studie mit Patienten mit Typ 2 Diabetes zeigte, dass die Kombinationstherapie mit Levemir und einem GLP-1 Rezeptor Agonisten plus Metformin wirksam und gut verträglich ist. In dieser 26-wöchigen klinischen Studie mit 162 Patienten traten unter der Behandlung mit 1× täglich Levemir und Liraglutide in Kombination mit Metformin keine schweren Hypoglykämien auf und statistisch signifikant mehr Patienten erreichten mit dieser Kombination den HbA1c-Zielwert von <7% im Vergleich zu den Patienten, die mit Liraglutide und Metformin alleine behandelt wurden (43,1% vs 16,8%).
Bei Hinzugaben von Levemir zu Liraglutide 1,8 mg und Metformin wurden keine schweren Hypoglykämien beobachtet. Die Häufigkeit leichter Hypoglykämien lag bei einer Behandlung mit Liraglutide 1,8 mg, Metformin und Levemir bei 0,228 Fällen pro Patientenjahr. In den Vergleichsgruppen, die beide mit Liraglutide 1,8 mg und Metformin behandelt wurden, lag die Rate der leichten Hypoglykämien in der randomisierten Gruppe bei 0,034 und in der nicht-randomisierten Gruppe bei 0,115 Fällen pro Patientenjahr.
Der Gewichtsverlust, der bei Patienten beobachtet wurde, die mit Liraglutide in Kombination mit Metformin behandelt wurden, blieb nach Hinzugabe von Levemir erhalten.
Wirksamkeits- und Sicherheitsstudien mit Typ-1- und Typ-2-Diabetikern
Die Wirksamkeit und Sicherheit von Levemir wurden in fünf multizentrischen, offenen, randomisierten Parallelgruppenvergleichen (4–6 Monate) und zwei Verlängerungsstudien (12 Monate) bei Erwachsenen mit Typ-1-Diabetes und einem HbA1c ≤12,0% mit NPH-Insulin verglichen. Die Wirksamkeit und Sicherheit von Levemir bei Typ-2-Diabetikern wurden in zwei offenen Parallelgruppenvergleichen (6 Monate) nachgewiesen. Die Insulindosis wurde in allen Studien individuell titriert. Endpunkte waren HbA1c, Nüchternblutzuckerwerte, intraindividuelle Tag-zu-Tag Variabilität der Nüchternblutzuckerwerte, 9-Punkt-Blutzuckerprofil, Hypoglykämien, Nebenwirkungen, Laborsicherheitsparameter und Körpergewicht. Es wurden total 1575 Typ-1- und 871 Typ-2-Diabetiker mit Levemir und 887 Typ-1- und 540 Typ-2-Diabetiker mit NPH-Insulin mit einer Basis-Bolus-Therapie (Bolustherapie war Insulin Aspart oder Humaninsulin) behandelt.
Die Blutzuckerkontrolle von Levemir gemessen anhand des HbA1c war in allen Studien mit Typ-1-Diabetikern und in einer von zwei Studien mit Typ-2-Diabetikern mit NPH Insulin vergleichbar. Der Nüchternblutzucker war bei Typ-1-Diabetikern mit Levemir im Vergleich zu NPH-Insulin besser, wobei in drei Studien mit signifikantem Unterschied, während bei Typ-2-Diabetikern der Nüchternblutzucker mit Levemir vergleichbar mit NPH-Insulin war.
Das nächtliche Blutzuckerprofil war mit Levemir flacher und gleichförmiger als mit NPH-Insulin, was in allen Behandlungsstudien mit Typ-1- und Typ-2-Diabetikern zu einem geringeren nächtlichen Hypoglykämierisiko mit Levemir als mit NPH-Insulin führte, davon in zwei Studien signifikant. Die Gesamtrate an Hypoglykämien war im Vergleich zu NPH Insulin ähnlich.
Die mit Levemir behandelten Diabetiker konnten ihr Gewicht halten im Vergleich zu den mit NPH-Insulin behandelten, bei denen das Gewicht durchschnittlich zunahm. Der Unterschied war in allen Studien mit Typ-1- und Typ-2-Diabetikern signifikant. Es wurde eine konstant niedrigere Tag-zu-Tag Variablität des Nüchternblutzuckers mit Levemir im Vergleich zu NPH-Insulin sowohl bei Typ-1- als auch Typ-2-Diabetikern erreicht.
Pharmakodynamik
Siehe unter «Wirkungsmechanismus».
Klinische Wirksamkeit
Siehe unter «Wirkungsmechanismus».
Kinder und Jugendliche
Zwei randomisierte, kontrollierte klinische Studien mit einer Dauer von bis zu 12 Monaten untersuchten die Wirksamkeit und Sicherheit von Levemir bei Kindern ab 2 Jahren mit Typ 1 Diabetes (n= 694). In beiden Studien war die Blutzuckerkontrolle (HbA1c) bei einer Basis-Bolus-Therapie mit Levemir und NPH-Insulin vergleichbar. Ferner wurde unter der Levemir Behandlung eine niedrigere Rate nächtlicher Hypoglykämien und eine geringere Gewichtszunahme (SD Score, Gewichtskorrektur nach Geschlecht und Alter) im Vergleich zu NPH-Insulin beobachtet.
Der Anstieg an Insulin Detemir spezifischen Antikörpern und kreuzreagierenden Antikörpern in der 26-wöchigen Wirksamkeits- und Sicherheitsstudie mit Kindern und Jugendlichen korrelierte nur mit der Dosis. Die Antikörper Entwicklung und deren klinische Relevanz nach 26 Wochen waren nicht bekannt. Um die Antikörperbildung bei einer Langzeitbehandlung unter Levemir zu untersuchen, wurde die Studie um zusätzliche 12 Monate verlängert (Daten über insgesamt 24 Monate). Nach einer Zunahme der Antikörper während des ersten Jahres nahmen die Antikörper im zweiten Behandlungsjahr wieder ab und sanken auf einen Level, der leicht über dem Level vor der Behandlung lag. Die Ergebnisse zeigen, dass die Antikörperentwicklung keine negative Wirkung auf die Blutzuckerkontrolle und die Levemir® Dosis hat.
Schwangerschaft
Eine randomisierte, kontrollierte klinische Studie, in der schwangere Frauen mit Typ 1 Diabetes (n= 310) mit einer Basis-Bolus Therapie mit Insulin Aspart als Mahlzeiteninsulin behandelt wurden, verglich Levemir (n= 152) mit NPH Insulin (n= 158).
Levemir war dem NPH Insulin in Bezug auf das HbA1c, gemessen in der 36. Schwangerschaftswoche, nicht unterlegen. Der Verlauf des durchschnittlichen HbA1c während der Schwangerschaft war in der Levemir Gruppe ähnlich wie in der NPH Insulin Gruppe.
41% der mit Levemir behandelten und 32% der mit NPH Insulin behandelten Patienten erreichten den HbA1c Zielwert von ≤6,0% sowohl in der 24. als auch in der 36. Schwangerschaftswoche.
In der 24. und 36. Schwangerschaftswoche war der durchschnittliche Nüchternblutzuckerspiegel statistisch signifikant tiefer in der Levemir Gruppe als in der NPH Insulin Gruppe.
Es gab keinen statistisch signifikanten Unterschied zwischen der mit Levemir und der mit NPH Insulin behandelten Gruppe in Bezug auf die Rate an hypoglykämischen Ereignissen während der Schwangerschaft.
Die Gesamtrate der Nebenwirkungen der Mutter während der Schwangerschaft war für die Behandlungsgruppen mit Levemir und NPH Insulin ähnlich. Es zeigte sich jedoch eine numerisch höhere Häufigkeit von schwerwiegenden Nebenwirkungen bei der Mutter (n= 61 [40%] gegenüber n= 49 [31%]) und beim Neugeborenen (n= 36 [24%] gegenüber n= 32 [20%]) unter Levemir verglichen mit NPH Insulin. Die Häufigkeit der angeborenen Fehlbildungen lag bei 4 (5%) für Levemir und 11 (7%) für NPH mit 3 (4%) schweren Fehlbildungen für Levemir und 3 (2%) für NPH. Die Anzahl an lebendgeborenen Kindern von Frauen, die nach der Randomisierung schwanger wurden, lag bei 50 (83%) für Levemir und 55 (89%) für NPH.
|
