ZusammensetzungWirkstoffe
Humaner Blutgerinnungsfaktor II
Humaner Blutgerinnungsfaktor VII
Humaner Blutgerinnungsfaktor IX
Humaner Blutgerinnungsfaktor X
Humanes Protein C
Humanes Protein S
Hilfsstoffe
|
Name des Bestandteils
|
Octaplex 500
Menge pro Flasche
|
Octaplex 1000
Menge pro Flasche
|
Octaplex
Menge pro ml gebrauchsfertiger Lösung
| |
Heparin
|
100 – 250 I.E.
|
200 – 500 I.E.
|
5 – 12.5 I.E./ml
| |
Natriumcitrat-Dihydrat
|
Lösungsmittel: Wasser für Injektionszwecke.
Dieses Arzneimittel enthält 75 - 125 mg (500 I.E. Flasche) bzw. 150 – 250 mg (1000 I.E. Flasche) Natrium pro Durchstechflasche.
Indikationen/Anwendungsmöglichkeiten·Behandlung von Blutungen und perioperative Notfall-Prophylaxe von Blutungen bei einem erworbenen Mangel an Prothrombinkomplex-Faktoren, zum Beispiel infolge der Behandlung mit Vitamin-K-Antagonisten.
·Überdosierung von Vitamin-K-Antagonisten, wenn eine schnelle Korrektur des Mangels erforderlich ist.
·Behandlung von Blutungen und perioperative Prophylaxe bei einem angeborenen Mangel eines Vitamin-K-abhängigen Gerinnungsfaktors, wenn Einzelfaktorkonzentrate nicht zur Verfügung stehen.
Dosierung/AnwendungDosierung
Nachstehend werden nur allgemeine Richtlinien gegeben. Der Rat eines Spezialisten mit Erfahrung in der Behandlung von Gerinnungsstörungen sollte eingeholt werden.
Dosierung und Dauer der Ersatztherapie hängen vom Schweregrad der Gerinnungsstörung, dem Ort und Ausmass der Blutung und von dem klinischen Zustand des Patienten ab.
Die zu verabreichende Menge und die Häufigkeit der Verabreichung sollte immer auf die klinische Wirksamkeit ausgerichtet sein.
Die erforderliche Dosis bei einem angeborenen Mangel an Prothrombinkomplex-Faktoren hängt auch von der in-vivo-Halbwertszeit des erforderlichen Faktors ab (siehe unter «Pharmakokinetik»).
Grundlage der individuellen Dosierung ist die regelmässige Bestimmung der Plasmakonzentration der entsprechenden Gerinnungsfaktoren, die Messung von Globalparametern der Prothrombinkomplex-Konzentration (z.B. Quickwert/INR) sowie die kontinuierliche Überwachung des klinischen Zustands des Patienten.
Bei einem angeborenen Faktorenmangel sollte der entsprechende Faktor regelmässig bestimmt werden, wie dies für einen erworbenen Mangel empfohlen wird.
Bei grösseren chirurgischen Eingriffen ist eine genaue Überwachung des Gerinnungsstatus unerlässlich.
a) Erworbener Mangel an Prothrombinkomplex-Faktoren
Die gleichzeitige Verabreichung von Vitamin K mit dem Prothrombinkomplex-Konzentrat sollte immer in Erwägung gezogen werden. Eine wiederholte Gabe von Octaplex kann sich dadurch erübrigen, dass die Wirkung von Vitamin K meistens innerhalb von 4 – 6 h einsetzt, während diejenige von Octaplex ca. 6 – 8 h anhält.
Der gewünschte Anstieg der INR/des Quickwertes, der mit der Aktivität des Faktors IX korreliert, sollte abhängig vom klinischen Zustand festgelegt werden. Die erforderliche Dosis des Prothrombinkomplex-Konzentrats kann anhand der folgenden Formel berechnet werden: Erforderliche Einheiten des Faktors IX = Körpergewicht x [gewünschte Faktor-IX-Aktivität – (minus) der tatsächlichen Faktor-IX-Aktivität (%)].
Alternative Berechnungsmethode auf Basis des Quick-Zielwertes:
Zu infundierende Einheiten Octaplex (IU) = (Quick Zielwert – Quick Basiswert) x kg Körpergewicht
Im Falle einer lebensbedrohenden Blutung ist im Allgemeinen eine Faktor-IX-Aktivität von 50% erforderlich (entspricht einem Quick-Wert von 60 – 80 % bzw. einer INR von ca. 1,15 – 1,4); im Falle von leichten Blutungen bzw. kleineren Verletzungen oder Eingriffen ist eine Faktor-IX-Aktivität von 20 – 25 % (entspricht einem Quickwert von 30 – 50 % bzw. einer INR von ca. 1,6 – 2,4) erforderlich.
Erfolgt die Behandlung mit Prothrombinkomplex-Konzentrat mit dem Ziel, die Wirkung von Vitamin-K-Antagonisten mit einer langen Halbwertszeit umzukehren, sollte berücksichtigt werden, dass die Aktivität der Vitamin-K-Antagonisten länger als die Wirkung von Octaplex anhalten kann. Dies wird durch die relativ kurze Halbwertszeit des Faktors VII im Prothrombinkomplex-Konzentrat verursacht.
Daher ist eine regelmässige Bestimmung der/des INR/Quick-Wertes erforderlich, auch wenn kurz nach der Infusion von Octaplex eine Korrektur der INR erreicht worden ist.
b) Angeborener Mangel an Prothrombinkomplex-Faktoren, wenn ein hoch gereinigtes spezifisches Gerinnungskonzentrat nicht zur Verfügung steht
Die Aktivität im Plasma eines spezifischen Gerinnungsfaktors wird entweder in Prozent (im Vergleich zum normalen Plasmagehalt) oder in Internationalen Einheiten (im Vergleich zum Internationalen Standard für einen spezifischen Gerinnungsfaktor) ausgedrückt. Eine Internationale Einheit (I.E.) eines Gerinnungsfaktors entspricht der Menge, die in 1 ml humanem Normalplasma enthalten ist.
Die Berechnung der erforderlichen Anfangsdosierung basiert auf der folgenden, empirisch ermittelten Formel:
Die Basisanleitung für die Anfangsdosis lautet: 1 I.E./kg Körpergewicht erhöht die Aktivitäten der Faktoren VII und IX um 0,01 I.E./ml und der Faktoren II und X um 0,02 resp. 0,017 I.E./ml.
Formeln für die Bestimmung der erforderlichen Dosierung:
FIX: Erforderliche Einheiten = Körpergewicht (kg) x gewünschter Faktor-IX-Anstieg (%) x 1 (I.E./kg)
FVII: Erforderliche Einheiten = Körpergewicht (kg) x gewünschter Faktor-VII-Anstieg (%) x 1 (I.E./kg)
FII: Erforderliche Einheiten = Körpergewicht (kg) x gewünschter Faktor-II-Anstieg (%) x 0,50 (I.E./kg)
FX: Erforderliche Einheiten = Körpergewicht (kg) x gewünschter Faktor-X-Anstieg (%) x 0,59 (I.E./kg)
Die Erhaltungsdosis hängt von der klinischen Situation, den Halbwertszeiten und den erforderlichen Aktivitätsgraden ab.
Die Erfahrung bei der Behandlung eines angeborenen Mangels der Faktoren II, VII oder X ist begrenzt. Wegen der langen Halbwertszeit der Faktoren II und X wird das humane Prothrombinkomplex-Konzentrat bei Patienten mit einem angeborenen Faktor-II- oder Faktor-X-Mangel in grösseren Abständen verabreicht.
Die Halbwertszeit des Faktors VII beträgt 1,5 – 6 Stunden. Patienten mit einem angeborenen Faktor-VII-Mangel benötigen deshalb Prothrombinkomplex-Konzentrat in kürzeren Zeitabständen.
Nach Beginn der Substitutionstherapie muss der Gehalt des fehlenden Faktors durch einen spezifischen Test bestimmt werden, um die Reaktion auf die Therapie beurteilen und eine weitere Behandlung planen zu können.
Spezielle Dosierungsanweisungen
Für den Einsatz von Octaplex bei perinatalen Blutungen, verursacht durch einen Mangel an Faktoren des Prothrombinkomplexes liegen keine Daten vor. Die Erfahrung bei der Behandlung eines angeborenen Mangels an Faktoren II, VII oder X ist begrenzt.
Kinder und Jugendliche
Die Anwendung und Sicherheit von Octaplex, Pulver und Lösung zur Herstellung einer Infusionslösung bei Kindern und Jugendlichen ist bisher nicht geprüft worden.
Art der Anwendung
Das Produkt muss intravenös verabreicht werden. Angaben zur Verabreichung siehe unter «Sonstige Hinweise, Hinweise für die Handhabung».
KontraindikationenOctaplex sollte nicht verwendet werden bei Patienten mit:
·Bekannter Überempfindlichkeit gegenüber den arzneilich wirksamen Bestandteilen oder einem der Hilfsstoffe.
·Bekannter Überempfindlichkeit gegenüber Heparin oder Anamnese einer Heparin-induzierten Thrombozytopenie.
·Da Octaplex kein AT III enthält, sollte es in klinischen Situationen, die zu AT-III-Mangel führen können (z.B. bei bestehender Verbrauchskoagulopathie oder im Rahmen einer Leberzirrhose oder eines Nephrotischen Syndroms) nicht eingesetzt werden.
(siehe auch unter «Warnhinweise und Vorsichtsmassnahmen»).
Warnhinweise und VorsichtsmassnahmenSiehe auch unter «Schwangerschaft, Stillzeit» und «Unerwünschte Wirkungen».
Vor der Anwendung von Octaplex sollte der Rat eines Spezialisten eingeholt werden, der Erfahrung in der Behandlung von Gerinnungsstörungen hat.
Das Arzneimittel sollte bei Patienten mit einem erworbenen Mangel an Prothrombinkomplex-Faktoren (z.B. verursacht durch die Behandlung mit Vitamin-K-Antagonisten) nur verwendet werden, wenn ein schneller Anstieg des Prothrombinkomplex-Gehalts erforderlich ist, wie zum Beispiel bei starken Blutungen oder einer Notoperation. In anderen Fällen ist häufig die Verabreichung von Vitamin K und/oder Plasma und/oder die Verringerung der Dosis des Vitamin-K-Antagonisten ausreichend.
Patienten, die Vitamin-K-Antagonisten erhalten, können eine Hyperkoagulationsbereitschaft aufweisen, die sich durch die Infusion des Prothrombinkomplex-Konzentrats verstärken kann.
Bei einem angeborenen Mangel an einem der Vitamin-K-abhängigen Gerinnungsfaktoren sollten vorzugsweise Einzelfaktorkonzentrate eingesetzt werden, wenn diese zur Verfügung stehen.
Wenn allergische oder anaphylaktische Reaktionen auftreten, muss die Infusion sofort unterbrochen werden. Bei einem Schock sind die medizinischen Standards für die Behandlung eines Schocks zu befolgen.
Octaplex wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen, die sich durch den Einsatz von Arzneimitteln ergeben, die aus Blut und Blutplasma hergestellt sind, schliessen die Auswahl der Spender und das Screening der einzelnen Spenden auf spezifische Infektionsmarker sowie effektive Schritte zur Inaktivierung/Entfernung von Viren im Herstellungsverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu aufgetretene Viren oder andere Pathogene.
Die getroffenen Massnahmen werden als wirksam für umhüllte Viren wie HIV, HBV und HCV angesehen. Bei nicht umhüllten Viren, wie HAV oder Parvovirus-B19, können sie von eingeschränkter Wirksamkeit sein. Parvovirus-B19-Infektionen können schwerwiegende Folgen für schwangere Frauen (Infektion des Fötus) und für Patienten mit einem Immunmangel oder einer erhöhten Produktion von roten Blutkörperchen (z.B. hämolytische Anämie) haben.
Um die Rückverfolgbarkeit biologischer Arzneimittel sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Es wird generell empfohlen, Patienten gegen Hepatitis A und Hepatitis B zu impfen, wenn sie regelmässig oder wiederholt aus humanem Plasma hergestellte Prothrombinkomplex-Konzentrate erhalten.
Patienten, denen ein humanes Prothrombinkomplex–Konzentrat verabreicht wird, sollten auf Symptome einer intravasalen Gerinnung oder Thrombose beobachtet werden. Insbesondere bei Patienten mit wiederholter Gabe von Prothrombinkomplex-Konzentraten besteht ein Risiko einer Thrombose oder einer disseminierten intravasalen Gerinnung (DIC). Dies gilt sowohl für Patienten mit kongenitalem als auch für solche mit erworbenem Mangel an Faktoren des Prothrombinkomplexes. Das Risiko kann erhöht sein bei Behandlung eines isolierten Faktor-VII-Mangels, da in einer solchen Situation die anderen Faktoren des Prothrombinkomplexes wegen ihrer vergleichsweise längeren Halbwertszeit akkumulieren können. Patienten, denen ein humanes Prothrombinkomplex-Konzentrat verabreicht wird, sollten auf Symptome einer intravasalen Gerinnung oder Thrombose beobachtet werden. Aufgrund des Risikos thromboembolischer Komplikationen sollte bei der Verabreichung von Prothrombinkomplex-Konzentrat an Patienten mit einer Anamnese einer koronaren Herzerkrankung, an Patienten mit einer Lebererkrankung und an peri- oder postoperative Patienten, Neugeborene oder Patienten mit einem Risiko eines thromboembolischen Phänomens oder einer disseminierten intravasalen Gerinnung mit Vorsicht vorgegangen werden. Dies gilt auch für Patienten oder klinische Situationen, wo ein AT-III-Mangel vermutet werden muss (vgl. «Kontraindikationen»). Bei postoperativen Patienten kann eine Thromboseprophylaxe mit Heparin angebracht sein. In jeder dieser Situationen muss der potentielle Vorteil der Behandlung mit Octaplex gegen das Risiko dieser Komplikationen abgewogen werden.
Dieses Arzneimittel enthält 75 - 125 mg (500 I.E. Flasche) bzw. 150 – 250 mg (1000 I.E. Flasche) Natrium pro Durchstechflasche, entsprechend 3.8 – 6.3 % bzw. 7.5 - 12,5% der von der WHO empfohlenen maximalen Tagesdosis von 2 g Natrium für einen Erwachsenen.
Heparin kann allergische Reaktionen hervorrufen und die Blutzellenzahl vermindern mit der Folge einer Blutgerinnungsstörung. Wenn bei Ihnen früher durch Heparin bedingte allergische Reaktionen aufgetreten sind, sollten Sie heparinhaltige Arzneimittel nicht anwenden
InteraktionenWechselwirkungen von humanem Prothrombinkomplex-Konzentrat sind, ausser mit Vitamin-K-Antagonisten, nicht bekannt. Bei Gerinnungstests, die durch Heparin gestört werden, muss insbesondere bei hochdosierten Patienten das mit Octaplex zugeführte Heparin berücksichtigt werden.
Schwangerschaft, StillzeitSchwangerschaft
Die Sicherheit von humanem Prothrombinkomplex-Konzentrat in der Schwangerschaft ist nicht untersucht worden. Es liegen keine hinreichenden tierexperimentellen Studien zur Auswirkung auf Schwangerschaft, Embryonalentwicklung, Entwicklung des Föten und/oder die postnatale Entwicklung vor. Das potentielle Risiko für den Menschen ist nicht bekannt.
Octaplex sollte schwangeren oder stillenden Frauen nur bei einer klaren Indikation verabreicht werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt.
Unerwünschte WirkungenAllergische oder anaphylaktische Reaktionen und ein Anstieg der Körpertemperatur können in seltenen Fällen auftreten.
Es besteht das Risiko von Thromboembolien nach der Verabreichung von humanen Prothrombinkomplex-Präparaten. Besonders zu beachten ist dies bei der Behandlung eines isolierten Faktor-VII-Mangels. (siehe unter «Warnhinweise und Vorsichtsmassnahmen»).
Eine Substitutionstherapie kann in Einzelfällen zur Bildung von zirkulierenden Antikörpern gegen einzelne Gerinnungsfaktoren führen. Wenn solche Inhibitoren auftreten, wird der infundierte Prothrombinkomplex teilweise oder vollständig inaktiviert. Dadurch wird die klinische Wirksamkeit von Prothrombinkomplex-Konzentraten eingeschränkt.
Bei den Häufigkeitsangaben zu Nebenwirkungen wurden folgende Kategorien zugrunde gelegt: selten (≥1/10'000 bis < 1/1'000); sehr selten (< 1/10'000).
|
MedDRA Systemorganklasse
|
Nebenwirkung
|
Häufigkeit
| |
Erkrankungen des Blutes und des Lymphsystems
|
Inhibition von Gerinnungsfaktoren
|
Einzelfälle
| |
|
Heparin-induzierte Thrombozytopenie
|
selten
| |
Erkrankungen des Immunsystems
|
Anaphylaktischer Schock
|
sehr selten
| |
|
Anaphylaktische Reaktion
|
selten
| |
|
Überempfindlichkeit
|
sehr selten
| |
Erkrankungen des Nervensystems
|
Tremor
|
sehr selten
| |
Herzerkrankungen
|
Herzstillstand
|
sehr selten
| |
|
Tachykardie
|
sehr selten
| |
Gefässerkrankungen
|
Thromboembolisches Ereignis
|
sehr selten
| |
|
Kreislaufkollaps
|
sehr selten
| |
|
Hypotonie
|
sehr selten
| |
|
Hypertonie
|
sehr selten
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
|
Respiratorische Insuffizienz
|
Einzelfälle
| |
|
Dyspnoe
|
sehr selten
| |
Erkrankungen des Gastrointestinaltrakts
|
Übelkeit
|
sehr selten
| |
Erkrankungen der Haut und des Unterhautzellgewebes
|
Urtikaria
|
sehr selten
| |
|
Ausschlag
|
sehr selten
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Fieber
|
sehr selten
| |
|
Schüttelfrost
|
sehr selten
| |
Untersuchungen
|
Transaminasen erhöht
|
selten
|
Octaplex enthält Heparin. Daher können selten Heparin-Antikörper-vermittelte Thrombozytopenien (Typ II) mit Thrombozytenwerten deutlich unter 100'000/µl oder einem Abfall auf weniger als 50 % des Ausgangswertes beobachtet werden. Bei Patienten ohne vorbestehende Überempfindlichkeit gegen Heparin beginnt der Thrombozytenabfall in der Regel 6–14 Tage nach Behandlungsbeginn. Bei Patienten mit Überempfindlichkeit gegenüber Heparin tritt dieser Abfall unter Umständen innerhalb von Stunden auf. Bei Patienten, bei denen die genannten allergischen Reaktionen auftreten, muss Octaplex sofort abgesetzt werden. Bei ihnen darf auch in Zukunft kein heparinhaltiges Arzneimittel mehr angewendet werden.
Angaben zur Sicherheit im Hinblick auf übertragbare Krankheitserreger siehe «Warnhinweise und Vorsichtsmassnahmen».
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungUm eine Überdosierung während der Behandlung zu vermeiden, sollten die Gerinnungsparameter sorgfältig überwacht werden. Die Verwendung hoher Dosen von aus humanem Plasma gewonnenen Prothrombinkomplex-Konzentrats ist mit Fällen eines Myokardinfarkts, einer disseminierten intravasalen Gerinnung, Venenthrombose und Lungenembolie in Verbindung gebracht worden. Im Falle einer Überdosis wird daher die Entstehung thromboembolischer Komplikationen oder einer disseminierten intravasalen Gerinnung bei Patienten mit einem Risiko für diese Komplikationen erhöht. Besondere Vorsicht ist bei Patienten geboten, bei denen ein AT-III-Mangel vorliegen könnte (vgl. «Kontraindikationen»).
Eigenschaften/WirkungenATC-Code
B02BD01
Wirkstoffgruppe: Gerinnungsfaktor IX, II, VII und X in Kombination.
Wirkungsmechanismus
Die Verabreichung von humanem Prothrombinkomplexkonzentrat führt zu einem Anstieg der Vitamin-K-abhängigen Gerinnungsfaktoren im Plasma und kann die Gerinnungsstörung vorübergehend bei den Patienten korrigieren, die unter einem Mangel an einem oder mehreren dieser Faktoren leiden.
Der isolierte schwere Mangel an Faktor VII führt aufgrund einer gestörten primären Hämostase mit einer reduzierten Thrombin- und Fibrinbildung zu Blutungsneigungen. Der isolierte Mangel an Faktor IX ist eine der klassischen Hämophilien (Hämophilie B). Der isolierte Mangel an Faktor II oder Faktor X ist sehr selten, kann aber in schweren Fällen Blutungen wie bei klassischen Hämophilien verursachen.
Die Behandlung mit Vitamin-K-Antagonisten kann zu einem Mangel an verschiedenen Gerinnungsfaktoren des Prothrombinkomplexes führen (erworbener Mangel).
Schwerwiegende Mangelerscheinungen resultieren in einer schweren Blutung, die eher durch retroperitoneale oder zerebrale Blutungen als durch Muskel- und Gelenksblutungen gekennzeichnet ist. Bei schwerer Leberinsuffizienz besteht infolge verminderter Prothrombinkomplexfaktoren eine Blutungsneigung sowie eine gleichzeitig aktivierte (intravasale) Gerinnung, welche durch einen Anstieg der D-Dimerkonzentration gekennzeichnet ist. Eine Reduzierung der Gerinnungsinhibitoren, eine verminderte Fibrinolyse wie auch eine erniedrigte Thrombozytenzahl machen die Situation komplex.
Pharmakodynamik
Die Gerinnungsfaktoren II, VII, IX und X, die Vitamin-K-abhängig in der Leber synthetisiert werden, werden im Allgemeinen als Prothrombinkomplex bezeichnet.
Faktor VII ist das Zymogen der aktiven Serinprotease Faktor VIIa.
Der Komplex aus Gewebsthromboplastin und Faktor VIIa aktiviert die Gerinnungsfaktoren X und IX zu Xa und IXa. Im weiteren Verlauf der Gerinnungskaskade wird Prothrombin (Faktor II) zu Thrombin. Durch Thrombin wird aus Fibrinogen Fibrin gebildet, das zu einem Gerinnsel vernetzt wird. Die Bildung von Thrombin ist ebenfalls für die Thrombozytenfunktion als Teil der primären Hämostase von grosser Bedeutung.
Klinische Wirksamkeit
In einer multizentrischen Studie mit 60 chirurgischen Patienten konnten 56 per Protokoll ausgewertet werden, wovon 19 einem grösseren Eingriff unterzogen wurden. 91 % der Patienten erwiesen sich als «responder» (ausreichender Quick-Anstieg).
Fast alle Patienten erhielten eine postoperative Thromboseprophylaxe meist in Form von niedermolekularen Heparinen. Die klinische Verträglichkeit wurde von den Untersuchern als zufriedenstellend beurteilt.
PharmakokinetikAbsorption
Octaplex ist aufgrund der intravenösen Verabreichung sofort und vollständig verfügbar.
Distribution
Keine Angaben.
Metabolismus
Die Halbwertszeiten im Plasma lauten für:
|
Faktor II
|
48 - 60 Stunden
| |
Faktor VII
|
1,5 - 6 Stunden
| |
Faktor IX
|
20 - 24 Stunden
| |
Faktor X
|
24 - 48 Stunden
|
Elimination
Keine Angaben.
Präklinische DatenEine Prüfung auf Toxizität der Einzeldosis im Tiermodell ist aufgrund der Volumenüberlastung bei Gaben höherer Dosen irrelevant. Prüfungen auf Toxizität wiederholter Gaben sind im Tiermodell nicht durchführbar, da die Tiere Antikörper gegen menschliches Protein entwickeln.
Sonstige HinweiseInkompatibilitäten
Octaplex darf nicht mit anderen Arzneimitteln gemischt werden.
Beeinflussung diagnostischer Methoden
Nach Anwendung hoher Dosen ist bei der Durchführung Heparin-empfindlicher Gerinnungsanalysen das mit Octaplex zugeführte Heparin zu berücksichtigen und gegebenenfalls mit Protaminsulfat oder anderen Reagenzien in vitro zu neutralisieren.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Die rekonstituierte Infusionszubereitung ist nicht konserviert.
Chemische und physikalische Stabilität der gebrauchsfertigen Lösung wurde für 8 Stunden bei +2°C bis +25°C gezeigt.
Aus mikrobiologischen Gründen ist die gebrauchsfertige Lösung unmittelbar nach Rekonstitution zu verwenden. Wenn es nicht sofort verwendet wird, liegen die Aufbewahrungszeit und die Bedingungen vor Anwendung in der Verantwortung des Anwenders.
Besondere Lagerungshinweise
Nicht über 25°C lagern. Nicht einfrieren. In der Originalverpackung aufbewahren. Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Bitte lesen Sie alle Anweisungen durch und befolgen Sie sie sorgfältig!
Der Lösungsvorgang des Arzneimittels und die Infusion müssen unter aseptischen Bedingungen erfolgen.
Das Produkt löst sich bei Raumtemperatur schnell in eine klare oder leicht opaleszente Lösung auf. Verwenden Sie keine Lösungen, die trüb sind oder Ablagerungen aufweisen.
Das gebrauchsfertige Arzneimittel soll unmittelbar nach dem Auflösen verwendet werden.
Es wird empfohlen, das in der Packung enthaltene Transfer-Set zu verwenden.
Anweisungen für die Herstellung der Lösung:
1.Lösungsmittel (Wasser für Injektionszwecke) und Konzentrat in den ungeöffneten Flaschen auf Zimmertemperatur (max. 37 °C) erwärmen. Wird zum Erwärmen des Lösungsmittels ein Wasserbad benutzt, muss sorgfältig darauf geachtet werden, dass das Wasser nicht mit dem Gummistopfen oder dem Verschluss der Flaschen in Berührung kommt. Die Temperatur des Wasserbades sollte 37 °C nicht übersteigen.
2.Schutzdeckel (Flip-off) von der Konzentratflasche (P) und der Lösungsmittelflasche (LM) entfernen und die Gummistopfen beider Flaschen mit einem Alkoholtupfer desinfizieren.
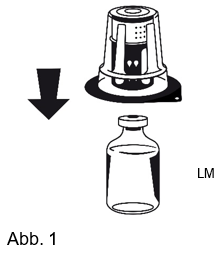
3.Die Schutzfolie von der äusseren Verpackung des Nextaro® entfernen, aber das Nextaro® nicht aus dem Blister entnehmen. Die Lösungsmittelflasche (LM) auf eine ebene Fläche stellen und festhalten. Das Nextaro® mit dem Blister fassen und den Dorn des blauen Adapters senkrecht durch das Zentrum des Stopfens der Lösungsmittelflasche (LM) stechen, bis es einrastet (Abb. 1). Beim Einstechen nicht drehen! Die Verpackung vom Nextaro® entfernen, indem man die Lösungsmittelflasche (LM) festhält und den Blister senkrecht nach oben abzieht. Dabei ist darauf zu achten, dass nicht das Nextaro® entfernt wird (Abb. 2).

4.Die Konzentratflasche (P) auf eine ebene Fläche stellen und festhalten. Die Lösungsmittelflasche (LM) mit dem Nextaro® umdrehen und senkrecht mit dem weissen Ende des Nextaro®-Adapters auf die Konzentratflasche (P) aufsetzen und nach unten drücken, bis es einrastet (Abb. 3). Beim Verbinden nicht drehen! Das Lösungsmittel fliesst automatisch in die Konzentratflasche.
5.Während beide Flaschen noch verbunden sind, die Konzentratflasche leicht schwenken (nicht schütteln) bis das Pulver gelöst ist. Octaplex löst sich bei Raumtemperatur schnell zu einer farblosen bis leicht blauen Lösung. Die Lösungsmittelflasche zusammen mit dem blauen Nextaro®-Adapter von der Konzentratflasche abdrehen (Abb. 4). Die Lösungsmittelflasche mit dem blauen Teil des Nextaro®-Adapters verwerfen.


Die gebrauchsfertigen Lösungen sollten vor der Verabreichung visuell kontrolliert werden. Wenn sich das Konzentrat nicht vollständig auflöst oder sich Aggregate gebildet haben, darf die Lösung nicht verwendet werden.
Anweisungen für die Infusion:
Als Vorsichtsmassnahme sollte die Herzfrequenz des Patienten vor und während der Infusion kontrolliert werden. Wenn ein deutlicher Anstieg der Herzfrequenz erfolgt, muss die Infusionsgeschwindigkeit verringert oder die Verabreichung unterbrochen werden.
1.Nachdem das Konzentrat auf die vorstehend beschriebene Art und Weise zubereitet worden ist, eine Einmalspritze mit dem Luer-Lock-Anschluss am weißen Teil des Nextaro®-Adapters der Konzentratflasche verbinden. Die Flasche samt Einmalspritze umdrehen und das aufgelöste Arzneimittel in die Spritze aufziehen.Nachdem die Lösung in die Spritze überführt wurde, den Spritzenkolben fassen und die Spritze vom Nextaro®-Adapter der Konzentratflasche entfernen. Dabei den Spritzenkolben weiter nach unten halten. Verwerfen Sie die leere Konzentratflasche mit dem Nextaro®-Adapter.
2.Vorgesehene Infusionsstelle auf geeignete Weise desinfizieren.
3.Die Lösung intravenös mit langsamer Geschwindigkeit (zu Beginn 1 ml/Minute, nicht mehr als 2-3 ml pro Minute) injizieren.
Es ist darauf zu achten, dass kein Blut in die gefüllte Spritze gelangt, da die Gefahr besteht, dass es dort gerinnt und dadurch Fibringerinnsel injiziert werden. Das Nextaro® ist nur zum einmaligen Gebrauch bestimmt.
Nicht verwendete Produkte oder Abfallmaterialien sind entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer57918 (Swissmedic)
Packungen1 Packung Octaplex 500 enthält:
1 Durchstechflasche mit Pulver
1 Durchstechflasche mit 20 ml Wasser für Injektionszwecke
1 Transfer-Set Nextaro®.
(B)
1 Packung Octaplex 1000 enthält:
1 Durchstechflasche mit Pulver
1 Durchstechflasche mit 40 ml Wasser für Injektionszwecke
1 Transfer-Set Nextaro®
(B)
ZulassungsinhaberinOctapharma AG
Seidenstrasse 2
CH-8853 Lachen
Stand der InformationNovember 2021
| 



