ZusammensetzungWirkstoffe
Humalog, 100 I.E./ml
Insulinum Lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*).
Humalog Mix 25, 100 I.E./ml
Insulinum Lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*),
Insulinum solutum, Insulinum isophanum.
Humalog Mix 50, 100 I.E./ml
Insulinum Lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*),
Insulinum solutum, Insulinum isophanum.
Humalog, 200 I.E./ml
Insulinum Lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*).
* Insulin Lispro ist ein Insulin-Analogon, das mittels gentechnologischer Methoden unter Verwendung von Escherichia coli gewonnen wird.
Hilfsstoffe
Humalog, 100 I.E./ml
Glycerolum, Zinci oxidum, Dinatrii phosphas heptahydricus, Metacresolum, Natrii hydroxidum, Acidum hydrochloridum, Aqua ad iniectabile q.s. ad solutionem pro 1 ml.
Gesamt-Natriumgehalt: 0,5 mg/ml
Humalog Mix 25, 100 I.E./ml
Protamini sulfas, Glycerolum, Zinci oxidum, Dinatrii phosphas heptahydricus,Metacresolum, Phenolum, Natrii hydroxidum, Acidum hydrochloridum, Aqua ad iniectabile q.s. ad suspensionem pro 1 ml.
Gesamt-Natriumgehalt: 0,8 mg/ml
Humalog Mix 50, 100 I.E./ml
Protamini sulfas, Glycerolum, Zinci oxidum, Dinatrii phosphas heptahydricus, Metacresolum, Phenolum, Natrii hydroxidum, Acidum hydrochloridum, Aqua ad iniectabile q.s. ad suspensionem pro 1 ml.
Gesamt-Natriumgehalt: 0,8 mg/ml
Humalog, 200 I.E./ml
Glycerolum, Zinci oxidum, Trometamolum, Metacresolum, Natrii hydroxidum, Acidum hydrochloridum, Aqua ad iniectabile q.s. ad solutionem pro 1 ml.
Gesamt-Natriumgehalt: 0,2 mg/ml
Indikationen/AnwendungsmöglichkeitenZur Behandlung von Erwachsenen und Kindern mit insulinpflichtigem Diabetes mellitus. Humalog ist ebenfalls angezeigt bei der Ersteinstellung des Diabetes mellitus.
Dosierung/AnwendungDie Dosierung wird vom behandelnden Arzt bzw. Ärztin je nach Stoffwechsellage des Patienten festgesetzt.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Übliche Dosierung
Humalog ist ein kurz wirksames Insulin, das in Kombination mit einem länger wirkenden Humaninsulin verwendet werden kann.
Humalog 100 I.E./ml oder 200 I.E./ml, Humalog 100 I.E./ml Mix 25 oder Humalog 100 I.E./ml Mix 50 können kurz vor der Mahlzeit verabreicht werden. Falls nötig können die Präparate auch unmittelbar nach der Mahlzeit verabreicht werden.
Humalog 100 I.E./ml oder 200 I.E./ml, Humalog 100 I.E./ml Mix 25 oder Humalog 100 I.E./ml Mix 50 sollten nur subkutan verabreicht werden. Humalog 100 I.E./ml Mix 25 und Humalog 100 I.E./ml Mix 50 dürfen nicht intravenös appliziert werden.
Falls notwendig, kann Humalog 100 I.E./ml auch intravenös verabreicht werden. Humalog 200 I.E./ml KwikPen Injektionslösung darf nicht intravenös verabreicht werden.
Auf ärztliche Empfehlung können Humalog 100 I.E./ml und Humalog 200 I.E./ml in Kombination mit Huminsulin Basal verabreicht werden.
Mit Humalog 100 I.E./ml KwikPen, Humalog 100 I.E./ml Mix 25 KwikPen, Humalog 100 I.E./ml Mix 50 KwikPen und Humalog 200 I.E./ml KwikPen können Dosierungen von 1 bis 60 Einheiten in 1er-Schritten (1 Einheit pro Schritt) eingestellt werden.
Mit Humalog 100 I.E./ml Junior KwikPen können Dosierungen von 0.5 bis 30 Einheiten in Schritten von 0,5 Einheiten eingestellt werden.
Humalog 200 I.E./ml KwikPen ist für die Behandlung von Patienten mit Diabetes vorgesehen, die täglich mehr als 20 Einheiten schnell wirksames Insulin benötigen. Die Insulin Lispro Lösung mit 200 I.E./ml darf nicht aus dem Fertigpen (dem KwikPen) entnommen werden oder mit anderen Insulinen gemischt werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Sonstige Hinweise»).
Umstellung von einem Insulin auf andere Insuline
Bei jeder Umstellung auf ein anderes Insulin- bzw. Humaninsulin-Präparat ist Vorsicht angebracht; ein solcher Wechsel darf nur unter ärztlicher Kontrolle erfolgen. Änderungen hinsichtlich Stärke, Handelspräparat (Hersteller), Insulintyp (Normalinsulin, Basal, Long, etc.), Spezies (tierisches Insulin, Humaninsulin, Humaninsulin-Analogon) und/oder Herstellungsmethode (gentechnisch hergestelltes Insulin versus tierisches Insulin) kann dazu führen, dass die Dosierung verändert werden muss.
Kinder und Jugendliche
Bei Kindern und Jugendlichen sollte die Therapie durch einen pädiatrischen Diabetologen betreut werden. Insbesondere im frühen Lebensalter steht neben einer Senkung der postprandialen Blutzuckerspitzen eine Reduktion des Risikos hypoglykämischer Episoden im Vordergrund der Behandlung. Hier sind je nach Alter verschiedene Insulinkombinationen empfohlen. Bei Kindern sollten deshalb die Glukosespiegel in häufigen Intervallen (4 bis 6 mal pro Tag) bestimmt werden.
Art der Anwendung
Erstbehandelte Patienten sind sorgfältig in der Handhabung und Anwendung zu schulen (Mischempfehlungen, Hygiene, Wechsel der Injektionsstellen).
Humalog und Humalog Mix-Zubereitungen werden durch subkutane Injektion verabreicht. Humalog, aber nicht Humalog Mix, kann jedoch in Ausnahmefällen auch intramuskulär injiziert werden.
Subkutane Injektionen werden im Bereich der Oberarme, Hüften, des Gesässes oder des Abdomens vorgenommen. Bei jeder Injektion ist die Einstichstelle zu wechseln, so dass ein und dieselbe Stelle nicht häufiger als einmal pro Monat verwendet wird. Wie bei allen Insulinen muss die Injektionsstelle bei jeder Injektion innerhalb des gewählten Injektionsbereichs gewechselt werden, um das Risiko einer Lipodystrophie oder einer kutanen Amyloidose zu verringern.
Bei subkutaner Applikation muss darauf geachtet werden, dass Humalog, Humalog Mix 25 oder Humalog Mix 50 nicht direkt in die Blutbahn gelangt. Nach der Injektion darf die Injektionsstelle nicht massiert werden.
Humalog KwikPen (Fertigpen) steht in zwei Stärken zur Verfügung:
Humalog 100 I.E./ml KwikPen und Junior KwikPen
Humalog 200 I.E./ml KwikPen
Bei beiden Stärken wird die benötigte Dosis in Einheiten eingestellt. Die Dosisanzeige zeigt unabhängig von der Stärke stets die Anzahl der Einheiten, daher darf bei der Umstellung eines Patienten auf eine neue Stärke keine Dosisumrechnung vorgenommen werden.
Patienten müssen angewiesen werden, dass sie die Kennzeichnung ihres Insulins vor jeder Injektion überprüfen, um sicherzugehen, dass eine Verwechselung der zwei unterschiedlichen Humalog-Stärken genauso wie eine Verwechslung mit einem anderen Insulin-Präparat vermieden wird.
Die Insulin Lispro Injektionslösung mit 200 I.E./ml darf nicht aus der Fertigpen, dem KwikPen, in eine Spritze aufgezogen werden. Die Skalierung der Insulinspritze gibt die Dosis nicht korrekt wieder. Sonst kann es zu einer Überdosierung kommen, die zu einer schweren Hypoglykämie führen kann.
Anwendung von Humalog mittels einer Infusionspumpe
Humalog 100 I.E./ml, nicht aber Humalog 100 I.E./ml Mix 25 oder Humalog 100 I.E./ml Mix 50, kann zusätzlich im Rahmen einer kontinuierlichen subkutanen Infusionstherapie mittels einer Pumpe infundiert werden. Die Patienten sind anzuweisen, die Gebrauchsanweisungen der Pumpen-Hersteller genau zu befolgen.
Humalog 200 I.E./ml KwikPen Injektionslösung darf nicht mittels einer Insulin-Infusionspumpe verabreicht werden.
KontraindikationenHypoglykämie.
Insulinom.
Unter keinen Umständen sollten Humalog 100 I.E./ml Mix 25 oder Humalog 100 I.E./ml Mix 50 oder Humalog 200 I.E./ml KwikPen intravenös verabreicht werden.
Überempfindlichkeit gegenüber Insulin oder anderen Bestandteilen von Humalog.
Warnhinweise und VorsichtsmassnahmenEine schwere Insulinallergie vom Soforttyp muss eine völlige Neukonzeption der Diabetestherapie nach sich ziehen.
Bei spezies-spezifischer Überempfindlichkeit gegenüber Insulin ist die Verträglichkeit von Humaninsulin-Präparaten durch Hauttests (intrakutan) zu prüfen. Eine immunologische Kreuzreaktion zwischen Humaninsulin und tierischem Insulin ist möglich.
Hypoglykämie und Hypokaliämie gehören zu den potentiellen klinischen Nebenwirkungen, die mit der Anwendung aller Insuline assoziiert sind. Vorsicht ist geboten bei Patienten, für die dieses potentielle Risiko klinisch relevant sein könnte (z.B. Patienten die fasten, die eine autonome Neuropathie haben, die orale Antidiabetika anwenden oder die gleichzeitig Arzneimittel einnehmen, welche den Kaliumspiegel erniedrigen oder welche im Hinblick auf den Kaliumspiegel empfindlich sind).
Beim insulinbehandelten Diabetiker besteht grundsätzlich das Risiko leichter oder schwerer Hypoglykämien. Dies kann seine Aufmerksamkeit und insbesondere die Sicherheit beim Autofahren oder Bedienen von Maschinen beeinträchtigen. Dies besonders zu Beginn der Behandlung, bei Präparatewechsel, unregelmässigen Injektionen oder unregelmässiger Nahrungsaufnahme, sowie allgemein bei nicht optimaler Stoffwechseleinstellung, wo es zu starken Blutzuckerschwankungen vor allem Hypoglykämien kommen kann. Er muss hierauf aufmerksam gemacht werden, und auch darauf, dass Alkoholeinnahme die Gefährdung zusätzlich erhöht.
Ebenso ist bei früher durchgemachten schweren Hypoglykämien das Risiko grösser, dass sich solche wiederholen.
Um einer Hypoglykämie frühzeitig begegnen zu können, ist der Patient zu instruieren, immer Traubenzucker oder Würfelzucker, mit sich zu führen. Er soll auch seinen Diabetikerausweis mittragen.
Bestimmte Umstände wie lange Diabetes-Dauer, intensivierte Insulintherapie, diabetische Nervenerkrankung oder Medikation mit Beta-Blockern können die frühen Warnsymptome einer Hypoglykämie unterschiedlich oder weniger ausgeprägt erscheinen lassen.
Einige Patienten, bei denen nach Umstellung von tierischen auf Humaninsulin Hypoglykämien auftraten, berichteten, dass die Frühwarnsymptome weniger stark ausgeprägt waren als diejenigen, die unter dem vorher verwendeten Insulin auftraten, oder sich von diesen deutlich unterschieden. Unbehandelte hypoglykämische und hyperglykämische Reaktionen können zu Bewusstlosigkeit, Koma oder Tod führen (siehe auch «Unerwünschte Wirkungen»).
Die Anwendung ungenügender Dosierungen oder Abbrechen der Behandlung, besonders bei Insulin-abhängigen Diabetikern, kann zu Hyperglykämie und diabetischer Ketoacidose, und letztlich zum Tode führen.
Der Insulinbedarf kann bei bestehender Nierenschädigung vermindert sein. Der Insulinbedarf kann bei Patienten mit eingeschränkter Leberfunktion aufgrund einer reduzierten Fähigkeit zur Glukoneogenese und aufgrund eines geringeren Insulinabbaus vermindert sein, allerdings kann bei Patienten mit einer chronischen Leberfunktionsstörung eine erhöhte Insulinresistenz auch zu einem erhöhten Insulinbedarf führen.
Krankheiten oder seelische Störungen können den Insulinbedarf steigern.
Eine Anpassung der Insulindosis kann auch bei erhöhter körperlicher Belastung oder Diätfehlern erforderlich werden.
Körperliche Belastung unmittelbar nach einer Mahlzeit kann das Hypoglykämie-Risiko erhöhen. Eine Folge der pharmakodynamischen Eigenschaften schnell wirksamer Insulin-Analoga besteht darin, dass nach der Injektion im Vergleich zu Humaninsulin eine Hypoglykämie rascher auftreten kann.
Humalog sollte Kindern an Stelle von Normalinsulin nur dann verabreicht werden, wenn ein schneller Wirkungseintritt von Vorteil sein kann, beispielsweise bei der Wahl des passenden Injektionszeitpunkts im Zusammenhang mit einer Mahlzeit.
β-Blocker können die üblichen Hypoglykämie-Warnsymptome abschwächen bzw. maskieren.
Alkoholkonsum kann die Hypoglykämie-Gefahr erhöhen (Hemmung der hepatischen Glukoneogenese).
Marihuana-Konsum kann möglicherweise eine Verschlechterung der Glukosetoleranz bewirken.
(Andere illegale Substanzen wurden nicht getestet; andere Interaktionen siehe «Interaktionen»).
Humalog enthält Metacresol, das in seltenen Fällen allergische Reaktionen auslösen kann.
Kombination von Thiazolidindionen (TZD) mit Insulin:
Die Kombination von TZD mit Insulin ist mit einem erhöhten Risiko für Ödeme und Herzinsuffizienz verbunden, insbesondere bei Patienten mit vorbestehender Herzerkrankung.
Vermeidung von Anwendungsfehlern bei der Anwendung von Humalog 200 I.E./ml KwikPen (siehe auch «Dosierung/Anwendung»)
Die Insulin Lispro Injektionslösung mit 200 I.E./ml darf nicht aus der Fertigpen, dem KwikPen, in eine Spritze aufgezogen werden. Die Skalierung der Insulinspritze gibt die Dosis nicht korrekt wieder. Sonst kann es zu einer Überdosierung kommen, die zu einer schweren Hypoglykämie führen kann. Die Insulin Lispro Injektionslösung mit 200 I.E./ml darf nicht aus dem KwikPen in irgendein anderes Insulin-Injektionsgerät überführt werden, auch nicht in Insulin-Infusionspumpen.
Bei Umstellung der Therapie auf eine andere Darreichungsform und/oder ein anderes Arzneimittel mit gleichem Wirkstoff ist Vorsicht geboten. Der Patient sollte adäquat kontrolliert werden.
Patienten müssen angewiesen werden, die Einstichstelle kontinuierlich innerhalb des gegebenen Injektionsbereiches zu wechseln, um das Risiko zu verringern, eine Lipodystrophie oder eine kutane Amyloidose zu entwickeln. Injektionen in einen Bereich, der von Lipodystrophie oder kutaner Amyloidose betroffen ist, birgt die Gefahr einer verzögerten Insulinresorption. Ein plötzlicher Wechsel der Einstichstelle (in einen nicht betroffenen Bereich) kann zu einer Hypoglykämie führen.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosiereinheit, d.h. es ist nahezu «natriumfrei».
Interaktionen1. Der Insulinbedarf kann vermindert sein in Gegenwart von Substanzen, welche die Insulinwirkung verbessern (Insulinsensitivität erhöhen), die Insulinsekretion steigern, die hepatische Glukoneogenese hemmen oder die intestinale Glukoseaufnahme beeinflussen. Bei gleichbleibender Insulinmenge besteht somit erhöhte Hypoglykämie-Gefahr durch gleichzeitige Einnahme von:
oralen Antidiabetika; Alkohol; ACE-Hemmern (z.B. Captopril und Enalapril); Angiotensin II Rezeptorblocker; antiarrhythmischen Substanzen wie Disopyramid; α-Blockern und Clonidin; SSRI; Fenfluramine; MAO-Hemmern; trizyklischen Antidepressiva; Salicylaten und (selten) anderen NSAIDs; Fibraten; Tetracyclinen; Pentamidin (Hypoglykämie: gelegentlich mit nachfolgender Hyperglykämie); Anti-Malariamitteln (Chinin, Chloroquin, Mefloquin); Sulfonamiden (z.B. Cotrimoxazol); Cimetidin und Ranitidin.
2. Der Insulinbedarf kann erhöht sein bei gleichzeitiger Anwendung der folgenden Substanzen bzw. Substanzgruppen:
orale Kontrazeptiva und andere Östrogen- oder Progestagen-Präparate; Kortikosteroide und ACTH; GH (Somatotropin); Danazol; Schilddrüsenhormone; Sympathomimetika, (vor allem β2-Sympathomimetika, wie Ritodrin, Salbutamol, Terbutalin, aber auch α-selektive sowie nicht selektive Sympathomimetika, wie Epinephrin); Diazoxid; Nikotinsäure und –Derivate; Chlorpromazin (vor allem in hohen Dosen) und andere Phenothiazin-Derivate; Diuretika (z.B. Thiazid-Diuretika, Indapamid und Furosemid); anti-retrovirale Substanzen; immunsuppressive Substanzen (Ciclosporin, Tacrolimus, Sirolimus); atypische Antipsychotika.
3. Bei Anwendung der folgenden Substanzen kann die Insulinwirkung je nach Dosis verstärkt bzw.. abgeschwächt werden:
Octreotid-, Salicylsäure-Derivate, Lithium-Salze (selten).
β-Blocker können zu einer Verstärkung der Insulinresistenz, aber auch, in gewissen Fällen, zu einer Hypoglykämie führen. Ausserdem können die Hypoglykämie-Warnsymptome abgeschwächt bzw. maskiert werden.
Mischen von Humalog 100 I.E./ml Mix 25 oder Humalog 100 I.E./ml Mix 50 mit anderen Insulinen wurde nicht untersucht. Der Arzt bzw. die Ärztin sollte konsultiert werden, wenn andere Medikamente zusätzlich zu Humalog 100 I.E./ml oder 200 I.E./ml, Humalog 100 I.E./ml Mix 25 oder Humalog 100 I.E./ml Mix 50 verwendet werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Sonstige Hinweise, Inkompatibilitäten»).
Schwangerschaft, StillzeitSchwangerschaft
Tierexperimentelle Untersuchungen mit Insulin Lispro haben keine Hinweise auf teratogene Effekte ergeben. Daten über exponierte Schwangerschaften (retrospektive Studie von 533 Schwangerschaften sowie prospektives Follow-up von 192 Schwangerschaften) lassen nicht auf Nebenwirkungen von Humalog auf die Schwangerschaft oder die Gesundheit des Fetus / Neugeborenen schliessen. Bisher sind keine anderen einschlägigen epidemiologischen Daten verfügbar. Bei der Anwendung in der Schwangerschaft ist Vorsicht geboten.
Es ist unbedingt notwendig, dass eine mit Insulin behandelte Patientin (insulinabhängig oder mit Schwangerschaftsdiabetes) während der Schwangerschaft sehr genau überwacht wird. Patientinnen mit Diabetes sollten unbedingt ärztlichen Rat einholen, wenn eine Schwangerschaft geplant wird oder eingetreten ist. Eine genaue Blutzuckerkontrolle sowie ein allgemein guter Gesundheitszustand sind bei Schwangeren mit Diabetes besonders wichtig. Beim Neugeborenen müssen Blutzuckerwerte kontrolliert werden.
Erstes Trimenon
Der Insulinbedarf sinkt meistens während der ersten drei Schwangerschaftsmonate.
Zweites Trimenon
Der Insulinbedarf steigt ab dem vierten Schwangerschaftsmonat an.
Stillzeit
Während der Stillzeit kann eine neue Einstellung der Insulindosierung und der Diät oder beides notwendig sein.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEine Hypoglykämie kann die Konzentrations- und Reaktionsfähigkeit eines Patienten herabsetzen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z.B. beim Fahren eines Autos oder beim Bedienen von Maschinen), ein Risiko darstellen.
Dem Patienten sollte geraten werden, Vorsichtsmassnahmen zur Vermeidung von Hypoglykämien beim Führen von Kraftfahrzeugen zu treffen. Dieses ist bei Patienten mit häufigen Hypoglykämie-Episoden oder verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnsymptomen besonders wichtig. In diesen Fällen sollte überlegt werden, ob das Führen eines Kraftfahrzeugs überhaupt ratsam ist.
Unerwünschte WirkungenDie unerwünschten Wirkungen aus den klinischen Studien und aus Post-marketing Daten sind unten gemäss MedDRA System Organklassen,und nach absteigendem Schweregrad klassifiziert.
Häufigkeitseinteilung: Sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10000, <1/1000), sehr selten (<1/10000).
Erkrankungen des Immunsystems
Generalisierte, systemische Allergien gegen Insulin.
Diese können einen Hautausschlag am ganzen Körper (Urtikaria), Kurzatmigkeit (Dyspnoe), Röcheln, einen Blutdruckabfall (arterielle Hypotonie), einen beschleunigten Puls (Tachycardie) oder Schwitzen hervorrufen. In schweren Fällen können generalisierte Allergien lebensbedrohlich sein.
Stoffwechsel und Ernährungsstörungen
Hypoglykämie, Hyperglykämie.
Augenerkrankungen
Veränderung der Sehschärfe.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich kommt es bei den Patienten zu lokalen allergischen Reaktionen wie Rötung, Schwellung und Juckreiz am Injektionsort.
Funktionsstörungen der Haut und des Unterhautzellgewebes
Unbekannt: kutane Amyloidose.
Bei Beginn der Insulintherapie wurde über Ödeme berichtet, insbesondere dann, wenn eine vorherige unzureichende Stoffwechselkontrolle durch eine Intensivierung der Insulintherapie verbessert wurde. Diese sind transitorisch und gehen im weiteren Behandlungsverlauf meist von selbst zurück.
An der Injektionsstelle kann es vereinzelt zu Fettgewebsschwund oder zunahme (Lipodystrophie) kommen. Durch ständigen Wechsel der Injektionstelle können diese Erscheinungen vermindert oder ganz vermieden werden.
Der Patient ist darüber aufzuklären, bei welchen Symptomen er unbedingt sofort seinen Arzt bzw. seine Ärztin verständigen muss, etwa bei starken Rötungen, die mit Juckreiz und Quaddelbildung einhergehen und sich schnell über die Injektionsstelle hinaus ausdehnen.
In manchen Fällen können die lokalen allergischen Reaktionen auf andere Ursachen als auf das Insulin zurückzuführen sein, beispielsweise auf irritierende Bestandteile des Hautdesinfektionsmittels oder auf eine schlechte Injektionstechnik.
Beschreibung ausgewählter Nebenwirkungen
Hypoglykämie
Die Hypoglykämie (Blutzuckerabfall < 2-3 mmol/l) ist die häufigste unerwünschte Wirkung, welche bei einem Diabetiker auftreten kann. Anzeichen dafür sind:
a) Neurovegetative Zeichen: Schwitzen, Hungergefühl, Zittern, Blässe, Herzklopfen, Kopfschmerzen.
b) Neuroglykopenische Zeichen: Konzentrationsstörungen, Verhaltensauffälligkeiten (Unruhe, Reizbarkeit, Aggressivität, Verwirrtheit, usw.), Bewusstseinsstörungen, Koordinations-, Seh- und Sprachstörungen. Diese können über Benommenheit und Somnolenz bis Bewusstlosigkeit zum Koma fortschreiten. Die Hypoglykämie kann auch zu epileptischen Anfällen führen, oder als zerebraler Insult, z.B. mit (meist vorübergehender) Hemiparese, Aphasie, positivem Babinskizeichen, imponieren.
c) Abgeschwächte/veränderte Warnsymptome: besonders bei Einstellung auf tiefe Blutzuckerwerte (z.B. bei Mehrfachinjektionen nach dem Basis-Bolus-Prinzip), aber auch bei lang bestehendem Diabetes (unter anderem mit Neuropathie), bei Präparatwechsel, können die Warnsymptome der Hypoglykämie verändert und die neurovegetativen Symptome abgeschwächt sein oder erst spät auftreten. Dies wurde von einigen Patienten auch nach Umstellung von tierischem auf humanes Insulin, aber auch sonst gelegentlich bei Präparatwechsel, beobachtet.
Der insulinbehandelte Diabetiker und seine Umgebung sind deshalb zu instruieren, dass sich eine Hypoglykämie auch überraschend und als erstes durch neuroglykopenische Zeichen wie Konzentrationsstörungen, Unruhe, Verhaltensauffälligkeiten und Bewusstseinsstörungen anzeigen kann, so dass er eventuell nicht früh genug mit Einnahme von Zucker reagiert.
Die Umstellung auf ein anderes Insulinpräparat soll nur unter sorgfältiger ärztlicher Kontrolle und nach genauer Instruktion erfolgen. Auch Dosis und Zeitpunkt der Injektion sollen nur nach Absprache mit dem Arzt bzw. der Ärztin oder auf seine bzw. ihre Anweisung geändert werden.
Als Ursachen einer Hypoglykämie kommen in Frage: Auslassen einer Mahlzeit, Erbrechen, Durchfall, aussergewöhnliche körperliche Anstrengung, Insulinüberdosierung, endokrine Krankheiten wie Nebennierenrindeninsuffizienz, Hypothyreose, usw.
Alkoholgenuss kann eine Hypoglykämie verstärken (siehe «Interaktionen»).
Therapie der Hypoglykämie: siehe «Überdosierung».
Nach jeder schweren Hypoglykämie ist die Diabeteseinstellung zu überprüfen; der Patient ist anzuweisen, den Arzt bzw. die Ärztin über jede durchgemachte schwere Hypoglykämie zu orientieren.
Dem Patienten ist zu empfehlen, seine nähere Umgebung (Freunde, Arbeitskollegen) über seine Zuckerkrankheit zu informieren sowie über die entsprechenden Verhaltensregeln; unter anderem auch wie man Glukagon subkutan injiziert.
Hyperglykämie
Ein diabetisches Koma kann die Folge von überhöhtem Blutzucker sein. Als Ursache kommen in Frage: Auslassen oder Verringern von Insulininjektionen oder erhöhter Insulinbedarf wegen Infektionen oder anderen Krankheiten.
Das diabetische Koma entwickelt sich langsam über Stunden und Tage. Erste Anzeichen sind Durst, grosse Urinmengen, Appetitlosigkeit, Müdigkeit, trockene Haut, schnelle und tiefe Atmung sowie hohe Glucose- und Acetonwerte im Urin. Auch in diesen Fällen ist der Patient zu instruieren, den Arzt bzw. die Ärztin sofort zu kontaktieren.
Erkrankungen der Haut und des Unterhautzellgewebes
Wie bei jeder Insulintherapie kann es an der Injektionsstelle zu einer Lipodystrophie und kutaner Amyloidose kommen, die die Insulinresorption im betroffenen Bereich verzögert. Ein ständiger Wechsel der Einstichstelle im gegebenen Injektionsbereich kann helfen, diese Reaktionen abzuschwächen oder zu vermeiden (siehe auch Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungBehandlung
Behandlung der Hypoglykämie: sofort Traubenzucker oder Würfelzucker (mindestens 2-4 Stück) einnehmen, eventuell zwischen Wange und Zahnreihe legen, oder Einnahme kohlenhydratreicher Nahrung. Beim Bewusstlosen 20 g Glucose i.v. (z.B. 40 ml Glucose 50%) gefolgt von Glucose-Infusion (z.B. 1 l Glucose 5% während einer halben bis mehreren Stunden) unter Blutzuckerkontrolle. Eventuell Glucagon 0,5 - 1 mg s.c. oder i.v. (setzt intakte Leberglykogenreserven voraus), gefolgt von Glucosezufuhr.
Bei jeder unklaren Bewusstlosigkeit soll sofort eine Blutzuckerbestimmung erfolgen.
Es kann notwendig sein, Kohlenhydrat-Aufnahme und Beobachtung fortzuführen, da eine Hypoglykämie nach nur scheinbarer Genesung nochmals auftreten kann.
Eigenschaften/WirkungenATC-Code
A10AB04 (Humalog 100 I.E./ml und Humalog 200 I.E./ml) und A10AD04 (Humalog 100 I.E./ml Mix 25 und Humalog 100 I.E./ml Mix 50)
Wirkungsmechanismus
Humalog enthält ein gentechnologisch hergestelltes humanes Insulin-Analog, das Insulin Lispro. Im Vergleich zum menschlichen, körpereigenen Insulin ist in der B-Kette die Reihenfolge zweier Aminosäuren (Humaninsulin hat die Sequenz Pro (B28), Lys (B29), Insulin Lispro hat die Sequenz Lys (B28), Pro (B29)) vertauscht. Dadurch weist Humalog eine im Vergleich zu den herkömmlichen Insulinen leicht veränderte Kinetik auf; pharmakodynamische Wirkung und Wirkungsweise werden durch diese Aminosäure-Umkehr nicht verändert.
Die Hauptwirkung von Insulin Lispro ist die Regulierung des Glukosestoffwechsels.
Ausserdem haben Insuline zahlreiche anabole und anti-katabole Wirkungen in zahlreichen verschiedenen Geweben. Im Muskelgewebe bedeutet dies eine Steigerung der Glykogen-, Fettsäure-, Glycerol- und Proteinsynthese und der Aminosäureaufnahme; gleichzeitig werden die Glykogenolyse, die Glukoneogenese, die Ketogenese, die Lipolyse, der Proteinkatabolismus und der Aminosäuretransport aus der Zelle vermindert.
Insulin Lispro hat einen raschen Wirkungseintritt (ca. 15 Minuten), was eine zeitlich nähere Applikation in Bezug auf die Mahlzeit erlaubt (innerhalb von 15 Minuten vor oder nach der Mahlzeit) als bei Normalinsulin (30 - 45 Minuten vor der Mahlzeit).
Im Vergleich zu Normalinsulin tritt die Wirkung von Insulin Lispro schneller ein und hält kürzer an (Wirkdauer 2 -5 Stunden).
(Wirkungsverlauf zu Humalog 100 I.E./ml Mix 25 und Humalog 100 I.E./ml Mix 50, siehe weiter unten.)
Bei Typ 1- und bei Typ 2-Diabetikern konnte in klinischen Untersuchungen mit Insulin Lispro im Vergleich zu Normalinsulin eine reduzierte postprandiale Hyperglykämie nachgewiesen werden. Für schnell-wirksame Insuline muss jeder Patient, der auch ein Insulin Basal nimmt, die Dosierung für beide Insuline optimieren, um eine verbesserte Glucosekontrolle über den ganzen Tag zu erreichen.
Bei Typ 1- und bei Typ 2-Diabetikern konnte in klinischen Untersuchungen mit Humalog 100 I.E./ml Mix 25 im Vergleich zu Humaninsulin 30/70 Mischungen eine reduzierte postprandiale Hyperglykämie nachgewiesen werden.
Der Wirkungsverlauf von Insulin Lispro kann bei verschiedenen Individuen und zu verschiedenen Zeitpunkten bei denselben Individuen unterschiedlich sein und hängt von der Injektionsstelle, der Durchblutung, der Temperatur und der körperlichen Aktivität ab. Der typische Wirkungsverlauf nach einer subkutanen Injektion ist in der folgenden Graphik dargestellt:
Abbildung 1
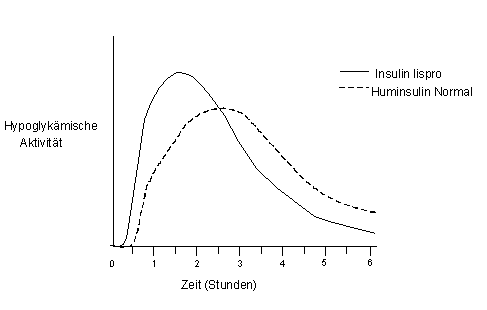
Die obige Graphik (Abbildung 1) zeigt die relative Glukosemenge, die notwendig ist, um den Blutglukosespiegel des Probanden nahe den Nüchternwerten zu halten, aufgetragen gegen die Zeit. Sie ist ein Mass für die Wirkung dieser Insuline (100 I.E./ml) auf den Glukosestoffwechsel über einen bestimmten Zeitraum.
In klinischen Studien wurde die Behandlung von Kindern (61 Patienten zwischen 2 und 11 Jahren) sowie Kindern und Jugendlichen (481 Patienten zwischen 9 und 19 Jahren) untersucht, wobei Insulin Lispro mit Normalinsulin verglichen wurde. Das pharmakodynamische Profil von Insulin Lispro bei Kindern ist ähnlich dem bei Erwachsenen beobachteten.
Für die Anwendung von Insulin Lispro im Rahmen einer subkutanen Pumpentherapie wurde gezeigt, dass - verglichen mit Normalinsulin - niedrigere Spiegel an glykosyliertem Hämoglobin erhalten werden. In einer doppelblinden cross-over Studie reduzierte Insulin Lispro nach 12-wöchiger Gabe den Spiegel an glykosyliertem Hämoglobin um 0,37 Prozentpunkte im Vergleich zu 0,03 Prozentpunkten bei Normalinsulin-Gabe (p = 0,004).
Studien haben gezeigt, dass bei Typ 2 Diabetikern, die mit Höchstdosen eines Sulfonylharnstoff-Präparates behandelt werden, durch zusätzliche Anwendung von Insulin Lispro der HbA1c Wert signifikant reduziert wird, verglichen mit der alleinigen Gabe des Sulfonylharnstoff-Präparates. Die Reduzierung des HbA1c Werts ist auch bei der Verwendung anderer Insulinprodukte wie lösliche oder Isophan-Insuline zu erwarten.
Klinische Studien mit Typ 1 und Typ 2 Diabetikern zeigten eine kleinere Anzahl nächtlicher Hypoglykämien unter Insulin Lispro verglichen mit Insulin human. In einigen Studien war die Reduktion der nächtlichen Hypoglykämien assoziiert mit vermehrten Episoden während des Tages.
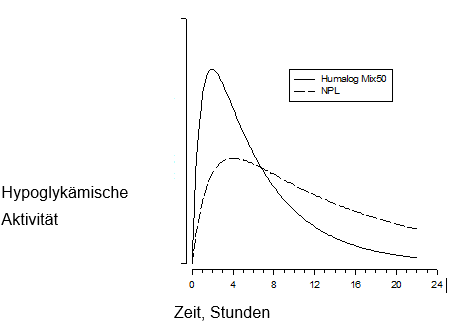
Wirkungsverlauf zu Humalog 100 I.E./ml Mix 25 und Humalog 100 I.E./ml Mix 50:
Nach subkutaner Verabreichung von Humalog 100 I.E./ml Mix 25 oder Humalog 100 I.E./ml Mix 50 wird auch ein rascher Wirkeintritt und ein frühes Wirkungsmaximum von Insulin Lispro beobachtet. I. Lisprum PS/Insulin Lispro-Protaminsuspension (NPL) weist ein Wirkprofil auf, das dem von Insulin Basal (NPH) über einen Zeitraum von ca. 15 Stunden weitgehend ähnlich ist.
In den untenstehenden Figuren ist die Pharmakodynamik von Humalog 100 I.E./ml Mix 25 und NPL:

und Humalog 100 I.E./ml Mix 50 und NPL illustriert.
Die glucodynamische Reaktion auf Insulin Lispro wird von einer Nieren- oder Leberfunktionsstörung nicht beeinflusst. Glucodynamische Unterschiede zwischen Insulin Lispro und löslichem Humaninsulin, wie sie während eines ”Glucose clamp” gemessen wurden, bleiben über einen weiten Nierenfunktionsbereich bestehen.
Es wurde nachgewiesen, dass Insulin Lispro auf molarer Basis äquipotent zu Humaninsulin ist, dass es aber einen rascheren Wirkungseintritt und eine kürzere Wirkungsdauer besitzt.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
Nicht zutreffend.
PharmakokinetikAbsorption
Die Pharmakokinetik von Insulin Lispro weist auf eine Substanz hin, die sehr schnell resorbiert wird und Plasmaspitzenspiegel innerhalb von 30 - 70 Minuten nach der subkutanen Injektion erzielt. Wenn man die klinische Relevanz dieser Kinetik bedenkt, ist es wohl eher angebracht, die Glukoseutilisationskurve zu studieren (in «Eigenschaften/Wirkungen» diskutiert).
Humalog 200 I.E./ml KwikPen
Insulin Lispro 200 I.E./ml Injektionslösung war bioäquivalent zu Insulin Lispro 100 I.E./ml Injektionslösung bei einmaliger subkutaner Verabreichung einer Dosis mit 20 Einheiten bei gesunden Probanden. Die Zeit bis zum Erreichen der Maximalkonzentration war bei beiden Formulierungen ebenfalls ähnlich.
Humalog 100 I.E./ml Mix 25 und Humalog 100 I.E./ml Mix 50 sind vorgemischte Suspensionen bestehend aus Insulin Lispro (schnellwirksames Humaninsulin-Analog) und Insulin Lispro Protamin-Suspension (mittelschnell wirksames Insulin-Analog).
Der schnelle Wirkungseintritt und das frühe Wirkungsmaximum von Insulin Lispro wird auch nach s.c. Applikation von Humalog 100 I.E./ml Mix 25 und Humalog 100 I.E./ml Mix 50 beobachtet.
Die Pharmakokinetik von Insulin Lispro Protamin Suspension ist vergleichbar mit der eines mittelschnell wirksamen Insulins wie z.B. Basal (NPH). Die Pharmakokinetik von Humalog 100 I.E./ml Mix 25 und Humalog 100 I.E./ml Mix 50 entspricht den pharmakokinetischen Eigenschaften der beiden Einzelkomponenten.
Der zeitliche Wirkungsverlauf jedes Insulins kann in verschiedenen Patienten oder zu verschiedenen Zeiten im selben Patienten erheblich variieren.
Für alle Insuline hängen Wirkungseintritt und Wirkungsdauer vom Injektionsort, Blutversorgung, Temperatur und körperlicher Aktivität, von der verabreichten Dosis und auch von der gewählten Bestimmungsmethode ab. Basierend auf einer klinisch relevanten Dosis von 0.3 U/kg wurden für Humalog 100 I.E./ml Mix 25 und Humalog 100 I.E./ml Mix 50 folgende durchschnittlichen Werte ermittelt:
|
Formulierung
|
Wirkungseintritt
nach Std. ca.
|
Wirkungsdauer
Std. ca.
|
Wirkungsmaximum
Std. ca.
| |
Humalog Mix 25
|
0.25 - 0.75
|
8 – 24
|
2.25 - 3.5
| |
Humalog Mix 50
|
0.25 - 0.5
|
7 – 16
|
1.75 - 2.75
|
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Leberfunktionsstörungen
Die schnellere Absorption und Elimination von Insulin Lispro im Vergleich zu löslichem Humaninsulin bleibt bei Patienten mit Leberfunktionsstörung unverändert.
Nierenfunktionsstörungen
Die schnellere Absorption von Insulin Lispro im Vergleich zu löslichem Humaninsulin bleibt bei Patienten mit Nierenfunktionsstörung unverändert. Im Regelfall bleiben bei Patienten mit Typ 2 Diabetes über einen weiten Nierenfunktionsbereich die pharmakokinetischen Unterschiede zwischen Insulin Lispro und löslichem Insulin bestehen und zeigen sich unabhängig der Nierenfunktion.
Präklinische DatenIn in-vitro Studien waren die Wirkungen von Insulin Lispro denen von Humaninsulin sehr ähnlich, einschliesslich der Bindung an Insulinrezeptoren und der Wirkung auf wachsende Zellen. Studien belegen ebenfalls, dass die Dissoziation vom Insulinrezeptor für Insulin Lispro und Humaninsulin äquivalent ist. In Studien zur akuten Toxizität über einen Zeitraum von einem und zwölf Monaten wurden keine nennenswerten toxikologischen Befunde erhoben.
Mutagenität
Tierexperimentelle Studien bei Ratten und Kaninchen haben keine Hinweise auf Effekte bezüglich Teratogenität ergeben.
Reproduktionstoxizität
Tierexperimentelle Studien bei Ratten und Kaninchen haben keine Hinweise auf Effekte bezüglich Fertilität ergeben.
Sonstige HinweiseDer Patient muss darauf hingewiesen werden, bei unvorhergesehenem Arztwechsel (Unfall oder Erkrankung auf Reisen) den behandelnden Arzt bzw. Ärztin auf die Zuckerkrankheit hinzuweisen.
Inkompatibilitäten
Humalog 100 I.E./ml darf weder mit Insulinen tierischen Ursprungs noch mit Insulinpräparaten anderer Hersteller gemischt werden.
Humalog 200 I.E./ml KwikPen darf nicht mit anderen Insulinen oder anderen Arzneimitteln gemischt werden. Humalog 200 I.E./ml KwikPen darf nicht verdünnt werden.
Mischen von Humalog 100 I.E./ml Mix 25 oder Humalog 100 I.E./ml Mix 50 mit anderen Insulinen wurde nicht untersucht. Ohne Kompatibilitätsstudien dürfen diese Arzneimittel nicht mit einem anderen Arzneimittel gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach Anbruch, d.h. nach Öffnen der Durchstechflasche, nach Einsetzen der Humalog-Patrone in den Pen und nach Anbruch des Fertigpens (Humalog KwikPen) maximal 4 Wochen (28 Tage) bei Raumtemperatur (15-25°C) aufbewahren. Direkte Sonneneinstrahlung vermeiden.
Danach soll die Zubereitung nicht mehr verwendet werden, auch dann nicht, wenn noch Insulin (Humalog) enthalten ist.
Besondere Lagerungshinweise
Vor starker Hitze und Sonnenlicht schützen.
Im Kühlschrank (2-8°C) lagern.
Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Zur Vermeidung einer möglichen Übertragung von Krankheiten darf jeder KwikPen oder Patrone nur von einer einzigen Person benutzt werden, auch wenn die Nadel gewechselt wird.
Wenn Humalog 100 I.E./ml mit anderen Insulinen kombiniert wird, muss das kürzer wirksame Humalog zuerst in die Spritze aufgezogen werden, um zu verhindern, dass das Fläschchen durch das länger wirksame Insulin kontaminiert wird. Die beiden Insuline dürfen erst unmittelbar vor der Injektion vermischt werden.
Durchstechflaschen
Präparate mit 100 I.E./ml dürfen nur mit Spritzen für 100 I.E./ml verwendet werden.
Patronen
Humalog 100 I.E./ml, Humalog 100 I.E./ml Mix 25 und Humalog 100 I.E./ml Mix 50-Patronen sollten nur mit einem geeigneten Lilly Pen verwendet werden. Vor der Anwendung soll sichergestellt werden, dass in der beigepackten Bedienungsanleitung des Pens Humalog oder Lilly Patronen erwähnt werden. Die Gebrauchsanleitung für den Pen ist genau zu verfolgen. Die Patronen können nach dem Aufbrauchen nicht wieder gefüllt werden.
Humalog KwikPen
Die Gebrauchsanleitung für den Humalog KwikPen ist genau zu befolgen.
Die Fertigpens Humalog KwikPen können nach dem Aufbrauchen nicht nachgefüllt werden, sondern werden verworfen oder dem Recycling zugeführt.
Humalog 100 I.E./ml Mix 25 und Humalog 100 I.E./ml Mix 50:
Patronen oder Fertigpens (Humalog KwikPen), welche Humalog 100 I.E./ml Mix 25 oder Humalog 100 I.E./ml Mix 50 enthalten, sollten unmittelbar vor Gebrauch 10x zwischen den Handflächen gerollt und dann 10x gekippt (180°-Winkel) werden, um das Insulin wieder zu suspendieren, bis es einheitlich wolkig oder milchig erscheint. Falls nicht ist das genannte Prozedere zu wiederholen bis der Inhalt gemischt ist. Nicht stark schütteln, da dies Schaumbildung bewirken und damit die korrekte Dosierung stören kann.
Die Patronen sollten vor Gebrauch überprüft werden und sollten nicht verwendet werden, falls Klumpen vorhanden sind oder falls weisse Partikel auf Patronenboden oder -wand kleben, welche einen «gefrorenen» Eindruck machen.
Humalog 100 I.E./ml Mix 25- oder Humalog 100 I.E./ml Mix 50-Patronen sind nicht vorgesehen, um mit irgendeinem anderen Insulin in der Patrone gemischt zu werden.
Zulassungsnummer53290, 53553, 54762, 54763, 59354, 59355, 59356 (Swissmedic).
PackungenHumalog Injektionslösung zu 100 I.E./ml:
Durchstechflasche zu 10 ml: 1 (B)
Patronen (3,0 ml) für 3,0 ml Pen: 5 (B)
Humalog KwikPen (3,0 ml): 5 (B)
Humalog Junior KwikPen (3,0 ml): 5 (B)
Humalog Injektionslösung zu 200 I.E./ml:
Humalog KwikPen (3,0 ml): 5 (B)
Humalog Mix 25 Suspension zu 100 I.E./ml:
Patronen (3,0 ml) für 3,0 ml Pen: 5 (B)
Humalog KwikPen (3,0 ml): 5 (B)
Humalog Mix 50 Suspension zu 100 I.E./ml:
Patronen (3,0 ml) für 3,0 ml Pen: 5 (B)
Humalog KwikPen (3,0 ml): 5 (B)
ZulassungsinhaberinEli Lilly (Suisse) SA Vernier/Genève.
Stand der InformationFebruar 2022
|



