ZusammensetzungWirkstoffe
Somatropinum humanum (gentechnologisch in E.coli-Bakterien hergestellt).
Hilfsstoffe
Mannitolum, Histidinum, Poloxamerum 188, Phenolum, Natrii hydroxidum (zur pH-Einstellung) / Acidum hydrochloridum (zur pH-Einstellung), Aqua ad iniectabilia.
Das Arzneimittel enthält 0.002 mmol Natrium pro Fertigpen.
Indikationen/AnwendungsmöglichkeitenKinder
Hypophysärer Minderwuchs.
Turner-Syndrom.
Noonan-Syndrom.
Wachstumsstörungen bei Kindern infolge chronischer Niereninsuffizienz.
Wachstumsstörungen bei Kindern mit intrauterinem Kleinwuchs (SGA= Small for Gestational Age), die den Wachstumsrückstand bis zum Ende des dritten Lebensjahres oder später nicht aufgeholt haben.
In Kombination mit einer hypokalorischen Diät zur Verbesserung des Wachstums und der Körperzusammensetzung bei Kindern mit Prader-Willi-Syndrom (PWS), welches durch entsprechende genetische Tests bestätigt ist.
Erwachsene
Beginn des Wachstumshormonmangels in der Kindheit
Patienten mit Beginn des Wachstumshormonmangels in der Kindheit sollten nach Abschluss des Längenwachstums erneut auf die Fähigkeit zur Ausschüttung von Wachstumshormon untersucht werden.
Die Untersuchung ist nicht erforderlich bei Patienten mit mehr als drei defizitären Hypophysenhormonen sowie bei solchen mit schwerem Wachstumshormonmangel aufgrund einer definierten genetischen Ursache, struktureller hypothalamisch-hypophysärer Abnormalitäten, Tumoren des zentralen Nervensystems oder einer hoch dosierten kranialen Bestrahlung oder aufgrund eines Wachstumshormonmangels infolge einer hypophysären oder hypothalamischen Erkrankung oder eines hypophysären oder hypothalamischen Insultes, falls die Messung des IGF-I (Insulin-like Growth Factor-I) nach einer mindestens 4-wöchigen Pause der Wachstumshormon-Behandlung <–2 SDS beträgt.
Bei allen anderen Patienten sind eine IGF-I-Bestimmung sowie ein Wachstumshormon-Stimulationstest erforderlich.
Beginn des Wachstumshormonmangels im Erwachsenenalter
Ausgeprägter Wachstumshormonmangel bei Patienten mit bekannter hypothalamisch-hypophysärer Erkrankung oder infolge einer kranialen Bestrahlung oder eines Gehirntraumas. Eine weitere Hypothalamus-Hypophysenachse ausser Prolaktin muss betroffen sein. Der Mangel muss durch einen Stimulationstest nachgewiesen sein. Eine angemessene Substitutionstherapie der anderen betroffenen Hormonachsen sollte zuvor eingeleitet worden sein.
Bei Erwachsenen ist der Insulintoleranztest der gebräuchlichste diagnostische Test. Sollte der Insulintoleranztest kontraindiziert sein, müssen andere Stimulationstests eingesetzt werden. Der kombinierte Arginin-Wachstumshormon-Releasinghormon-Test wird empfohlen. Ein Arginin- oder Glucagon-Test kann ebenfalls in Erwägung gezogen werden. Diese Tests sind jedoch im Vergleich zum Insulintoleranztest von geringerer diagnostischer Aussagekraft.
Dosierung/AnwendungEine Behandlung mit Norditropin sollte nur von einem Facharzt durchgeführt werden, der mit Diagnose und Behandlung von Wachstumshormon-Mangelzuständen vertraut ist.
Norditropin wird subkutan (s.c.) injiziert, die i.m. Applikation von Wachstumshormon ist nicht mehr adäquat. Einige Studien haben gezeigt, dass es bei Kindern beim Wechsel von i.m.- zu s.c.-Injektionen zu einem Wachstumsspurt kommen kann. Zudem führt eine i.m.-Injektion kurzfristig zu supraphysiologischen Wachstumshormonspiegeln, während bei s.c.-Injektion gleichmässigere und den physiologischen Werten besser entsprechende Serumkonzentrationen erreicht werden.
Die Injektionsstelle sollte regelmässig gewechselt werden, um eine Lipoatrophie zu vermeiden.
Die Injektion erfolgt in der Regel abends.
Die Dosierung ist individuell. Die jeweils genannte empfohlene tägliche Maximaldosis soll nicht überschritten werden.
Aufzeichnung der Chargennummer
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Allgemein empfohlene Dosierungen
Kinder
Die Dauer der im Allgemeinen über mehrere Jahre lang kontinuierlich durchzuführenden Behandlung hängt von der Entwicklung der Körpergrösse und dem vorgesehenen Therapieziel ab. Ein Grössenwachstum kann nur dann erwartet werden, wenn der Epiphysenschluss noch nicht erfolgt ist.
Wachstumshormonmangel
0,025–0,035 mg/kg Körpergewicht pro Tag oder 0,7–1,0 mg/m² Körperoberfläche pro Tag.
Wenn der Wachstumshormonmangel nach Beendigung des Längenwachstums fortbesteht, sollte die Behandlung fortgeführt werden, um eine vollständige körperliche Entwicklung zum Erwachsenen, inklusive speicherfettfreier Körpermasse und Knochenmineralzuwachs, zu erreichen (zur empfohlenen Dosierung siehe «Wachstumshormonmangel bei Erwachsenen» unten).
Turner-Syndrom und Noonan-Syndrom
0,045–0,067 mg/kg Körpergewicht pro Tag oder 1,3–2,0 mg/m² Körperoberfläche pro Tag.
Die Behandlung muss vor der Pubertät begonnen werden.
Chronische Niereninsuffizienz
0,050 mg/kg Körpergewicht pro Tag oder 1,4 mg/m² Körperoberfläche pro Tag.
Vor Verordnung einer Norditropin-Therapie muss ein Nierenfunktionstest durchgeführt werden. Der GFR-Wert sollte dabei unter 50% des Normalwertes liegen.
Bei Kindern mit chronischer Niereninsuffizienz sollte die Behandlung so früh wie möglich nach Diagnose der Wachstumsverzögerung begonnen werden. Das Wachstum sollte über 1 Jahr kontrolliert werden. Nach einer Nierentransplantation soll die Behandlung abgebrochen werden.
Kinder mit intrauterinem Kleinwuchs (SGA)
0,033–0,067 mg/kg Körpergewicht pro Tag oder 1,0–2,0 mg/m² Körperoberfläche pro Tag.
Die Behandlung sollte nach dem ersten Therapiejahr beendet werden, falls der SDS der Wachstumsgeschwindigkeit unterhalb von +1 liegt.
Die Behandlung sollte auch beendet werden, wenn die Wachstumsgeschwindigkeit <2 cm/Jahr beträgt sowie bei Erreichen eines Knochenalters >14 Jahre bei Mädchen bzw. >16 Jahre bei Jungen, was einem Schluss der Wachstumsfugen entspricht. Gemäss Literatur kann im Falle eines schweren Wachstumshormonmangels (d.h. Somatropin-Anstieg auf <6ng/ml im Stimulationstest) eine Weiterbehandlung bis zu einem Alter von etwa 25 Jahren erwogen werden.
Prader-Willi-Syndrom
0,025–0,035 mg/kg Körpergewicht pro Tag oder 0,7–1,0 mg/m² Körperoberfläche pro Tag.
Die empfohlene Dosis beträgt in der Regel 0,035 mg/kg Körpergewicht pro Tag bis zum Erreichen der Endkörpergrösse. Eine tägliche Dosis von 2,7 mg sollte nicht überschritten werden. Die Behandlung sollte beendet werden, wenn die Wachstumsgeschwindigkeit weniger als 1 cm pro Jahr beträgt sowie bei baldigem Epiphysenschluss.
Erwachsene
Wachstumshormonmangel
Die Dosis muss den Bedürfnissen jedes einzelnen Patienten angepasst werden. Es sollte jeweils die niedrigst-wirksame Dosis verabreicht werden.
Bei Patienten mit Beginn des Wachstumshormonmangels in der Kindheit wird empfohlen, die Behandlung mit einer Dosis von 0,2–0,5 mg/Tag neu aufzunehmen und die Dosis anschliessend entsprechend der gemessenen IGF-I-Konzentration anzupassen.
Bei Patienten mit Beginn des Wachstumshormonmangels im Erwachsenenalter wird empfohlen, die Therapie mit einer niedrigen Dosis von 0,15–0,30 mg/Tag zu beginnen. Diese sollte in monatlichen Schritten erhöht werden, abhängig von Therapieerfolg, Auftreten unerwünschter Wirkungen und IGF-I im Serum.
Die Erhaltungsdosis weist eine erhebliche inter-individuelle Variabilität auf, sollte aber nur selten 1,0 mg/Tag (3 IE/Tag) übersteigen. Die Dosierung sollte anhand von IGF-I Messungen kontrolliert werden. Erfahrungen mit Dosierungen über 1 mg/Tag liegen nicht vor.
Die Dauer der Behandlung beim Erwachsenen ist unbestimmt. In jährlichen Intervallen ist fachärztlich zu überprüfen, ob die Behandlung dem Patienten einen reellen klinischen Nutzen bringt und eine Weiterbehandlung sinnvoll ist.
Spezielle Dosierungsempfehlungen
Ältere Patienten: Die benötigte Dosis nimmt mit zunehmendem Alter ab.
Geschlecht: Bei Frauen und Mädchen ab der Pubertät werden zur Erreichung einer adäquaten Wirksamkeit höhere Dosen benötigt als bei Männern. Dies gilt in verstärktem Masse bei Zufuhr exogener Östrogene (siehe «Interaktionen»).
Eingeschränkte Nierenfunktion: Für Erwachsene mit eingeschränkter Nierenfunktion liegen keine spezifischen Daten vor, sodass keine Dosierungsempfehlungen möglich sind. Es ist jedoch bekannt, dass bei chronischer Niereninsuffizienz die Somatropin-Clearance reduziert ist.
Eingeschränkte Leberfunktion: Norditropin wurde bei Patienten mit eingeschränkter Leberfunktion nicht untersucht. Es können daher keine Dosierungsempfehlungen gemacht werden. Es ist jedoch bekannt, dass bei chronischer Leberinsuffizienz die Somatropin-Clearance reduziert ist.
Kontraindikationen·Somatropin darf nicht angewendet werden, wenn es irgendwelche Hinweise auf eine Tumoraktivität gibt. Intrakranielle Tumore müssen inaktiv und eine Tumortherapie vor Beginn einer Behandlung mit Wachstumshormon abgeschlossen sein. Die Behandlung muss abgebrochen werden, wenn Anzeichen für ein Tumorwachstum auftreten.
·kritisch kranke Patienten mit akuter respiratorischer Insuffizienz oder mit Komplikationen nach grösseren abdominal- oder herzchirurgischen Eingriffen oder nach Polytrauma.
·Kinder mit Down- oder Bloom-Syndrom.
·Kinder mit Fanconi-Anämie.
·Prader-Willi-Syndrom mit schwerer Adipositas oder Ateminsuffizienz.
·proliferative oder präproliferative diabetische Retinopathie.
·Bei Kindern mit chronischer Nierenerkrankung sollte die Behandlung mit Norditropin bei einer Nierentransplantation abgesetzt werden.
·Schwangerschaft, Stillzeit.
·Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenTumore und maligne Erkrankungen
Patienten mit Wachstumshormonmangel als Sekundärfolge einer Tumorbehandlung müssen unter Behandlung mit Norditropin auf mögliche Rezidive hin überwacht werden, insbesondere in Fällen, in welchen der Wachstumshormonmangel eine Sekundärfolge der Malignombehandlung darstellt.
Bei Patienten nach in der Kindheit überstandener maligner Erkrankung (sogenannte «childhood cancer survivors») wurde unter Behandlung mit Somatropin über ein erhöhtes Risiko für Zweitneoplasien berichtet. Am häufigsten handelte es sich dabei um intrakranielle Tumoren, insbesondere Meningeome. Diese Tumoren wurden v.a. bei Patienten beobachtet, welche zur Therapie ihrer ersten Neoplasie eine Strahlentherapie des Kopfes erhalten hatten.
Bei Erwachsenen ist bisher nicht bekannt, ob ein Zusammenhang zwischen einer Somatropin-Therapie und Rezidiven von Tumoren des ZNS bestehen könnte.
Leukämien
In wenigen Fällen wurde bei Patienten mit Wachstumshormonmangel, von denen einige mit Wachstumshormon behandelt wurden, über eine Leukämie berichtet.
Benigne intrakranielle Hypertension
Im Falle von schweren und häufig wiederkehrenden Kopfschmerzen, Sehstörungen, Übelkeit und/oder Erbrechen wird empfohlen, eine ophthalmologische Untersuchung bezüglich eines möglichen Papillenödems durchzuführen. Sollte eine Stauungspapille bestätigt werden, muss die Diagnose eines Pseudotumors cerebri (benigne intrakranielle Hypertension) in Betracht gezogen und, falls dies zutrifft, die Behandlung mit Wachstumshormon abgebrochen werden.
Über die weitere Behandlung von Patienten nach intrakranieller Hypertonie liegen nur ungenügende Erfahrungen vor. Falls die Behandlung mit Wachstumshormon wieder aufgenommen wird, ist eine sorgfältige Überwachung auf mögliche Anzeichen einer intrakraniellen Drucksteigerung erforderlich.
Insulinresistenz / Einfluss auf den Blutzucker
Da Somatropin eine Insulinresistenz hervorrufen kann, die zu Hyperinsulinismus und in seltenen Fällen zu Hyperglykämie führen kann, sollten Patienten, die Norditropin erhalten, hinsichtlich Anzeichen eines abnormen Glukose-Metabolismus bzw. eines Diabetes mellitus überwacht werden. Bei allen Patienten sollte der Urin regelmässig auf Glucose getestet werden.
Faktoren, welche das Risiko erhöhen, während einer Behandlung mit Somatotropin eine Insulinresistenz bzw. einen Diabetes mellitus zu entwickeln, sind familiäre Disposition, Adipositas (insbesondere bei Patienten mit Prader-Willi-Syndrom), Acanthosis nigricans, vorbestehende verminderte Glukosetoleranz sowie gleichzeitige Therapie mit Corticosteroiden. Auch bei Patientinnen mit Turner-Syndrom sowie bei Kindern mit intrauterinem Kleinwuchs (SGA) ist das Risiko erhöht. Bei solchen Risikopatienten wird empfohlen, vor Therapiebeginn sowie danach jährlich die Nüchternglukose- und Insulinspiegel zu bestimmen. Ggf. sollte ein oraler Glukosetoleranztest (OGTT) durchgeführt werden. Falls unter Therapie ein manifester Diabetes auftritt, sollte kein Wachstumshormon mehr verabreicht werden.
Bei Patienten mit vorbestehendem Diabetes mellitus sollte Norditropin nur mit Vorsicht angewendet werden. Nach Beginn einer Somatotropin-Behandlung kann eine Anpassung der antidiabetischen Therapie erforderlich sein.
Schilddrüsenfunktion
Die Serum-Thyroxinspiegel können während der Behandlung mit Norditropin infolge der erhöhten peripheren Dejodierung von T4 zu T3 absinken. Vor allem bei Patienten mit einer fortschreitenden Hypophysenerkrankung kann sich eine Hypothyreose entwickeln. Patientinnen mit Turner-Syndrom weisen ein erhöhtes Risiko auf, eine primäre Hypothyreose zu entwickeln, welche mit der Bildung von Anti-Thyroid-Antikörpern einhergeht. Eine Hypothyreose beeinträchtigt die Wirksamkeit von Norditropin. Daher sollten regelmässig Schilddrüsen-Funktionstests durchgeführt und wenn nötig Schilddrüsenhormone verabreicht werden.
Pankreatitis
Es liegen Berichte über das Auftreten einer Pankreatitis unter Behandlung mit Somatropin vor, insbesondere bei Kindern. Publizierte Daten deuten darauf hin, dass vor allem Mädchen mit Turner-Syndrom unter einer Somatropin-Therapie ein erhöhtes Risiko für eine Pankreatitis aufweisen könnten. Treten bei einem Patienten unter Behandlung mit Norditropin akute Oberbauchbeschwerden auf, sollte die Möglichkeit einer Pankreatitis in Betracht gezogen werden.
Akute Nebennierenrinden(NNR)-Insuffizienz
Somatropin kann die Aktivität der 11β-Hydroxysteroid-Dehydrogenase Typ 1, einem Enzym der Cortisolsynthese, reduzieren. Dadurch kann bei mit Somatropin behandelten Patienten eine latente zentrale (sekundäre) NNR-Insuffizienz demaskiert werden, wodurch eine Glukokortikoid-Substitutionstherapie erforderlich werden kann. Darüber hinaus kann bei Patienten, die bereits eine Glukokortikoid-Substitutionstherapie aufgrund einer bekannten NNR-Insuffizienz erhalten, nach Beginn der Somatropin-Therapie eine Erhöhung der Erhaltungs- und/oder der Stressdosis erforderlich sein (siehe «Interaktionen»).
Interaktion mit exogenen Östrogenen
Exogene Östrogene können, insbesondere bei oraler Gabe, die IGF-1-Konzentration im Serum reduzieren und dadurch die Wirksamkeit einer Wachstumshormon-Behandlung abschwächen. Bei Patientinnen unter einer Östrogentherapie kann daher eine höhere Norditropin-Dosis erforderlich sein, um IGF-1-Serumspiegel im altersentsprechenden Normbereich zu erreichen. Dies sollte beachtet werden, wenn bei einer Patientin unter Substitutionstherapie mit Wachstumshormon neu eine Östrogenbehandlung eingeleitet wird (siehe auch «Dosierung / Anwendung»). Umgekehrt muss die Norditropin-Dosis unter Umständen reduziert werden, wenn eine Östrogentherapie beendet wird.
Zur Kontrazeption sollten nicht-hormonale Methoden eingesetzt werden (siehe «Schwangerschaft / Stillzeit»).
Es gibt Hinweise, dass diese Veränderungen bei transdermalen Östrogen-Applikation geringer ausgeprägt ist.
Antikörper
Wie bei allen Arzneimitteln, die Somatropin enthalten, kann ein geringer Prozentsatz der Patienten Antikörper gegen Somatropin entwickeln. Die Bindungskapazität dieser Antikörper ist gering, und Auswirkungen auf die Wachstumsgeschwindigkeit wurden nicht beobachtet. Trotzdem sollte bei jedem Patienten, der nicht auf die Therapie anspricht, ein Nachweistest für Antikörper gegen Somatropin durchgeführt werden.
Sonstige Vorsichtsmassnahmen
Bei Vorliegen einer kompletten oder partiellen Hypophysenvorderlappeninsuffizienz kann eine Substitutionstherapie mit zusätzlichen Hormonen (z.B. Glukokortikoiden) notwendig sein. In diesem Fall muss die Dosis dieser Zusatztherapie besonders sorgfältig eingestellt werden, um eine Wachstumshemmung zu vermeiden.
Warnhinweise bei der Behandlung von Wachstumsstörungen bei Kindern
Bei Kindern ist eine Längenwachstum fördernde Wirkung nur bis zum Schluss der Epiphysenfugen zu erwarten.
Prader-Willi-Syndrom
Es gab Berichte von Todesfällen nach Therapiebeginn mit Wachstumshormon bei pädiatrischen Patienten mit Prader-Willi-Syndrom. Patienten mit schwerer Adipositas, Obstruktion der oberen Atemwege, Schlaf-Apnoe oder unerkannter Atemwegsinfektion gelten als besonders gefährdet. Patienten mit Prader-Willi-Syndrom sollten vor Therapiebeginn mit Wachstumshormon auf Zeichen einer Obstruktion der oberen Atemwege, Schlaf-Apnoe oder Atemwegsinfektionen untersucht werden. Wenn sich aufgrund pathologischer Befunde der Verdacht auf eine Obstruktion der oberen Atemwege ergibt, muss der Patient an einen ORL-Spezialisten überwiesen werden. Eine Schlafapnoe muss vor Beginn der Wachstumshormon-Therapie durch anerkannte Methoden wie Polysomnographie oder nächtliche Oxymetrie untersucht und gegebenenfalls weiter überwacht werden. Wenn Patienten mit Prader-Willi-Syndrom während der Behandlung Zeichen einer Obstruktion der oberen Atemwege (inkl. verstärktes Schnarchen) und/oder Hinweise auf eine Schlaf-Apnoe zeigen, sollte die Behandlung unterbrochen und eine ORL-Untersuchung durchgeführt werden.
Alle Patienten mit Prader-Willi-Syndrom müssen auf Anzeichen von Atemwegsinfektionen überwacht werden, die so früh als möglich diagnostiziert und aggressiv behandelt werden müssen.
Kinder mit intrauterinem Kleinwuchs (SGA)
Bei Kindern mit intrauterinem Kleinwuchs (SGA) sollten andere medizinische Gründe oder Behandlungen, die die Wachstumsstörung erklären könnten, vor Therapiebeginn ausgeschlossen werden.
Die Erfahrungen mit einem Therapiebeginn bei Kindern mit intrauterinem Kleinwuchs (SGA) nahe dem Pubertätsbeginn sind begrenzt. Daher wird ein Therapiestart nahe dem Pubertätsbeginn nicht empfohlen.
Der Gewinn an Längenwachstum, der durch die Behandlung von Kindern mit intrauterinem Kleinwuchs (SGA) erzielt wurde, kann teilweise verloren gehen, falls die Behandlung vor Erreichen der Endkörpergrösse beendet wird.
Turner-Syndrom
Bei Mädchen mit Turner-Syndrom, die mit Wachstumshormon behandelt werden, wurde über ein verstärktes Wachstum von Händen und Füssen berichtet. Patientinnen mit Turner-Syndrom, die mit Norditropin behandelt werden, sollten daher bezüglich des Wachstums von Händen und Füssen beobachtet werden. Falls ein verstärktes Wachstum auftritt, sollte eine Dosisreduktion auf den unteren Dosisbereich in Erwägung gezogen werden.
Treten bei Patientinnen mit Turner-Syndrom Knochenschmerzen auf, sollte ein Morbus Scheuermann ausgeschlossen werden.
Mädchen mit Turner-Syndrom haben ein erhöhtes Risiko für eine Otitis media. Daher wird empfohlen, mindestens einmal jährlich eine ohrenärztliche Untersuchung durchzuführen.
Pädiatrische Patienten mit chronischer Niereninsuffizienz
Die Wachstumsstörung aufgrund einer chronischen Niereninsuffizienz sollte vor einer Therapie mit Norditropin eindeutig durch eine mindestens einjährige Wachstumskontrolle unter optimaler Therapie der Nierenerkrankung diagnostiziert sein. Die konservative Behandlung einer Urämie mit üblicher Medikation bzw., falls erforderlich, Dialyse sollte unter der Therapie mit Norditropin fortgesetzt werden.
Unter Somatropin kann es sowohl zu einer übermässigen Abnahme der glomerulären Filtrationsrate (d.h. stärker als im Verlauf der chronischen Niereninsuffizienz zu erwarten) als auch zu einer Zunahme (als Hinweis auf eine mögliche Hyperfiltration) kommen. Die Nierenfunktion muss daher während der Behandlung mit Norditropin überwacht werden.
Langzeitwirkung bei Turner-Syndrom und chronischer Niereninsuffizienz
Daten zur Langzeitwirksamkeit von Norditropin sowohl bei Turner-Syndrom als auch bei chronischer Niereninsuffizienz sind nicht vorhanden, und die Behandlung der Patienten sollte unter strenger medizinischer Kontrolle erfolgen.
Skelettveränderungen
Eine Epiphysenverschiebung des Femur (Epiphyseolysis capitis femoris) kann bei Patienten mit endokrinen Störungen (wie z.B. Wachstumshormonmangel) gehäuft vorkommen. Auch ein Morbus Legg-Calvé-Perthes kann bei kleinwüchsigen Patienten gehäuft vorkommen. Dies kann sich durch Hinken oder Hüft- bzw. Knieschmerzen äussern. Die Eltern sollten informiert werden, auf solche Symptome zu achten und sie ggf. unverzüglich dem behandelnden Arzt mitzuteilen.
Eine Skoliose kann sich bei jedem Kind während Phasen eines schnellen Wachstums manifestieren oder verschlechtern und tritt vor allem bei Kindern mit Prader-Willi-Syndrom oder Turner-Syndrom gehäuft auf. Da Norditropin die Wachstumsrate steigert, sollte während der Behandlung auf mögliche Anzeichen einer Skoliose geachtet werden. Es gibt jedoch bisher keine Hinweise, dass eine Behandlung mit Wachstumshormon Inzidenz oder Schweregrad einer Skoliose erhöht.
IGF-I
Bei Turner-Syndrom und bei Kindern mit intrauterinem Kleinwuchs (SGA) wird empfohlen, den IGF-I-Spiegel vor Therapiebeginn und danach zweimal jährlich zu messen. Falls der IGF-I-Spiegel wiederholt die dem jeweiligen Alter und Pubertätsstadium entsprechenden Normwerte um mehr als +2 SD übersteigt, könnte das IGF-I/IGFBP-3-Verhältnis bei der Dosisanpassung berücksichtigt werden.
Warnhinweise bei Behandlung eines Wachstumshormonmangels bei Erwachsenen
Ein Wachstumshormonmangel bei Erwachsenen ist eine lebenslange Erkrankung, die dementsprechend behandelt werden muss, jedoch liegen bis jetzt nur wenige Erfahrungen in der Therapie von Patienten über 60 Jahre und von Erwachsenen vor, die über einen Zeitraum von mehr als 5 Jahre Wachstumshormon erhalten haben.
Daten über die Auswirkungen von humanem Wachstumshormon auf die Endkörpergrösse bei Erwachsenen, die als Kind aufgrund einer chronischen Niereninsuffizienz oder eines Prader-Willi-Syndroms mit Somatropin behandelt wurden, liegen nicht vor.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d.h. es ist nahezu «natriumfrei».
InteraktionenPharmakokinetische Interaktionen
Die Gabe von Somatotropin kann die Clearance von Substanzen erhöhen, die durch das Cytochrom P450 3A4 metabolisiert werden (z.B. Antikonvulsiva, Cyclosporin, Kortikosteroide, Sexualhormone). Die klinische Bedeutung dieser Interaktion ist unklar.
Pharmakodynamische Interaktionen
Einfluss anderer Arzneimittel auf die Wirksamkeit von Wachstumshormon
Eine gleichzeitige Behandlung mit Glukokortikoiden hemmt die wachstumsfördernde Wirkung von Norditropin. Bei Patienten mit gleichzeitigem ACTH-Mangel sollte die Glukokortikoid-Substitutionstherapie sorgfältig angepasst werden, um eine mögliche hemmende Wirkung auf das Wachstum zu vermeiden.
Exogene Östrogene können, insbesondere bei oraler Gabe, die IGF-1-Konzentration im Serum reduzieren und dadurch die Wirksamkeit von Somatropin abschwächen (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»). Der Mechanismus dieser Interaktion ist nicht bekannt.
Die gleichzeitige Behandlung mit folgenden Substanzen kann zu einer additiven Wirkung auf die Knochenreifung führen: Anabolika, Androgene, Gonadotropine, Schilddrüsenhormone.
Einfluss von Wachstumshormon auf die Wirksamkeit anderer Arzneimittel
Somatropin reduziert die Umwandlungsrate von Cortison zu Cortisol, wodurch eine latente sekundäre NNR-Insuffizienz demaskiert werden bzw. die bisherige Glucocorticoid-Substitutionsdosis nicht mehr ausreichend wirksam sein kann (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei Diabetikern kann nach Beginn der Behandlung mit Norditropin eine Dosisanpassung der Antidiabetika notwendig werden.
Schwangerschaft, StillzeitEs sind weder kontrollierte Studien bei Tieren noch bei schwangeren Frauen verfügbar. Aufgrund der ungewissen Auswirkungen eines Konzentrationsschubes von Wachstumshormon auf die spezifischen Stadien der Embryogenese bzw. des fötalen Wachstums darf Norditropin während der Schwangerschaft nicht verabreicht werden. Eine Schwangerschaft muss während der Behandlung mit Norditropin ausgeschlossen werden, und die Patientinnen sind über die Methoden einer nicht-hormonalen Kontrazeption zu beraten.
Über den Übergang von Wachstumshormon in die Muttermilch liegen keine Angaben vor. Aus Vorsichtsgründen ist bei Gabe von Norditropin abzustillen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenStudien zu möglichen Auswirkungen einer Behandlung mit Wachstumshormon auf die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen wurde nicht durchgeführt. Ein entsprechender Einfluss von Norditropin wird aber nicht erwartet.
Unerwünschte WirkungenPatienten mit Wachstumshormonmangel zeichnen sich durch ein extrazelluläres Volumendefizit aus. Wenn eine Behandlung mit Somatropin begonnen wird, wird dieses Defizit behoben. Vor allem bei Erwachsenen kann eine Flüssigkeitsretention mit peripheren Ödemen auftreten. Ein Karpaltunnelsyndrom ist selten, kann aber bei Erwachsenen auftreten. Die Symptome sind gewöhnlich vorübergehend, dosisabhängig und können eine Dosisreduktion erforderlich machen.
Milde Gelenkschmerzen, Muskelschmerzen und Parästhesien können auftreten.
Die nachfolgend genannten unerwünschten Wirkungen stammen aus klinischen Studien und Post-Marketing Erfahrungen:
Zur Klassifikation der Häufigkeit der unerwünschten Wirkungen wurden die folgenden Definitionen verwendet: «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1000, <1/100), «selten» (≥1/10'000, <1/1000), «sehr selten» (<1/10'000).
Erkrankungen des Blutes und des Lymphsystems
Sehr selten: Leukämie bei Kindern mit hypophysärem Kleinwuchs. Die Inzidenz scheint jedoch mit jener bei Kindern ohne Wachstumshormonmangel vergleichbar zu sein.
Erkrankungen des Immunsystems
Selten: anaphylaktische Reaktionen.
Sehr selten wurde (in klinischen Studien) die Bildung von Antikörpern gegen Somatropin während der Behandlung mit Norditropin beobachtet. Titer und Bindungskapazität dieser Antikörper waren sehr gering und zeigten keinen Einfluss auf die Wirkung von Norditropin.
Endokrine Erkrankungen
Selten: Erhöhung des Blutglukosespiegels, Diabetes mellitus Typ II, Hypothyreose.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Parästhesien.
Gelegentlich: Karpaltunnelsyndrom.
Sehr selten: Benigne intrakranielle Hypertension.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Pruritus.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Steifheit der Gelenke, Arthralgien, Myalgien.
Gelegentlich: Muskelsteifheit.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Gynäkomastie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: periphere Ödeme.
Häufig: generalisierte Ödeme.
Gelegentlich: Schmerzen an der Injektionsstelle.
Pädiatrische Population
Bei Kindern zeigten sich im Wesentlichen dieselben unerwünschten Wirkungen wie bei Erwachsenen, teilweise jedoch mit unterschiedlicher Häufigkeit, wie nachfolgend angegeben:
Erkrankungen des Nervensystems
Gelegentlich: Kopfschmerzen.
Erkrankungen der Haut und des Unterhautzellgewebes
Selten: Hautausschlag.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr selten: Arthralgien, Myalgien.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Schmerzen und andere Reaktionen an der Applikationsstelle.
Sehr selten: verstärktes Schwitzen, periphere Ödeme.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungKurzfristige Überdosierung kann zunächst zu hypoglykämischen Reaktionen und anschliessend zu Hyperglykämien führen. Die niedrigen Blutzuckerwerte konnten nur biochemisch festgestellt werden und verliefen klinisch asymptomatisch. Eine Langzeitüberdosierung könnte sich in den Symptomen einer Akromegalie äussern. Solche wurden für die registrierten Indikationen bisher nicht gemeldet.
Eigenschaften/WirkungenATC-Code
H01AC01
Wirkungsmechanismus
Norditropin ist ein gentechnologisch hergestelltes humanes Wachstumshormon (Somatropinum humanum), das mit der 191 Aminosäuren enthaltenden Peptidkette des aus der Hypophyse des Menschen gewonnenen Hormons identisch ist. In pharmakologischen und klinisch-experimentellen Untersuchungen wurde bestätigt, dass Norditropin die gleichen therapeutischen Wirkungen ausübt wie das aus der Hypophyse gewonnene Wachstumshormon.
Pharmakodynamik
Die Hauptwirkung des Wachstumshormons besteht in der Stimulation des Knochen- und Körperwachstums und einer deutlichen Beeinflussung metabolischer Prozesse im Körper.
Somatropin übt die meisten seiner Wirkungen indirekt über IGF-I aus. IGF-I wird in vielen Geweben des Körpers produziert, hauptsächlich jedoch in der Leber. Über 90% des IGF-I ist an Bindungsproteine gebunden (IGFBP), wobei das IGFBP-3 das wichtigste ist.
Klinische Wirksamkeit
Erwachsene
Bei Erwachsenen waren die Resultate klinischer Studien (insgesamt 303 Patienten in 7 placebokontrollierten Studien mit verschiedenen Endpunkten) unterschiedlich und überwiegend nicht signifikant. Trendmässig wurden die nachfolgend aufgeführten Parameter wie folgt beeinflusst:
Zentrale Obesitas: wird leicht vermindert.
Fettfreie Masse: wird leicht erhöht.
Gesamtfettmasse: bleibt unverändert.
Knochendichte (BMD): nach initialer leichter Abnahme erfolgt in der Regel nach 1–2 Jahren eine Zunahme. Frakturdaten liegen nicht vor.
Plasmalipide: Verminderung von Gesamtcholesterin und LDL, Erhöhung von HDL. Die klinische Relevanz dieser Veränderungen ist nicht geklärt.
Muskelkraft und kardiovaskuläre Leistungsfähigkeit: kein Einfluss.
Subjektive Lebensqualität: variabler insignifikanter Einfluss.
Mortalität (gesamte und kardiovaskuläre): es liegen keine Daten vor.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Kinder mit intrauterinem Kleinwuchs (SGA)
In einer Population von 58 Kindern mit intrauterinem Kleinwuchs mit einer Körpergrösse von<–2 SDS (Standard Deviation Score) und ohne Defizienz an Wachstumshormon konnte bei Behandlungsbeginn gezeigt werden, dass eine kontinuierliche Norditropin-Behandlung mit 0,033 mg/kg/Tag (3 IE) oder 0,067 mg/kg/Tag (6 IE) zu einer markanten Zunahme der SDS Körpergrösse während des ersten Behandlungsjahres führte. Während der gesamten 7-jährigen Beobachtungsdauer war die Körpergrösse statistisch signifikant grösser als bei Studienbeginn, was den Langzeiteffekt der Wachstumshormonbehandlung bestätigt.
Die Patienten wurden unter folgenden Voraussetzungen in die Studien aufgenommen (Einschlusskriterien): Geburtslänge <P3 für SGA, kein Aufholwachstum (Erlangen einer Körpergrösse von ≥P3) in den ersten zwei Lebensjahren oder später, Wachstumsgeschwindigkeit (cm/Jahr) in Bezug auf das chronologische Alter <P50, chronologisches Alter bei Therapiebeginn: Mädchen: 3,00 bis 8,99 Jahre, Knaben: 3,00 bis 10,99 Jahre.
Änderung der SDS Körpergrösse (bis 7 Jahre)
Änderung der SDS Körpergrösse vom Ausgangswert (geschätztes +/- 95% Konfidenzintervall).

Anzahl Jahre der Wachstumshormonbehandlung
Der initiale Aufholeffekt war unter 0,067 mg/kg/Tag grösser als unter 0,033 mg/kg/Tag. Der Unterschied zwischen den Dosierungsgruppen war im Jahr 1 und 2 statistisch signifikant bezüglich der Änderung der SDS Körpergrösse.
SDS Körpergrösse (bis 8 Jahre)
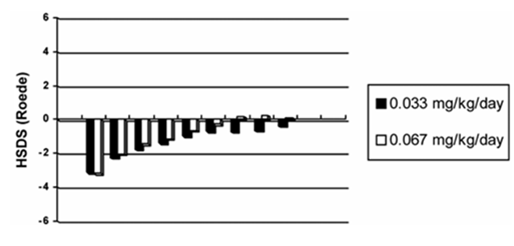
Die mittlere SDS-Körpergrösse lag mit -3.1 zu Beginn unterhalb des Referenzbereichs. Nach 2-jähriger Wachstumshormonbehandlung lag die mittlere SDS-Körpergrösse innerhalb des Referenzbereichs normalwüchsiger Kinder und näherte sich nach 8-jähriger Behandlung weiter auf Werte innerhalb des (dann engeren) Referenzbereichs normalwüchsiger Kinder an.
Unter der Dosierung von 0.067 mg/kg/Tag war die Zunahme der SDS-Körpergrösse über die Zeit durchschnittlich stärker als unter 0,033 mg/kg/Tag.)
Für 39 Kinder mit SGA liegen Langzeitdaten zur (Beinah-)Endgrösse für eine kontinuierliche Behandlung mit Wachstumshormon vor. Die geschätzte mittlere Zunahme der Körpergrösse gegenüber dem Ausgangswert lag in der 0.033 mg/kg/Tag-Dosisgruppe bei +1.56 SDS, in der 0.067 mg/kg/Tag-Gruppe bei +2.09 SDS. Die geschätzte Endgrösse betrug unter 0.033 mg/kg/Tag -1.50 SDS, unter 0.067 mg/kg/Tag -0.99 SDS. Der Unterschied zwischen den beiden Dosisgruppen war statistisch nicht signifikant. Hingegen fand sich eine signifkante negative Korrelation zwischen dem Alter bei Behandlungsbeginn und der Zunahme der Körpergrösse. Dies deutet darauf hin, dass ein früherer Behandlungsbeginn mit einer stärkeren Zunahme der Körpergrösse assoziert ist.
Langzeitsicherheitsdaten sind noch limitiert.
Prader-Willi-Syndrom (PWS)
Eine retrospektive Studie bei Kindern mit PWS, die mit Norditropin behandelt wurden, zeigte eine klinisch relevante und statistisch signifikante Veränderung der mittleren SDS Körpergrösse um 0,9 während des ersten Behandlungsjahres.
PharmakokinetikAbsorption
Bei gesunden Probanden wurde, unter Suppression des endogenen Somatropins durch eine kontinuierliche Somatostatin-Infusion, nach subkutaner Injektion von Somatropin in einer Dosis von 2.5 mg/m2 die maximale Somatropin-Konzentration von 42-46 ng/ml nach ca. 4 Stunden erreicht.
Norditropin erwies sich gegenüber genuinem Wachstumshormon als bioäquivalent.
Distribution
Das Verteilungsvolumen wurde (nach i.v.-Applikation) mit 67.7 +/- 14.6 ml/kg bestimmt.
Metabolismus
Der Metabolismus von gentechnologisch hergestelltem Somatropin entspricht jenem des endogenen Wachstumshormons. Es wird duch Proteasen inaktiviert. Nach intravenöser Infusion in einer Dosierung von 33 ng/kg/min über 3 Stunden wurde bei Patienten mit Wachstumshormonmangel die metabolische Clearance mit 2.33 +/- 0.58 ml/kg/min bestimmt.
Elimination
Nach intravenöser Infusion in einer Dosierung von 33 ng/kg/min über 3 Stunden wurde bei Patienten mit Wachstumshormonmangel eine Eliminationshalbwertszeit von 21.1 +/- 1.7 Minuten bestimmt.
Nach subkutaner Applikation einer Dosis von 2.5 mg/m2 bei gesunden Probanden lag die Halbwertszeit bei ca. 2.6 Stunden.
Präklinische DatenUntersuchungen mit Somatropin bei Mäusen, Ratten und Affen zeigten keine relevanten toxikologischen Befunde. Es hat sich kein mutagenes Potential gezeigt.
Die allgemeinen pharmakologischen Effekte auf ZNS, kardiovaskuläres und respiratorisches System nach der Anwendung von Somatropin mit und ohne erzwungenem Abbau wurden an Mäusen und Ratten untersucht; ebenso wurde die Nierenfunktion ausgewertet. Es wurde eine dosisabhängige Abnahme des Urinvolumens und die Retention von Natrium- und Chloridionen beobachtet.
Toxizitäts- und lokale Toleranzstudien nach Einfach- und Mehrfachgabe von Somatropin bzw. dem Abbauprodukt zeigten keine toxischen Effekte oder Schäden im Muskelgewebe.
Die Toxizität von Poloxamer 188 wurde an Mäusen, Ratten, Kaninchen und Hunden getestet. Die Untersuchungen zeigten keine Ergebnisse von toxikologischer Relevanz. Poloxamer 188 wird schnell absorbiert, es war keine signifikante Retention der Dosis an der Injektionsstelle zu erkennen. Poloxamer 188 wird hauptsächlich über den Urin ausgeschieden.
Sonstige HinweiseInkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Die Haltbarkeitsdauer beträgt 2 Jahre. Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Norditropin FlexPro 5 mg/10 mg/15 mg: nach Anbruch im Kühlschrank bei 2 °C bis 8 °C 4 Wochen (28 Tage) oder nicht über 25 °C 3 Wochen (21 Tage) lang haltbar.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C) lagern.
Vor Licht schützen.
Nicht einfrieren. Nicht in der Nähe von Kühlelementen lagern.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Der Patient sollte darauf hingewiesen werden, die Hände vor Kontakt mit Norditropin gründlich mit Wasser und Seife und/oder einem Desinfektionsmittel zu waschen.
Norditropin darf nicht kräftig geschüttelt werden.
Norditropin FlexPro 5 mg, 10 mg und 15 mg ist ein vorgefüllter Fertigpen, welcher zusammen mit NovoFine Einmal-Nadeln angewendet wird. Dieser Fertigpen gibt pro Dosis ein Maximum von 2,0 mg/4,0 mg/8,0 mg Wachstumshormon ab, in Schritten von 0,025 mg/0,050 mg/0,1 mg.
Die genaue Gebrauchsanweisung liegt der jeweiligen Packung bei. Der Patient sollte aufgefordert werden, die Gebrauchsanweisung sorgfältig zu lesen.
Um eine korrekte Dosierung sicherzustellen und eine Injektion von Luft zu vermeiden, muss vor der ersten Injektion geprüft werden, ob die Lösung ordnungsgemäss austritt. Norditropin FlexPro darf nicht verwendet werden, falls nicht an der Spitze der Injektionsnadel ein Tropfen Wachstumshormon erscheint.
Die Dosis wird eingestellt, indem der Dosiswahlknopf soweit gedreht wird, bis die gewünschte Dosis im Sichtfenster des Gehäuses erscheint. Wird eine falsche Dosis eingestellt, so kann diese durch Zurückdrehen des Dosiswahlknopfes in die entgegengesetzte Richtung korrigiert werden. Zur Injektion der Dosis wird der Druckknopf betätigt.
Um zu überprüfen, ob die Lösung klar und farblos ist, wird der Fertigpen ein- oder zweimal hin- und herbewegt, so dass sich die Patrone wechselweise oben und unten befindet. Norditropin darf nur angewendet werden, falls die Injektionslösung klar und farblos ist.
Zulassungsnummer60469 (Swissmedic).
PackungenNorditropin FlexPro 5 mg Fertigpen 1. (A)
Norditropin FlexPro 10 mg Fertigpen 1. (A)
Norditropin FlexPro 15 mg Fertigpen 1. (A)
Die Injektionsnadeln NovoFine® sind separat erhältlich.
ZulassungsinhaberinNovo Nordisk Pharma AG, Kloten
Domizil: Zürich
Stand der InformationAugust 2021
|


