ZusammensetzungWirkstoffe
Triptorelin als Triptorelin-Embonat.
Hilfsstoffe
Poly(lactid-co-glycolid), Mannitol, Carmellose-Natrium*, Polysorbat 80.
Lösungsmittel: Wasser für Injektionszwecke.
*Die Menge an Natrium, die durch Carmellose-Natrium zugeführt wird, entspricht 2,3 mg pro Dosis.
Indikationen/AnwendungsmöglichkeitenHormonabhängiges Prostatakarzinom im fortgeschrittenen Stadium.
Lokalisiertes hormonabhängiges Prostatakarzinom mit hohem Risiko oder lokal fortgeschrittenes Prostatakarzinom, das in Kombination mit einer Strahlentherapie behandelt wird (siehe «Klinische Wirksamkeit»).
Zentrale Pubertas praecox (CPP) bei Kindern ab 2 Jahren mit Beginn der CPP vor Vollendung des 8. Lebensjahres bei Mädchen bzw. des 9. Lebensjahres bei Knaben.
Dosierung/AnwendungPamorelin LA 22,5 mg darf nur von Ärzten oder medizinischem Fachpersonal angewendet werden.
Art der Anwendung
Pamorelin LA 22,5 mg ist intramuskulär zu injizieren.
Da es sich bei Pamorelin LA 22,5 mg um eine Suspension von Mikrogranula handelt, ist eine intravasale Injektion unbedingt zu vermeiden. Die Injektionsstelle sollte in regelmässigen Abständen gewechselt werden.
Für die Herstellung der gebrauchsfertigen Injektionssuspension siehe «Sonstige Hinweise», Rubrik «Art der Herstellung».
Übliche Dosierung
Die übliche Dosierung für alle Indikationen ist eine intramuskuläre Injektion von Pamorelin LA 22,5 mg alle 24 Wochen unter ärztlicher Aufsicht.
Prostatakarzinom
Die Wirksamkeit der Behandlung kann durch die Bestimmung der Serumspiegel von Testosteron und des prostataspezifischen Antigens (PSA) sowie durch eine subjektive Beurteilung (Verbesserung der Symptome wie Miktionsbeschwerden, Krebsschmerzen usw.) überprüft werden. Das Testosteron kann unmittelbar vor oder nach der Injektion bestimmt werden.
Zentrale Pubertas praecox
Die Behandlung von Kindern mit Pamorelin LA 22,5 mg sollte unter der allgemeinen Aufsicht eines Facharztes für pädiatrische Endokrinologie, eines Kinderarztes oder Endokrinologen mit Erfahrung in der Behandlung von zentraler Pubertas praecox erfolgen.
Um die Behandlung zu überwachen, sollten 1 bis 2 Monate nach der Injektion der ersten Dosis und anschliessend nach Ermessen des behandelnden Arztes geeignete Hormonbestimmungen durchgeführt werden. Die Körpergrösse des Kindes sollte alle 3 bis 6 Monate gemessen werden. Ausserdem sollte eine regelmässige Überwachung des Knochenalters durchgeführt werden.
Die Behandlung muss bei Mädchen vor dem Alter von 11 Jahren und bei Knaben vor dem Alter von 12 Jahren beendet werden.
Spezielle Dosierungsanweisungen
Pädiatrische Population
Die Sicherheit und Wirksamkeit von Pamorelin LA 22,5 mg bei Kindern unter 2 Jahren wurden nicht untersucht. Eine Verwendung in dieser Altersgruppe wird daher nicht empfohlen.
Ältere Patienten
Eine altersabhängige Anpassung der Dosis ist nicht erforderlich.
Patienten mit beeinträchtigter Nierenfunktion
Bei Patienten mit beeinträchtigter Nierenfunktion ist keine Anpassung der Dosierung erforderlich.
Patienten mit beeinträchtigter Leberfunktion
Bei Patienten mit beeinträchtigter Leberfunktion ist keine Anpassung der Dosierung erforderlich.
KontraindikationenAllgemeine Kontraindikationen
Schwangerschaft und Stillzeit (siehe «Schwangerschaft, Stillzeit»).
Überempfindlichkeit gegen Triptorelin, andere GnRH-Analoga oder einen der Hilfsstoffe in der Zusammensetzung.
Prostatakarzinom
Pamorelin LA 22,5 mg darf nicht angewendet werden, wenn es Hinweise gibt, dass der Tumor nicht hormonabhängig ist, oder nach einer chirurgischen Kastration.
Pamorelin LA 22,5 mg ist bei Patienten mit einer Rückenmarkskompression durch Metastasen eines Prostatakarzinoms kontraindiziert.
Warnhinweise und VorsichtsmassnahmenAllgemeine Warnhinweise
Überempfindlichkeitsreaktionen:
Kurz nach der Injektion von Pamorelin LA 22,5 mg wurden einige seltene allergische Reaktionen beobachtet. Es wurden seltene Fälle von anaphylaktischem Schock und angioneurotischem Ödem nach der Gabe von Triptorelin beschrieben.
Hypophysenapoplexie:
Bei männlichen Patienten unter Behandlung mit GnRH-Agonisten wurden seltene Fälle von Hypophysenapoplexie beschrieben (klinisches Syndrom als Folge eines Hypophyseninfarkts). In den meisten dieser Fälle wurde ein Hypophysenadenom diagnostiziert. Die meisten Fälle traten innerhalb von zwei Wochen auf, einige innerhalb einer Stunde nach der ersten Injektion. Eine Hypophysenapoplexie äusserte sich durch plötzliche Kopfschmerzen, Erbrechen, Sehstörungen, Lähmung der Augenmuskeln, veränderten Geisteszustand und mitunter durch kardiovaskulären Kollaps.
Sofortige medizinische Massnahmen sind unerlässlich.
Daher sollte bei einem bekannten Hypophysenadenom kein GnRH-Agonist verabreicht werden.
Stimmungsschwankungen/Depression:
Unter Behandlung mit Triptorelin wurde über Stimmungsschwankungen bis hin zu Depression (mitunter schwer) berichtet. Seltene Fälle von Suizidgedanken oder Suizidversuchen wurden auch unter der Behandlung mit anderen GnRH-Analoga berichtet. Patienten mit Depression (auch in der Anamnese) sind daher während der Behandlung mit Pamorelin LA 22,5 mg engmaschig zu überwachen Die Patienten oder Eltern bzw. Pflegepersonen von Kindern sind auf das Risiko des Auftretens solcher Symptome (und auf die Möglichkeit der Verschlimmerung einer bereits bestehenden Depression) hinzuweisen.
Krampfanfälle
Unter der Behandlung mit GnRH-Analoga wurde über das Auftreten von Krampfanfällen berichtet, insbesondere bei Frauen und Kindern. Einige dieser Patienten wiesen Risikofaktoren für Krampfanfälle auf (wie Epilepsie in der Vorgeschichte, intrakranielle Tumore oder gleichzeitige Behandlung mit Arzneimitteln, von denen bekannt ist, dass sie mit einem Risiko für Reaktionen in Form von Krampfanfällen einhergehen). Es wurden aber auch Fälle von Krampfanfällen bei Patienten gemeldet, die keine derartigen Risikofaktoren aufwiesen.
Patienten unter Antikoagulation
Bei Patienten unter Antikoagulation ist besondere Vorsicht geboten, da das Risiko eines Hämatoms an der Injektionsstelle besteht.
Weitere Vorsichtsmassnahmen
Parästhesien und schwere Migräne sind selten. In schweren oder rezidivierenden Fällen ist die Behandlung zu unterbrechen.
Bei Patienten, die mit GnRH-Analoga behandelt wurden, wurde ein Anstieg der Lymphozytenzahl beschrieben.
Warnhinweise im Zusammenhang mit der Behandlung von Prostatakarzinom
Symptome und Komplikationen von Prostatakarzinom: Wie andere GnRH-Agonisten bewirkt auch Triptorelin einen vorübergehenden Anstieg des zirkulierenden Testosteronspiegels innerhalb der ersten Woche nach der ersten Injektion der Depotform des Wirkstoffs. Dies ist auch möglich, wenn der Abstand zwischen zwei Injektionen > 24 Wochen beträgt. Im Gegensatz zum Abfall des Testosteronspiegels nach einer Orchiektomie kann es bei einem geringen Prozentsatz der Patienten (< 5 %) zu einem anfänglichen Anstieg des zirkulierenden Testosteronspiegels und dadurch bedingt zu einer vorübergehenden Verschlechterung der Anzeichen und Symptome eines Prostatakarzinoms kommen. Dies äussert sich meist in einer Verstärkung der Krebsschmerzen, hauptsächlich durch eine Neuropathie, Hämaturie und Knochenschmerzen, die durch eine symptomatische Behandlung unter Kontrolle gebracht werden können. In Einzelfällen kann es zu einer Verschlimmerung der Symptome kommen, entweder zu einer Obstruktion der Harnröhre oder des Blasensphinkters oder zu einer Rückenmarkskompression durch Metastasen, was mit Lähmungen mit oder ohne Todesfolge einhergehen kann.
Wenn eine Rückenmarkskompression oder Nierenversagen auftritt, ist eine Standardbehandlung dieser Komplikationen einzuleiten und allenfalls eine notfallmässige Orchiektomie in Betracht zu ziehen Eine gewissenhafte Kontrolle ist daher in den ersten Behandlungswochen unerlässlich, besonders bei Patienten mit Wirbelsäulenmetastasen und/oder Harnwegsobstruktion.
In der Anfangsphase der Behandlung sollte die gleichzeitige Gabe eines Antiandrogens in Betracht gezogen werden, um den anfänglichen Anstieg des Serumtestosteronspiegels zu kompensieren und einer Verschlechterung der klinischen Symptomatik vorzubeugen.
Osteoporose/Knochendichte:
Die Gabe von synthetischen GnRH-Analoga bei der Behandlung des Prostatakarzinoms kann zu Knochenschwund bis hin zur Osteoporose führen und somit das Risiko von Knochenbrüchen erhöhen. Die Folge kann eine falsche Diagnose von Knochenmetastasen sein. Besondere Vorsicht ist bei Patienten geboten, die zusätzliche Risikofaktoren für Osteoporose aufweisen (wie chronischer Alkoholabusus, Rauchen, Unterernährung, positive Familienanamnese für Osteoporose oder Langzeitbehandlung mit Arzneimitteln, welche die Knochendichte reduzieren, wie Kortikosteroide oder Antiepileptika).
Diabetesrisiko/kardiovaskuläres Risiko:
Epidemiologische Studien zeigten metabolische Veränderungen (z.B. beeinträchtigte Glukosetoleranz, Fettleber) und ein erhöhtes Risiko für Diabetes mellitus und/oder kardiovaskuläre Erkrankungen bei Männern, die mit GnRH-Agonisten behandelt wurden. Dennoch haben prospektive Daten den Zusammenhang zwischen der Behandlung mit GnRH-Analoga und einer erhöhten kardiovaskulären Mortalität nicht bestätigt. Es ist ratsam, vor Beginn der Behandlung mit Triptorelin das Risiko von metabolischen oder kardiovaskulären Erkrankungen zu beurteilen und die Patienten während der Therapie zu überwachen.
Auswirkung auf das QT/QTc-Intervall:
Langfristiger Androgenentzug kann das QT-Intervall verlängern. Patienten mit QT-Verlängerung, Elektrolytstörungen oder Herzinsuffizienz sind daher zu überwachen. Die gleichzeitige Anwendung von Triptorelin mit Arzneimitteln, die bekanntermassen das QT-Intervall verlängern oder Torsade de Pointes auslösen können, wie Antiarrhythmika der Klasse IA (z.B. Chinidin, Disopyramid) oder der Klasse III (z.B. Amiodaron, Sotalol), ist mit Vorsicht zu erwägen.
Anämie Risiko:
Aufgrund des Androgenentzugs kann die Behandlung mit GnRH-Analoga das Risiko einer Anämie erhöhen. Dieses Risiko sollte bei behandelten Patienten beurteilt und entsprechend überwacht werden.
Warnhinweise im Zusammenhang mit der Behandlung von zentraler Pubertas praecox
Die Diagnose PPC ist vor Beginn der Behandlung durch geeignete Hormonbestimmungen (z.B. GnRH-Stimulationstest) und das nachweisliche Vorhandensein entsprechender klinischer Symptome zu bestätigen.
Eine Pseudopubertas praecox (Hyperplasie oder Tumor der Nebennieren oder der Gonaden) und eine Gonadotropin-unabhängige Pubertas praecox (Testotoxikose, familiäre Leydig-Zell-Hyperplasie) sind auszuschliessen,
ebenso wie das Vorhandensein eines intrakraniellen Tumors. Es liegen keine Daten zur Anwendung von Pamorelin 22,5 mg bei pädiatrischen Patienten mit intrakraniellem Tumor vor. Daher muss in diesem Fall eine sorgfältige individuelle Risiko-Nutzen-Bewertung vorgenommen werden.
Bei Mädchen muss vor der Verschreibung von Triptorelin bestätigt werden, dass die Patientin nicht schwanger ist.
Im ersten Monat der Behandlung bei Mädchen kann die anfängliche Stimulation der Eierstöcke, gefolgt von der durch die Behandlung induzierten Suppression des Östrogenspiegels, zu leichten bis mittelstarken vaginalen Blutungen führen. Die Eltern sind auf das mögliche Auftreten solcher Blutungen hinzuweisen. Bei anhaltenden Blutungen ist ein Arzt hinzuzuziehen.
Idiopathische intrakranielle Hypertension
Bei pädiatrischen Patienten, die Triptorelin erhielten, wurde über intrakranielle Hypertension (Pseudotumor cerebri) berichtet. Die Patienten sind auf die Anzeichen und Symptome einer idiopathischen intrakraniellen Hypertension hinzuweisen (starke oder wiederkehrende Kopfschmerzen, Sehstörungen, Schmerzen hinter dem Auge, Schwindel, Übelkeit und Tinnitus). Bei idiopathischer intrakranieller Hypertension sollte das Absetzen von Triptorelin in Betracht gezogen werden.
Epiphysiolyse
Nach Absetzen der Behandlung kann es zu einer Epiphysiolyse der Hüfte kommen, gegebenenfalls als Folge der Schwächung des Epiphysenfugenknorpels aufgrund der niedrigen Östrogenkonzentrationen während der Behandlung und der erhöhten Wachstumsgeschwindigkeit nach dem Absetzen der Behandlung, was eine Verschiebung der Epiphysen begünstigt.
Knochendichte
Die Behandlung mit GnRH-Agonisten kann zu einer Abnahme der Knochenmineraldichte (KMD) führen. Nach Absetzen der Behandlung bleibt jedoch die anschliessende Knochenmasse erhalten und der Höhepunkt der Zunahme der Knochenmasse am Ende der Pubertät scheint durch die Behandlung nicht beeinflusst zu werden. Es gibt jedoch keine Langzeitdaten über die Entwicklung der Knochenmineraldichte nach Absetzen einer Triptorelin-Behandlung bei Kindern.
Sonstige Vorsichtsmassnahmen bei Kindern
Nach Beendigung der Behandlung setzt die pubertäre Entwicklung wieder ein.
Die Daten zur Fertilität von Patienten, die in der Kindheit mit GnRH-Analoga behandelt wurden, sind nach wie vor begrenzt. Bei den meisten Mädchen setzt die Menarche etwa 1 Jahr nach dem Ende der Behandlung ein.
Die Sicherheit und Wirksamkeit von Pamorelin LA 22,5 mg wurde nur bei Kindern mit zentraler vorzeitiger Pubertät untersucht. Eine Anwendung bei Kindern, die keine erhöhten LH-Werte aufweisen, wird daher nicht empfohlen.
Es liegen nur begrenzte Daten zur Wirksamkeit von Pamorelin LA 22,5 mg bei Jungen vor (siehe Abschnitt «Eigenschaften/Wirkungen»).
Pharmazeutische Hilfsstoffe von besonderem Interesse
Dieses Arzneimittel enthält weniger als 1 mmol (23 mg) Natrium pro Tablette, d.h. es ist nahezu «natriumfrei».
InteraktionenPharmakodynamische Interaktionen
Wenn Triptorelin zusammen mit Arzneimitteln angewendet wird, welche die hypophysäre Sezernierung von Gonadotropinen beeinflussen, ist besondere Vorsicht geboten und es wird empfohlen, den Hormonstatus der Patienten zu überwachen.
Pharmakokinetische Interaktionen
Die Wahrscheinlichkeit einer Beteiligung von Cytochrom-P450(CYP)-Enzymen am Stoffwechsel und an der Elimination von Triptorelin ist gering. Darüber hinaus haben In-vitro-Daten gezeigt, dass Triptorelin weder ein CYP-Inhibitor oder -Induktor noch ein Substrat oder Inhibitor von P-Glykoprotein (P-gp) ist. Daher sind pharmakokinetische Interaktionen mit Triptorelin unwahrscheinlich.
Schwangerschaft, StillzeitSchwangerschaft
Es sind keine Studien bei schwangeren Frauen durchgeführt worden. Triptorelin ist während der Schwangerschaft kontraindiziert, da die Anwendung von GnRH-Agonisten mit einem Risiko für Fehlgeburt oder fetale Anomalien verbunden ist.
Stillzeit
Es ist nicht bekannt, ob Triptorelin in die Muttermilch übergeht oder die Produktion von Muttermilch beeinflussen kann. Triptorelin ist während der Stillzeit kontraindiziert.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt. Verschiedene Nebenwirkungen wie Apathie, Krampfanfälle und Sehstörungen können jedoch die Reflexe abschwächen und die Fähigkeit zum Führen eines Kraftfahrzeugs und zum Bedienen von Werkzeugen oder Maschinen beeinträchtigen.
Unerwünschte WirkungenAllgemein
Kurz nach der Injektion von Pamorelin LA 22,5 mg wurden einige seltene allergische Reaktionen festgestellt, die sich unter der üblichen Behandlung zurückbildeten.
Die häufigsten Nebenwirkungen, die unter der Behandlung mit Triptorelin beobachtet wurden, waren auf seine erwarteten physiologischen Effekte zurückzuführen: anfänglicher Anstieg des Testosteronspiegels, gefolgt von einer fast vollständigen Suppression des Testosterons.
Prostatakarzinom
Aufgrund des vorübergehenden Anstiegs des Testosteronspiegels kann es 7 bis 10 Tage nach der ersten Injektion zu einer Verstärkung der Krebsschmerzen kommen (siehe «Warnhinweise und Vorsichtsmassnahmen»). Diese Schmerzen gehen gewöhnlich zurück, sobald das Karzinom auf die Behandlung anspricht. Es kann eine vorübergehende Behandlung mit einem Antiandrogen in Betracht gezogen werden.
Die am häufigsten beobachteten Wirkungen waren Hitzewallungen (70 %), Knochenschmerzen (26 %) und eine Atrophie der Genitalien (12 %).
Die folgenden unerwünschten Wirkungen wurden in klinischen Studien oder im Rahmen der Pharmakovigilanz berichtet. Entsprechend ihrer Häufigkeit werden die folgenden unerwünschten Wirkungen wie folgt klassifiziert: sehr häufig (≥1/10); häufig (≥1/100, < 1/10); gelegentlich (≥1/1000, < 1/100); selten (≥1/10'000, < 1/1000); sehr selten (< 1/10'000), nicht bekannt (beruht hauptsächlich auf spontanen Meldungen aus der Marktüberwachung, die genaue Häufigkeit kann nicht angegeben werden).
Infektionen und parasitäre Erkrankungen
Gelegentlich: Harnwegsinfektionen.
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen)
Häufig: Tumor-Flare.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Thrombozytose.
Selten: Lymphadenopathie.
Nicht bekannt: Anämie
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Endokrine Erkrankungen
Während der Post-Marketing-Phase wurden seltene Fälle von Hypophysenapoplexie beschrieben (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Stoffwechsel- und Ernährungsstörungen
Häufig: Anstieg der alkalischen Phosphatase, Hyperurikämie, Anorexie.
Gelegentlich: Hyperglykämie, Anstieg des Harnstoff-Stickstoffs, Diabetes, Anstieg des nicht aus Proteinen stammenden Stickstoffgehalts im Blut (Azotämie), Gewichtszunahme.
Psychiatrische Erkrankungen
Häufig: Stimmungsschwankungen, Depression, verminderte Libido.
Gelegentlich: Nervosität, Amnesie, Euphorie.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Schwindel, Schlaflosigkeit.
Gelegentlich: Parästhesie, Schläfrigkeit, Synkope.
Selten: Migräne, Dysgeusie, Rückenmarkskompression, Hypästhesien.
Nicht bekannt: Krampfanfälle.
Augenerkrankungen
Häufig: Augenschmerzen, Bindehautentzündung.
Selten: Sehstörungen, Gesichtsfeldstörungen, Stauungspapille.
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Tinnitus.
Herzerkrankungen
Selten: myokardiale Ischämie.
Nicht bekannt: Verlängerung des QT-Intervalls.
Gefässerkrankungen
Sehr häufig: Hitzewallungen (70 %).
Häufig: Hypertonie.
Gelegentlich: Hypotonie, tiefe Venenthrombose, Lungenembolie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten, Dyspnoe, Pharyngitis.
Gelegentlich: Rhinitis.
Erkrankungen des Gastrointestinaltrakts
Häufig: Bauchschmerzen, Übelkeit, Obstipation, Durchfall, Dyspepsie.
Gelegentlich: Erbrechen, Tenesmus, gastroösophagealer Reflux.
Leber und Gallenerkrankungen
Häufig: Leberfunktionsstörungen.
Gelegentlich: cholestatische Hepatitis.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Exanthem.
Gelegentlich: vermehrtes Schwitzen, Alopezie, analer Juckreiz, Ekzem, bullöser Hautausschlag.
Selten: Urtikaria, Photosensibilisierungsreaktionen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Knochenschmerzen (26 %).
Häufig: Rückenschmerzen, Schmerzen in den Beinen, Arthralgie, Myalgie, Muskelkrämpfe in den unteren Gliedmassen.
Gelegentlich: Arthrose, Muskelschwäche.
Selten: pathologische Frakturen.
Erkrankungen der Nieren und Harnwege
Häufig: Dysurie, Harnverhalt.
Gelegentlich: Pollakisurie, Nykturie, Funktionsstörungen der Harnröhre, Harninkontinenz, Nierenschmerzen, Hämaturie, Nierenfunktionsstörung.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Sehr häufig: Volumenabnahme der Genitalien (12 %).
Häufig: Impotenz, Gynäkomastie, Brustdrüsenschmerzen.
Gelegentlich: Prostatabeschwerden, Hodenbeschwerden, Entzündung der Brustdrüse.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Schmerzen, Müdigkeit, Brustkorbschmerzen, Asthenie, Schmerzen an der Injektionsstelle, periphere Ödeme.
Gelegentlich: Unwohlsein, Entzündungen und andere Reaktionen an der Injektionsstelle.
Selten: perineale Schmerzen.
Sicherheit bei pädiatrischen Patienten (zentrale Pubertas praecox)
Die folgenden unerwünschten Wirkungen wurden bei der Anwendung von Triptorelin-Präparaten im Rahmen von klinischen Studien oder der Pharmakovigilanz berichtet. Entsprechend ihrer Häufigkeit werden unerwünschte Wirkungen wie folgt klassifiziert: sehr häufig (≥1/10); häufig (≥1/100, < 1/10); gelegentlich (≥1/1000, < 1/100); selten (≥1/10'000, < 1/1000); sehr selten (< 1/10'000), nicht bekannt (beruht hauptsächlich auf spontanen Meldungen aus der Marktüberwachung, die genaue Häufigkeit kann nicht angegeben werden).
Erkrankungen des Immunsystems
Häufig: Überempfindlichkeitsreaktionen (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Nicht bekannt: anaphylaktischer Schock, angioneurotisches Ödem.
Endokrine Störungen
Nicht bekannt: erhöhter Prolaktinspiegel.
Stoffwechsel- und Ernährungsstörungen
Häufig: Gewichtszunahme.
Gelegentlich: Adipositas.
Psychiatrische Erkrankungen
Gelegentlich: Stimmungsschwankungen.
Nicht bekannt: Depression, Nervosität, emotionale Labilität.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen.
Nicht bekannt: Krampfanfälle, idiopathische intrakranielle Hypertension (Pseudotumor cerebri).
Augenerkrankungen
Gelegentlich: Sehstörungen.
Nicht bekannt: Störungen des Gesichtsfeldes.
Gefässerkrankungen
Häufig: Hitzewallungen.
Nicht bekannt: Hypertonie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Epistaxis.
Erkrankungen des Gastrointestinaltrakts
Häufig: Bauchschmerzen.
Gelegentlich: Übelkeit, Obstipation, Erbrechen.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Akne.
Gelegentlich: Pruritus, Urtikaria, Hautausschlag.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Nackenschmerzen.
Nicht bekannt: Myalgie.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Sehr häufig: Vaginalblutungen (einschliesslich vaginaler Blutung, Abbruchblutung, Uterusblutung, vaginalem Ausfluss, vaginaler Blutung einschliesslich Schmierblutung).
Gelegentlich: Brustdrüsenschmerzen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Reaktion an der Injektionsstelle (einschliesslich Schmerzen an der Injektionsstelle, Erythem und Entzündung).
Nicht bekannt: Unwohlsein.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungDie pharmakologischen Eigenschaften von Triptorelin machen eine versehentliche oder absichtliche Überdosierung unwahrscheinlich. Tierversuche zeigen, dass auch bei höheren Dosen von Triptorelin keine anderen als die erwarteten therapeutischen Auswirkungen auf die Konzentration der Sexualhormone und das Fortpflanzungssystem auftreten.
Behandlung
Eine mögliche Überdosierung ist symptomatisch zu behandeln.
Eigenschaften/WirkungenATC-Code
L02AE04
Wirkungsmechanismus
Durch den Ersatz der Aminosäure Glycin durch D-Tryptophan an Position 6 von Gonadorelin entsteht ein Agonist, dessen biologische Aktivität stärker ist als die des natürlichen Hormons Gonadotropin-Releasing-Hormon (GnRH). Diese erhöhte Wirkung kann auf eine verstärkte Affinität für die Hypophysenrezeptoren und eine langsamere Inaktivierung im Zielgewebe zurückgeführt werden.
Pharmakodynamik
Bei der einmaligen und intermittierenden Gabe von GnRH wird die Freisetzung von LH und FSH aus der Hypophyse stimuliert. Bei einer kontinuierlichen Dosierung hingegen, wie sie bei der verzögerten Freisetzung nach Injektion von Pamorelin LA 22,5 mg erfolgt, kann ein «paradoxer» Effekt beobachtet werden: Die Plasmaspiegel von LH, FSH, Testosteron und Östrogenen/Progesteron sinken nach einem vorübergehenden Anstieg zu Beginn der Behandlung innerhalb von 2–4 Wochen bis auf Kastrationsniveau ab. Dies führt zu einer Atrophie der akzessorischen Geschlechtsdrüsen. Diese Auswirkungen sind nach Beendigung der medikamentösen Behandlung in der Regel reversibel.
Bei Kindern mit Pubertas praecox führt die Hemmung der gonadotropen Hyperaktivität der Hypophyse zu einem Abfall des LH-Spiegels laut GnRH (oder GnRH-Agonist)-Stimulationstest und zur Suppression der Östradiol- und Testosteronsezernierung bei Mädchen bzw. Knaben. Es ist zu erwarten, dass nach Absetzen der Behandlung mit Triptorelin die physiologischen Reifungsprozesse wieder einsetzen, sobald die Gonadotropine wieder präpubertäre Werte erreicht haben.
Die Derivate Triptorelin-Embonat und -Acetat sind in Bezug auf Pharmakodynamik und Toxizität gleichwertig und austauschbar.
Klinische Wirksamkeit
Prostatakarzinom
Pamorelin LA 22,5 mg wurde in einer offenen, nicht kontrollierten klinischen Studie bei 120 männlichen südafrikanischen Patienten mit fortgeschrittenem Prostatakarzinom untersucht, von denen 64 % Kaukasier, 23 % Schwarze und 13 % andere ethnische Gruppen waren. Ihr Alter reichte von 51 bis 96 Jahren (Durchschnittsalter 71 Jahre).
Diese Patienten erhielten Pamorelin LA 22,5 mg (n = 120) alle 168 Tage für insgesamt 2 Dosen (maximale Behandlungsdauer: 336 Tage). Die primären Wirksamkeitskriterien waren das Erreichen des Kastrationsniveaus nach 29 Tagen und dessen Aufrechterhaltung von Tag 57 bis 337.
Die dem Niveau nach Kastration entsprechenden Serumtestosteronspiegel (≤1,735 nmol/l) wurden an Tag 29e bei 117 von 120 mit Pamorelin LA 22,5 mg behandelten Patienten (97,5 %) erreicht.
Die dem Niveau nach Kastration entsprechenden Testosteronspiegel im Serum von Tag 57e bis 337e wurden bei 93 % der mit Pamorelin LA 22,5 mg behandelten Patienten aufrechterhalten.
In einer randomisierten klinischen Studie der Phase III (EORTC 22961) mit 970 Patienten mit lokal fortgeschrittenem Prostatakarzinom (hauptsächlich T2c-T4, mit Patienten im Stadium T1c bis T2b mit Befall der regionären Lymphknoten), die mit Strahlentherapie behandelt wurden, erhielten 483 Patienten eine kurze (6 Monate) kombinierte Androgen-Suppression und 487 Patienten eine lange (3 Jahre) kombinierte Androgen-Suppression. Insgesamt betrug die Gesamtmortalität nach 5 Jahren 19 % in der Gruppe «kurze Hormontherapie» und 15 % in der Gruppe «lange Hormontherapie», was einem relativen Risiko von 1,42 entspricht. Die spezifisch auf Prostatakarzinom zurückzuführende 5-Jahres-Mortalität betrug 5 % in der Gruppe «kurze Hormontherapie» und 3 % in der Gruppe «lange Hormontherapie», was einem relativen Risiko von 1,71 entspricht.
Zentrale Pubertas praecox:
In einer nicht vergleichenden klinischen Studie erhielten 44 Kinder mit zentraler Pubertas praecox (39 Mädchen und 5 Knaben) 2 intramuskuläre Injektionen von Pamorelin LA 22,5 mg im Abstand von 6 Monaten und wurden 12 Monate (48 Wochen) lang überwacht. Die Suppression der stimulierten LH-Konzentrationen bis auf präpubertäre Werte wurde nach 6 bzw. nach 12 Monaten bei 93 % bzw. 98 % der Teilnehmenden erreicht.
Nachfolgend wurden eine Rückbildung oder Stabilisierung der sekundären Geschlechtsmerkmale sowie eine Verlangsamung der beschleunigten Knochenreifung und des Wachstums beobachtet. Nach 6 Monaten Behandlung erreichten über 90 % der Mädchen und 3 der 5 Knaben LH-Werte, die einem präpubertären Niveau entsprachen. Angesichts der sehr geringen Anzahl von Knaben, die in die Studie einbezogen wurden, sind mögliche geschlechtsspezifische Unterschiede im Ansprechen auf die Behandlung nicht auszuschliessen.
PharmakokinetikAbsorption
Nach einer einmaligen intramuskulären Injektion von Pamorelin LA 22,5 mg bei Patienten mit Prostatakarzinom betrug die Tmax 3 (2–12) Stunden und die Cmax (Tag 0–169) 40,0 (22,2–76,8) ng/ml.
Es wurde keine klinisch relevante Akkumulation nach der zweiten Injektion beobachtet.
Distribution
Nach intravenöser Bolusgabe entspricht die Distribution von Triptorelin einem 3-Kompartiment-Modell mit Halbwertszeiten von 6 Minuten, 45 Minuten und 3 Stunden. Das Distributionsvolumen entspricht ungefähr 30 Litern im Steady-State. In klinisch relevanten Konzentrationen wird Triptorelin nicht an Plasmaproteine gebunden.
Metabolismus
Beim Menschen wurden keine Metaboliten von Triptorelin gefunden. Die pharmakokinetischen Daten beim Menschen zeigen aber, dass die durch Gewebezerstörung entstehenden C-terminalen Fragmente entweder vollständig im Gewebe zerstört oder schnell und endgültig im Plasma zerstört oder über die Nieren ausgeschieden werden. Eine Beteiligung der CYP450-Enzyme am Metabolismus ist unwahrscheinlich.
Elimination
Triptorelin wird über die Leber und Nieren ausgeschieden. Nach i. v. Injektion von 0,5 mg Triptorelin wurden 42 % dieser Dosis als nicht metabolisiertes Triptorelin im Urin ausgeschieden.
Die Gesamt-Clearance von Triptorelin liegt bei etwa 200 ml/min und die terminale Halbwertszeit bei 2,8 Stunden.
Kinetik spezieller Patientengruppen
Pädiatrische Population
Es liegen nur begrenzte pharmakokinetische Daten bei pädiatrischen Patienten vor. Die Cmax und Tmax unterscheiden sich nicht signifikant von denen der Erwachsenen.
Ältere Patienten
Der Einfluss des Alters auf die Pharmakokinetik von Triptorelin wurde nicht systematisch untersucht. Pharmakokinetische Daten, die an jungen männlichen Freiwilligen im Alter von 20 bis 22 Jahren mit einer supraphysiologischen Kreatinin-Clearance (ca. 150 ml/min) erhoben wurden, deuten jedoch darauf hin, dass Triptorelin bei jungen Menschen doppelt so schnell eliminiert wird. Dies ist darauf zurückzuführen, dass die Kreatinin-Clearance mit zunehmendem Alter abnimmt.
Beeinträchtigte Nierenfunktion
Bei einer beeinträchtigten Nierenfunktion nimmt die Clearance von Triptorelin proportional zur Kreatinin-Clearance ab. So war der AUC-Wert bei erwachsenen Patienten mit mittelstark beeinträchtigter Nierenfunktion (mittlere Kreatinin-Clearance 40 ml/min) etwa doppelt so hoch wie bei Patienten mit normaler Nierenfunktion und bei Patienten mit stark beeinträchtigter Nierenfunktion (mittlere Kreatinin-Clearance 8,9 ml/min) etwa 2,5-mal so hoch.
Die Halbwertszeit betrug 6,7 Stunden bei Patienten mit mittelstark beeinträchtigter Nierenfunktion und 7,8 Stunden bei Patienten mit stark beeinträchtigter Nierenfunktion.
Beeinträchtigte Leberfunktion
Bei erwachsenen Patienten mit eingeschränkter Leberfunktion war der AUC-Wert von Triptorelin etwa 3,7-mal höher als bei gesunden Probanden und die Halbwertszeit von Triptorelin betrug 7,65 Stunden. Der Anteil an nicht-metabolisiertem Triptorelin, der im Urin ausgeschieden wurde, war bei diesen Patienten auf 62 % erhöht.
Präklinische DatenDie akute Toxizität von Triptorelin ist gering. Die beobachteten Effekte sind im Wesentlichen auf eine Verstärkung der pharmakologischen Wirkung von Triptorelin zurückzuführen.
Nach subkutaner Injektion von 10 µg/kg bei Ratten an Tag 6 bis 15 der Trächtigkeit (im Vergleich zur klinischen Dosis von 3,75 mg alle 4 Wochen beim Menschen) hatte Triptorelin keine embryotoxischen, teratogenen oder fetotoxischen Auswirkungen. Bei 100 µg/kg wurde hingegen eine geringere Gewichtszunahme der Muttertiere sowie eine Zunahme der Resorptionen beobachtet.
Toxizität bei wiederholter Gabe
Es wurden keine Fertilitätsstudien bei männlichen Ratten durchgeführt. In Studien zur chronischen Toxizität mit klinischen Dosierungen verursachte Triptorelin makro- und mikroskopische Veränderungen in Fortpflanzungsorganen von Ratten und Hunden, die auf die Suppression der Gonadenfunktion aufgrund der pharmakologischen Aktivität dieses Wirkstoffs zurückgeführt wurden Diese Veränderungen bildeten sich in der Erholungsphase teilweise zurück.
Mutagenität
Triptorelin ist nicht mutagen, weder in vitro noch in vivo.
Kanzerogenität
Eine 23-monatige Kanzerogenesestudie bei Ratten zeigte, dass bei jeder Dosierungsstufe fast 100 % benigner Hypophysentumore zum vorzeitigen Tod führten. Diese erhöhte Inzidenz benigner Hypophysentumore bei Ratten ist eine häufige Folge der Behandlung mit GnRH-Agonisten. Die klinische Relevanz dieser Beobachtung ist nicht bekannt.
Triptorelin wurde Mäusen in Dosen von bis zu 6000 µg/kg verabreicht und zeigte nach 18 Monaten Behandlung keine onkogene Wirkung.
Reproduktionstoxizität
Bei einer 8-mal höheren Dosis als für Menschen empfohlen (bezogen auf die Körperoberfläche) wurde in Tierversuchen bei Ratten eine Toxizität für die Organogenese nachgewiesen (maternale und embryonale Toxizität). Bei jungen Ratten, die in utero hohen Dosen von Triptorelin ausgesetzt waren, gab es vereinzelte Fälle von Hydroureter.
Im Rahmen der assistierten Reproduktion wurde Triptorelin in kontrollierten Studien häufig zur Suppression endogener Gonadotropine und Östrogene eingesetzt.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Beeinflussung diagnostischer Methoden
Triptorelin in therapeutischen Dosen führt zur Suppression der Hypophysen-Gonaden-Achse. Die normale Funktion wird in der Regel nach Absetzen der Behandlung wiederhergestellt. Die Ergebnisse diagnostischer Hypophysen-Gonaden-Funktionstests während der Behandlung oder 4 bis 12 Wochen nach Absetzen der GnRH-Agonisten können daher irreführend sein.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach dem Öffnen
Aus mikrobiologischen Gründen sollte die Suspension unmittelbar nach der Rekonstitution injiziert werden.
Besondere Lagerungshinweise
Nicht über 25 °C lagern.
Nicht einfrieren.
In der Originalverpackung aufbewahren.
Behälter fest verschlossen halten.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Die Herstellung der Suspension zur Injektion sollte unmittelbar vor der Injektion erfolgen.
Es ist die bebilderte Anleitung am Ende des Dokuments zu beachten.
Zulassungsnummer61238 (Swissmedic)
PackungenPamorelin LA 22,5 mg ist in zwei Darreichungsformen erhältlich:
·1 Durchstechflasche mit 22,5 mg Triptorelin als Pulver
·1 Fertigspritze mit 2 ml Lösungsmittel
·1 Durchstechflaschenadapter und 1 Nadel (A)
oder
·1 Durchstechflasche mit 22,5 mg Triptorelin als Pulver
·1 Ampulle mit 2 ml Lösungsmittel
·1 Spritze und 2 Nadeln. (A)
ZulassungsinhaberinDebiopharm Research & Manufacturing SA, 1920 Martigny
Stand der InformationMai 2025
02-010626/12
Anleitung zur Herstellung einer Suspension
Allgemeine Anweisungen und Empfehlungen
Das Produkt ist eine Suspension von Mikropartikeln:
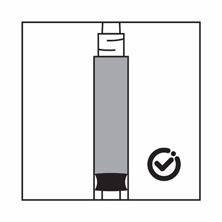
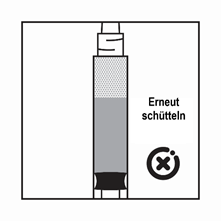
·Das Produkt ist eine Suspension von Mikropartikeln, die in der Verdünnung sedimentieren können. Das Produkt sollte homogen, dickflüssig und milchig aussehen. Wenn das Produkt in der Durchstechflasche sedimentiert, schütteln Sie sie erneut:
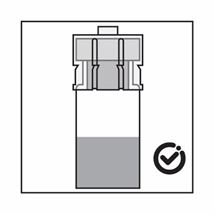

·Wenn sich die Partikel in der Spritze absetzen, führt dies zu einer Blockierung der Nadel bei der Verabreichung. Es ist sehr wichtig, das Produkt innerhalb von 2 Minuten nach der Rekonstitution in der Durchstechflasche zu injizieren.
·Wenn das Produkt in der Spritze sedimentiert, ziehen Sie etwas Luft in die Spritze auf, schütteln Sie sie erneut und drücken Sie die Luft heraus (ohne Flüssigkeit aus der Nadel herauszudrücken), bevor Sie das Produkt verabreichen.
Anweisungen zur Herstellung der Suspension von Pamorelin LA 22,5 mg in der Darreichungsform mit einer Fertigspritze mit Lösungsmittel
|
1
|
Die Durchstechflasche mit dem Pulver entnehmen.
Den Plastikdeckel der Durchstechflasche entfernen.
|
|

| |
2
|
Die Schutzfolie vom Adaptersystem entfernen.
Den Durchstechflaschenadapter nicht aus dem Blister nehmen. Die Durchstechflasche auf eine flache, harte Oberfläche stellen. Den Durchstechflaschenadapter auf dem Verschluss der Durchstechflasche zentrieren und hineindrücken, bis ein Klicken zu hören ist.
Den Blister entfernen und entsorgen.
|
|

|
| |
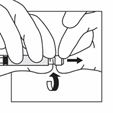
3
|
Nehmen Sie die Spritze zur Hand, halten Sie sie am (drehbaren) Kunststoff-Konnektor zwischen Zeigefinger und Daumen einer Hand fest und schrauben Sie mit der anderen Hand die Kappe ab.
Halten Sie die Spritze weiterhin am drehbaren Konnektor fest und befestigen Sie sie vertikal am Adapter, indem Sie eine halbe Drehung im Uhrzeigersinn machen (nur, bis ein Widerstand zu spüren ist).
Achtung: Ein zu festes Anziehen kann zu einer Unterbrechung der Verbindung und zu Undichtigkeiten führen.
|
|
|
| |
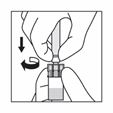
4
|
Halten Sie die Durchstechflasche am Adapter mit einer Hand fest, drücken Sie mit der anderen Hand den Kolben der Spritze hinunter und injizieren Sie langsam den gesamten Inhalt der Spritze in die Durchstechflasche.
Nun den Patienten für die Injektion vorbereiten. Die folgenden Schritte sollten ohne Unterbrechung durchgeführt werden.
|
|
| |
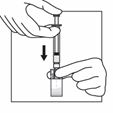
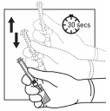
5
|
Halten Sie das gesamte System (Spritze, Adapter und Durchstechflasche) fest in der Hand und schütteln Sie es dann 30 Sekunden lang kräftig auf und ab.
Überprüfen Sie das Aussehen der Suspension, indem Sie durch den Boden der Durchstechflasche schauen. Die Suspension sollte homogen, dickflüssig und milchig aussehen.
Schütteln Sie das System erneut, wenn sich eine Sedimentation zeigt.
Wenn während des Schüttelns ein Teil der Suspension in der Spritze aufsteigt, drücken Sie mit dem Kolben die Suspension wieder in die Durchstechflasche. Schütteln Sie das System erneut, bevor Sie zum nächsten Schritt übergehen.
Das Produkt sollte nun innerhalb von 2 Minuten injiziert werden.
|
|
| |
6
|
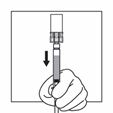
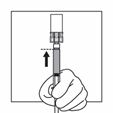
Drehen Sie das System unmittelbar so, dass die Durchstechflasche oben und die Spritze unten ist. Ziehen Sie vorsichtig an der Kolbenstange, um den gesamten Inhalt der Durchstechflasche in die Spritze aufzuziehen.
|
|
|
| |
7
|
Wenn der gesamte Inhalt in die Spritze aufgezogen ist, drücken Sie die Luft aus der Spritze in die Durchstechflasche. Stoppen Sie, sobald die Suspension die Basis des Spritzenkopfes erreicht.
|
|

| |
|
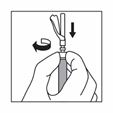
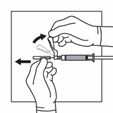
Trennen Sie die Spritze vom Adapter, indem Sie die Spritze mit einer Hand festhalten und mit der anderen Hand den Adapter gegen den Uhrzeigersinn drehen.
Halten Sie die Spritze am drehbaren Konnektor fest und befestigen Sie die Injektionsnadel.
Vergewissern Sie sich vor der Injektion, dass das Produkt homogen, dickflüssig, milchig und frei von Sedimenten ist.
|
|
|
| |
8
|
Schieben Sie die Sicherheitshülle hinter die Nadel und in Richtung des Spritzenkörpers. Die Sicherheitshülle bleibt in der Position, in die sie gebracht wurde.
Entfernen Sie den transparenten Nadelschutz.
|
|

| |
|
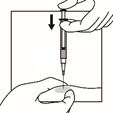
Die Nadel nicht mit der Suspension aspirieren.
Die Spritze mit der Suspension ist nun bereit für die Injektion. Die Suspension sollte sofort verabreicht werden (weniger als 2 Minuten nach der Rekonstitution), um eine übermässige Verdickung der Suspension zu vermeiden.
|
|
| |
9
|
Injizieren Sie die Suspension relativ schnell und ohne Unterbrechung intramuskulär. Achten Sie darauf, dass die gesamte Menge innerhalb von 10 Sekunden ohne Unterbrechung injiziert wird.
Die Injektionsstelle muss regelmässig gewechselt werden.
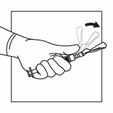
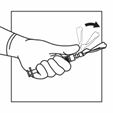
Aktivieren Sie das Sicherheitssystem der Injektionsnadel, indem Sie Ihren Daumen oder Zeigefinger auf dem strukturierten Bereich der Sicherheitshülle zentrieren und ihn nach vorne auf die Nadel drücken, bis Sie hören oder fühlen, dass er einrastet. Führen Sie den Vorgang mit einer Hand durch und aktivieren Sie den Sicherheitsmechanismus mit grossem Abstand zu sich und anderen. Entsorgen Sie die Spritze nach einmaligem Gebrauch sofort in einem Behälter für scharfe Gegenstände.
|
|
|
|
Die Nadeln in einem dafür vorgesehenen Behälter entsorgen.
Nur zur einmaligen Verwendung. Jede nicht verwendete Suspension muss entsorgt werden.
Anweisungen zur Herstellung der Suspension von Pamorelin LA 22,5 mg in der Darreichungsform mit Lösungsmittelampulle
|
1. Vorbereitung der Injektion
2 Nadeln sind im Set enthalten:
·Die Rekonstitutionsnadel ohne Sicherheitssystem
·Die Injektionsnadel mit Sicherheitssystem
·Die Lösung, die sich eventuell im oberen Teil der Ampulle befindet, wird in den Hauptbehälter der Lösungsmittelampulle geklopft.
·Die Nadel ohne Sicherheitssystem auf die Spritze drehen (den Nadelschutz noch nicht entfernen!).
·Die Lösungsmittelampulle aufbrechen (Brechpunkt zu sich gerichtet).
|
| |
·Den Nadelschutz der Rekonstitutionsnadel entfernen und das gesamte Lösungsmittel in die Spritze aufziehen (Abb. A).
·Die Spritze mit dem Lösungsmittel beiseitelegt.
·Die Durchstechflasche mit dem Pulver entnehmen.
·Den Plastikdeckel der Durchstechflasche entfernen.
|
|
| |
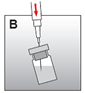
·Die Spritze mit dem Lösungsmittel wieder aufnehmen, die Nadel in den Gummistopfen der Durchstechflasche einstechen und das Lösungsmittel langsam injizieren, sodass es weitgehend an der Wand der Durchstechflasche herunterläuft (Abb. B).
·Nun den Patienten für die Injektion vorbereiten. Die folgenden Schritte sollten ohne Unterbrechung durchgeführt werden.
|
|
| |
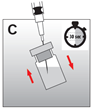
·Die Nadel oberhalb des Flüssigkeitsspiegels zurückziehen und die Durchstechflasche 30 Sekunden lang kräftig schütteln. Die Suspension sollte milchig und homogen aussehen (Abb. C). Überprüfen, dass kein Pulver in der Durchstechflasche verbleibt, und wenn nötig, den Suspensionsvorgang fortsetzen, bis das Pulver vollständig verschwunden ist.
Achtung: Die Mischung darf nicht durch mehrmaliges Aufziehen und Entleeren der Spritze erfolgen!
·Das Produkt sollte nun innerhalb von 2 Minuten injiziert werden.
|
|
| |
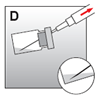
·Die gesamte Injektionssuspension in die Spritze aufziehen (Abb. D).
|
|
| |
·Die Rekonstitutionsnadel entfernen. Die Injektionsnadel mit Sicherheitssystem fest auf die Spritze drehen (bis zum Anschlag). Nur die farbige Hülle fassen.
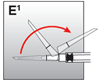
·Die Sicherheitshülle hinter die Nadel und in Richtung des Spritzenkörpers bewegen (Abb. E1). Die Sicherheitshülle bleibt in der Position, in die sie gebracht wurde.
·Den Schutz der Injektionsnadel entfernen.
·Dann sofort den gesamten Inhalt der Spritze verabreichen.
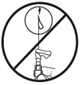
·Keine Suspension aus der Nadel herausdrücken (Abb. E2).
|
|
|
| |
2. Injektion
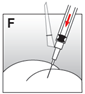
·Die Injektionssuspension relativ schnell und ohne Unterbrechung intramuskulär injizieren (Abb. F).
|
|
| |
3. Nach der Verabreichung
·Das Sicherheitssystem der Injektionsnadel nach einer der folgenden Methoden aktivieren:
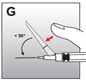
·Mit einer Hand die Sicherung nach vorne drücken, um die Nadel zu bedecken und die Sicherung zu schliessen (Abb. G). Immer den Zeigefinger oder Daumen hinter der Nadelspitze halten.
Oder
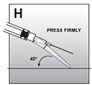
·Die Sicherung mit der nach unten gerichteten Seite auf eine flache Oberfläche, z.B. den Tisch, drücken, um die Nadel zu bedecken und die Sicherung zu schliessen (Abb. H).
·Die Sicherung der Injektionsnadel ist geschlossen, sobald die Nadelspitze vollständig bedeckt ist (Abb. I).
Dies kann anhand eines hörbaren, spürbaren und/oder optischen Zeichens sichergestellt werden. Die Nadeln in einem dafür vorgesehenen Behälter entsorgen.
·Nur zur einmaligen Verwendung. Jede nicht verwendete Suspension muss entsorgt werden.
|
|
Oder
|

|

|
|






























