ZusammensetzungWirkstoffe
Allergenextrakt aus den folgenden Gräserpollen: Wiesen-Knäuelgras (Dactylis glomerata), Gewöhnliches Ruchgras (Anthoxanthum odoratum), Deutsches Weidelgras (Lolium perenne), Wiesen-Rispengras (Poa pratensis) und Wiesen-Lieschgras (Phleum pratense).
Hilfsstoffe
Mannitol, mikrokristalline Cellulose, Croscarmellose-Natrium), hochdisperses Siliciumdioxid, Magnesiumstearat, Lactose-Monohydrat
Eine Sublingualtablette mit 100 IR enthält max. 0.27 mg Natrium und 83.1 – 83.6 mg Lactose-Monohydrat.
Eine Sublingualtablette mit 300 IR enthält max. 0.27 mg Natrium und 81.7 – 83.2 mg Lactose-Monohydrat.
Indikationen/AnwendungsmöglichkeitenBehandlung der durch Gräserpollen ausgelösten allergischen Rhinitis mit oder ohne Konjunktivitis bei Erwachsenen, Jugendlichen und Kindern (ab 5 Jahren), die durch einen positiven Hauttest und/oder einen positiven Titer des spezifischen IgE gegen die Gräserpollen bestätigt wurde.
Dosierung/AnwendungDie Therapie mit ORALAIR darf nur von Ärzten mit entsprechender Ausbildung und Erfahrung in der Therapie allergischer Erkrankungen verschrieben und eingeleitet werden. Bei der Therapie von Kindern müssen die Ärzte über entsprechende Ausbildung und Erfahrung bei Kindern verfügen
Um Patient und Arzt die Möglichkeit zu geben, etwaige Nebenwirkungen und mögliche Massnahmen zu besprechen, ist die erste Tablette ORALAIR unter ärztlicher Aufsicht einzunehmen und der Patient ca. 30 Minuten zu überwachen. Schwere allergische Reaktionen können auch im späteren Therapieverlauf auftreten, meistens innerhalb 30 Minuten nach einer Tabletteneinnahme (vgl. Rubrik Warnhinweise und Vorsichtsmassnahmen).
Kindern <12 Jahren soll nach jeder Einnahme von ORALAIR noch mindestens 30 Minuten unter der Aufsicht einer erwachsenen Person bleiben, um eine schnelle Reaktion im Falle von allfälligen Schwellungen im Mund- oder Rachenbereich, welche eine schnelle symptomatische Behandlung erfordern, zu ermöglichen.
Dosierung bei Erwachsenen, Jugendlichen und Kindern (ab 5 Jahren)
Die Behandlung setzt sich aus einer Einleitungsbehandlung (einschliesslich einer Dosiserhöhung über 3 Tage) und einer Fortsetzungsbehandlung zusammen.
Die Einleitungsbehandlung entspricht dem ersten Behandlungsmonat mit ORALAIR 100 IR & 300 IR Sublingualtabletten.
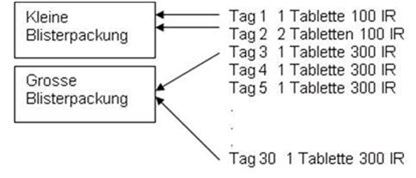
Ab dem 2. Monat muss die Fortsetzungsbehandlung mit einer ORALAIR 300 IR Sublingualtabletten bis zum Ende der Pollensaison fortgeführt werden.
Die Tablette muss bis zur vollständigen Auflösung (mindestens 1 Minute lang) unter der Zunge gehalten und dann geschluckt werden. Am zweiten Behandlungstag müssen 2 Tabletten 100 IR gleichzeitig unter die Zunge gelegt und dann geschluckt werden.
Es wird empfohlen, die Tablette morgens auf nüchternen Magen einzunehmen.
Die Behandlung sollte etwa 4 Monate vor dem erwarteten Anfang der Pollensaison begonnen und über die gesamte Pollensaison fortgeführt werden.
Die höchste, in klinischen Studien untersuchte Behandlungsdauer beträgt 26 Wochen.
Bisher liegen noch keine Daten zur Wirksamkeit für die Therapie mit ORALAIR vor, die über die Dauer einer Gräserpollensaison hinausgehen.
Klinische Erfahrungen zur Immuntherapie mit ORALAIR bei Kleinkindern (unter 5 Jahren) und Patienten, die älter als 45 Jahre sind, liegen nicht vor.
Kontraindikationen·Überempfindlichkeit gegen einen der sonstigen Bestandteile
·Schweres und/oder instabiles Asthma (FEV1< 70% des Vorhersagewertes)
·Schwere Immunschwäche oder Autoimmunkrankheit
·Maligne Erkrankungen (z.B. Krebs)
·Orale Entzündungen (z.B. oraler Lichen planus, orale Ulzerationen oder orale Mykose)
Warnhinweise und VorsichtsmassnahmenWährend der Behandlung mit ORALAIR werden die Patienten Allergenen ausgesetzt, die lokale und/oder systemische allergische Reaktionen auslösen können.
Wie bei jeder Allergen-Immuntherapie können schwerwiegende allergische Reaktionen einschliesslich schwerer laryngopharyngealer Störungen oder anaphylaktische Reaktionen auftreten. Deswegen ist die medizinische Überwachung zu Beginn der Behandlung eine wichtige Vorsichtsmassnahme. Schwerwiegende Reaktionen treten meistens innerhalb 30 Minuten nach einer Tabletteneinnahme auf. Sie können auch erst bei einer späteren Einnahme und nicht bereits bei der Ersteinnahme auftreten.
Patienten müssen über das Risiko schwerer Reaktionen, deren Anzeichen und Symptome und deren Behandlung informiert werden. Dabei sollte auch die Abgabe und Instruktion eines Notallsets (inklusive Adrenalin-Autoinjektor) besprochen werden. Patienten sollten angewiesen werden, bei akut auftretenden schwerwiegenden, Reaktionen (wie Angioödem, Schluckschwierigkeiten, Atemschwierigkeiten, Stimmveränderungen oder Klossgefühl im Hals, juckende Hautausschläge) nebst Anwendung des Notfallsets sofort medizinische Hilfe in Anspruch zu nehmen. Beim Auftreten schwerer systemischer Reaktionen soll die Behandlung abgebrochen werden, entweder für immer oder bis auf andere Anweisung des Arztes.
Die Auswirkungen von Adrenalin können bei Patienten, die mit trizyklischen Antidepressiva und Monoamino-Oxidase-Hemmer (MAO-Hemmer) behandelt werden, fatale Konsequenzen haben. Dies sollte vor Einleitung einer spezifischen Immuntherapie in Betracht gezogen werden.
Patienten, die Beta-Rezeptorenblocker einnehmen, können auf die üblichen Dosen von Adrenalin nicht mehr genügend ansprechen, um schwerwiegende systemische Reaktionen, einschliesslich Anaphylaxie zu behandeln. Insbesondere Betablocker antagonisieren die herzstimulierende und bronchodilatierende Wirkungen von Adrenalin.
Wenn bei Patienten mit begleitendem Asthma Symptome und Anzeichen auftreten, die auf eine Verschlimmerung des Asthmas hinweisen, ist die Therapie abzubrechen und sofort ein Arzt aufzusuchen, der über die Fortsetzung der Therapie entscheidet.
Wenn ein Patient leichte bis mittelschwere lokale unerwünschte Reaktionen während der Behandlung erfährt, kann die Behandlung mit Arzneimitteln, die die Symptome lindern, in Erwägung gezogen werden (z.B. Antihistaminika).
Es wird empfohlen, dass Kinder <12 Jahren nach Einnahme von ORALAIR jeweils noch während mindestens einer halben Stunde unter der Aufsicht einer erwachsenen Person bleiben.
Im Falle eines chirurgischen Eingriffs in der Mundhöhle, einschliesslich Zahnextraktionen und Ausfall eines Milchzahnes, sollte die Behandlung mit ORALAIR für 7 Tage unterbrochen werden, um die Heilung der Mundhöhle zu ermöglichen. Danach sollte die Behandlung mit der bisherigen Dosierung wieder aufgenommen werden. Falls die Behandlung für einen längeren Zeitraum unterbrochen wurde, kann sie unter ärztlicher Aufsicht mit der bisherigen Dosierung wieder aufgenommen werden.
Bei Kindern, die gleichzeitig Asthma und eine akute Infektion der oberen Atemwege haben, muss die Behandlung mit Oralair bis zum Abklingen der Infektion unterbrochen werden.
Eosinophile Ösophagitis wurde im Zusammenhang mit einer Immuntherapie mit sublingualen Tabletten beobachtet. Wenn während der Behandlung mit ORALAIR schwere oder anhaltende gastroösophageale Symptome, einschliesslich Dysphagie oder Schmerzen im Brustbereich, auftreten, sollte ORALAIR ausgesetzt und der Patient von seinem Arzt untersucht werden.
Die Behandlung darf nur nach Anweisung des Arztes wieder aufgenommen werden.
Oralair enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-mangel oder Glucose-Galactose Malabsorption sollten dieses Arzneimittel nicht anwenden.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Tablette, d.h. es ist nahezu «natriumfrei».
InteraktionenEs liegen keine Daten über die möglichen Risiken einer gleichzeitigen Immuntherapie mit anderen Allergenen während der Therapie mit ORALAIR vor.
Bezüglich Wirksamkeit und Sicherheit von Impfungen während einer ORALAIR-Allergen-Immuntherapie liegen keine klinischen Daten vor.
Schwangerschaft, StillzeitSchwangerschaft
Für ORALAIR liegen keine klinischen Daten für die Anwendung in der Schwangerschaft vor.
Es wird nicht empfohlen, eine Immuntherapie während der Schwangerschaft einzuleiten. Tritt eine Schwangerschaft während der Behandlung ein, kann die Behandlung unter engmaschiger Überwachung weitergeführt werden.
Stillzeit
Es gibt keine klinischen Daten zur Anwendung von ORALAIR während der Stillzeit.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt.
Unerwünschte WirkungenMit milden bis mittelschweren lokalen allergischen Reaktionen (z.B. Schwellungen oder Beschwerden im Mundraum) sollte gerechnet werden. 50% dieser Reaktionen treten während der ersten drei Tage der Behandlung (Dosiserhöhung) auf.
Wie bei jeder Allergen-Immuntherapie können schwerwiegende allergische Reaktionen, einschliesslich schwerer laryngopharyngealer Erkrankungen (wie Dysphonie, Mundrachenbeschwerden und Pharynxödem) oder anaphylaktischer Reaktionen auftreten (d.h. akutes Einsetzen einer Erkrankung mit Beteiligung der Haut und/oder der Schleimhäute, Beeinträchtigung der Atmung, anhaltendegastrointestinaleSymptomen, wie krampfartige Bauchschmerzen oder Erbrechen, oder Blutdruckabfall und damit verbundenen Symptomen).
Die Nebenwirkungen werden nach der MedDRA-Konvention nach Systemorganklassen und folgenden Häufigkeiten gegliedert:
Sehr häufig: (≥1/10)
Häufig: (≥1/100, < 1/10)
Gelegentlich: (≥1/1'000, < 1/100)
Selten: (≥1/10'000, < 1/1'000)
Sehr selten: (< 1/10'000)
Nicht bekannt: (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Klinische Erfahrungen bei Erwachsenen (VO34.04-Studie)
Während einer klinischen Studie mit Erwachsenen, die an allergischer Rhinokonjunktivitis litten und eine Dosis von 300 IR pro Tag erhielten, berichteten 97/155 Patienten (63%) von unerwünschten Ereignissen im Vergleich zu 76/156 Patienten (49%), die ein Placebopräparat erhielten.
Die am häufigsten berichtete Nebenwirkung bei Patienten, die mit einer Dosis von 300 IR behandelt wurden, war ein oraler Pruritus bei 26% der Patienten (5% in der Placebo-Gruppe).
Die Anzahl der Patienten, die ihre Behandlung auf Grund einer Nebenwirkung vorzeitig abbrachen, betrug 6/155 (4%) in der behandelten Gruppe und 0/156 in der Placebo-Gruppe.
Die folgenden Nebenwirkungen wurden von Erwachsenen berichtet:
Infektionen
Häufig: Rhinitis.
Immunsystem
Gelegentlich: Überempfindlichkeit.
Psychiatrische Störungen
Gelegentlich: Angst.
Nervensystem
Häufig: Kopfschmerz, Parästhesie.
Gelegentlich: Geschmacksstörung, Schwindelgefühl.
Augenleiden
Häufig: Konjunktivitis, Augenjucken.
Gelegentlich: Augenlidpruritus.
Ohr/Innenohr
Häufig: Ohrenjucken.
Gelegentlich: Vertigo.
Atmungsorgane
Sehr häufig: Rachenreizung (9%).
Häufig: Dyspnoe, oropharyngeale Schwellung, Nasenverstopfung, Rhinorrhöe, Rhinitis, Halstrockenheit, Niesen, Beschwerden an der Nase.
Gelegentlich: Engegefühl des Halses, Pharyngolaryngealschmerzen, Kehlkopfirritation, Nasenschleimhaut trocken.
Gastrointestinale Störungen
Sehr häufig: Oraler Pruritus (26%).
Häufig: Schmerzen im Oberbauch, Übelkeit, Dyspepsie, Glossitis, Glossodynie, geschwollene Zunge, Zungenödem, Mundschleimhautbläschen, orale Parästhesie, Ödem des Mundes, Mundschmerzen, orale Beschwerden, Mundtrockenheit.
Gelegentlich: Kolitis, Stomatitis, Ösophagitis, Gastritis, Dysphagie, Hyperchlorhydrie, Hypersalivation, abdominale Beschwerden, Diarrhö, Aufstossen, Hypoästhesie oral, Gaumenödem, Zunge blasig, Erkrankung der Zunge, Lippenbläschen.
Haut
Häufig: Gesichtsödem, schwellendes Gesicht, Pruritus, Urtikaria.
Gelegentlich: Angioödem, lokalisierte Urtikaria.
Allgemeine Störungen und Reaktionen an der Applikationsstelle
Häufig: Ermüdung, Fremdkörpergefühl im Mund.
Gelegentlich: Schmerzen an der Applikationsstelle, lokale Schwellung, Brustkorbbeschwerden, Ödem peripher.
Diese Reaktionen traten gewöhnlich während der ersten drei Tage der Behandlung (Dosiserhöhung) auf und waren alle reversibel.
Klinische Erfahrungen bei Kindern und Jugendlichen (VO52.06-Studie)
Während einer klinischen Studie mit Kindern und Jugendlichen (zwischen 5 und 17 Jahren alt), die an allergischer Rhinokonjunktivitis litten und eine Dosis von 300 IR pro Tag erhielten, berichteten 118/139 Patienten (85%) von unerwünschten Ereignissen im Vergleich zu 114/139 Patienten (82%), die ein Placebopräparat erhielten.
Die am häufigsten berichtete Nebenwirkung bei Kindern und Jugendlichen, die mit einer Dosis von 300 IR behandelt wurden, war oraler Pruritus bei 32% der Patienten (1% in der Placebo-Gruppe).
Die Anzahl der Patienten, die ihre Behandlung auf Grund einer Nebenwirkung vorzeitig abbrachen, betrug 6/139 (4%) in der 300 IR Gruppe und 1/139 (0,7% in der Placebo-Gruppe).
Die folgenden Nebenwirkungen wurden von Kindern und Jugendlichen (5-17 Jahre) berichtet:
Infektionen
Gelegentlich: Nasopharyngitis, Tonsillitis, Bronchitis, Grippe.
Immunsystem
Gelegentlich: Überempfindlichkeit.
Nervensystem
Gelegentlich: Kopfschmerz.
Augenleiden
Häufig: Augenjucken.
Gelegentlich: Okuläre Hyperämie.
Ohr/Innenohr
Häufig: Ohrenjucken.
Gelegentlich: Ohrkongestion, Ohrenbeschwerden.
Atmungsorgane
Häufig: Rachenreizung, Nasenverstopfung, Asthma, Niesen, Beschwerden an der Nase, Dyspnoe, Kehlkopfirritation, Engegefühl des Halses.
Gelegentlich: Husten, Rhinorrhöe, Dysphonie, Kehlkopfödem, Pharynxödem, Asthmaexazerbation.
Gastrointestinale Störungen
Sehr häufig: Oraler Pruritus (32%), Ödem des Mundes (13%).
Häufig: Lippe geschwollen, geschwollene Zunge, Mundschleimhautbläschen, Stomatitis, Erbrechen, Cheilitis, Glossitis, orale Beschwerden.
Gelegentlich: Abdominalschmerz, Schmerzen Oberbauch, Übelkeit, Dyspepsie, Dysphagie, Hypoästhesie oral, schmerzhaftes Schlucken, Mundschmerzen, Zungenödem.
Haut
Häufig: Dermatitis atopisch, Pruritus.
Gelegentlich: Ekzem, zirkumorales Ödem.
Muskelsystem
Gelegentlich: Wachstumsschmerzen.
Allgemeine Störungen und Reaktionen an der Applikationsstelle
Häufig: Brustkorbbeschwerden.
Gelegentlich: Asthenie, Brustkorbschmerz.
Unerwünschte Wirkungen nach Markteinführung
Während der Arzneimittelüberwachung nach der Marktzulassung wurden zusätzlich die folgenden Nebenwirkungen bei Erwachsenen, Jugendlichen und Kindern beobachtet: anaphylaktische Reaktionen, Exazerbation eines Asthmas, eosinophile Ösophagitis.
Die Häufigkeit dieser Reaktionen bei einer Behandlung mit ORALAIR ist nicht bekannt.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs wurden keine Fälle von Überdosierung berichtet.
Sollte eine höhere Dosis als die empfohlene Tagesdosis eingenommen werden, ist das Risiko für unerwünschte Wirkungen einschliesslich systemischer Nebenwirkungen und schwerer lokaler Reaktionen erhöht. Falls schwere systemische Symptome wie Angioödem, Schwierigkeiten beim Schlucken oder Atmen, Veränderungen der Stimme oder Engegefühl im Hals auftreten, muss sofort ein Arzt aufgesucht werden.
Im Falle einer Überdosierung sollten die auftretenden Nebenwirkungen symptomatisch behandelt werden.
Eigenschaften/WirkungenATC-Code
V01AA02
Wirkungsmechanismus
ORALAIR wird zur Behandlung von Patienten mit durch spezifisches IgE vermittelten Allergiesymptomen wie Rhinitis mit oder ohne Konjunktivitis, die durch Gräserpollen hervorgerufen wurde, angewendet.
Der vollständige und genaue Wirkmechanismus der klinischen Wirkungen der spezifischen Immuntherapie ist noch nicht exakt geklärt und dokumentiert.
Pharmakodynamik
Die pharmakodynamische Wirkung zielt auf das Immunsystem. Es soll eine Immunreaktion auf das Allergen, mit dem der Patient behandelt wird, erzeugt werden. Es wurde nachgewiesen, dass die Therapie mit ORALAIR eine systemische kompetitive Antikörperreaktion auf Gräser induziert und zu einem Anstieg des spezifischen IgG führt. Die klinische Bedeutung dieser Befunde wurde noch nicht belegt.
Klinische Wirksamkeit
Klinische Wirksamkeit bei Erwachsenen (V034.04 Studie)
Es wurde eine europäische, multizentrische, multinationale, randomisierte, doppelt-verblindete, Placebo-kontrollierte Studie durchgeführt.
Die Studie umfasste insgesamt 628 Patienten mit saisonbedingter, allergischer Rhinitis und/oder Rhinokonjunktivitis, ausgelöst durch Gräserpollen und bestätigt durch Hauttests und/oder positiven Nachweis spezifischen IgEs gegen Gräserpollen.
Die Patienten wurden in 4 Gruppen randomisiert: Placebo (n=156), Oralair 100 IR/Tag (n=157), Oralair 300 IR/Tag (n=155) und Oralair 500 IR/Tag (n=160).
Jeder Patient erhielt einmal täglich eine sublinguale Dosis über ca. 4 Monate vor Beginn der Pollensaison und danach über eine gesamte Pollensaison. Der Analyse lagen die Ergebnisse von 569 auswertbaren Patienten zugrunde (Placebo, n=148; Oralair 100 IR, n=142; Oralair 300 IR, n=136, Oralair 500 IR, n=143). Die Wirksamkeit wurde über diese eine Pollensaison anhand des Rhinokonjunktivitis Total Symptom Score (RTSS) bewertet (Einzelheiten siehe unten).
Die Ergebnisse dieser Studie zeigten eine vergleichbare Wirksamkeit von 500 und 300 IR, wobei die Sicherheitsdaten für 300 IR sprachen, was zu einer empfohlenen Dosis von 300 IR pro Tag führte.
In der 300 IR Gruppe zeigten sich hinsichtlich der Wirksamkeit im Vergleich zur Placebo-Gruppe folgende Ergebnisse (in die Intent-to-Treat-Population (ITT) wurden 136 bzw. 148 Patienten aufgenommen):
V034.04 Studie: Wirksamkeitsergebnisse (während der einen Pollensaison)
Primärer Endpunkt
|
V034.04 Studie
|
ORALAIR 300 IR Mittelwert (SD)
Median
|
Placebo Mittelwert (SD)
Median
|
Absolute angepasste Differenz
Mittelwert
[KI 95 %]
|
Relative mittlere Differenz*
%
|
p-Wert**
| |
Rhinokonjunktivi-tis Symptom ScoreA
|
3,58 (2,98)
2,91
|
4,93 (3,23)
4,62
|
-1,39 [-2,09; -0,69]
|
27,3 %
|
0,0001
|
* Relative mittlere Differenz: Absolute Differenz/ Placebo
** p-Wert ANCOVA
A Symptom Score: Durchschnittlicher täglicher Gesamt-Score der Rhinokonjunktivitis-Symptome für jeden Patienten während der Gräserpollensaison. Rhinokonjunktivitis-Symptome umfassen Niesen, laufende Nase, juckende Nase, verstopfte Nase, tränende Augen und juckende Augen (Bereich des Scores von 0 bis 18, der Höchstwert von 18 gibt an, dass alle 6 Symptome permanent in sehr starker Form vorhanden sind).
Sekundäre Endpunkte
|
V034.04 Studie
|
ORALAIR 300 IR Mittelwert (SD)
Median
|
Placebo Mittelwert (SD)
Median
|
Absolute angepasste Differenz
Mittelwert
[KI 95 %]
|
Relative mittlere Differenz*
%
|
p-Wert**
| |
Anwendung von Rescue-MedikationB
|
19,7 % (24,8)
10,6 %
|
27,9 % (29,3)
19,7 %
|
-
|
-
|
-
| |
Quality of Life ScoreC
|
1,15 (0,99)
0,90
|
1,45 (1,04)
1,27
|
-0,26 [-0,36; -0,16]
|
20,7 %
|
< 0,0001
|
* Relative mittlere Differenz: Absolute Differenz/ Placebo
** p-Wert ANCOVA
B Anwendung von Rescue-Medikation: Prozentsatz der Tage pro Patient, an denen mindestens einmal Rescue-Medikation eingenommen wurde.
C Die Lebensqualität wurde auf dem Höhepunkt der Pollensaison mittels Rhinokonjunktivitis Quality of Life Questionnaire (RQLQ) bewertet (Bereich des Scores von 0 bis 7, ein höherer Score spiegelt eine schlechtere Lebensqualität wider).
Gesamtbeurteilung der Wirksamkeit der Behandlung durch die Patienten: 119 Patienten (88%) in der Gruppe mit ORALAIR 300 IR und 108 Patienten (73%) in der Placebo-Gruppe stellten eine leichte bis mittlere oder starke bis sehr starke Verbesserung im Vergleich zu ihrer Erinnerung an die vorangegangene Pollensaison fest.
Die ANCOVA-Ergebnisse jedes der 6 einzelnen mittleren Symptom-Scores im Bereich von 0 bis 3 zeigten für folgende Symptome eine Unterschied, der verglichen mit Placebo für Tabletten 300 IR sprach: Niesen (-0,19), laufende Nase (-0,23), juckende Nase (-0,23), verstopfte Nase (-0,28), juckende Augen (-0,24) und tränende Augen (-0,21).
Der Anteil an Patienten, die keine Rescue-Medikation anwendeten, betrug 35,3% in der Gruppe mit 300 IR und 27,0% in der Placebo-Gruppe (NS).
Post-hoc-Endpunkte (nach Entblindung)
|
V034.04 Studie
|
ORALAIR 300 IR Mittelwert (SD)
Median
|
Placebo Mittelwert (SD)
Median
|
Absolute angepasste Differenz
Mittelwert
[KI 95 %]
|
Relative mittlere Differenz*
%
|
p-Wert
| |
Average Adjusted Symptom ScoreD
|
4,17 (3,39)
3,57
|
5,88 (3,82)
5,26
|
-1,84 [-2,66;
-1,02]
|
29,1%
|
< 0,0001**
| |
Average Rescue Medication ScoreE
|
0,31 (0,43)
0,16
|
0,48 (0,53)
0,31
|
-0,17 [-0,29;
-0,05]
|
35,0%
|
0,0047**
| |
PSCD2-0F
|
43,5% (33,8)
38,6
|
28,7%
(30,7)
17,1
|
-
|
-
|
0,0001***
| |
PSFDG
|
25,3% (30,2)
10,9
|
14,9%
(23,6)
0,0
|
-
|
-
|
0,0006***
|
* Relative mittlere Differenz: Absolute Differenz/ Placebo
** p-Wert ANCOVA/*** p-Wert Wilcoxon
D Average Adjusted Symptom Score (AASS): Durchschnittlicher Symptom-Score, angepasst an die Anwendung der Rescue-Medikation (für jeden Patienten, anhand der täglichen Symptom-Scores und der täglichen Anwendung der Rescue-Medikation).
E Average Rescue Medication Score: Durchschnittlicher täglicher Score für die Rescue-Medikation für jeden Patienten während der Gräserpollensaison. Die angewendeten Medikationen wurden wie folgt klassifiziert: keine Rescue-Medikation = 0, Antihistaminika (oral und/oder am Auge) = 1, nasale Kortikosteroide = 2 und orale Kortikosteroide = 3.
F Prozentsatz Tage, an denen Symptome unter Kontrolle sind (Percentage of Symptom Controlled Days)
PSCD2-0: Prozentsatz der Tage mit einem Symptom-Score von maximal 2 und ohne Rescue-Medikation.
G Anteil symptomfreier Tage ohne Rescue-Medikation (Proportion of Symptom and rescue medication–Free Days, PSFD): Prozentsatz der Tage, an denen keine Symptome auftraten und keine Rescue-Medikation eingenommen wurde.
In der Gruppe mit 300 IR waren bei 61 Patienten (45%) an mehr als 50% der Tage der Gräserpollensaison die Symptome unter Kontrolle (Symptom-Score von maximal 2 und keine Rescue-Medikation). In der Placebo-Gruppe waren es hingegen 40 Patienten (27%).
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Klinische Erfahrungen bei Kindern und Jugendlichen (V052.06 Studie)
Es wurde eine europäische, multizentrische, multinationale, randomisierte, doppelt-verblindete, placebo-kontrollierte Studie durchgeführt.
Die Studie umfasste insgesamt 278 Patienten zwischen 5 und 17 Jahren, die an saisonaler allergischer Rhinitis und/oder Rhinokonjunktivitis litten, die durch Gräserpollen ausgelöst und durch Hauttests und den positiven Nachweis spezifischer IgEs gegen Gräserpollen bestätigt wurden.
Die Patienten wurden in 2 Gruppen randomisiert: Placebo (n=139) oder ORALAIR 300 IR/Tag (n=139). Jeder Patient erhielt einmal täglich eine sublinguale Dosis über ca. 4 Monate vor Beginn der Pollensaison und danach über eine gesamte Pollensaison. Für die ersten drei Tage der Behandlungsphase wurde ein stufenweises Dosierungsschema eingehalten. Dabei wurde die Anfangsdosis von 100 IR/Tag täglich um 100 IR bis auf 300 IR/Tag erhöht. Der Analyse lagen die Ergebnisse von 266 auswertbaren Patienten zugrunde (Placebo, n=135 und Oralair 300 IR, n=131). Die Wirksamkeit wurde über diese eine Pollensaison anhand des Rhinokonjunktivitis Total Symptom Score (RTSS) bewertet (Einzelheiten siehe unten).
Die Wirksamkeitsanalyse der 300 IR Gruppe ergab im Vergleich zur Placebo-Gruppe folgende Ergebnisse (in die Intent-to-Treat-Population (ITT) wurden 131 bzw. 135 Patienten aufgenommen):
V052.06 Studie: Wirksamkeitsergebnisse (während der einen Pollensaison)
Primärer Endpunkt
|
V052.06 Studie
|
ORALAIR 300 IR Mittelwert (SD)
Median
|
Placebo Mittelwert (SD)
Median
|
Absolute angepasste Differenz
Mittelwert
[KI 95 %]
|
Relative mittlere Differenz*
%
|
p-Wert**
| |
Rhinokonjunktivitis Symptom ScoreA
|
3,25 (2,86)
2,48
|
4,51 (2,93)
4,08
|
-1,13 [-1,80; -0,46]
|
28,0 %
|
0,001
|
* Relative mittlere Differenz: Absolute Differenz/ Placebo
** p-Wert ANCOVA
A Symptom Score: Durchschnittlicher täglicher Gesamt-Score der Rhinokonjunktivitis-Symptome für jeden Patienten während der Gräserpollensaison. Rhinokonjunktivitis-Symptome umfassen Niesen, laufende Nase, juckende Nase, verstopfte Nase, tränende Augen und juckende Augen (Bereich des Scores von 0 bis 18, der Höchstwert von 18 gibt an, dass alle 6 Symptome permanent in sehr starker Form vorhanden sind).
Sekundäre Endpunkte
|
V052.06 Studie
|
ORALAIR 300 IR Mittelwert (SD)
Median
|
Placebo Mittelwert (SD)
Median
|
Absolute angepasste Differenz
Mittelwert
[KI 95 %]
|
Relative mittlere Differenz*
%
|
p-Wert**
| |
Average Rescue Medication ScoreB
|
0,60 (0,61)
0,39
|
0,79 (0,65)
0,76
|
-0,20 [-0,34; -0,06]
|
24,1 %
|
0,0064
| |
Anwendung von Rescue-MedikationC
|
35,4 % (33,2)
26,8 %
|
46,5 % (34,6)
49,0 %
|
-
|
-
|
-
|
* Relative mittlere Differenz: Absolute Differenz/ Placebo
** p-Wert ANCOVA
B Average Rescue Medication Score: Durchschnittlicher täglicher Score für die Rescue-Medikation für jeden Patienten während der Gräserpollensaison. Die angewendeten Medikationen wurden wie folgt klassifiziert: keine Rescue-Medikation = 0, Antihistaminika (oral und/oder am Auge) = 1, nasale Kortikosteroide = 2 und orale Kortikosteroide = 3.
C Anwendung von Rescue-Medikation: Protzentsatz der Tage pro Patient, an denen mindestens einmal Rescue-Medikation eingenommen wurde.
Scores der einzelnen Symptome: Die ANCOVA-Ergebnisse jedes der 6 einzelnen mittleren Symptom-Scores im Bereich von 0 bis 3 zeigten für folgende Symptome einen Unterschied, der verglichen mit Placebo für Tabletten 300 IR sprach: laufende Nase (-0,16), verstopfte Nase (-0,26), juckende Augen (-0,33) und tränende Augen (-0,21).
Der Anteil an Patienten, die keine Rescue-Medikation anwendeten, betrug 18,3 % in der Gruppe mit 300 IR und 14,8 % in der Placebo-Gruppe (NS).
Post-hoc-Endpunkte (nach Entblindung)
|
V052.06 Studie
|
ORALAIR 300 IR Mittelwert (SD)
Median
|
Placebo Mittelwert (SD)
Median
|
Absolute angepasste Differenz
Mittelwert
[KI 95 %]
|
Relative mittlere Differenz*
%
|
p-Wert
| |
Average Adjusted Symptom ScoreD
|
4,30 (3,57)
3,33
|
6,12 (3,85)
5,28
|
-1,64 [-2,51; -0,78]
|
29,8 %
|
0,0002**
| |
PSCD2-0E
|
33,8 % (30,0)
30,0
|
23,7 % (27,2)
12,2
|
-
|
-
|
0,0107***
| |
PSFDF
|
19,2 % (24,9)
5,2
|
10,5 % (18,4)
0,0
|
-
|
-
|
0,0037***
|
* Relative mittlere Differenz: Absolute Differenz/ Placebo
** p-Wert ANCOVA/*** p-Wert Wilcoxon
D Average Adjusted Symptom Score (AASS): Durchschnittlicher Symptom-Score, angepasst an die Anwendung der Rescue-Medikation (für jeden Patienten, anhand der täglichen Symptom-Scores und der täglichen Anwendung der Rescue-Medikation).
E Prozentsatz Tage, an denen Symptome unter Kontrolle sind (Percentage of Symptom Controlled Days); PSCD2-0: Prozentsatz der Tage mit einem Symptom-Score von maximal 2 und ohne Rescue-Medikation.
F Anteil symptomfreier Tage ohne Rescue-Medikation (Proportion of Symptom and rescue medication–Free Days, PSFD): Prozentsatz der Tage, an denen keine Symptome auftraten und keine Rescue-Medikation eingenommen wurde.
In der Gruppe mit 300 IR waren bei 44 Patienten (34%) an mehr als 50% der Tage der Gräserpollensaison die Symptome unter Kontrolle (Symptom-Score von maximal 2 und keine Rescue-Medikation). In der Placebo-Gruppe waren es 26 Patienten (19%).
PharmakokinetikDer grössere Anteil der Allergene in Oralair ist eine Mischung aus Proteinen und Glycoproteinen. Es ist keine direkte Bioverfügbarkeit intakter Allergene im Blut zu erwarten. Aus diesem Grunde sind keine pharmakokinetischen Studien an Tieren oder Menschen durchgeführt worden, um das pharmakokinetische Profil und den Metabolismus von ORALAIR zu untersuchen.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische DatenBasierend auf konventionellen Studien zur Toxizität bei einfacher und wiederholter Gabe, Genotoxizität, lokalen Verträglichkeit und embryo-fötalen Entwicklung lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Sonstige HinweiseInkompatibilitäten
Nicht zutreffend.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Blister mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
In der Originalverpackung aufbewahren. Nicht über 25°C lagern.
Nicht einfrieren.
Zulassungsnummer61384 (Swissmedic)
PackungenEinleitungsbehandlung: 3 Tabletten à 100 IR und 28 Tabletten à 300 IR [A]
Fortsetzungsbehandlung: 30 oder 90 Tabletten à 300 IR [A]
ZulassungsinhaberinStallergenes AG
8305 Dietlikon
Stand der InformationDezember 2020
|

