Eigenschaften/WirkungenATC-Code
L04AG04
Wirkungsmechanismus
Der B-Lymphozyten-Stimulator (BLyS, auch als BAFF und TNFSF13 bezeichnet) gehört zur Familie der Tumornekrosefaktor-(TNF-)Liganden und ist das Zielmolekül von Belimumab. BLyS hemmt die B-Zell-Apoptose und stimuliert die B-Zell-Proliferation und die Differenzierung von B-Zellen zu Immunglobulin produzierenden Plasmazellen.
BLyS wird bei Patienten mit SLE überexprimiert. Es besteht ein starker Zusammenhang zwischen der SLE-Krankheitsaktivität (gemessen anhand des «Safety of Estrogen in Lupus Erythematosus National Assessment-Systemic Lupus Erythematosus Disease Activity Index» [SELENA-SLEDAI]) und den BLyS-Plasmaspiegeln.
Belimumab ist ein humaner monoklonaler IgG1λ-Antikörper von ca. 147 kDa, der spezifisch an löslichen humanen BLyS bindet und dessen biologische Aktivität hemmt. Belimumab bindet nicht direkt an B-Zellen, sondern bewirkt über Bindung und Neutralisation von BLyS eine Hemmung des Überlebens von B-Zellen – einschliesslich der autoreaktiven B-Zellen – und vermindert die Differenzierung von B-Zellen zu Immunglobulin produzierenden Plasmazellen.
Pharmakodynamik
In Studien mit intravenöser oder subkutaner Verabreichung gingen die medianen IgG-Konzentrationen bei Patienten mit SLE unter Belimumab bis Woche 52 um 11-15% zurück, bei Patienten unter Placebo um 2,5-0,7%.
Bei SLE-Patienten mit Anti-dsDNA-Antikörpern zu Studienbeginn war unter Belimumab bereits in Woche 4 eine Reduktion feststellbar; bis Woche 52 waren 16-18% der Patienten unter Belimumab gegenüber 7-15% der Patienten unter Placebo Anti-dsDNA-negativ.
Bei SLE-Patienten mit niedrigen Komplementspiegeln zu Studienbeginn führte die Behandlung mit Belimumab zu einem Anstieg der Komplementspiegel (C3 und C4), der bereits in Woche 4 zu beobachten war und im weiteren Verlauf anhielt. Bis Woche 52 hatten sich die C3- und C4-Spiegel bei 38-42% bzw. 44-53% der Patienten unter Belimumab, jedoch nur bei 17-21% bzw. 19-20% der Patienten unter Placebo normalisiert.
Unter Belimumab waren in Woche 52 die zirkulierenden B-Zellen, transitionale, naive und aktivierte B-Zellen, Plasmazellen und das SLE-B-Zell-Subset vermindert. Reduktionen von naiven, Plasma- und kurzlebigen Plasmazellen sowie des SLE-B-Zell-Subsets waren bereits in Woche 8 feststellbar. Die Gedächtniszellen stiegen anfänglich an und kehrten bis Woche 52 langsam wieder auf die Ausgangswerte zurück.
In einer unkontrollierten Langzeit-Verlängerungsstudie bei SLE mit intravenöser Verabreichung wurden B-Zellen (unter anderem naive, aktivierte, Plasmazellen und die SLE-B-Zell-Untergruppe) sowie die IgG-Konzentrationen unter laufender Behandlung mehr als 7 Jahre lang beobachtet. Es wurde ein deutlicher, anhaltender und progressiver Rückgang unterschiedlicher B-Zell-Untergruppen festgestellt, der zu einer medianen Abnahme der naiven B-Zellen um 87%, der B-Gedächtniszellen um 67%, der aktivierten B-Zellen um 99% und der Plasmazellen um 92% nach mehr als 7-jähriger Behandlung führte. Nach ca. 7 Jahren wurde eine mediane Abnahme der IgG-Konzentrationen um 28% beobachtet, wobei 1,6% der Patienten einen Rückgang der IgG-Konzentrationen auf unter 400 mg/dL zeigten. Die Inzidenz der gemeldeten unerwünschten Wirkungen blieb im Studienverlauf insgesamt stabil oder ging leicht zurück.
Bei Patienten mit Lupusnephritis kam es nach der Behandlung mit Benlysta (10 mg/kg intravenös) oder Placebo zu einem Anstieg der Serum-IgG-Spiegel, der mit einer verminderten Proteinurie assoziiert war. Im Vergleich zu Placebo wurde in der Benlysta-Gruppe ein geringerer Anstieg des Serum-IgG-Spiegels beobachtet, wie bei dem bekannten Mechanismus von Belimumab zu erwarten war. In Woche 104 betrug der mediane prozentuale Anstieg der IgG-Spiegel gegenüber dem Ausgangswert 17% für Benlysta und 37% für Placebo. Die beobachteten Verringerungen der Autoantikörper, Erhöhungen des Komplements und Verringerungen der zirkulierenden gesamten B-Zellen und B-Zell-Untergruppen stimmten mit den SLE-Studien überein.
Das in einer Studie bei pädiatrischen Patienten mit SLE beobachtete pharmakodynamische Ansprechen stand im Einklang mit den Daten von Erwachsenen.
Klinische Wirksamkeit
Intravenöse Infusion bei Erwachsenen mit SLE
In einer Phase-II-Studie in 449 Patienten, behandelt mit intravenös verabreichtem Belimumab 1, 4 vs. 10 mg/kg, wurde ein Effekt nur in ANA positiven Patienten beobachtet. In zwei randomisierten, doppelblinden, placebokontrollierten Phase-III-Studien (1 mg vs. 10 mg/kg) wurden 1'684 Patienten mit einer aktiven SLE-Erkrankung mit SELENA-SLEDAI-Score ≥6 und ANA-Titer ≥1:80 und/oder positiv für Anti-dsDNA [≥30 Einheiten/mL]) aufgenommen. Patienten mit schwerer, aktiver Lupusnephritis und schwerem, zentralnervösem Lupus waren von der Teilnahme ausgeschlossen. Ausgeschlossen waren ausserdem Patienten, die positiv auf HIV-Antikörper, Hepatitis-B-Oberflächenantigene oder Hepatitis-C-Antikörper getestet wurden, sowie Transplantationspatienten und Patienten mit Hypogammaglobulinämie oder IgA-Mangel.
Die Patienten erhielten eine SLE-Basistherapie mit Kortikosteroiden, Anti-Malaria-Mittel, NSAR oder anderen Immunsuppressiva. Ausschlusskriterien waren eine vorausgegangene B-Zell-gerichtete Therapie, ein anderes experimentelles biologisches Arzneimittel im vorausgegangenen Jahr, HIV-Infektion, und aktive Hepatitis-B oder Hepatitis-C. Sowohl Studie 1 (über 76 Wochen) als auch Studie 2 (über 52 Wochen) hatten die primären Endpunkte zu Woche 52, bestehend aus einem zusammengesetzten Endpunkt (SLE-Responder-Index) und definiert als das Erfüllen aller nachfolgenden Kriterien in Woche 52 gegenüber Studienbeginn:
·Verminderung des SELENA-SLEDAI-Score um ≥4 Punkte und
·kein neuer Organbefall im BILAG-A-Score bzw. mehr als 1 neuer Organbefall im BILAG-B-Score (BILAG=British Isles Lupus Assessment Group)
·keine Verschlechterung (Anstieg um ≤0,30 Punkte) des PGA-Scores (PGA=Physician's Global Assessment)
Der SLE-Responder-Index stützt sich auf den SELENA-SLEDAI-Score als objektives Mass für die Verminderung der globalen Krankheitsaktivität, den BILAG-Index zum Ausschluss einer relevanten Verschlechterung in einem spezifischen Organsystem und den PGA-Score, um sicherzustellen, dass Verbesserungen der Krankheitsaktivität nicht auf Kosten des Allgemeinzustands des Patienten erreicht werden.
Studie 1 (HGS1006-C1056) wurde vorwiegend in Nordamerika und Westeuropa durchgeführt. Nach ihrer ethnischen Abstammung waren die Teilnehmer wie folgt verteilt: 70% Weisse/Kaukasier, 14% Schwarze/Afroamerikaner, 13% Ureinwohner Alaskas oder Amerikas und 3% Asiaten. Als Basisbehandlung wurden unter anderem Kortikosteroide (76%), Immunsuppressiva (56%) und Anti-Malaria-Mittel (63%) eingesetzt.
Studie 2 (HGS1006-C1057) wurde in Südamerika, Osteuropa, Asien und Australien durchgeführt. Nach ihrer ethnischen Abstammung waren die Teilnehmer wie folgt verteilt: 38% Asiaten, 26% Weisse/Kaukasier, 32% Ureinwohner Alaskas oder Amerikas und 4% Schwarze/Afroamerikaner. Als Basisbehandlung wurden unter anderem Kortikosteroide (96%), Immunsuppressiva (42%) und Anti-Malaria-Mittel (67%) eingesetzt.
Das mediane Alter der Patienten betrug in beiden Studien 37 Jahre (Bereich: 18 bis 73 Jahre), die Patienten waren mehrheitlich (94%) weiblich. Bei der Voruntersuchung wurden die Patienten nach dem Schweregrad der Krankheit – auf Grundlage ihres SELENA-SLEDAI-Scores (≤9 vs. ≥10) –, der Proteinurie (<2 g pro 24 Stunden vs. ≥2 g pro 24 Stunden) und ihrer ethnischen Abstammung stratifiziert und anschliessend per Randomisierung einer Behandlung mit Belimumab 1 mg/kg, Belimumab 10 mg/kg oder Placebo zusätzlich zur Basistherapie zugeteilt. Die Patienten erhielten die Studienmedikation intravenös über 1 Stunde an den Tagen 0, 14 und 28 und anschliessend alle 28 Tage über 48 oder 72 Wochen.
Belimumab induzierte in beiden Studien zu Woche 52 signifikante Verbesserungen des SLE-Responder-Index sowie dessen einzelnen Komponenten, siehe Tabelle 1. In Studie 1 zu Woche 76 unterschied sich der SLE-Responder-Index (SRI) mit Belimumab nicht signifikant von dem mit Placebo (39% bzw. 32%).
Tabelle 1: Ansprechrate zu Woche 52
|
Ansprechen
|
Studie 1
|
Studie 2
| |
Placebo
(n=275)
|
Belimumab
1 mg/kg*
(n=271)
|
Belimumab
10 mg/kg
(n=273)
|
Placebo
(n=287)
|
Belimumab
1 mg/kg*
(n=288)
|
Belimumab
10 mg/kg
(n=290)
| |
SLE-Responder-Index
|
33,8%
|
40,6%
(p=0,104)
|
43,2%
(p=0,021)
|
43,6%
|
51,4%
(p=0,013)
|
57,6%
(p=0,0006)
| |
Komponenten des SLE-Responder-Index
| |
Prozent Patienten mit Verminderung des SELENA-SLEDAI ≥4
|
35,6%
|
42,8%
|
46,9%
(p=0,006)
|
46,0%
|
53,1%
|
58,3%
(p=0,0024)
| |
Prozent Patienten ohne Verschlechterung nach BILAG-Index
|
65,1%
|
74,9%
|
69,2%
(p=0,32)
|
73,2%
|
78,5%
|
81,4%
(p=0,018)
| |
Prozent Patienten ohne Verschlechterung nach PGA
|
62,9%
|
72,7%
|
69,2%
(p=0,13)
|
69,3%
|
78,8%
|
79,7%
(p=0,0048)
|
* Die 1 mg/kg Dosis ist nicht zugelassen.
In einer gepoolten Analyse der beiden Studien belief sich der prozentuale Anteil der Patienten, die bei Studienbeginn >7,5 mg/Tag Prednison (oder Äquivalent) erhalten hatten und deren durchschnittliche Kortikosteroid-Dosis während der Wochen 40 bis 52 gegenüber Studienbeginn um mindestens 25% auf ≤7,5 mg/Tag Prednisonäquivalent reduziert wurde, auf 17,9% in der Gruppe mit Belimumab bzw. 12,3% in der Placebogruppe (p=0,0451).
Schwere SLE-Schübe mit einem Anstieg des SELENA-SLEDAI-Scores auf >12 waren ausgeschlossen. Das Risiko schwerer Schübe <12 war während des 52-wöchigen Beobachtungszeitraums in der Belimumab-Gruppe gegenüber der Placebogruppe um 36% vermindert (Hazard-Ratio=0,64; p=0,0011).
Die Wirksamkeit und Sicherheit von Benlysta in Kombination mit einem einzigen Zyklus Rituximab wurde in einer 104-wöchigen randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie mit 292 Patienten (BLISS-BELIEVE) untersucht. Der primäre Endpunkt war der Anteil an Patienten mit dem Status einer kontrollierten Erkrankung, definiert als SLEDAI-2K-Score ≤2, der ohne Immunsuppressiva und mit Kortikosteroiden in einer Dosis äquivalent zu ≤5 mg Prednison pro Tag in Woche 52 erreicht wurde. Dies wurde bei 19,4% (n = 28/144) der mit Benlysta in Kombination mit Rituximab behandelten Patienten und bei 16,7% (n = 12/72) der mit Benlysta in Kombination mit Placebo behandelten Patienten erreicht (Odds-Ratio 1,27; 95%-KI: 0,60; 2,71; p = 0,5342). Bei Patienten, die mit Benlysta in Kombination mit Rituximab behandelt wurden, wurden Nebenwirkungen (91,7% vs. 87,5%), schwere Nebenwirkungen (22,2% vs. 13,9%) und schwere Infektionen (9,0% vs. 2,8%) häufiger beobachtet als bei Patienten, die mit Benlysta in Kombination mit Placebo behandelt wurden.
Intravenöse Infusion bei Lupusnephritis
Die Wirksamkeit und Sicherheit von Belimumab 10 mg/kg intravenös verabreicht über einen Zeitraum von 1 Stunde an den Tagen 0, 14 und 28 und in der Folge alle 28 Tage wurde in einer 104-wöchigen randomisierten (1:1) doppelblinden placebokontrollierten Phase-III-Studie (BEL114054) mit 448 Patienten mit aktiver Lupusnephritis bewertet.
Bei den Patienten lag zum Zeitpunkt des Screenings eine klinische SLE-Diagnose entsprechend den Klassifizierungskriterien des ACR, eine durch Biopsie bestätigte Lupusnephritis Klasse III, IV und/oder V sowie eine aktive Nierenerkrankung vor, die eine Standardtherapie erforderlich machte (Kortikosteroide mit Mycophenolat-Mofetil für Induktion und Erhaltung oder Cyclophosphamid für die Induktions-, gefolgt von Azathioprin für die Erhaltungstherapie). Die Studie wurde in Asien, Nordamerika, Südamerika und Europa durchgeführt. Das Patientenalter betrug im Median 31 Jahre (Spanne: 18 bis 77 Jahre). Die Teilnehmenden waren mehrheitlich weiblich (88%).
Primärer Wirksamkeitsendpunkt war das primäre renale Ansprechen (Primary Efficacy Renal Response, PERR) in Woche 104, definiert als ein Ansprechen in Woche 100, bestätigt durch eine Wiederholungsmessung der folgenden Parameter in Woche 104: Urinprotein/Kreatinin-Verhältnis (uPCR) ≤0,7 und geschätzte glomeruläre Filtrationsrate (eGFR) ≥60 ml/min/1,73 m2 oder kein Abfall der eGFR von >20% im Vergleich zum Wert vor dem Schub.
Zu den wichtigsten sekundären Endpunkten gehörten:
·vollständiges renales Ansprechen (Complete Renal Response, CRR), definiert als ein Ansprechen in Woche 100, bestätigt durch eine Wiederholungsmessung der folgenden Parameter in Woche 104: uPCR <0,5 und eGFR ≥90 ml/min/1,73 m2 oder kein Abfall der eGFR von >10% im Vergleich zum Wert vor dem Schub
·PERR in Woche 52
·Zeit bis zum nierenbezogenen Ereignis oder Tod (nierenbezogenes Ereignis definiert als erstes Ereignis einer terminalen Niereninsuffizienz, Verdopplung des Serum-Kreatininwerts, Verschlechterung der Nierenfunktion [definiert als zunehmende Proteinurie und/oder eingeschränkte Nierenfunktion] oder Erhalt einer unzulässigen Therapie zur Behandlung von Nierenerkrankungen)
Hinsichtlich der PERR- und CRR-Endpunkte wurden Patienten, die die Studie frühzeitig abbrachen oder unzulässige Medikamente erhielten, als Non-Responder betrachtet. Für eine Einstufung als Responder hinsichtlich der betreffenden Endpunkte musste die Steroidbehandlung ab Woche 24 auf ≤10 mg/Tag reduziert werden.
Der Anteil der Patienten, die in Woche 104 PERR erreichten, war in der Belimumab-Gruppe signifikant höher als in der Placebo-Gruppe. Auch hinsichtlich der wichtigsten sekundären Endpunkte zeigten sich mit Belimumab signifikant bessere Ergebnisse als mit Placebo (Tabelle 2).
Tabelle 2: Wirksamkeitsergebnisse bei erwachsenen Lupusnephritis-Patienten
|
Wirksamkeitsendpunkt
|
Placebo
n=223
|
Belimumab
10 mg/kg
n=223
|
beobachteter Unterschied vs. Placebo
|
Odds/Hazard Ratio vs. Placebo
(95%-KI)
|
P-Wert
| |
PERR in Woche 1041
Responder
|
32,3%
|
43,0%
|
10,8%
|
OR 1,55
(1,04, 2,32)
|
0,0311
| |
PERR-Komponenten
| |
Urinprotein/Kreatinin-Verhältnis ≤0,7
|
33,6%
|
44,4%
|
10,8%
|
OR 1,54
(1,04, 2,29)
|
0,0320
| |
eGFR ≥60 ml/min/1,73 m2
oder kein eGFR-Abfall von >20% im Vergleich zum Wert vor dem Schub
|
50,2%
|
57,4%
|
7,2%
|
OR 1,32
(0,90, 1,94)
|
0,1599
| |
kein Therapieversagen
|
74,4%
|
83,0%
|
8,5%
|
OR 1,65
(1,03, 2,63)
|
0,0364
| |
CRR in Woche 1041
Responder
|
19,7%
|
30,0%
|
10,3%
|
OR 1,74
(1,11, 2,74)
|
0,0167
| |
CRR-Komponenten
| |
Urinprotein/Kreatinin-Verhältnis <0,5
|
28,7%
|
39,5%
|
10,8%
|
OR 1,58
(1,05, 2,38)
|
0,0268
| |
eGFR ≥90 ml/min/1,73 m2
oder kein eGFR-Abfall von >10% im Vergleich zum Wert vor dem Schub
|
39,9%
|
46,6%
|
6,7%
|
OR 1,33
(0,90, 1,96)
|
0,1539
| |
kein Therapieversagen
|
74,4%
|
83,0%
|
8,5%
|
OR 1,65
(1,03, 2,63)
|
0,0364
| |
PERR in Woche 521
Responder
|
35,4%
|
46,6%
|
11,2%
|
OR 1,59
(1,06, 2,38)
|
0,0245
| |
Zeit bis zum nierenbezogenen Ereignis oder Tod1
Anteil der Patienten mit Ereignis2
|
28,3%
|
15,7%
|
-
|
|
| |
Zeit bis zum Ereignis [Hazard Ratio (95%-KI)]
|
|
|
-
|
0,51
(0,34, 0,77)
|
0,0014
| |
1
PERR in Woche 104 war die primäre Wirksamkeitsanalyse; CRR in Woche 104, PERR in Woche 52 und Zeit bis zum nierenbezogenen Ereignis oder Tod waren Teil der vorab festgelegten Testhierarchie.
2 Bei Ausschluss der Todesfälle aus der Analyse (einer bei Belimumab, zwei bei Placebo) lag der Anteil der Patienten mit nierenbezogenem Ereignis mit Belimumab bei 15,2% und mit Placebo bei 27,4% (HR=0,51; 95%-KI: 0,34, 0,78).
|
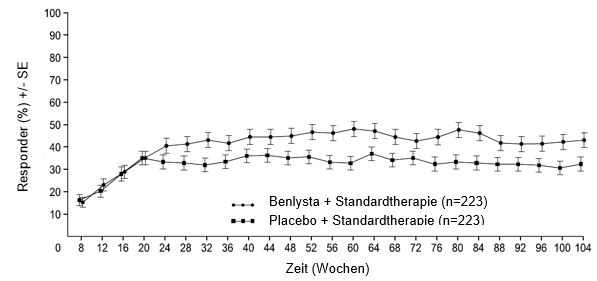
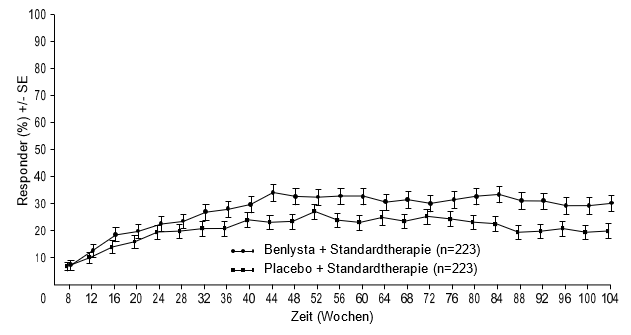
Ab Woche 24 erreichte verglichen mit Patienten unter Placebo ein numerisch grösserer Anteil der Patienten unter Belimumab PERR. Der betreffende Behandlungsunterschied blieb bis Woche 104 hindurch erhalten. Ab Woche 12 erreichte verglichen mit Patienten unter Placebo ein numerisch grösserer Anteil der Patienten unter Belimumab CRR. Der betreffende numerische Unterschied blieb bis Woche 104 hindurch erhalten (Abbildung 1).
Abbildung 1: Ansprechraten von Erwachsenen mit Lupusnephritis nach Visite
Primäres renales Ansprechen (Primary Efficacy Renal Response, PERR)
Komplettes renales Ansprechen (Complete Renal Response, CRR)
In deskriptiven Subgruppenanalysen wurden die PERR- und CRR-Raten nach Induktionstherapie (Mycophenolat oder Cyclophosphamid), Biopsieklasse (Klasse III oder IV, Klasse III + V oder Klasse IV + V oder Klasse V) und uPCR-Werten zu Studienbeginn (<3 g/g oder ≥3 g/g; Post-hoc-Analyse) untersucht (Abbildung 2).
Abbildung 2: Odds Ratio für PERR und CRR in Woche 104 in den verschiedenen Subgruppen
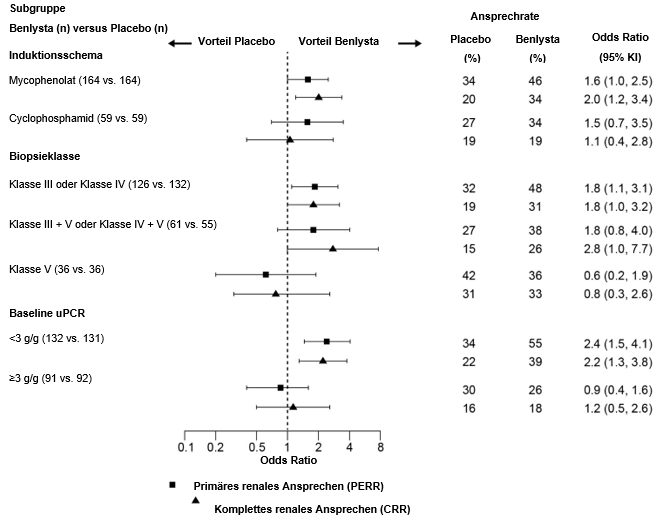
¹ Klasse III=Fokal proliferative Lupusnephritis; Klasse IV=Diffus proliferative Lupusnephritis; Klasse V=Membranöse Lupusnephritis; Klasse III + V=Gemischt membranös-fokal proliferative Lupusnephritis; Klasse IV + V=Gemischt membranös-diffus proliferative Lupusnephritis.
² Baseline-Urinprotein/Kreatinin-Verhältnis (uPCR) war eine Post-hoc-Analyse.
Andere besondere Patientengruppen
An den kontrollierten klinischen Studien nahmen zu wenige Männer oder Patienten im Alter von über 65 Jahren teil, um stichhaltige Schlüsse über die Auswirkungen von Geschlecht oder Alter auf die klinischen Outcomes ziehen zu können.
Intravenöse Infusion bei Kindern und Jugendlichen mit SLE (Benlysta wurde bei Kindern und Jugendlichen mit schwerem, aktivem Lupus des Zentralnervensystems oder schwerer, aktiver Lupusnephritis nicht untersucht).
Die Sicherheit und Wirksamkeit von Benlysta wurden in einer 52-wöchigen randomisierten, doppelblinden, placebokontrollierten Studie (BEL114055) an 93 pädiatrischen Patienten mit klinisch gemäss den Klassifizierungskriterien des American College of Rheumatology diagnostiziertem SLE untersucht. Die Patienten wiesen eine aktive SLE-Erkrankung auf, die definiert war als SELENA-SLEDAI-Score von mindestens 6 und Autoantikörper-Positivität zum Screeningzeitpunkt, entsprechend der Definition in den Studien an Erwachsenen. Die Patienten standen unter einem stabilen SLE-Behandlungsregime (Standardbehandlung). Ein- und Ausschlusskriterien entsprachen den Studien in Erwachsenen. Patienten mit schwerer aktiver Lupusnephritis, schwerem aktivem ZNS-Lupus, primärem Immundefekt, IgA-Mangel oder akuten oder chronischen behandlungsbedürftigen Infektionen wurden von der Studie ausgeschlossen. Die Studie wurde nicht für statistische Vergleiche herangezogen und alle Daten sind deskriptiv.
Diese Studie wurde in den USA, in Südamerika, Europa und Asien durchgeführt. Das Patientenalter betrug im Median 15,0 Jahre (Spanne: 6 bis 17 Jahre). In der Gruppe der 5- bis 11-Jährigen erhielten 10 Patienten Belimumab und 3 Patienten Placebo; der SELENA-SLEDAI-Score lag zwischen 4 und 13. In der Gruppe der 5-11-Jährigen waren die drei jüngsten Patienten 6 und 7 Jahre alt beim Screening. Alle drei waren in 52 Woche keine SRI-Responder, zwei davon unter einer Therapie mit Belimumab. Die übrigen Kinder in dieser Gruppe waren 9 Jahre oder älter.
In der Gruppe der 12- bis 17-Jährigen (n=79) lag der SELENA-SLEDAI-Wert zwischen 4 und 20. Die Teilnehmenden waren mehrheitlich weiblich (94,6%).
Primärer Wirksamkeitsendpunkt war der SLE-Responder-Index (SRI) nach 52 Wochen, wie in den Studien mit intravenöser Verabreichung an Erwachsene beschrieben. Unter Benlysta erreichte ein höherer Anteil der pädiatrischen Patienten ein SRI-Ansprechen als unter Placebo,. Das Ansprechen bezüglich der Einzelkomponenten des Endpunkts stimmte mit dem SRI-Gesamtansprechen überein.
Tabelle 3: Pädiatrische Ansprechrate nach Woche 52
|
Ansprechen
|
Placebo
(n=391)
|
Benlysta
10 mg/kg
(n=53)
| |
SLE-Responder-Index
Odds Ratio (95%-KI) vs. Placebo
|
43,6%
|
52,8%
1,49 (0,64; 3,46)
| |
Komponenten des SLE-Responder-Index
| |
Prozentualer Anteil Patienten mit SELENA-SLEDAI-Rückgang ≥4
Odds Ratio (95%-KI) vs. Placebo
|
43,6%
|
54,7%
1,62 (0,69; 3,78)
| |
Anteil Patienten ohne Verschlechterung gemäss BILAG-Index (%)
Odds Ratio (95%-KI) vs. Placebo
|
61,5%
|
73,6%
1,96 (0,77; 4,97)
| |
Anteil Patienten ohne Verschlechterung gemäss PGA (%)
Odds Ratio (95%-KI) vs. Placebo
|
66,7%
|
75,5%
1,70 (0,66; 4,39)
|
¹ Bei den Analysen wurden alle Probanden ausgeschlossen, bei denen eine Ausgangsmessung für eine der Komponenten fehlte (1 für Placebo).
Pädiatrische Patienten unter Benlysta 10 mg/kg wiesen ein um 64% geringeres Risiko von schweren Schüben auf als die Placebogruppe (Hazard Ratio 0,36; 95%-KI: 0,15–0,86). Unter den Patienten, die einen schweren Schub erlitten, trat der erste schwere Schub in der Placebogruppe im Median an Tag 113 ein, in der Benlysta-Gruppe an Tag 150. Dies stand im Einklang mit den Ergebnissen der klinischen Studien mit intravenöser Verabreichung an Erwachsene.
Auf Grundlage der Ansprechkriterien für den juvenilen SLE gemäss Paediatric Rheumatology International Trials Organisation/American College of Rheumatology (PRINTO/ACR) zeigte unter Benlysta ein höherer Anteil von pädiatrischen Patienten eine Verbesserung als unter Placebo.
|



