ZusammensetzungWirkstoffe
Methylphenidati hydrochloridum.
Hilfsstoffe
Lactosum monohydricum, antioxidans E 321, excip. pro compresso obducto.
Indikationen/AnwendungsmöglichkeitenMethylphenidat Sandoz ist indiziert zur Behandlung einer seit dem Kindesalter fortbestehenden Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) im Rahmen einer therapeutischen Gesamtstrategie.
Die Behandlung soll nur von einem Arzt bzw. einer Ärztin, die auf Verhaltensstörungen von Kindern und Jugendlichen bzw. Erwachsenen spezialisiert sind, begonnen werden und muss auch von ihm/ihr überwacht werden. Die Wirksamkeit von Methylphenidat bei der Behandlung von ADHS wurde in kontrollierten klinischen Studien an Kindern und Jugendlichen zwischen 6 und 17 Jahren und Erwachsenen ab 18 bis 65 Jahren, die die DSM-lV-Kriterien für ADHS aufwiesen, dokumentiert (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Ein Teil der Kinder, bei denen ADHS festgestellt wurde, haben die Symptome auch im Erwachsenenalter. Bei Erwachsenen soll die Symptomatik also bereits in der Kindheit begonnen haben, wenn eine Behandlung eingeleitet wird. Die Anwendung von Methylphenidat Sandoz sollte sich auf jene Patienten und Patientinnen beschränken, welche ein Präparat benötigen, bei dem die Wirkungen bei morgendlicher Einnahme bis zum Abend andauern.
Methylphenidat Sandoz sollte als Teil eines umfassenden Therapieprogramms eingesetzt werden, wenn sich Verhaltensmassnahmen allein als unzureichend erwiesen haben. Ein umfassendes Therapieprogramm zur Behandlung von ADHS kann psychologische, erzieherische und soziale Massnahmen beinhalten.
Die Diagnose sollte entsprechend den aktuellen DSM-Kriterien oder der ICD-Klassifikation gestellt werden.
Eine Behandlung mit Methylphenidat Sandoz ist nicht bei allen Kindern und Jugendlichen mit ADHS angezeigt, und die Entscheidung über die Anwendung des Arzneimittels muss auf einer sehr sorgfältigen Beurteilung des Schweregrads der Symptome des Patienten beruhen. Stimulanzien sind nicht zur Anwendung bei Patienten vorgesehen, die sekundäre umfeldbedingte Symptome und/oder andere primäre psychiatrische Störungen, einschliesslich Psychosen, zeigen. Geeignete edukative Massnahmen sind essenziell und eine psychosoziale Betreuung ist oft hilfreich.
Die spezifische Ätiologie dieses Syndroms ist unbekannt. Eine adäquate Diagnose kann nicht durch einen einzelnen diagnostischen Test gestellt werden. Sie erfordert den Einsatz medizinischer, spezieller psychologischer, pädagogischer und sozialer Ressourcen. Das Lernen kann, muss aber nicht, beeinträchtigt sein. Durch die Behandlung mit Methylphenidat Sandoz können die Hauptsymptome des ADHS wie mässige bis starke Ablenkbarkeit, rasch nachlassende Aufmerksamkeit, Impulsivität, verstärkte motorische Aktivität und gestörtes Sozialverhalten gemildert werden.
Dosierung/AnwendungAbklärungen vor Behandlungsbeginn
Vor Beginn der Behandlung mit Methylphenidat Sandoz ist es notwendig einen kardiovaskulären Status, einschliesslich körperlicher Untersuchung, Blutdruck und Herzfrequenz und sorgfältiger Anamnese sowie gegebenenfalls weiterführende kardiologische Untersuchungen, zu erheben und zu dokumentieren (siehe «Warnhinweise und Vorsichtsmassnahmen»). Da keine Langzeitdaten vorliegen, sollten regelmässige kardiovaskuläre Untersuchungen bei Vorliegen von entsprechenden Risikofaktoren erfolgen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Weiterhin ist vor Beginn der Behandlung das Gewicht und die Grösse zu erheben und in einer Wachstumskurve zu dokumentieren (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Übliche Dosierung
Kinder (ab 6 Jahren), Jugendliche und Erwachsene
Die Behandlung darf nur von einem Arzt bzw. einer Ärztin mit Erfahrung in der Therapie mit Verhaltensstörungen bei Kindern und Jugendlichen bzw. Erwachsenen begonnen und muss auch von einem oder einer solchen überwacht werden.
Methylphenidat Sandoz wird einmal täglich oral verabreicht. Da die Wirkung nach Einnahme während 12 Stunden andauert, soll das Arzneimittel einmal täglich am Morgen eingenommen werden.
Verabreichungsschema
Patienten, die Methylphenidat neu einnehmen
Die empfohlene anfängliche Tagesdosis von Methylphenidat Sandoz für Patienten, die zurzeit kein Methylphenidat einnehmen, oder denen andere Stimulanzien als Methylphenidat verabreicht werden, beträgt 18 mg einmal täglich für Kinder und Jugendliche und 18 oder 36 mg einmal täglich für Erwachsene.
Patienten, die zurzeit schon Methylphenidat einnehmen
Die empfohlene Dosis von Methylphenidat Sandoz für Patienten, die zurzeit dreimal täglich schnellfreisetzendes Methylphenidat in Dosierungen von 10 bis 60 mg/Tag einnehmen, ist in der folgenden Tabelle angegeben:
Tabelle 1: Empfohlene Dosisumstellung von einem Methylphenidat-Schema auf Methylphenidat Sandoz
|
Bisherige Methylphenidat-Tagesdosis
|
Empfohlene Startdosis von Methylphenidat Sandoz
| |
5 mg Methylphenidat 3x täglich
|
18 mg 1x täglich morgens
| |
10 mg Methylphenidat 3x täglich
|
36 mg 1x täglich morgens
| |
15 mg Methylphenidat 3x täglich
|
54 mg 1x täglich morgens
| |
20 mg Methylphenidat 3x täglich
|
72 mg 1x täglich morgens
|
Dosisanpassung/Titration
Die Festlegung der Dosierung für Patienten, die gegenwärtig Methylphenidat in anderen Dosierungsschemata einnehmen, soll aufgrund einer klinischen Beurteilung vorgenommen werden.
Die Dosis kann in wöchentlichen Abständen in 18-mg-Schritten erhöht werden.
Die maximale Tagesdosis von Methylphenidat Sandoz beträgt 54 mg bei Kindern und 72 mg bei Jugendlichen und Erwachsenen.
Dosisreduktion und Absetzen
Bei paradoxen Reaktionen (Verschlimmerung von Symptomen) oder anderen unerwünschten Wirkungen soll die Dosierung reduziert oder, falls notwendig, das Arzneimittel abgesetzt werden.
Therapiedauer und Langzeitbehandlung
Wenn sich die Symptome nach Dosissteigerung über 1 Monat nicht bessern, sollte das Arzneimittel abgesetzt werden.
Methylphenidat Sandoz muss von Zeit zu Zeit (spätestens aber nach 12 Monaten) abgesetzt werden, um den Zustand der Patienten ohne Arzneimitteleinnahme zu prüfen, und der Nutzen der Langzeitbehandlung muss regelmässig neu bewertet werden.
Zur Langzeitanwendung von Methylphenidat, v.a. im Hinblick auf Suchtpotential und andere unerwünschte Wirkungen (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen») liegen keine systematischen Untersuchungen anhand kontrollierter Studien vor.
Umstellung von Methylphenidat Sandoz auf ein anderes Methylphenidat-Arzneimittel mit verzögerter Wirkstofffreisetzung
Andere Methylphenidat-Arzneimittel mit verzögerter Wirkstofffreisetzung und anderen Freisetzungsprofilen weisen möglicherweise andere Wirksamkeits- und Verträglichkeitsprofile auf als Methylphenidat Sandoz. Es wird empfohlen, eine Umstellung nur unter zusätzlicher ärztlicher Aufsicht durchzuführen.
Ältere Patienten (>65 Jahre)
Die Anwendung von Methylphenidat Sandoz bei älteren Patienten über 65 Jahre ist in kontrollierten Studien nicht untersucht worden.
Patienten mit Leberfunktionsstörungen
Methylphenidat wurde nicht bei Patienten mit Leberinsuffizienz untersucht.
Patienten mit Nierenfunktionsstörungen
Methylphenidat wurde nicht bei Patienten mit Niereninsuffizienz untersucht.
Kinder (<6 Jahre)
In kontrollierten Studien wurde die Anwendung von Methylphenidat Sandoz bei Patienten unter 6 Jahren nicht untersucht. Methylphenidat Sandoz darf bei Patienten unter 6 Jahren nicht angewendet werden.
Art der Anwendung
Methylphenidat Sandoz Retardtabletten müssen zusammen mit Flüssigkeit als Ganzes geschluckt werden. Sie dürfen nicht zerkaut, zerteilt oder zerkleinert werden, da der Wirkstoff in einer nicht-resorbierbaren Hülle enthalten ist, durch welche dieser kontrolliert und kontinuierlich freigesetzt wird (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Kontraindikationen·Ausgeprägte Angst- und Spannungszustände sowie ausgeprägte Agitiertheit, da Methylphenidat diese Symptome verstärken kann;
·Diagnose oder Anamnese von schwerer Depression, Anorexia nervosa, psychotische Symptome, Suizidneigung, Manie, Schizophrenie oder Borderline-Persönlichkeitsstörung, da Methylphenidat diese Zustände verschlechtern könnte;
·Alkohol- und Drogenabusus;
·familiäre Belastung oder Diagnose von Tourette-Syndrom;
·Glaukom;
·bei Patienten mit vergrösserter Prostata mit Restharnbildung;
·Phäochromozytom;
·Hyperthyreose;
·Herzrhythmusstörungen;
·vorbestehende Herz-Kreislauferkrankungen einschliesslich schwerer Hypertonie, Herzinsuffizienz, Angina pectoris, hämodynamisch signifikanter, angeborener Herzfehler, Kardiomyopathien, Myokardinfarkt, potenziell lebensbedrohender Arrhythmien und Kanalopathien (Erkrankungen, die aufgrund von Dysfunktionen der Ionenkanäle verursacht wurden);
·arterielle Verschlusskrankheit;
·vorbestehende zerebrovaskuläre Erkrankungen, wie zum Beispiel zerebrale Aneurysmen, Gefässanomalien einschliesslich Vaskulitis oder Schlaganfall;
·Behandlung mit nicht-selektiven, irreversiblen Monoaminooxidase-Hemmern (MAO-Hemmern) und während mindestens 14 Tagen im Anschluss an das Absetzen eines MAO-Hemmers, da dann das Risiko einer hypertensive Krise besteht (siehe «Interaktionen»);
·bekannte Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenAllgemeines
Die Entscheidung, Methylphenidat Sandoz nach detaillierter Anamnese und Untersuchung bei hyperkinetischen Verhaltensstörungen zu verschreiben, sollte von der Beurteilung des Schweregrades der Symptome und dem Alter des Kindes abhängig gemacht werden. Die Verschreibung sollte nicht allein aufgrund des Vorhandenseins einzelner oder mehrerer auffälliger Verhaltensmerkmale erfolgen. Stehen die Symptome mit akuten Stressreaktionen in Verbindung, ist Methylphenidat Sandoz im Allgemeinen nicht indiziert.
Langzeitanwendung (mehr als 12 Monate)
Die Sicherheit und Wirksamkeit der Langzeitanwendung von Methylphenidat wurden nicht systematisch in kontrollierten Studien untersucht. Die Behandlung mit Methylphenidat sollte und muss nicht unbegrenzt erfolgen. Bei Kindern und Jugendlichen wird sie in der Regel während oder nach der Pubertät abgesetzt. Patienten unter Langzeitbehandlung (d.h. über mehr als 12 Monate) müssen laufend entsprechend den Richtlinien in «Warnhinweise und Vorsichtsmassnahmen» (siehe unten) sorgfältig hinsichtlich Herz-Kreislaufstatus, Wachstum (Kinder), Gewicht, Appetit, Entwicklung von neuen oder Verschlechterung von bestehenden psychiatrischen Erkrankungen überwacht werden. Psychiatrische Erkrankungen, die überwacht werden sollten, werden unten beschrieben und beinhalten (sind aber nicht begrenzt auf): motorische oder vokale Tics, aggressives Verhalten, Agitiertheit, Angst, Depression, Psychose, Manie, Wahnvorstellungen, Reizbarkeit, mangelnde Spontaneität, Rückzug und übermässige Perseveration.
Wird Methylphenidat über längere Zeit (über 12 Monate) verordnet, soll regelmässig der langfristige Nutzen des Arzneimittels für den einzelnen Patienten neu bewerten werden, indem behandlungsfreie Zeitabschnitte eingelegt werden, um das Verhalten des Patienten ohne medikamentöse Behandlung zu beurteilen. Es wird empfohlen, Methylphenidat mindestens einmal im Jahr abzusetzen, um das Befinden des Patienten zu beurteilen (bei Kindern vorzugsweise während der Schulferien). Eine Besserung kann möglicherweise aufrechterhalten bleiben, wenn das Arzneimittel vorübergehend oder dauerhaft abgesetzt wurde.
Ältere Patienten
Methylphenidat darf nicht bei älteren Patienten angewendet werden. Sicherheit und Wirksamkeit von Methylphenidat in dieser Altersgruppe wurden nicht nachgewiesen. Methylphenidat wurde nicht für ADHS bei Patienten, die älter als 65 Jahre sind, untersucht.
Patienten unter 6 Jahren
Methylphenidat Sandoz darf bei Patienten unter 6 Jahren nicht angewendet werden. Zu Wirksamkeit und Sicherheit und zur Dosierung bei Kindern unter 6 Jahren liegen keine ausreichenden Daten vor.
Strukturelle Herzanomalien, andere schwere Herzerkrankungen und plötzlicher Tod
Bei Patienten mit strukturellen Herzanomalien oder anderen schweren Herzproblemen, die mit ZNS-Stimulanzien, einschliesslich Methylphenidat, in normalen Dosierungen behandelt wurden, wurde über plötzliche Todesfälle berichtet. Solche Ereignisse wurden vereinzelt auch bei Patienten mit vermuteten vorbestehenden kardiovaskulären Erkrankungen beobachtet. Bei Patienten mit strukturellen Herzanomalien oder kardiovaskulären Vorerkrankungen (z.B. Kardiomyopathien, schwerwiegenden Herzrhythmusstörungen oder anderen schwerwiegenden Herzproblemen) sollte Methylphenidat deshalb nicht angewendet werden, da diese sie einer erhöhten Gefährdung für die sympathomimetischen Wirkungen des stimulierenden Arzneimittels aussetzen könnten.
Kardiale Erkrankungen - Erwachsene
Plötzlicher Tod, Schlaganfall und Myokardinfarkt wurden bei Erwachsenen berichtet, die stimulierende Arzneimittel in normalen Dosierungen für ADHS einnehmen. Obwohl in diesen Fällen der Einfluss der Stimulanzien unbekannt ist, haben Erwachsene eine höhere Wahrscheinlichkeit als Kinder für schwerwiegende strukturelle Herzanomalien, Kardiomyopathien, schwerwiegende Herzrhythmusstörungen, koronare Herzkrankheiten oder andere schwerwiegende Herzprobleme. Erwachsene mit diesen Anomalien dürfen generell nicht mit stimulierenden Arzneimitteln behandelt werden.
Missbrauch und kardiovaskuläre Ereignisse
Der Missbrauch von Stimulanzien des zentralen Nervensystems kann mit plötzlichem Tod und anderen schwerwiegenden kardiovaskulären unerwünschten Ereignissen assoziiert sein.
Kardiovaskulärer Status vor und unter der Therapie
Um bestehende Herzkrankheiten zu erkennen, sollte bei Patienten, bei denen eine Behandlung mit Methylphenidat vorgesehen ist, eine sorgfältige Anamnese (einschliesslich Abklärung der Familiengeschichte in Bezug auf plötzliche Todesfälle oder ventrikuläre Arrhythmien) und eine physische Untersuchung durchgeführt werden. Falls erste Befunde oder anamnestische Angaben auf eine solche Erkrankung hinweisen, sollten weitere kardiologische Untersuchungen durchgeführt werden (z.B. Elektrokardiogramm, Echokardiogramm).
Vorsicht ist insbesondere angebracht bei der Behandlung von Patienten, deren Gesundheitszustand durch eine Erhöhung von Blutdruck oder Pulsfrequenz beeinträchtigt werden könnte (siehe «Kontraindikationen»).
Der kardiovaskuläre Status sollte sorgfältig beobachtet werden. Blutdruck und Herzfrequenz sollten bei jeder Dosisanpassung und bei klinischem Bedarf und dann in angemessenen Abständen (mindestens aber alle 6 Monate) überprüft und schriftlich dokumentiert werden.
Treten während einer Behandlung mit Methylphenidat Symptome wie Palpitationen, Brustschmerzen bei körperlicher Anstrengung, Synkopen, Dyspnoe oder andere Symptome auf, welche auf eine Herzerkrankung hindeuten, sollte umgehend eine kardiologische Abklärung erfolgen.
Methylphenidat sollte bei Patienten abgesetzt werden, bei denen wiederholt Tachykardien, Arrhythmien oder ein erhöhter systolischer Blutdruck (>95. Perzentil) gemessen wurde. Eine Überweisung an einen Kardiologen ist indiziert.
Die Anwendung von Methylphenidat ist kontraindiziert bei bestimmten vorbestehenden Herz-Kreislauferkrankungen, wenn nicht der Rat eines Kardiologen eingeholt wurde (siehe «Kontraindikationen»).
Die Auswertung von Daten aus klinischen Studien mit Methylphenidat bei Kindern und Jugendlichen mit ADHS hat gezeigt, dass Patienten unter Methylphenidat-Behandlung häufig eine Änderung des diastolischen und systolischen Blutdrucks um über 10 mmHg gegenüber dem Ausgangswert im Vergleich zu den Kontrollen entwickeln. Ein Anstieg der diastolischen und systolischen Blutdruckwerte wurde ebenfalls bei klinischen Studiendaten von erwachsenen ADHS-Patienten festgestellt. Darüber hinaus kam es in klinischen Studien an Kindern unter Methylphenidat gegenüber Placebo während des Tages zu einer Erhöhung des Ruhepulses um durchschnittlich 2-6 Schläge pro Minute.
Die kurz- und langfristigen klinischen Auswirkungen dieser kardiovaskulären Effekte bei Kindern und Jugendlichen sind nicht bekannt. Mögliche klinische Komplikationen können als Ergebnis der in den klinischen Studiendaten beobachteten Wirkungen nicht ausgeschlossen werden, insbesondere wenn die Behandlung bei Kindern und Jugendlichen in das Erwachsenenalter fortgeführt wird.
Zentral wirksame alpha-2-Agonisten
Vorsicht ist geboten bei der gleichzeitigen Anwendung zentral wirksamer alpha-2-Agonisten wie Clonidin, da schwere unerwünschte Wirkungen einschliesslich plötzlicher Todesfälle berichtet wurden (siehe «Interaktionen»).
Halogenierte Anästhetika
Wenn ein chirurgischer Eingriff geplant ist, sollte Methylphenidat am Tag des Eingriffs nicht eingenommen werden, da sonst das Risiko eines plötzlichen Anstiegs von Blutdruck und Herzfrequenz im Verlauf der Operation besteht (siehe «Interaktionen»).
Zerebrovaskuläre Erkrankungen
Bei der Anwendung von Methylphenidat wurde über zerebrovaskuläre Erkrankungen, wie zerebrale Vaskulitis/Arteriitis, zerebrovaskuläre Okklusion und zerebrale Hämorrhagie berichtet (siehe «Unerwünschte Wirkungen»). Ein frühzeitiges Erkennen aufgrund starker Hinweise kann das umgehende Absetzen von Methylphenidat Sandoz ermöglichen und ist für eine frühzeitige Behandlung wesentlich. Starke Hinweise sind neu auftretende neurologische Symptome, die auf eine zerebrale Ischämie oder Hämorrhagie hindeuten, wie starke Kopfschmerzen, Taubheitsgefühl, (einseitige) Schwäche, Lähmung, Beeinträchtigung von Koordination, Visus, Sprache, Sprechen oder Gedächtnis.
Patienten mit zusätzlichen Risikofaktoren (wie kardiovaskuläre Erkrankungen in der Vorgeschichte, Begleitmedikation, die den Blutdruck erhöht) sollten bei jedem Termin auf neurologische Anzeichen und Symptome nach Behandlungsbeginn mit Methylphenidat untersucht werden.
Bei Patienten mit vorbestehenden zerebrovaskulären Erkrankungen (z.B. Aneurysma, vaskuläre Fehlbildungen/Anomalien) wird die Behandlung mit Methylphenidat Sandoz nicht empfohlen (siehe «Kontraindikationen»).
Krampfanfälle
Methylphenidat Sandoz darf nur mit Vorsicht bei Patienten mit Epilepsie angewendet werden.
Es gibt klinische Hinweise darauf, dass Methylphenidat bei Patienten mit epileptischen Anfällen in der Anamnese, oder mit vorbestehenden Anomalien des EEG ohne epileptische Anfälle oder, in sehr seltenen Fällen, bei Patienten ohne vorherige epileptische Anfälle und Hinweise im EEG, die Krampfschwelle herabsetzen kann. Beim Auftreten von Krampfanfällen oder bei einer Zunahme der Anfallshäufigkeit sollte Methylphenidat abgesetzt werden.
Sehstörungen
In seltenen Fällen sind Symptome von Sehstörungen vorgekommen. Dabei ist über Akkommodationsstörungen und verschwommenes Sehen berichtet worden.
Serotoninsyndrom
Bei gleichzeitiger Anwendung von Methylphenidat mit serotonergen Arzneimitteln ist über das Auftreten des Serotoninsyndroms berichtet worden. Wenn die gleichzeitige Anwendung von Methylphenidat mit einem serotonergen Arzneimittel gerechtfertigt ist, ist das unverzügliche Erkennen der Symptome des Serotoninsyndroms wichtig. Zu diesen Symptomen gehören unter anderem Veränderungen des mentalen Zustandes (z.B. Agitiertheit, Halluzinationen, Koma), vegetative Instabilität (z.B. Tachykardie, labiler Blutdruck, Hyperthermie), neuromuskuläre Anomalien (z.B. Hyperreflexie, Koordinationsstörung, Rigidität) und/oder gastrointestinale Symptome (z.B. Übelkeit, Erbrechen, Diarrhö). Methylphenidat muss bei Verdacht auf ein Serotoninsyndrom so schnell wie möglich abgesetzt werden (siehe «Interaktionen»).
Medikamentenabhängigkeit und Missbrauch
Patienten sollten sorgfältig hinsichtlich Missbrauchs und Fehlgebrauchs von Methylphenidat überwacht werden.
Wegen des Potentials für Fehlgebrauch und Missbrauch sollte Methylphenidat bei Patienten mit bekannter Drogen- und/oder Alkoholabhängigkeit mit Vorsicht angewendet werden.
Chronischer Missbrauch kann zu ausgeprägter Toleranz und psychischer Abhängigkeit mit abnormalem Verhalten in verschiedenen Schweregraden führen. Speziell bei parenteralem Abusus können manifeste psychotische Episoden vorkommen.
Bei der Entscheidung über eine ADHS-Behandlung ist das Patientenalter, das Bestehen von Risikofaktoren für Suchtstörungen (wie z.B. gleichzeitige oppositionelle oder Verhaltens- und bipolare Störungen), früherer oder bestehender Missbrauch zu berücksichtigen. Vorsicht ist geboten bei emotional instabilen Patienten, wie z.B. früheren Drogen- oder Alkoholabhängigen, da diese Patienten die Dosis eigenständig erhöhen könnten.
Bei einigen Patienten mit einem hohen Missbrauchsrisiko sind möglicherweise Methylphenidat oder andere Stimulanzien nicht geeignet, und eine Therapie ohne Stimulanzien sollte erwogen werden.
Absetzen
Eine sorgfältige Überwachung ist beim Absetzen des Arzneimittels erforderlich, da es dabei zu Entzugserscheinungen sowie zur Demaskierung von Depressionen oder von chronischer Überaktivität kommen kann. So ist insbesondere beim Absetzen nach missbräuchlicher Anwendung eine engmaschige Beobachtung erforderlich, da schwere Depressionen auftreten können. Zudem benötigen einige Patienten auch bei therapeutischem Gebrauch möglicherweise Nachuntersuchungen über einen längeren Zeitraum und/oder eine Nachbehandlung demaskierter Symptome der zugrundeliegenden Störung.
Psychiatrische Erkrankungen
Psychiatrische Komorbiditäten bei ADHS sind häufig und sollten bei der Verschreibung von Stimulanzien berücksichtigt werden. Vor Behandlungsbeginn mit Methylphenidat sollte der Patient auf bestehende psychiatrische Erkrankungen untersucht und eine Familienanamnese hinsichtlich psychiatrischer Erkrankungen erhoben werden. Im Falle des Auftretens psychiatrischer Symptome oder der Verschlimmerung einer bestehenden psychiatrischen Erkrankung sollte die Therapie mit Methylphenidat nicht fortgesetzt werden, wenn nicht der Nutzen der Behandlung das potenzielle Risiko für den Patienten überwiegt.
Bei jeder Dosisanpassung und dann mindestens alle 6 Monate und bei jedem Besuch ist zu kontrollieren, ob sich psychiatrische Störungen entwickelt oder verschlechtert haben; eine Unterbrechung der Behandlung könnte angebracht sein.
Psychotische und manische Symptome
Die Verabreichung von Methylphenidat an Patienten mit psychotischen Störungen kann die Symptome von Verhaltens- oder Denkstörungen verstärken.
Behandlungsbedingte psychotische Symptome (visuelle/taktile/auditive Halluzinationen und Wahnvorstellungen) oder Manie bei Patienten ohne bekannte psychotische Erkrankung oder Manie können durch übliche Dosierungen von Methylphenidat hervorgerufen werden (siehe «Unerwünschte Wirkungen»). Wenn manische oder psychotische Symptome auftreten, sollte an einen möglichen kausalen Zusammenhang mit Methylphenidat gedacht und ein Abbruch der Therapie in Erwägung gezogen werden.
Bipolare Störungen
Besondere Vorsicht ist geboten bei der Anwendung von Stimulanzien zur Behandlung von ADHS bei Patienten, bei denen eine komorbide bipolare Störung vorliegen könnte, die sich aber aktuell im euthymen oder Erhaltungs-Intervall befinden, da bei solchen Patienten eine manische Episode ausgelöst werden kann. Vor dem Behandlungsbeginn mit Stimulanzien muss bei Patienten mit komorbiden depressiven Symptomen sehr sorgfältig abgeklärt werden, ob bei ihnen ein Risiko für eine bipolare Störung besteht. Zu diesen Abklärungen gehört die Aufnahme einer detaillierten psychiatrischen Krankengeschichte, einschliesslich einer Familien-Anamnese von Suiziden, bipolaren Störungen und Depressionen.
Eine engmaschige kontinuierliche Überwachung ist bei diesen Patienten erforderlich (siehe oben unter «Psychiatrische Erkrankungen»). Die Patienten sollten bei jeder Dosisanpassung, mindestens alle 6 Monate und bei jeder Untersuchung auf Symptome hin überwacht werden.
Schwere Depressionen
Methylphenidat Sandoz soll nicht zur Behandlung schwerer Depressionen verwendet werden.
Aggressives oder feindseliges Verhalten
Bei Patienten, die eine Therapie mit Methylphenidat beginnen, sollte auf das Auftreten oder die Verstärkung von aggressivem Verhalten oder Feindseligkeit geachtet werden. Eine sorgfältige Überwachung ist nötig, und zwar bei Behandlungsbeginn, bei jeder Dosisanpassung und dann mindestens alle 6 Monate und bei jeder Untersuchung. Aggression ist häufig mit ADHS assoziiert; dennoch wurde von unerwartetem Auftreten oder einer Verstärkung von Aggression während der Therapie mit Methylphenidat berichtet. Bei Patienten, die diese Verhaltensänderungen zeigen, sollte der Arzt bzw. die Ärztin die Notwendigkeit einer Anpassung der Behandlung abklären, wobei zu beachten ist, dass eine Auf- oder Abtitration angebracht sein kann. Ein Therapieabbruch kann in Betracht gezogen werden (siehe «Unerwünschte Wirkungen»).
Suizidalität
Patienten, bei denen während der ADHS-Behandlung Suizidgedanken oder suizidales Verhalten auftreten, sollten sofort von ihrem Arzt bzw. ihrer Ärztin beurteilt werden. Eine Verschlimmerung der zugrunde liegenden psychiatrischen Erkrankung und ein möglicher kausaler Zusammenhang mit der Methylphenidat-Behandlung sollte in Erwägung gezogen werden. Eine entsprechende Behandlung der zu Grunde liegenden psychiatrischen Erkrankung kann notwendig sein und eine Beendigung der Methylphenidat-Behandlung sollte in Erwägung gezogen werden.
Tics
Stimulanzien mit Wirkung auf das Zentralnervensystem einschliesslich Methylphenidat sind mit der Auslösung oder Verschlimmerung motorischer und verbaler Tics in Verbindung gebracht worden. Die Verschlimmerung eines Tourette-Syndroms wurde ebenfalls beobachtet (siehe «Unerwünschte Wirkungen»). Vor der Behandlung mit Stimulanzien sollte deshalb eine klinische Beurteilung der Patienten und der Familienanamnese hinsichtlich Tics oder eines Tourette-Syndroms durchgeführt werden. Während der Behandlung mit Methylphenidat sollten die Patienten bei jeder Dosisanpassung und dann mindestens alle 6 Monate oder bei jedem Besuch hinsichtlich des Auftretens von Tics oder eines Tourette-Syndroms überwacht werden; falls klinisch geboten, sollte die Behandlung abgebrochen werden.
Angst- und Spannungszustände oder Agitiertheit
Bei Patienten, die mit Methylphenidat behandelt wurden, ist über Angstzustände, Agitiertheit und Anspannung berichtet worden (siehe «Unerwünschte Wirkungen»). Methylphenidat wird auch mit der Verschlimmerung bestehender Angst- oder Spannungszustände oder Agitiertheit in Verbindung gebracht. Bei einigen Patienten führten die Angstzustände zu einem Absetzen von Methylphenidat. Die klinische Bewertung von Angst- und Spannungszuständen oder Agitiertheit sollte der Anwendung von Methylphenidat vorausgehen und die Patienten sollten regelmässig während der Behandlung, bei jeder Dosisanpassung und dann mindestens alle 6 Monate oder bei jeder Untersuchung auf das Auftreten oder die Verschlimmerung dieser Symptome hin untersucht werden.
Wachstum bei Kindern
Bei der Langzeitbehandlung von Kindern mit Methylphenidat wurde über eine unzureichende Gewichtszunahme und eine Wachstumsverzögerung berichtet. Follow-up-Untersuchungen bei Kindern zwischen 7 und 10 Jahren deuten darauf hin, dass Kinder, die konstant (z.B. 7 Tage pro Woche während 1 Jahr) Methylphenidat einnehmen, eine vorübergehende Verlangsamung der Wachstumsrate (im Durchschnitt 2 cm weniger Längenwachstum und 2,7 kg weniger Gewichtszunahme über 3 Jahre) zeigen können. Follow-up-Daten in einem Alter von 25 Jahren zeigten, dass die dauerhaft behandelten Patienten durchweg eine um 3,3 cm geringere Körpergrösse und ein um 7,4 kg höheres Gewicht aufwiesen als die unbehandelte Gruppe. Andere Langzeitstudien zeigten jedoch keine signifikante Wirkung von Methylphenidat auf Körpergrösse und Gewicht.
Aus diesem Grunde sollten Kinder und Jugendliche, die eine Langzeitbehandlung benötigen, sorgfältig (mindestens alle 6 Monate) bezüglich Grösse, Gewicht und Appetit überwacht und mindestens alle 6 Monate in einer Wachstumskurve dokumentiert werden. Bei Patienten, bei denen Wachstum oder Gewichtszunahme nicht den Erwartungen entsprechen, sollte die Behandlung unterbrochen werden.
Körpergewicht
Methylphenidat kann zu vermindertem Appetit und erniedrigtem Gewicht führen. Eine Gewichtsabnahme wurde unter der Behandlung mit Methylphenidat auch bei Erwachsenen berichtet (siehe «Unerwünschte Wirkungen»). Auch bei Erwachsenen sollte das Gewicht daher regelmässig überwacht werden.
Möglichkeit einer gastrointestinalen Obstruktion
Da die Methylphenidat Sandoz Retardtabletten nicht verformbar sind und auch im Gastrointestinaltrakt ihre Form nicht merklich ändern, sollte Methylphenidat Sandoz normalerweise nicht an Patienten mit vorbestehender schwerer gastrointestinaler Stenose oder Verengung (pathologisch oder iatrogen), Dysphagie oder ausgeprägter Schwierigkeit, Tabletten zu schlucken, verabreicht werden. Es sind seltene Fälle obstruktiver Symptome bei Patienten mit bekannter Verengung in Verbindung mit der Einnahme von nicht-deformierbaren Arzneimitteln mit verzögerter Wirkstofffreisetzung berichtet worden.
Patienten mit Schluckstörungen
Um die verzögerte Wirkstofffreigabe der Retardtablette zu gewährleisten, sollte Methylphenidat Sandoz nur an Patienten verschrieben werden, die die Retardtablette als Ganzes schlucken können (siehe «Möglichkeit einer gastrointestinalen Obstruktion»). Die Patienten sollten informiert werden, dass Methylphenidat Sandoz Retardtabletten zusammen mit Flüssigkeit als Ganzes (ungeteilt) geschluckt werden müssen. Die Retardtabletten dürfen nicht zerkaut, zerteilt oder zerkleinert werden.
Ausscheidung der Tablettenhülle
Der Wirkstoff ist in einer nicht resorbierbaren Hülle enthalten, entwickelt für eine kontinuierliche Freisetzung des Wirkstoffes. Die nicht resorbierbare Tablettenhülle wird zusammen mit unlöslichen Komponenten des Tablettenkerns aus dem Körper ausgeschieden; die Patienten sollten nicht beunruhigt sein, falls sie in ihrem Stuhl ein tablettenähnliches Objekt entdecken.
Hämatologisch-klinische Untersuchung und andere laborchemische Parameter
Die Sicherheit der Langzeitbehandlung mit Methylphenidat ist nicht vollständig bekannt. Während einer länger dauernden Therapie sind regelmässige hämatologische Untersuchungen (komplettes Differentialblutbild und Thrombozytenzahlbestimmung) angezeigt. Bei Vorliegen einer Leukopenie, Thrombozytopenie, Anämie oder anderen Veränderungen einschliesslich der Hinweise auf schwerwiegende Nieren- oder Lebererkrankungen ist an einen Abbruch der Behandlung zu denken (siehe «Unerwünschte Wirkungen»).
Priapismus
Im Zusammenhang mit der Behandlung mit methylphenidathaltigen Produkten wurden sowohl bei Kindern und Jugendlichen als auch bei Erwachsenen über Einzelfälle von langanhaltenden und schmerzhaften Erektionen (Priapismus) berichtet, die eine sofortige ärztliche Behandlung, gelegentlich auch eine chirurgische Intervention erforderten (siehe «Unerwünschte Wirkungen»). Priapismus wurde meist nicht während des Therapiebeginns berichtet, sondern entwickelte sich nach einiger Zeit der Einnahme des Arzneimittels, oft im Anschluss an eine Dosiserhöhung. Priapismus trat auch während einer methylphenidatfreien Zeit (Therapiepause oder Therapieabbruch) auf. Patienten, die schmerzhafte Erektionen entwickeln, die ungewöhnlich lang anhalten (mehr als 2 Stunden) oder häufig sind, sollten unverzüglich einen Arzt bzw. eine Ärztin aufsuchen. Die Medizinalpersonen sollen Patienten und ihre Eltern ausdrücklich auf dieses Problem und dessen Dringlichkeit hinweisen.
Ermüdung (Fatigue)
Methylphenidat Sandoz soll nicht zur Prävention oder Behandlung normaler Ermüdungszustände verwendet werden.
Nieren- oder Leberinsuffizienz
Es liegen keine Erfahrungen zur Anwendung von Methylphenidat bei Patienten mit Nieren- oder Leberinsuffizienz vor.
Lactose
Dieses Arzneimittel enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
Auswahl der Methylphenidat-Darreichungsform
Der behandelnde Spezialist muss auf individueller Basis und je nach gewünschter Wirkungsdauer entscheiden, welche methylphenidathaltige Darreichungsform ausgewählt wird.
Drogenscreening
Dieses methylphenidathaltige Arzneimittel kann zu einem falsch positiven Laborwert für Amphetamine führen, insbesondere bei Verwendung von Immunoassay-Methoden. Leistungssportler müssen sich bewusst sein, dass dieses Arzneimittel bei Dopingkontrollen zu positiven Ergebnissen führen kann.
InteraktionenEinfluss anderer Substanzen auf die Pharmakokinetik von Methylphenidat
Methylphenidat wird nicht in klinisch relevantem Ausmass durch Cytochrom P450 metabolisiert. Es ist nicht zu erwarten, dass Cytochrom-P450-Induktoren oder -Inhibitoren einen relevanten Einfluss auf die Pharmakokinetik von Methylphenidat haben. Umgekehrt hemmen die D- und L-Enantiomere von Methylphenidat die Cytochrome P450 1A2, 2C8, 2C9, 2C19, 2D6, 2E1 oder 3A nicht in relevantem Ausmass.
Einfluss von Methylphenidat auf die Pharmakokinetik anderer Substanzen
Es ist nicht bekannt, wie Methylphenidat die Plasmakonzentrationen von gleichzeitig angewendeten Arzneimitteln beeinflussen kann. Daher ist Vorsicht geboten, wenn Methylphenidat mit anderen Arzneimitteln, besonders bei solchen mit enger therapeutischer Breite, angewendet wird.
Weitere Interaktionen
Es liegen Berichte mit Hinweisen vor, dass Methylphenidat den Metabolismus von Antikoagulanzien vom Cumarin-Typ, Antikonvulsiva (z.B. Phenobarbital, Phenytoin, Primidon) und einigen Antidepressiva (trizyklische Antidepressiva und selektive Serotonin-Wiederaufnahme-Inhibitoren) hemmen kann. Bei Beginn oder Absetzen einer Methylphenidat-Therapie kann es erforderlich werden, die Dosis dieser gleichzeitig verabreichten Arzneimittel anzupassen und die Wirkstoffkonzentrationen im Plasma zu bestimmen (bzw. bei Cumarin die Koagulationszeiten).
Einfluss von Methylphenidat auf die Pharmakodynamik anderer Substanzen
Gleichzeitige Anwendung kontraindiziert
Monoaminoxidase (MAO)-Hemmer
Wegen des Risikos einer möglichen hypertensiven Krise ist Methylphenidat bei mit nicht-selektiven, irreversiblen MAO-Hemmern (momentan oder während der letzten zwei Wochen) behandelten Patienten kontraindiziert (siehe «Kontraindikationen»).
Halogenierte Anästhetika
Im Verlauf einer Operation besteht das Risiko eines plötzlichen Anstiegs von Blutdruck und Herzfrequenz. Wenn ein chirurgischer Eingriff geplant ist, sollte Methylphenidat am Tag des Eingriffs nicht eingenommen werden.
Zentral wirksame alpha-2-Agonisten (z.B. Clonidin)
Schwere unerwünschte Wirkungen (einschliesslich des plötzlichen Todes) wurden bei gleichzeitiger Anwendung von Clonidin und Methylphenidat berichtet. Die Sicherheit der Langzeitanwendung von Methylphenidat in Kombination mit Clonidin oder anderen zentral wirkenden alpha-2-Agonisten wurde bisher nicht systematisch untersucht.
Gleichzeitige Anwendung nicht empfohlen
Alkohol
Alkohol kann unerwünschte zentralnervöse Effekte von Psychopharmaka, Methylphenidat eingeschlossen, verstärken. In-vitro-Daten lassen darauf schliessen, dass eine Alkoholkonzentration von mehr als 10% die kumulative Freisetzung von Methylphenidat aus den Methylphenidat-Tabletten erhöht. Die klinische Relevanz dieser Feststellung auf die Methylphenidat-Exposition nach oraler Einnahme von Methylphenidat zusammen mit Alkohol ist nicht bekannt. Es ist deshalb ratsam, während der Behandlung mit Methylphenidat Sandoz auf Alkohol zu verzichten.
Serotonerge Arzneimittel
Es liegen Berichte über das Auftreten eines Serotoninsyndroms nach gleichzeitiger Anwendung von Methylphenidat und anderen serotonergen Arzneimitteln vor.
Zu den serotonergen Arzneimitteln zählen beispielsweise Triptane, selektive Serotonin-Wiederaufnahmehemmer (SSRI), Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRI), Lithium, Fentanyl und seine Analoga, Tramadol, Dextromethorphan, Tapentadol, Pethidin, Methadon oder Johanniskraut (Hypericum perforatum) oder Wirkstoffe, die den Serotonin-Stoffwechsel hemmen (einschliesslich MAO-Hemmer, wie z.B. Methylenblau), der antibiotische Wirkstoff Linezolid oder von Serotonin-Vorstufen, beispielsweise Tryptophan-haltige Nahrungsergänzungsmittel.
Die gleichzeitige Anwendung von Methylphenidat Sandoz und einem der serotonergen Arzneimittel wird nicht empfohlen, da dies zur Entwicklung eines Serotoninsyndroms führen kann.
Das Serotoninsyndrom ist eine potenziell lebensbedrohliche Situation. Symptome können beispielsweise Veränderungen des mentalen Status, autonome Instabilität, neuromuskuläre Symptome, Krampfanfälle, Tremor und/oder gastrointestinale Symptome umfassen. In seiner schwersten Ausprägung kann das Serotoninsyndrom Ähnlichkeit mit einem malignen neuroleptischen Syndrom aufweisen.
Wenn die gleichzeitige Anwendung von Methylphenidat mit einem serotonergen Arzneimittel gerechtfertigt ist, ist das schnelle Erkennen der Symptome eines Serotoninsyndroms wichtig (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei Verdacht auf Vorliegen eines Serotoninsyndroms ist Methylphenidat umgehend abzusetzen, und es ist eine geeignete Behandlung einzuleiten.
Weitere Interaktionen
Antihypertensiva
Methylphenidat Sandoz kann die blutdrucksenkende Wirkung von Antihypertensiva reduzieren.
Blutdruckerhöhende Mittel
Vorsicht ist geboten, wenn mit Methylphenidat behandelte Patienten mit einem anderen Arzneimittel behandelt werden sollen, das ebenfalls den Blutdruck erhöhen kann (siehe «Warnhinweise und Vorsichtmassnahmen» – «Kardiovaskulärer Status vor und unter der Therapie» und «Zerebrovaskuläre Erkrankungen»).
Dopaminerge Substanzen einschliesslich Antipsychotika
Da eine Hauptwirkung von Methylphenidat darin besteht, die extrazellulären Dopaminspiegel zu erhöhen, kann Methylphenidat Sandoz mit pharmakodynamischen Interaktionen verbunden sein, wenn es zusammen mit direkten und indirekten Dopaminagonisten (einschliesslich dopaminergen Substanzen und trizyklischen Antidepressiva) oder Dopaminantagonisten (einschliesslich Antipsychotika) verabreicht wird. Bei Patienten, die sowohl Methylphenidat Sandoz als auch ein Antipsychotikum erhalten, ist Vorsicht geboten, da extrapyramidale Symptome auftreten könnten, wenn diese Arzneimittel gleichzeitig verabreicht werden oder wenn die Dosierung eines oder beider Arzneimittel angepasst wird.
Schwangerschaft, StillzeitSchwangerschaft
Während der Schwangerschaft darf Methylphenidat Sandoz nicht verwendet werden, es sei denn, dies ist eindeutig erforderlich.
Daten aus einer Kohortenstudie mit insgesamt etwa 3400 im ersten Trimenon exponierten Schwangerschaften deuten nicht auf ein insgesamt erhöhtes Risiko von Geburtsfehlern hin. Die Häufigkeit kardialer Fehlbildungen war leicht erhöht (gepooltes adjustiertes relatives Risiko 1,3; 95%-KI: 1,0–1,6), entsprechend 3 zusätzlichen Kindern mit kongenitaler kardialer Fehlbildung auf 1000 Frauen, die Methylphenidat im ersten Trimenon erhalten, im Vergleich zu nicht exponierten Schwangerschaften. Es liegen Spontanberichte von kardiorespiratorischer Toxizität bei Neugeborenen vor, insbesondere wurde von fetaler Tachykardie und Atemnot berichtet.
Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»).
Stillzeit
Methylphenidat wurde in der Muttermilch nachgewiesen. Ausgehend von Muttermilchproben von fünf Müttern führten die Methylphenidatkonzentrationen in der Muttermilch beim Säugling zu Dosen von 0,16 bis 0,7% der maternalen, nach Gewicht berichtigten Dosierung und zu einem Verhältnis der Menge in der Muttermilch zur Menge im maternalen Plasma im Bereich von 1,1 bis 2,7. Als Vorsichtsmassnahme sollte stillenden Müttern empfohlen werden, Methylphenidat Sandoz nicht einzunehmen.
Fertilität
Tierexperimentelle Studien zeigten keine Beeinträchtigung der Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs ist bekannt, dass Methylphenidat Sandoz Schwindelgefühle verursachen kann. Beim Fahren, Bedienen von Maschinen oder anderen potenziell gefährlichen Tätigkeiten ist deshalb Vorsicht angebracht. Die Patienten sollten angemessen gewarnt werden, bis sie sich hinreichend sicher sind, dass Methylphenidat Sandoz ihre Fähigkeit, derartige Tätigkeiten auszuführen, nicht negativ beeinflusst.
Unerwünschte WirkungenIn folgenden Abschnitten ist die Häufigkeit wie folgt angegeben: sehr häufig (≥1/10), häufig (<1/10 und ≥1/100), gelegentlich (<1/100 und ≥1/1000), selten (<1/1000 und ≥10'000), sehr selten (<1/10'000), nicht bekannt (kann aus den verfügbaren Daten nicht abgeschätzt werden).
Bei der Anwendung von methylphenidathaltigen Arzneimittel sind unerwünschte Wirkungen beobachtet worden, die als Klasseneffekte zu deuten sind.
Die dabei am häufigsten beobachteten Nebenwirkungen sind:
Infektionen und parasitäre Erkrankungen: Nasopharyngitis.
Stoffwechsel- und Ernährungsstörungen: Anorexie, verminderter Appetit, mässig verringerte Gewichts- und Grössenzunahme bei längerer Anwendung bei Kindern.
Psychiatrische Erkrankungen: Schlaflosigkeit, Nervosität, Anorexie, Affektlabilität, Aggression, Unruhe, Angst, Depression, Reizbarkeit, anormales Verhalten.
Erkrankungen des Nervensystems: Kopfschmerzen, Schwindel, Dyskinesie, psychomotorische Hyperaktivität, Somnolenz.
Herzerkrankungen: Arrhythmie, Tachykardie, Palpitationen.
Gefässerkrankungen: Hypertonie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Husten, Rachen- und Kehlkopfschmerzen.
Erkrankungen des Gastrointestinaltrakts: Bauchschmerzen, Durchfall, Übelkeit, Magenbeschwerden und Erbrechen, Mundtrockenheit.
Erkrankungen der Haut und des Unterhautgewebes: Alopezie, Pruritus, Hautauschlag, Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen: Arthralgie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Pyrexie, Wachstumsverzögerung unter längerer Anwendung bei Kindern.
Untersuchungen: Veränderungen von Blutdruck und Herzfrequenz (meist eine Erhöhung), Gewichtsabnahme.
Unabhängig von ihrer Häufigkeit muss auch auf die folgenden klinisch bedeutsamen oder schwerwiegenden Nebenwirkungen bei methylphenidathaltigen Arzneimitteln hingewiesen werden:
Psychiatrische Erkrankungen: Suizid, Suizidversuch, Suizidgedanken, repetitive Verhaltensweise, taktile Halluzinationen.
Erkrankungen des Nervensystems: choreatische Bewegungen, Tics oder Verschlechterung bestehender Tics, reversible Nervenausfälle, Migräne, malignes neuroleptisches Syndrom.
Augenerkrankungen: Akkomodationsstörungen.
Herzerkrankungen: plötzlicher Herztod, Herzinfarkt.
Gefässerkrankungen: zerebrovaskuläre Störungen bzw. Hämorrhagie, Vaskulitis, Raynaud-Syndrom, peripheres Kältegefühl (kalte Hände oder Füsse).
Erkrankungen des Gastrointestinaltrakts: Leberfunktionsstörung.
Erkrankungen der Haut und des Unterhautgewebes: exfoliative Dermatitis, Steven-Johnson-Syndrom, Erythema multiforme, Arzneimittelexanthem.
Erkrankungen der Nieren und Harnwege: Hämaturie.
Erkrankungen der Geschlechtsorgane und der Brustdrüse: Gynäkomastie.
Daneben wurde über unerwünschte Arzneimittelwirkungen im Zusammenhang mit der Anwendung von Methylphenidat berichtet:
Daten aus klinischen Studien
Die folgenden aufgeführten unerwünschten Wirkungen wurden entweder in den Studien bei pädiatrischen oder bei erwachsenen Patienten beobachtet und können für beide Patienten-Kollektive relevant sein.
Pädiatrische Patienten
Die Sicherheit von Methylphenidat wurde in vier placebokontrollierten, klinischen Doppelblindstudien an 639 pädiatrischen Patienten (Kinder und Jugendliche) mit ADHS untersucht. Den Informationen in diesem Abschnitt liegen gepoolte Daten zugrunde.
In Tabelle 2 sind unerwünschte Wirkungen aufgeführt, die in diesen Studien bei ≥1% der mit Methylphenidat behandelten pädiatrischen Patienten (Kinder und Jugendliche) berichtet wurden.
Tabelle 2: Unerwünschte Arzneimittelwirkungen, die in vier placebokontrollierten, klinischen Doppelblindstudien bei ≥1% der mit Methylphenidat behandelten Patienten (Kinder und Jugendliche) berichtet wurden
|
System/Organklasse
Unerwünschtes Ereignis
|
Methylphenidat
(n= 321)
%
|
Placebo
(n= 318)
%
| |
Infektionen und parasitäre Erkrankungen
| |
Nasopharyngitis
|
2,8
|
2,2
| |
Psychiatrische Erkrankungen
| |
Schlaflosigkeit*
|
2,8
|
0,3
| |
Erkrankungen des Nervensystems
| |
Schwindel
|
1,9
|
0
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
| |
Husten
|
1,9
|
0,9
| |
Pharyngolaryngeale Schmerzen
|
1,2
|
0,9
| |
Erkrankungen des Gastrointestinaltrakts
| |
Oberbauchschmerzen
|
6,2
|
3,8
| |
Erbrechen
|
2,8
|
1,6
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
| |
Pyrexie (Fieber)
|
2,2
|
0,9
|
* Beinhaltet anfängliche Schlafstörung (Methylphenidat = 0,6%) und Schlaflosigkeit im Verlauf (Methylphenidat = 2,2%).
Die meisten unerwünschten Wirkungen waren von leichtem bis mässigem Schweregrad.
Erwachsene Patienten
Die Sicherheit von Methylphenidat wurde an 905 erwachsenen ADHS-Patienten untersucht, welche an drei placebokontrollierten, klinischen Doppelblindstudien teilnahmen. Die Informationen in diesem Abschnitt stammen aus gepoolten Daten.
Unerwünschte Wirkungen, die in diesen Studien von ≥1% der Methylphenidat-Patienten angegeben wurden, sind in Tabelle 3 dargestellt.
Tabelle 3: Unerwünschte Wirkungen, die von ≥1% der erwachsenen Methylphenidat-Patienten in drei placebokontrollierten, klinischen Doppelblindstudien angegeben wurden
|
System/Organklasse
Unerwünschtes Ereignis
|
Methylphenidat
(n= 596)
%
|
Placebo
(n= 309)
%
| |
Infektionen und parasitäre Erkrankungen
| |
Infektion des oberen Respirationstrakts
|
1,7
|
1,0
| |
Sinusitis
|
1,3
|
1,0
| |
Stoffwechsel- und Ernährungsstörungen
| |
Verminderter Appetit
|
24,8
|
6,1
| |
Appetitlosigkeit
|
4,2
|
1,3
| |
Psychiatrische Erkrankungen
| |
Schlaflosigkeit
|
13,3
|
7,8
| |
Angstgefühle
|
8,4
|
2,9
| |
Anfängliche Schlafstörungen
|
5,7
|
2,6
| |
Depressive Verstimmung
|
4,4
|
2,6
| |
Unruhe
|
4,0
|
0
| |
Agitiertheit
|
3,2
|
0,6
| |
Nervosität
|
2,3
|
0,6
| |
Bruxismus
|
1,5
|
0,6
| |
Depressionen
|
1,5
|
0,6
| |
Affektlabilität
|
1,3
|
0,6
| |
Verminderte Libido
|
1,3
|
0,6
| |
Panikattacken
|
1,3
|
0,3
| |
Spannung
|
1,3
|
0,3
| |
Aggressionen
|
1,2
|
0,6
| |
Verwirrung
|
1,0
|
0,3
| |
Erkrankungen des Nervensystems
| |
Kopfschmerzen
|
24,2
|
18,8
| |
Schwindelgefühl
|
7,4
|
5,5
| |
Zittern
|
3,4
|
0,6
| |
Parästhesien
|
1,2
|
0
| |
Spannungskopfschmerzen
|
1,0
|
0,3
| |
Augenerkrankungen
| |
Akkommodationsstörung
|
1,3
|
0
| |
Verschwommenes Sehen
|
1,3
|
1,0
| |
Erkrankungen des Ohrs und des Labyrinths
| |
Vertigo
|
2,0
|
0,3
| |
Herzerkrankungen
| |
Tachykardie
|
6,0
|
0
| |
Palpitationen
|
4,5
|
0,6
| |
Gefässerkrankungen
| |
Hypertonie
|
2,2
|
1,6
| |
Hitzewallungen
|
1,3
|
0,6
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
| |
Oropharyngolaryngeale Schmerzen
|
1,5
|
1,3
| |
Husten
|
1,2
|
1,0
| |
Atemnot
|
1,2
|
0,6
| |
Erkrankungen des Gastrointestinaltrakts
| |
Mundtrockenheit
|
15,1
|
3,6
| |
Nausea
|
14,3
|
4,9
| |
Dyspepsie
|
2,0
|
1,9
| |
Erbrechen
|
1,8
|
0,6
| |
Obstipation
|
1,5
|
0,6
| |
Erkrankungen der Haut und des Unterhautgewebes
| |
Übermässiges Schwitzen
|
5,7
|
1,3
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
| |
Muskelanspannung
|
1,3
|
0
| |
Muskelkrämpfe
|
1,0
|
0,3
| |
Erkrankungen der Geschlechtsorgane und der Brustdrüse
| |
Erektile Dysfunktion
|
1,0
|
0,3
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
| |
Reizbarkeit
|
5,2
|
2,9
| |
Müdigkeit
|
4,7
|
4,2
| |
Durst
|
1,8
|
0,6
| |
Asthenie
|
1,2
|
0
| |
Untersuchungen
| |
Gewichtsverlust
|
8,7
|
3,6
| |
Erhöhte Herzfrequenz
|
3,0
|
1,9
| |
Erhöhter Blutdruck
|
2,5
|
1,9
| |
Erhöhte Alaninaminotransferase
|
1,0
|
0
|
Die meisten unerwünschten Arzneimittelwirkungen waren von leichtem bis mässigem Schweregrad.
Daten aus offenen Studien – Unerwünschte Wirkungen, die mit einer Häufigkeit ≥1% berichtet wurden
Die Sicherheit von Methylphenidat wurde in zwölf klinischen offenen Studien an 3782 pädiatrischen und erwachsenen Patienten mit ADHS untersucht. Den Informationen in diesem Abschnitt liegen gepoolte Daten zugrunde.
In Tabelle 4 sind unerwünschte Wirkungen aufgeführt, die in diesen Studien von ≥1% der mit Methylphenidat behandelten Patienten angegeben wurden und die nicht in den Tabellen 2 und 3 genannt sind.
Tabelle 4: Unerwünschte Wirkungen, die von ≥1% der mit Methylphenidat behandelten Patienten in zwölf offenen Studien angegeben wurden
|
System/Organklasse
Unerwünschtes Ereignis
|
Methylphenidat
(n= 3782)
%
| |
Psychiatrische Erkrankungen
| |
Tics
|
2,0
| |
Stimmungsschwankungen
|
1,1
| |
Erkrankungen des Nervensystems
| |
Schläfrigkeit
|
1,0
| |
Erkrankungen des Gastrointestinaltrakts
| |
Diarrhö
|
2,4
| |
Bauchbeschwerden
|
1,3
| |
Bauchschmerzen
|
1,2
| |
Erkrankungen der Haut und des Unterhautgewebes
| |
Exanthem
|
1,3
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
| |
Nervosität («Zappeligkeit»)
|
1,4
|
Die meisten unerwünschten Wirkungen waren von leichtem bis mässigem Schweregrad.
Daten aus Doppelblind- und offenen Studien − Unerwünschte Wirkungen, die mit einer Häufigkeit <1% berichtet wurden
Weitere unerwünschte Wirkungen, die in den klinischen Doppelblind- und offenen Studien mit einer Häufigkeit von <1% bei mit Methylphenidat behandelten pädiatrischen und erwachsenen Patienten auftraten, sind nachstehend aufgeführt.
Erkrankungen des Blutes und des Lymphsystems
Leukopenie.
Psychiatrische Erkrankungen
Zorn, Schlafstörungen, Hypervigilanz, Traurigkeit, Verstimmung.
Erkrankungen des Nervensystems
Psychomotorische Hyperaktivität, Sedierung, Lethargie.
Augenerkrankungen
Trockene Augen.
Erkrankungen der Haut und des Unterhautgewebes
Makuläres Exanthem.
Untersuchungen
Herzgeräusch.
Die meisten unerwünschten Arzneimittelwirkungen waren von leichtem bis mässigem Schweregrad.
Unerwünschte Wirkungen aus der Postmarketingphase
Nachstehend sind unerwünschte Wirkungen aufgeführt, die nach der Markteinführung von Methylphenidat als unerwünschte Wirkung identifiziert wurden. Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
«sehr häufig» (≥1/10),
«häufig» (≥1/100; <1/10),
«gelegentlich» (≥1/1000; <1/100),
«selten» (≥10'000;<1/1000),
«sehr selten» (<1/10'000), einschliesslich Einzelfälle,
«nicht bekannt» (kann aus den verfügbaren Daten nicht abgeschätzt werden)
Erkrankungen des Blutes und des Lymphsystems
Sehr selten: Leukopenie, Panzytopenie, Thrombozytopenie, thrombozytopenische Purpura.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeitsreaktionen wie Angioödem, anaphylaktische Reaktionen, aurikuläre Schwellung, bullöse und schuppende Beschwerden, Urtikaria, Pruritus, Rash, Ausschlag, Exantheme.
Psychiatrische Erkrankungen
Sehr selten: Verwirrung, Orientierungslosigkeit, Halluzinationen, akustische Halluzinationen, visuelle Halluzinationen, Manie, Nervosität, Unruhe, beginnende Medikamenten induzierte Psychose, Logorrhö, Libidostörung.
Erkrankungen des Nervensystems
Sehr selten: Konvulsionen, Grand Mal-Anfälle, Dyskinesie, zerebrovaskuläre Erkrankungen (einschliesslich zerebrale Vaskulitis/Arteriitis, zerebrale Hämorrhagie, zerebrovaskuläre Okklusion).
Augenerkrankungen
Sehr selten: Diplopie, Mydriasis, verschwommenes Sehen, Sehstörungen.
Herzerkrankungen
Sehr selten: Palpitationen, Angina pectoris, Bradykardie, Extrasystolen, supraventrikuläre Tachykardie, ventrikuläre Extrasystolen.
Gefässerkrankungen
Sehr selten: Raynaud-Syndrom.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Nicht bekannt: Epistaxis.
Leber- und Gallenerkrankungen
Sehr selten: Anstieg der alkalischen Phosphatase im Blut, Anstieg der Bilirubinkonzentration, Leberfunktionsstörung, von Erhöhung der Transaminasen bis hin zu Leberkoma, akutes Leberversagen.
Erkrankungen der Haut und des Unterhautgewebes
Sehr selten: Haarausfall, Erythem, übermässiges Schwitzen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr selten: Arthralgie, Myalgie, Muskelzuckungen.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Selten: Gynäkomastie.
Sehr selten: Priapismus.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Selten: vermindertes therapeutisches Ansprechen.
Sehr selten: Schmerzen im Brustkorb, Brustkorbbeschwerden, herabgesetzte Arzneimittelwirkung, Hyperpyrexie.
Untersuchungen
Selten: Gewichtsabnahme.
Sehr selten: Verminderung der Thrombozytenzahl, abnorme Leukozytenzahl.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungBei der Behandlung von Patienten mit einer Überdosierung muss auch der verzögert freisetzende Anteil von Methylphenidat-Formulierung berücksichtigt werden.
Anzeichen und Symptome
Zu den Anzeichen und Symptomen einer Methylphenidat Sandoz-Überdosierung, welche hauptsächlich von einer Überstimulierung des ZNS und überschiessenden sympathikomimetischen Wirkungen resultieren, gehören: Erbrechen, Agitiertheit, Muskelzuckungen, Konvulsion, Grand Mal-Konvulsion, Verwirrung, Halluzinationen (akustisch und/oder visuell), übermässiges Schwitzen, Kopfschmerzen, Pyrexie, Tachykardie, Palpitationen, erhöhte Herzfrequenz, Sinusarrhythmie, Hypertonie, Mydriasis, Mundtrockenheit und Rhabdomyolyse.
Behandlung
Die Behandlung besteht aus geeigneten unterstützenden Massnahmen. Der Patient muss vor Selbstverletzung geschützt und gegen äussere Reize abgeschirmt werden, welche die bereits vorhandene Übererregung verstärken könnten. Die Wirksamkeit von Aktivkohle ist nicht nachgewiesen. Zur Aufrechterhaltung der Blutzirkulation und der Atmung sind intensivmedizinische Massnahmen zu ergreifen. Zur Reduktion einer allfälligen Pyrexie können kühlende Massnahmen von aussen erforderlich sein.
Die Wirksamkeit einer peritonealen Dialyse oder Hämodialyse bei der Überdosierung mit Methylphenidat Sandoz sind nicht nachgewiesen.
Bei der Behandlung von Patienten bei Überdosierung ist die verzögerte Freisetzung von Methylphenidat aus der Methylphenidat-Formulierung in die Betrachtung miteinzubeziehen.
Eigenschaften/WirkungenATC-Code
N06BA04
Wirkungsmechanismus/Pharmakodynamik
Methylphenidathydrochlorid ist ein ZNS-Stimulans. Der therapeutische Wirkungsmechanismus auf ADHS ist nicht bekannt. Es wird angenommen, dass Methylphenidat die Wiederaufnahme von Noradrenalin und Dopamin in die präsynaptischen Neuronen blockiert und die Freisetzung dieser Monoamine in den extraneuronalen Raum verstärkt. Bei Methylphenidat handelt es sich um eine racemische Mischung der d- und l-Isomere, wobei das d-Isomer pharmakologisch aktiver ist als das l-Isomer.
Klinische Wirksamkeit
Klinische Studien
Die Wirksamkeit von Methylphenidat bei der Behandlung von ADHS wurde in 4 randomisierten doppelblinden placebokontrollierten Studien bei Kindern und Jugendlichen und in 2 doppelblinden placebokontrollierten Studien bei Erwachsenen aufgezeigt, auf welche die ADHS-Kriterien gemäss DSM-IV zutrafen.
Erwachsene
Es wurden zwei doppelblinde placebokontrollierte Studien bei 627 Erwachsenen im Alter von 18 bis 65 Jahren durchgeführt. Bei den kontrollierten Studien handelte es sich um eine multizentrische 7-wöchige Dosistitrationsstudie mit Parallelgruppen (Studie 02-159) und eine multizentrische 5-wöchige Fixdosisstudie mit Parallelgruppen (Studie 3002), in denen einmal täglich angewendetes Methylphenidat (36 bis 108 mg/Tag bzw. 18, 36 und 72 mg/Tag) mit einem Placebo verglichen wurde.
In Studie 02-159 wurde die Veränderung in dem primären Endpunkt AISR-Skala (Adult ADHD Investigator Rating Scale; Skala zur Prüferbeurteilung von ADHS bei Erwachsenen) bei Erwachsenen im Alter von 18 bis 65 Jahren mit ADHS am Ende der 7. Woche untersucht. Verglichen wurde Methylphenidat in Dosen von 36 mg/Tag bis 108 mg/Tag und Placebo. Von 226 Patienten, die in die 7-wöchige Studie aufgenommen worden waren, wurden 110 in die Behandlungsgruppe mit Methylphenidat und 116 in die Placebogruppe randomisiert. Die Anfangsdosis betrug 36 mg/Tag, wobei die Dosis je nachdem, ob bestimmte Verbesserungskriterien bei akzeptabler Verträglichkeit festgestellt wurden, stufenweise um 18 mg/Tag (36 bis 108 mg/Tag) erhöht wurde. Beim letzten Studientermin zeigte sich bei der Prüferbeurteilung für die Erwachsenen, die Methylphenidat eingenommen hatten, eine signifikant bessere Response in den mittleren Veränderungsscores (Mittelwert der Kleinstquadrate, SEM) der AISR-Skala als für die Erwachsene, die Placebo eingenommen hatten.
Studie 3002 war eine multizentrische doppelblinde randomisierte placebokontrollierte Dosis-Wirkungs-Studie mit Parallelgruppen (5-wöchige Dauer) mit 3 Fixdosisgruppen (18, 36 und 72 mg). Die Patienten, bei denen ein ADHS diagnostiziert worden war, wurden randomisiert, um Methylphenidat in Dosen von 18 mg (n=101), 36 mg (n=102), 72 mg/Tag (n=102) oder ein Placebo (n=96) zu erhalten. Die erwachsenen Patienten, die Methylphenidat eingenommen hatten, wiesen in allen drei Dosisgruppen im Gesamtscore auf der CAARS-SS-Skala (Conners' Adult ADHD Rating Scale – Self Report – Short Form (Conners-Skala zur Beurteilung von ADHS bei Erwachsenen) nach 5 Wochen eine signifikant bessere Response auf als die Patienten, die Placebo eingenommen hatten.
Jugendliche
In einer randomisierten doppelblinden multizentrischen placebokontrollierten Studie (Studie 01−146) mit 177 Patienten im Alter von 13 bis 18 Jahren mit ADHS wurde untersucht, inwieweit es Verbesserungen nach einer Behandlung mit Methylphenidat in Dosen von bis zu 72 mg/Tag (1,4 mg/kg/Tag) im Vergleich zu Placebo gibt. Von den in die unverblindete 4-wöchige Titrationsphase aufgenommenen 220 Patienten wurden 177 Patienten, je nachdem, ob bestimmte Verbesserungskriterien auf der ADHS-Beurteilungsskala erfüllt waren und bei der Gesamtbeurteilung der Wirksamkeit akzeptable Verträglichkeit festgestellt wurde, auf eine individualisierte Dosis (maximal 72 mg/Tag) eingestellt. Patienten, die diese Kriterien erfüllten, wurden anschliessend randomisiert, um während einer zweiwöchigen doppelblinden Phase entweder ihre individualisierte Dosis von Methylphenidat (18−72 mg/Tag, n=87) oder das Placebo (n=90) zu erhalten. Am Ende dieser Phase zeigten die mittleren Scores der Prüferbeurteilung auf der ADHS-Beurteilungsskala für die Jugendlichen, die Methylphenidat eingenommen hatten, signifikant bessere Ergebnisse als für die Jugendlichen, die Placebo eingenommen hatten.
Kinder
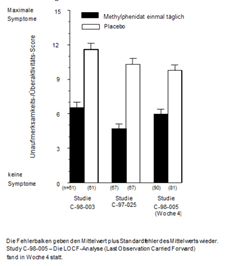
Es wurden drei doppelblinde, aktiv kontrollierte und placebokontrollierte Studien bei 416 Kindern im Alter von 6 bis 12 Jahren durchgeführt. In den kontrollierten Studien wurden einmal täglich angewendetes Methylphenidat (18, 36 oder 54 mg), dreimal täglich über 12 Stunden angewendetes Methylphenidat (Tagesgesamtdosis: 15, 30 oder 45 mg) und ein Placebo in zwei monozentrischen 3-wöchigen Crossover-Studien (Studie C-98-003 und C-97-025) und in einem multizentrischen 4-wöchigen Parallelgruppenvergleich (Studie C-98-005) gegenübergestellt. Das Studiendesign in allen drei Studien war darauf angelegt, eine Überlegenheit von Methylphenidat gegenüber Placebo zu zeigen.
In den Studien C-98-003, C-97-025, und C-98-005 wurden die ADHS-Symptome von Lehrern anhand der Conners-Skala für Unaufmerksamkeit/Überaktivität mit Aggression (IOWA) bewertet. In allen drei kontrollierten Studien übereinstimmend gab es bei den Kindern, die Methylphenidat erhalten hatten, eine statistisch signifikant bessere Einstufung in der Subskala für Unaufmerksamkeit/Überaktivität im Vergleich zu Placebo. Die Werte für Methylphenidat und Placebo aus den drei Studien sind in Abbildung 1 dargestellt.
Abbildung 1. Mittlere Bewertung der Unaufmerksamkeit/Überaktivität bei Kindern durch Lehrer anhand der Conners-Skala für IOWA bei Anwendung von Methylphenidat
PharmakokinetikAbsorption
Methylphenidat wird rasch absorbiert. Nach oraler Verabreichung von Methylphenidat mit kontinuierlicher Wirkstofffreisetzung an Erwachsene steigen die Plasmakonzentrationen von Methylphenidat rasch an und erreichen nach 1–2 Stunden ein erstes Maximum, um dann während mehrerer Stunden weiter leicht anzusteigen. Nach 6–8 Stunden erreicht die Plasmakonzentration ihren Peak, worauf ein langsames Absinken des Methylphenidatplasmaspiegels einsetzt. Einmal täglich verabreichtes Methylphenidat mit kontinuierlicher Wirkstofffreisetzung reduziert die Schwankungen zwischen hohen und tiefen Konzentrationen, wie sie bei dreimaliger täglicher Verabreichung von Methylphenidat auftreten, was sich in den Profilen der mittleren Plasmakonzentrationen im Zeitverlauf abbildet. Die relative Bioverfügbarkeit bei Methylphenidat mit kontinuierlicher Wirkstofffreisetzung, einmal täglich eingenommen, und Methylphenidat, dreimal täglich eingenommen, ist vergleichbar.
Die Mittelwerte der pharmakokinetischen Parameter von 36 Erwachsenen nach Verabreichung von Methylphenidat mit kontinuierlicher Wirkstofffreisetzung (einmal täglich 18 mg) bzw. Methylphenidathydrochlorid (dreimal täglich 5 mg) waren bezüglich Cmax (ng/ml), Tmax (h), AUCinf (ng h/ml) und der Halbwertszeit (h) vergleichbar.
Zwischen den pharmakokinetischen Parametern von Methylphenidat mit kontinuierlicher Wirkstofffreisetzung nach einmaliger und mehrmaliger täglicher Verabreichung wurden keine Unterschiede festgestellt, was darauf hinweist, dass keine signifikante Akkumulation des Wirkstoffs im Körper stattfindet. Sowohl AUC wie auch t½ weisen nach mehrmaliger täglicher Verabreichung ähnliche Werte auf wie nach der ersten Dosis Methylphenidat mit kontinuierlicher Wirkstofffreisetzung.
Methylphenidat mit kontinuierlicher Wirkstofffreisetzung wird nahezu vollständig resorbiert vergleichbar mit nicht retardiertem Methylphenidat. Aufgrund des First-pass Metabolismus variiert die systemische Verfügbarkeit von Methylphenidat individuell von 11–51%.
Dosisproportionalität
Nach Verabreichung von Methylphenidat mit kontinuierlicher Wirkstofffreisetzung in Einzeldosen zu 18, 36 und 54 mg/Tag an gesunde Erwachsene waren Cmax und AUC(0-inf) von d-Methylphenidat proportional zur Dosis, während Cmax und AUC(0-inf) von l-Methylphenidat sich nicht-proportional zur Dosis verhielten. Bei der Verabreichung von Methylphenidat mit kontinuierlicher Wirkstofffreisetzung betrugen die Plasmakonzentrationen des pharmakologisch weniger aktiven l-Isomers etwa 1/40 derjenigen des aktivieren d-lsomers. Dies ist auf den Enantiomeren-selektiven First-pass-Effekt zurückzuführen.
An gesunden Erwachsenen bewirkten einmalige oder mehrmalige, einmal tägliche Methylphenidat-Dosierungen mit kontinuierlicher Wirkstofffreisetzung von 54 bis 144 mg/Tag lineare und dosisproportionale Anstiege der Cmax und AUCinf des Gesamt-Methylphenidat (MPH) und seines wichtigsten Metaboliten (alpha)-Phenyl-Piperidinessigsäure. Die Einzeldosis- und Steady-State-Clearance (Tag 4) und die Parameter der Halbwertszeit waren ähnlich, was auf eine fehlende Zeitabhängigkeit in der Pharmakokinetik von Methylphenidat hinweist. Das Verhältnis zwischen Metabolit ([alpha]-Phenyl-Piperidinessigsäure) und Ausgangssubstanz (MPH) war über Dosierungen von 54 bis 144 mg/Tag sowohl nach einer Einmaldosis als auch nach Mehrfachdosen konstant.
In einer Mehrfachdosisstudie bei jugendlichen ADHS-Patienten im Alter von 13 bis 16 Jahren mit Methylphenidat Dosen mit kontinuierlicher Wirkstofffreisetzung zwischen 18 und 72 mg/Tag stieg die Cmax und AUCTAU von d-Methylphenidat bzw. vom Gesamtmethylphenidat proportional zur Dosis an.
Distribution
Die Plasmakonzentrationen von Methylphenidat fallen nach oraler Verabreichung biexponentiell ab. Die Halbwertszeit von Methylphenidat bei Erwachsenen nach oraler Verabreichung von Methylphenidat mit kontinuierlicher Wirkstofffreisetzung betrug ungefähr 3,5 Stunden.
Metabolismus
Im Menschen wird Methylphenidat primär durch Abspaltung der Estergruppe zu (Alpha)-Phenyl-Piperidinessigsäure (PPAA), die nur eine schwache oder gar keine pharmakologische Wirkung aufweist, metabolisiert. Der Metabolismus von einmal täglich verabreichtem Methylphenidat mit kontinuierlicher Wirkstofffreisetzung, bestimmt durch den Abbau zu PPAA, ist ähnlich dem von dreimal täglich verabreichtem Methylphenidat. Der Metabolismus einzelner und wiederholter täglicher Dosen von Methylphenidat mit kontinuierlicher Wirkstofffreisetzung weist ähnliche Werte auf.
Elimination
Nach oraler Verabreichung von radiomarkiertem Methylphenidat an Menschen konnte rund 90% der Radioaktivität im Urin nachgewiesen werden. Der wichtigste Metabolit im Urin war PPAA; er entsprach ca. 80% der Dosis.
Effekt gleichzeitig eingenommener Nahrung
Weder bei den pharmakokinetischen noch bei den pharmakodynamischen Parametern war ein Unterschied festzustellen, wenn Methylphenidat mit kontinuierlicher Wirkstofffreisetzung nach einem fettreichen Frühstück eingenommen wurde. Es gibt keine Hinweise auf eine Beeinflussung der Bioverfügbarkeit durch gleichzeitig aufgenommene Nahrung.
Kinetik spezieller Patientengruppen
Geschlecht: Bei gesunden Erwachsenen, denen Methylphenidat mit kontinuierlicher Wirkstofffreisetzung verabreicht wurde, betrugen die mittleren dosiskorrigierten Werte für AUC(0-inf) 36,7 ng·h/ml für Männer und 37,1 ng·h/ml für Frauen. Zwischen den beiden Gruppen konnten keine Unterschiede festgestellt werden.
Ethnischer Typus: Bei Erwachsenen, denen Methylphenidat mit kontinuierlicher Wirkstofffreisetzung verabreicht wurde, waren die mittleren dosiskorrigierten Werte der AUC(0-inf) konsistent bei den verschiedenen ethnischen Gruppen; es ist dabei aber möglich, dass ethnische Unterschiede infolge der geringen Populationszahlen nicht nachgewiesen werden konnten.
Alter: Die Pharmakokinetik von Methylphenidat mit kontinuierlicher Wirkstofffreisetzung wurde bei Kindern unter 6 Jahren nicht untersucht.
Leberfunktionsstörungen
Es liegen keine Erfahrungen zur Anwendung von Methylphenidat Sandoz bei Patienten mit Leberinsuffizienz vor.
Nierenfunktionsstörungen
Es liegen keine Erfahrungen zur Anwendung von Methylphenidat Sandoz bei Patienten mit Niereninsuffizienz vor. Nach oraler Verabreichung von radiomarkiertem Methylphenidat an Menschen wurde dieses grossteils metabolisiert und ungefähr 80% der Radioaktivität in Form von PPAA über die Niere ausgeschieden. Da die renale Clearance für die Methylphenidat-Clearance nicht von grosser Bedeutung ist, wird angenommen, dass eine Niereninsuffizienz nur eine geringe Auswirkung auf die Pharmakokinetik von Methylphenidat Sandoz hat.
Präklinische DatenEs wurden keine toxischen Effekte bei Hunden in zwei separaten 30-tägigen Studien mit Methylphenidat in oralen Dosierungen von 72 mg/Tag (bis 8,6 mg/kg/Tag) respektive 144 mg/Tag (bis 22 mg/kg/Tag) beobachtet.
Genotoxizität
Im In-vitro-Ames-Test (Reverse Mutation Assay) und im in-vitro Mouse Lymphoma Cell Forward Mutation Assay waren keine mutagenen Wirkungen von Methylphenidat nachweisbar. Der Austausch von Schwesterchromatiden (sister chromatid exchange) und Chromosom-Veränderungen (chromosome aberrations) zeigten in einem In-vitro-Test mit Eierstock-Zellkulturen des chinesischen Hamsters erhöhte Werte, wenn auch erst nach hohen cytotoxischen Dosen. Methylphenidat war in vivo im Mikrokern-Test von Knochenmark von Mäusen negativ.
Kanzerogenität
In einer Kanzerogenitäts-Lebenszeit-Studie an Mäusen führte Methylphenidathydrochlorid in einer Dosierung von ungefähr 60 mg/kg/Tag zu einer Zunahme hepatozellulärer Adenome und, aber nur bei Männchen, Hepatoblastomen. Diese Dosis ist in mg/kg deutlich höher als die für Menschen empfohlene Dosis. Eine einmalige Bolus-Verabreichung einer solchen Dosis führte bei Mäusen zu einer höheren systemischen Methylphenidatexposition. Gesamthaft wurde keine Zunahme an bösartigen Lebertumoren festgestellt. Der eingesetzte Mäusestamm ist anfällig auf die Entwicklung von Lebertumoren, und die Aussagekraft dieser Ergebnisse für den Menschen ist unsicher.
In einer ähnlich angelegten Lebenszeit-Studie mit Ratten und einer Dosierung von bis zu 45 mg/kg/Tag fanden sich keine Hinweise auf Kanzerogenität.
In einer 24-wöchigen Studie mit dem transgenen Mausstamm p53 ± zeigten sich bei Methylphenidathydrochlorid Dosierungen von bis zu 74 mg/kg/Tag keine Hinweise auf Kanzerogenität.
Reproduktionstoxizität
Bei Dosierungen von 200 mg/kg/Tag sind beim Kaninchen teratogene Wirkungen von Methylphenidathydrochlorid nachgewiesen worden. Diese Dosierung entspricht der rund 100-fachen maximalen Tagesdosis in mg/kg, die beim Menschen empfohlen wird.
Bei Ratten konnten bei Methylphenidathydrochlorid-Dosierungen von bis zu 30 mg/kg/Tag keine teratogenen Wirkungen nachgewiesen werden. Dies entspricht aufgrund der pharmakokinetischen Daten ungefähr der 7-fachen systemischen Methylphenidat-Exposition gegenüber Studien mit Freiwilligen und Patienten mit der maximalen empfohlenen Dosierung von Methylphenidat.
In einer kontinuierlichen Zucht-Studie über 18 Wochen mit Mäusen zeigte Methylphenidathydrochlorid in Dosierungen bis zu 160 mg/kg/Tag keine Beeinträchtigung der Fertilität.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, bei Raumtemperatur (15–25°C), dicht verschlossen und ausser Reichweite von Kindern lagern.
Zulassungsnummer62228 (Swissmedic)
PackungenMethylphenidat Sandoz 18, Retardtabletten: 30, 60 (2x 30). [A+]
Methylphenidat Sandoz 27, Retardtabletten: 30, 60 (2x 30). [A+]
Methylphenidat Sandoz 36, Retardtabletten: 30, 60 (2x 30). [A+]
Methylphenidat Sandoz 54, Retardtabletten: 30, 60 (2x 30). [A+]
ZulassungsinhaberinSandoz Pharmaceuticals AG, Risch; Domizil: Rotkreuz
Stand der InformationDezember 2023
|

