Eigenschaften/WirkungenATC-Code
R03BB06
Wirkungsmechanismus
Seebri Breezhaler ist ein inhalierbarer langwirksamer muskarinischer Rezeptor-Antagonist (anticholinerg) für die inhalative bronchienerweiternde Erhaltungstherapie bei COPD. Parasympathische Nerven stellen die wichtigsten bronchokonstriktorischen Nervenbahnen in den Atemwegen, und der cholinerge Tonus ist die wichtigste reversible Komponente der Atemwegsobstruktion bei COPD. Seebri Breezhaler hemmt die bronchokonstriktorische Wirkung von Acetylcholin auf die glatten Muskelzellen der Atemwege, wodurch die Luftwege erweitert werden.
Von den fünf bekannten muskarinischen Rezeptorsubtypen (M1-5) weisen nur die Subtypen M1-3 eine definierte physiologische Funktion in der menschlichen Lunge auf. Glycopyrroniumbromid ist ein muskarinischer Rezeptor-Antagonist mit hoher Affinität für diese drei Rezeptorsubtypen. In kompetitiven Bindungsstudien zeigte die Substanz eine 4- bis 5-fach höhere Selektivität für die humanen M3- und M1-Rezeptoren als für den humanen M2-Rezeptor. Wie anhand der beobachteten kinetischen Parameter für die Assoziation/Dissoziation am Rezeptor und dem Wirkungseintritt nach Inhalation in klinischen Studien nachgewiesen wurde, weist sie einen schnellen Wirkungseintritt auf.
Aus der verlängerten terminalen Eliminationshalbwertszeit von Glycopyrronium nach Inhalation von Seebri Breezhaler im Vergleich zur Halbwertszeit nach i.v. Anwendung kann vermutet werden, dass die lange Wirkdauer teilweise durch die anhaltenden Wirkstoffkonzentration in der Lunge bedingt ist (siehe «Pharmakokinetik»).
Pharmakodynamik
Primäre pharmakodynamische Wirkungen
Seebri Breezhaler zeigte in einer Reihe von klinischen Studien zur Pharmakodynamik und Wirksamkeit durchwegs signifikante Verbesserungen der Lungenfunktion (gemessen anhand des forcierten expiratorischen Volumens in einer Sekunde, FEV1) während 24 Stunden.
In den pivotalen Studien war ein schneller Wirkungseintritt innert 5 Minuten nach Inhalation von Seebri Breezhaler mit einer Erhöhung des FEV1 im Bereich von 0.091 l bis 0.094 l gegenüber dem Ausgangswert sichtbar. In der 52-wöchigen Studie wies Seebri Breezhaler im Vergleich zu Tiotropium einen signifikant höheren FEV1 Wert am Tag 1 und in Woche 26 auf, als Tiotropium. Ausserdem war FEV1 in den ersten 4 Stunden nach Einnahme in Woche 12 und Woche 52 nach der Einnahme von Seebri Breezhaler gegenüber Tiotropium numerisch höher.
Die bronchienerweiternde Wirkung von Seebri Breezhaler hielt während 24 Stunden an. Es gab keine Hinweise auf eine Tachyphylaxie betreffend der bronchienerweiternden Wirkung nach wiederholter Dosierung während bis zu 52 Wochen.
Sekundäre pharmakodynamische Wirkungen
Es wurden keine Veränderungen der mittleren Herzfrequenz oder des QTc-Intervalls nach Anwendung von Seebri Breezhaler in Dosierungen bis zu 176 Mikrogramm bei COPD Patienten beobachtet. In einer umfassenden QT-Studie an 73 gesunden Probanden bewirkte eine einzelne inhalierte Dosis von 352 Mikrogramm Glycopyrronium (dem 8-Fachen der therapeutischen Dosis) im Vergleich zu Placebo keine Verlängerungen der QTc-Zeit und eine leichte Verringerung der Herzfrequenz (maximaler Effekt: −5.9 Schläge/min; durchschnittlicher Effekt über 24 Stunden: −2.8 Schläge/min). Die Auswirkung von 150 Mikrogramm Glycopyrroniumbromid (entspricht 120 Mikrogramm Glycopyrronium) auf Herzfrequenz und QTc-Intervall nach intravenöser Anwendung wurde bei jungen gesunden Probanden untersucht. Die erreichte Spitzenkonzentrationen (Cmax) betrugen etwa das 50-Fache der Exposition nach Inhalation von 44 Mikrogramm Glycopyrronium im Steady State und gingen weder mit Tachykardie noch Verlängerungen der QTc-Zeit einher. Eine leichte Reduktion der Herzfrequenz (mittlere Differenz über 24h: −2 Schläge/min im Vergleich zu Placebo) wurde beobachtet; dies ist eine bekannte Auswirkung von geringen Anticholinergika-Konzentrationen bei jungen gesunden Personen.
In einer «thorough QT/QTc» Studie, mit 73 gesunden Personen hat die inhalierte Dosis von 352 Mikrogramm Seebri Breezhaler (das 8-fache der therapeutischen Dosis) im Vergleich zu Placebo keine Verlängerung des QTc-Intervalls hervorgerufen, aber die Herzfrequenz (maximal Wirkung 5.9 bpm; durchschnittliche Wirkung über 24 Stunden 2.8 bpm) leicht gesenkt.
Klinische Wirksamkeit
Das klinische Phase-III-Entwicklungsprogramm von Seebri Breezhaler bestand aus zwei Schlüsselstudien (eine 6monatige plazebo-kontrollierte Studie und eine 12-monatige plazebo- und aktiv kontrollierte Studie), welche insgesamt 1888 Patienten mit klinischer Diagnose einer COPD einschlossen. Die Patienten waren 40 Jahre alt oder älter und hatten eine Raucheranamnese von mindestens 10 Packungsjahren, ein postbronchodilatatorisches FEV1 von <80% und ≥30% des prognostizierten Normwertes sowie ein FEV1/FVC-Verhältnis von unter 70%. Patienten mit Herzkrankheiten und/oder Kontraindikationen für Anticholinergika wurden ausgeschlossen.
Lungenfunktion
In diesen Studien zeigte Seebri Breezhaler in einer Dosierung von 50 µg einmal täglich klinisch bedeutsame Verbesserungen der Lungenfunktion (gemessen anhand des forcierten expiratorischen Volumens in einer Sekunde, FEV1) während 24 Stunden. Beim primären Endpunkt nach 12 Wochen (24-Stunden FEV1-Talwert) wies Seebri Breezhaler im Vergleich zu Plazebo eine bronchodilatatorische Verbesserung von 0.108 l beziehungsweise 0.097 l in der 6- beziehungsweise 12-monatigen Studie auf (p<0.001). In der zweiten Studie betrug die Verbesserung gegenüber Plazebo für den nicht verblindeten Studienarm mit Tiotropium 18 µg einmal täglich 0.083 l (p<0.001).
In den Pivotstudien zeigte sich ein schneller Wirkungseintritt innerhalb 5 Minuten nach Inhalation von Seebri Breezhaler mit einer Erhöhung des FEV1 im Vergleich zum Ausgangswert im Bereich von 0.091 l bis 0.094 l.
Die beim primären Endpunkt (12 Wochen) beobachteten Verbesserungen des mittleren FEV1-Talwerts wurden während der gesamten Behandlungsdauer sowohl bei der 6- wie auch der 12-monatigen Studie aufrechterhalten. Der mittlere FEV1-Talwert erhöhte sich verglichen mit Plazebo in Woche 12 der 6-monatigen Studie um 0.1008 l und in Woche 26 der 6-monatigen Studie um 0.113 l; In der 12-monatigen Studie erhöhte sich dieser um 0.097 l in Woche 12 und um 0.108 l in Woche 52.
Diese Daten weisen darauf hin, dass der bronchienerweiternde Effekt von Seebri Breezhaler während 24-Stunden von der ersten Dosis an während einer Ein-Jahres-Periode aufrechterhalten wurde.
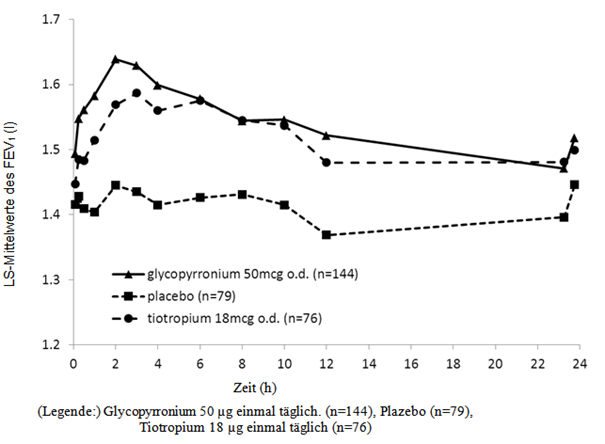
In der 6-monatigen Studie wurden serielle spirometrische Messungen am Tag 1 (Abb. 1-1), in Woche 12 (Abb. 1-2) und in Woche 26 durchgeführt. In der 12-monatigen Studie wurden serielle Spirometriemessungen am Tag 1 (Abb. 1-3), in Woche 12 (Abb. 1-4) und in Woche 52 durchgeführt.
Die Daten der seriellen spirometrischen Messungen wurden verwendet, um die (hinsichtlich der Zeit) standardisierte Fläche unter der FEV1-Kurve (AUC) zu berechnen. In der 6-monatigen Studie wies Seebri Breezhaler verglichen mit Plazebo eine Verbesserung der FEV1 AUC 0-24h um 0.133 l beziehungsweise 0.199 l in den Wochen 12 und 26 auf (p<0.001). In Woche 12 der 12-monatigen Studie wies Seebri Breezhaler verglichen mit Plazebo eine Verbesserung der FEV1 AUC 0-24h um 0.106 l auf (p<0.001); für Tiotropium lag der Behandlungsunterschied verglichen mit Plazebo bei 0.079 l (p=0.014). In Woche 52 der 12-monatigen Studie wies Seebri Breezhaler verglichen mit Plazebo eine Verbesserung der FEV1 AUC 0-24h um 0.106 l auf (p<0.001); für Tiotropium lag der Behandlungsunterschied verglichen mit Plazebo bei 0.040 l (p=0.279).
Die Stärke des bronchienerweiternden Effektes von Seebri Breezhaler ist möglicherweise abhängig vom Grad der Reversibilität der Atemflusslimitation zu Beginn der Studie (diese wurde durch Gabe eines kurzwirksamen bronchienerweiternden muskarinischen Antagonisten untersucht): Entsprechende sekundäre Subgruppenanalysen zeigen bei Patienten mit dem geringsten Grad an Reversibilität zu Beginn der Studie (<5%) im Allgemeinen auch eine geringere bronchodilatatorische Reaktion als bei jenen mit einem höheren Grad an Reversibilität zum selben Zeitpunkt (≥5%). Nach 12 Wochen (primärer Endpunkt) bewirkte Seebri Breezhaler im Vergleich zu Placebo bei den Patienten mit dem geringsten Grad an Reversibilität zu Beginn der Studie (<5%) eine Erhöhung des FEV1-Talwerts um 0.072 l und bei jenen mit einem höheren Grad an Reversibilität zum selben Zeitpunkt (≥5%) eine Erhöhung des FEV1-Talwerts um 0.113 l (jeweils p<0.05). Bei Patienten unter Tiotropium wurden vergleichbare Befunde erhoben. Nach zwölfwöchiger Behandlung mit Tiotropium zeigten die Patienten mit dem niedrigsten Grad an Reversibilität zu Beginn der Studie (<5%) eine Erhöhung des FEV1-Talwerts von 0.059 l verglichen mit Placebo, während die Patienten mit einem höheren Grad an Reversibilität zum selben Zeitpunkt (≥5%) eine Erhöhung des FEV1-Talwerts von 0.097 l verglichen mit Plazebo aufwiesen.
Abbildung 1-1 Sechsmonatige Pivotstudie: Serielle Spirometriedaten (Least-Square-Mittelwerte des FEV1 (l)) nach der ersten Dosis
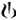
Abbildung 1-2 Sechsmonatige Pivotstudie: Serielle Spirometriedaten (Least-Square-Mittelwerte des FEV1 (l)) in Woche 12
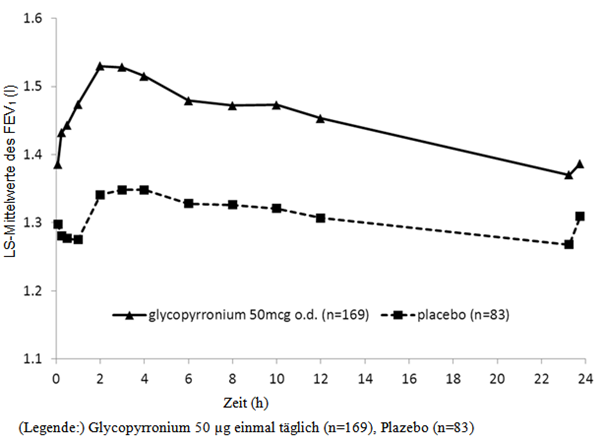
Abbildung 1-3 Zwölfmonatige Pivotstudie: Serielle Spirometriedaten (Least-Square-Mittelwerte des FEV1 (l)) nach der ersten Dosis
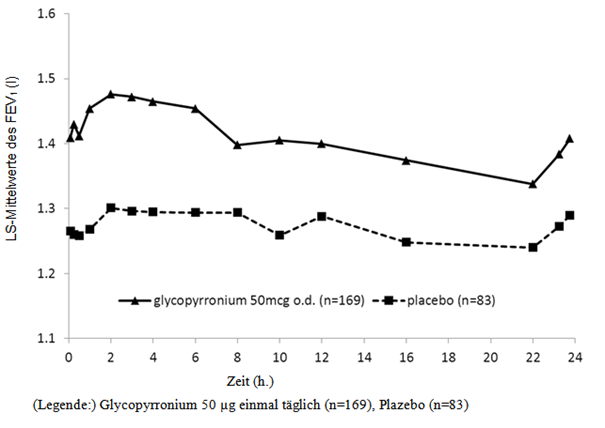
Abbildung 1-4 Zwölfmonatige Pivotstudie: Serielle Spirometriedaten (Least-Square-Mittelwerte des FEV1 (l)) in Woche 12
Zusätzlich zum Nachweis von Verbesserungen des FEV1 verbesserte Seebri Breezhaler in den beiden Pivotstudien durchgehend die forcierte Vitalkapazität (FVC) und die inspiratorische Kapazität (IC) in konsistenter Weise. In Woche 12 zeigte Seebri Breezhaler in der 6- beziehungsweise der 12-monatigen Studie eine Erhöhung des mittleren FVC-Talwerts im Vergleich zu Plazebo von 0.194 l und 0.183 l (p<0.001). Seebri Breezhaler verbesserte in der 6- beziehungsweise der 12-monatigen Studie in der Woche 12 im Vergleich zu Plazebo den IC-Talwert um 0.097 l und 0.129 l (p<0.001).
Symptomatischer Nutzen
Die einmal tägliche Anwendung von 50 µg Seebri Breezhaler reduzierte die anhand des Transitional Dyspnea Index (TDI) evaluierte Atemnot signifikant. In einer gepoolten Analyse der 6- und der 12-monatigen Pivotstudie betrug der prozentuale Anteil von Patienten, die mit einer klinisch bedeutsamen Verbesserung des fokalen TDI-Scores von ≥1 Punkt in Woche 26 ansprachen, unter Seebri Breezhaler 58.4% verglichen mit 46.4% bei Patienten unter Plazebo und 53.4% bei Patienten unter Tiotropium. Die Unterschiede in den Ansprechraten waren für den Vergleich von Seebri Breezhaler mit Plazebo (<0.001) und von Tiotropium mit Plazebo (p=0.009) statistisch signifikant.
Die einmal tägliche Verabreichung von Seebri Breezhaler 50 µg hat auch eine signifikante Wirkung auf den mittels des St. George's Respiratory Questionnaire (SGRQ) gemessenen Gesundheitszustand. Eine gepoolte Analyse der 6- und der 12-monatigen Pivotstudie zeigte, dass der prozentuale Anteil von Patienten, die mit einer klinisch bedeutsamen Verbesserung des SGRQ-Gesamtscores (≤ −4) in Woche 26 antworteten, unter Seebri Breezhaler bei 57.8% lag, verglichen mit 47.6% bei Patienten unter Plazebo und 61.0% bei Patienten unter Tiotropium. Die Unterschiede der Ansprechraten waren statistisch signifikant für den Vergleich von Seebri Breezhaler mit Plazebo (<0.001) und von Tiotropium mit Plazebo (p=0.004).
In einer gepoolten Analyse der 6- und der 12-monatigen Studie verlängerte die einmal tägliche Verabreichung von Seebri Breezhaler 50 µg die Dauer bis zur ersten mässigen oder schweren COPD-Exazerbation signifikant und reduzierte die Anzahl der mässigen oder schweren COPD-Exazerbationen (als mässige Exazerbationen galten diejenigen, die eine Behandlung mit systemischen Kortikosteroiden und/oder Antibiotika erforderten, als schwere Exazerbationen galten diejenigen, die eine Spitaleinweisung erforderten.) Der Anteil Patienten mit mässiger oder schwerer COPD-Exazerbation in der 26-wöchigen gepoolten Analyse lag bei 19.8% unter Seebri Breezhaler vs. 27.2% für Plazebo, und das geschätzte relative Risiko für die Zeit bis zu mässigen oder schweren Exazerbationen lag bei 0.64 [95% CI: 0.520, 0.799; p < 0.001], was auf eine Risikoreduktion vs. Plazebo von 36% hinweist. Desgleichen lag das geschätzte relative Risiko für die Zeit bis zur ersten schweren Exazerbation, die eine Spitaleinweisung erforderte, bei 0.39 [95% CI: 0.205, 0.728; p = 0.003]. In der 26-wöchigen gepoolten Analyse war die Exazerbationsrate bei Patienten, die mit Seebri Breezhaler behandelt wurden, statistisch signifikant niedriger im Vergleich zu den mit Plazebo behandelten Patienten, wobei das Ratenverhältnis bei 0.66 lag ([95% CI: 0.525, 0.841; p < 0.001]).
Verglichen mit Plazebo reduzierte Seebri Breezhaler 50 µg einmal täglich die Verwendung von Notfallmedikationen während 26 Wochen signifikant um 0.46 Hübe pro Tag (p = 0.005) und während 52 Wochen um 0.37 Hübe pro Tag (p = 0.039) in der 6- beziehungsweise der 12-monatigen Studie.
Die Wirkung von Seebri Breezhaler bezüglich der Reduktion der dynamischen Hyperinflation und die damit verbundenen Verbesserungen der Belastungstoleranz wurden in einer randomisierten, doppelblinden, plazebo-kontrollierten Studie bei 108 Patienten mit mässiger bis schwerer COPD untersucht. Seebri Breezhaler erreichte seine volle Wirkung der Verbesserung der inspiratorischen Kapazität unter Belastung (0.23 L) und weist statistisch signifikante Effekte von 43 Sekunden (eine Erhöhung von 10 %) auf die Belastungsdauer nach der ersten Dosis auf. Nach 3-wöchiger Behandlung verbesserte Seebri Breezhaler die Belastungsdauer um 89 Sekunden (eine Erhöhung von 21 %) und die inspiratorische Kapazität unter Belastung wurde um 0.20 l erhöht.
Borg Skala Messungen zeigten, dass Seebri Breezhaler Dyspnoe und Beinbeschwerden senkt. Die Abnahme der Dyspnoe im Ruhezustand wurde auch anhand des Transational Dyspnoea Index (TDI) gezeigt.
|