Eigenschaften/WirkungenATC-Code
L03AB13
Wirkungsmechanismus
Der Wirkungsmechanismus von Plegridy bei Multipler Sklerose ist nicht abschliessend geklärt. Da die biologischen Wirkungen von Plegridy jedoch denen von nicht-pegyliertem Interferon beta-1a entsprechen, dürfte auch der Wirkungsmechanismus vergleichbar sein. Plegridy bindet an den Typ-1-Interferonrezeptor auf der Zelloberfläche und leitet eine Kaskade intrazellulärer Ereignisse ein, die zur Regulierung der Expression von Interferon-induzierbaren Genen führen. Es wird angenommen, dass die Wirksamkeit von Plegridy bei Multipler Sklerose von diesen Genen und ihren Genprodukten vermittelt wird.
Als Interferon beta moduliert Plegridy Immunreaktionen, die bei der Pathogenese der Multiplen Sklerose vermutlich eine Rolle spielen. In Anbetracht der komplexen und facettenreichen Pathogenese der Krankheit wirkt Plegridy möglicherweise auf mehreren Ebenen, beispielsweise, indem es entzündungshemmende Zytokine (z.B. IL-4, IL-10, IL-27) hoch- und entzündungsfördernde Zytokine (z.B. IL-2, IL-12, IFN-γ, TNF-α) herunterreguliert und die Migration aktivierter T-Zellen durch die Bluthirnschranke hemmt. Es sind jedoch weitere Mechanismen denkbar.
Pharmakodynamik
Plegridy ist ein Interferon beta-1a, das an der alpha-Aminogruppe des N-terminalen Aminosäurerestes mit einem linearen 20 kDa grossen Methoxypolyethylenglycol-Molekül konjugiert ist.
Interferone sind eine Gruppe natürlich vorkommender Proteine, die von Zellen als Reaktion auf biologische und chemische Stimuli gebildet werden und zahlreiche antivirale, antiproliferative und immunmodulierende zelluläre Reaktionen vermitteln.
Die pharmakologischen Eigenschaften von Plegridy entsprechen denen von Interferon beta-1a und werden vermutlich vom Proteinanteil des Moleküls vermittelt.
Pharmakodynamik von Plegridy nach i.m. und s.c. Applikation
Für die Analyse der Pharmakodynamik (PD) wurde die Serumkonzentration von Neopterin, einem Marker für die IFN-beta-Aktivität, nach Verabreichung von 125 µg Plegridy i.m. und Plegridy s.c. gemessen.
Die Profile der Neopterinkonzentration im Serum im Zeitverlauf nach Einzeldosen von 125 µg Plegridy s.c. oder 125 µg Plegridy i.m. waren ähnlich, wobei die maximalen Konzentrationen (EPeak) bei einer mittleren ETmax von 40,1 Stunden bzw. 44,0 Stunden erreicht wurden. Die geometrischen Mittelwerte des Neopterinspiegels stiegen bei den beiden Injektionsarten in ähnlicher Weise von der Baseline bis auf die maximale Konzentration an (von 8,0 auf 22,6 nmol/l bei s.c. Applikation und von 8,1 auf 23,2 nmol/l bei i.m. Applikation). Auch die systemische Gesamtexposition gegenüber Neopterin (EAUC0-336h und EAUC0-504h) war im Vergleich der beiden Applikationsarten ähnlich.
Klinische Wirksamkeit
Subkutane Applikation
Wirksamkeit und Sicherheit von Plegridy wurden vom ersten Jahr (placebokontrollierte Phase) einer 2 Jahre dauernden randomisierten, doppelblinden, klinischen Studie bei Patienten mit schubförmig-remittierender Multipler Sklerose (der ADVANCE-Studie) untersucht. 1512 Patienten wurden randomisiert, um entweder mit einer Dosis von 125 µg Plegridy als s.c. Injektion alle 2 (n=512) oder 4 (n=500) Wochen behandelt zu werden oder ein Placebo zu erhalten (n=500). Am Ende des ersten Jahres wurden die Patienten in der Placebogruppe der alle 2 oder 4 Wochen verabreichten Behandlung mit Plegridy randomisiert zugewiesen, während die Patienten, die bereits im ersten Jahr den Plegridy-Behandlungsgruppen angehört hatten, mit ihrer ursprünglichen Dosis weiterbehandelt wurden. Die Wirksamkeitsergebnisse stammen aus dem placebokontrollierten ersten Studienjahr. Klinische Wirksamkeits-/ Sicherheitsstudien mit einem nicht-pegylierten Interferon beta-1a/-1b als aktive Kontrolle im Vergleich zum pegylierten Interferon beta-1a wurden nicht durchgeführt. Daten zum direkten Vergleich von Plegridy und nicht-pegyliertem Interferon beta oder Wirksamkeitsdaten von Plegridy bei einem Wechsel von nicht-pegyliertem Interferon beta liegen nicht vor.
An der Studie nahmen Patienten mit schubförmig-remittierender Multipler Sklerose teil, bei denen in den drei Vorjahren mindestens 2 Schübe aufgetreten waren, darunter mindestens 1 Schub in dem Jahr vor der Randomisierung, und einen EDSS (Expanded Disability Status Scale) Wert zwischen 0 bis 5 hatten. Neurologische Untersuchungen wurden zum Studienbeginn, alle 12 Wochen und bei Verdacht auf Vorliegen eines Schubes durchgeführt. Hirn-MRI-Untersuchungen fanden zu Studienbeginn und nach 24 und 48 Wochen statt.
Patienten, bei denen eine vorherige MS-Behandlung versagte, wurden nicht in die Studie eingeschlossen.
Das mittlere Alter des Studienkollektivs betrug 37 Jahre und insgesamt waren weniger als 1 % der Patienten > 59 Jahre alt. Die mittlere Krankheitsdauer betrug 3,6 Jahre (median 2,0 Jahre). Durchschnittlich waren 2,5 Schübe in den vergangenen 3 Jahren aufgetreten und der mittlere EDSS zum Baseline-Zeitpunkt war 2,46. Die Patienten waren überwiegend weiblich (71 %) und hatten keine MS-spezifische Vorbehandlung gehabt (83 %).
Der primäre Endpunkt war die jährliche Schubrate (ARR) über 1 Jahr. Sekundäre Endpunkte umfassten den Anteil an Studienteilnehmern mit einem Schub, neuen bzw. sich neu vergrössernden T2-hyperintensen Läsionen und die Zeit bis zum bestätigten Fortschreiten der Behinderung, definiert als Anstieg um mindestens einen Punkt bei einem Baseline-EDSS ≥1, oder um 1,5 Punkte bei Patienten mit einem Baseline-EDSS von 0, der 12 Wochen anhalten musste. Plegridy hatte eine statistisch signifikante Wirkung auf den primären und alle sekundären Endpunkte.
Verglichen mit dem Placebo hatte alle 2 Wochen appliziertes Plegridy die ARR nach einem Jahr um 36 % reduziert (p=0,0007) (Tabelle 3). In den nach demografischen Daten und Krankheitsmerkmalen zum Baseline-Zeitpunkt definierten Teilgruppen wurde eine einheitliche Reduzierung der ARR festgestellt. Plegridy reduzierte nach einem Jahr das Schubrisiko um 39 % (p=0,0003), das Risiko für das Fortschreiten der Behinderung mit Bestätigung nach 12 Wochen um 38 % (p=0,0383) bzw. nach 24 Wochen (Post-Hoc-Analyse) um 54 % (p=0,0069), die Zahl der neuen bzw. sich neu vergrössernden T2-Läsionen um 67 % (p< 0,0001), die Zahl der Gd-aufnehmenden Läsionen um 86 % (p< 0,0001) und die Zahl der neuen T1-hypointensen Läsionen um 53 % (p< 0,0001). Bei 2-wöchentlicher Applikation von 125 µg Plegridy wurde bereits nach 6 Monaten ein Behandlungseffekt in Form einer Reduzierung neuer bzw. sich neu vergrössernder T2-Läsionen um 61 % (p< 0,0001) verglichen mit dem Placebo festgestellt. Bei Anwendung von 125 µg Plegridy alle 2 Wochen ergab sich nach 1 Jahr in Bezug auf alle Schub- und MRI-Endpunkte ein zahlenmässig stärkerer Behandlungseffekt als bei dem Plegridy-Dosierungsplan alle 4 Wochen.
Die Ergebnisse des placebokontrollierten ersten Jahres dieser Studie sind in Tabelle 3 und Abbildung 1 gezeigt.
Tabelle 3: Klinische Ergebnisse und MRT-Ergebnisse von Studie 1*
|
Endpunkt
|
Placebo
|
Plegridy 125 µg s.c. alle 2 Wochen
| |
Klinische Endpunkte
|
n=500
|
n=512
| |
Jährliche Schubrate (primärer Endpunkt)
|
Berichtigte Rate
(95 % KI)
|
0,397
(0,328, 0,481)
|
0,256
(0,206, 0,318)
| |
% Reduzierung gegenüber Placebo
|
—
|
36
(p=0,0007)
| |
Anteil der Patienten mit Schub
|
Geschätzter Anteil
|
0,291
|
0,187
| |
% Risikoreduktion gegenüber Placebo
|
—
|
39
(p=0,0003)
| |
Behinderungsprogression°
|
Geschätzter Anteil der Patienten mit Progression (12 Wochen)
|
0,105
|
0,068
| |
% Risikoreduktion gegenüber Placebo
|
—
|
38
(p=0,0383)
| |
Geschätzter Anteil der Patienten mit Progression (24 Wochen)
|
0,084
|
0,040
| |
% Risikoreduktion gegenüber Placebo
|
—
|
54
(p=0,0069)
|
|
Endpunkt
|
Placebo
|
Plegridy 125 µg s.c. alle 2 Wochen
| |
MRI-Endpunkte
|
n=476
|
n=457
| |
Neue bzw. sich neu vergrössernde T2-hyperintense Läsionen
|
Berichtigter Mittelwert
|
10,9
|
3,6
| |
% Reduzierung gegenüber Placebo
|
—
|
67
(p< 0,0001)
| |
Gd-aufnehmende Läsionen
|
Mittelwert
|
1,4^
|
0,2
| |
|
% Reduzierung gegenüber Placebo
|
—
|
86
(p< 0,0001)
| |
Neue T1-hypointense Läsionen
|
Mittelwert
|
3,8
|
1,8
| |
|
% Reduzierung gegenüber Placebo
|
—
|
53
(p< 0,0001)
|
^n=477
* Intent-to-Treat-Analyse
°Behinderungsprogression war definiert als ein Anstieg um mindestens 1 Punkt ab Ausgangs-EDSS ≥1 oder ≥1,5 Punkte ab einem Ausgangs-EDSS von 0.
Abbildung 1: Zeit bis zum ersten Schub
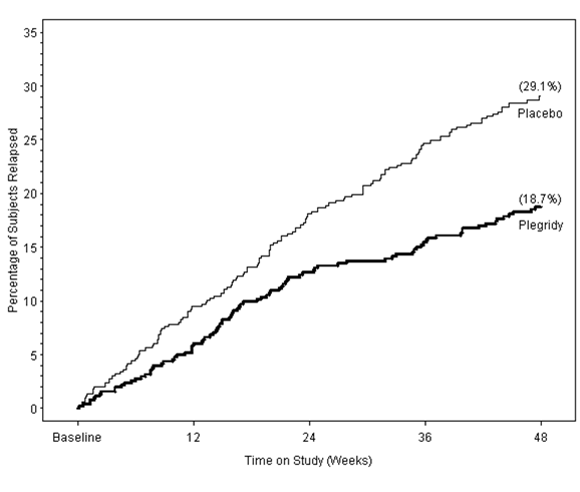
[Anteil der Patienten mit Schub (%); Baseline; Studienzeitpunkt (Wochen)]
Plegridy 125 µg alle 2 Wochen (n=512) versus Placebo (n=500) Hazard Ratio (95 % KI) = 0,61 (0,47, 0,80), p=0,0003
Die Ergebnisse über 2 Jahre bestätigten, dass die Wirksamkeit über das placebokontrollierte erste Studienjahr hinaus erhalten blieb. Bei 2-wöchentlicher Verabreichung von Plegridy zeigten sich verglichen mit einer 4-wöchentlichen Verabreichung über 2 Jahre in einer Post-Hoc-Analyse statistisch signifikante Reduzierungen der Endpunkte ARR (24 %, p=0,0209), Schubrisiko (24 %, p=0,0212), Risiko des Fortschreitens der Behinderung mit Bestätigung nach 24 Wochen (36 %, p=0,0459) und der MRI-Endpunkte (neue/sich vergrössernde T2-Läsionen 60 %, Gd+-Läsionen 71 % und neue T1-hypointense Läsionen 53 %; p< 0,0001 für alle). In der Verlängerungsstudie ATTAIN blieb die Langzeitwirksamkeit von Plegridy bei kontinuierlicher Behandlung über bis zu 4 Jahre erhalten.
Subgruppen der Patienten mit höherer Krankheitsaktivität wurden, wie nachstehend dargestellt, nach Schub und MRT-Kriterien definiert, mit folgenden Ergebnissen zur Wirksamkeit:
·Für Patienten mit ≥1 Schub im Vorjahr und ≥9 T2-Läsionen oder ≥1 Gd+-Läsion (n=1.401) betrug die jährliche Schubrate im 1. Jahr 0,39 für Placebo, 0,29 für Plegridy appliziert alle 4 Wochen und 0,25 für Plegridy appliziert alle 2 Wochen.
Die Ergebnisse dieser Subgruppe entsprachen denen der Gesamtpopulation.
·Für Patienten mit ≥2 Schüben im Vorjahr und mindestens 1 Gd+-Läsion (n=273) betrug die jährliche Schubrate im 1. Jahr 0,47 für Placebo, 0,35 für Plegridy appliziert alle 4 Wochen und 0,33 für Plegridy appliziert alle 2 Wochen.
Die Ergebnisse dieser Subgruppe waren numerisch übereinstimmend mit denen der Gesamtpopulation, aber nicht statistisch signifikant.
Bioäquivalenzstudie zwischen i.m. und s.c. Applikation
Da Bioäquivalenz zwischen der i.m. und der s.c. Applikation nachgewiesen wurde, ist davon auszugehen, dass Plegridy i.m. und s.c. ähnliche Wirksamkeitsprofile aufweisen.
|
