ZusammensetzungWirkstoffe
Atropini sulfas.
Hilfsstoffe
Natrii chloridum, Acidum hydrochloridum concentratum, Aqua ad iniectabile.
1 Fertigspritze mit 5 ml Injektionslösung enthält 17,7 mg Natrium.
Indikationen/AnwendungsmöglichkeitenPrämedikation vor einer Narkose, Herzrhythmusstörungen mit Bradykardie, Intoxikation mit Organphosphaten und Carbamaten.
Dosierung/AnwendungZur Prämedikation vor einer Narkose
I.V. Verabreichung kurz vor der Narkose oder die gleiche Dosis i.m. 30 Minuten vor der Narkose.
Erwachsene oder Kinder mit einem Körpergewicht über 40 kg: 0,5–1,0 mg.
Kinder mit einem Körpergewicht von 3–9 kg: 0,1 mg.
Kinder mit einem Körpergewicht von 10–19 kg: 0,2 mg.
Kinder mit einem Körpergewicht von 20–29 kg: 0,3 mg.
Kinder mit einem Körpergewicht von 30–40 kg: 0,4 mg.
Akutphase von Herzrhythmusstörungen mit Bradykardie
Bei Erwachsenen: 0,5–1,0 (–1,5) mg i.v., eventuell nach 3–5 Minuten zu wiederholen. Bei einer schweren Bradykardie sollte die insgesamt verabreichte Dosis nicht über 3 mg (0,04 mg/kg) liegen. Bei Bedarf alle 4–6 Stunden wiederholen.
Aufgrund des Risikos des Auftretens einer paradoxen Verlangsamung der Herzfrequenz bei der Verabreichung geringer Dosierungen oder bei einer sehr langsamen Anwendung wird empfohlen, bei Bradykardien Atropinsulfat nicht in Dosierungen unter 0,5 mg zu verabreichen.
Kinder: Mindestens 0,1 mg i.v.; einmalige i.v.-Höchstdosis: 0,5 mg bei Kindern und 1 mg bei Jugendlichen. Die Injektion kann nach 5 Minuten wiederholt werden. Die Gesamthöchstdosis beträgt 1 mg i.v. bei Kindern und 2 mg i.v. bei Jugendlichen.
Intoxikation mit Organphosphaten
Erwachsene: Die Dosierungsempfehlungen sind in den Literaturangaben sehr unterschiedlich.
Meistens werden Initialdosen zwischen 1 und 6 mg i.v. empfohlen (Kommentar DAB 10, 1991: initial 2,5 mg i.v.; AHFS 97: initial 1–2 mg i.v. [schwere Fälle 2–6 mg]).
Eine Wiederholung der Anwendung muss alle 5 bis 60 Minuten mit einer Dosis von 1–2 mg i.v. erfolgen.
Kinder: 0,05 mg/kg i.m. oder i.v., alle 10–30 Minuten zu wiederholen. Die Dosierung ist abhängig von den Symptomen (Pupillenerweiterung, Bronchialsekretion).
Intoxikation mit Carbamaten
Initial 1–2 mg i.v. oder i.m., bei Bedarf alle 20–30 Minuten zu wiederholen. Die Wiederholung sollte vorsichtiger dosiert werden als bei irreversiblen Cholinesterasehemmstoffen.
KontraindikationenTachykardie; Herzrhythmusstörungen, Koronarinsuffizienz, Engwinkelglaukom, Prostatahyperplasie mit Restharn, mechanische Stenose des Gastrointestinaltrakts, Megakolon, Obstipation mit intestinaler Atonie und Monotherapie der Myasthenia gravis.
Die Behandlung mit Atropin im letzten Schwangerschaftstrimenon, während der Geburt und der Sectio ist kontraindiziert, da bei der Mutter und beim Neugeborenen Herzrhythmusstörungen (insbesondere Tachykardien) auftreten können (siehe «Schwangerschaft/Stillzeit»).
Warnhinweise und VorsichtsmassnahmenVorsicht ist bei fieberhaften Zuständen, Hyperthyreose, Herzinsuffizienz, akutem Lungenödem, schwerer Cerebralparese, Down-Syndrom und Hämorrhagie geboten.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Fertigspritze d.h. es ist nahezu „natriumfrei“.
InteraktionenParasympathomimetika schwächen bei einer gleichzeitigen Anwendung die Wirkung von Atropin ab.
Trizyklische Antidepressiva, Neuroleptika, manche Antihistaminika, Parkinsonmittel, Procain, Procainamid, Disopyramid, Chinidin und Amantadin können die parasympatholytischen Wirkungen verstärken. Die Bioverfügbarkeit von Digoxin und Nitrofurantoin wird durch eine verzögerte Magenpassage durch Atropin erhöht, Levodopa und Phenothiazine werden hingegen aufgrund des gleichen Mechanismus weniger gut resorbiert.
Schwangerschaft, StillzeitSchwangerschaft
Atropinsulfat durchdringt die Plazentaschranke und geht in geringeren Mengen in die Muttermilch über. Atropin darf während der Schwangerschaft nur verwendet werden, wenn es unbedingt erforderlich ist.
Die Behandlung mit Atropin im letzten Schwangerschaftstrimenon, während der Geburt und der Sectio ist kontraindiziert, da bei der Mutter und beim Neugeborenen Herzrhythmusstörungen (insbesondere Tachykardien) auftreten können. Es besteht ein Risiko für eine Beeinträchtigung des autonomen Nervensystems des Fötus mit nachfolgenden Adaptationsschwierigkeiten nach der Geburt.
Stillzeit
Atropinsulfat geht in die Muttermilch über und verringert die Milchsekretion.
Daher muss das Stillen abgebrochen werden, wenn die Anwendung dieses Arzneimittels tatsächlich unerlässlich erscheint.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenHierzu wurde keine relevante Studie durchgeführt.
Unerwünschte WirkungenDie Nebenwirkungen von Atropinsulfat hängen von der Dosierung ab, und die individuelle Empfindlichkeit fällt sehr unterschiedlich aus.
Erkrankungen des Nervensystems
Trockenheit von Mund und Nase, Schluckstörungen, Hemmung der Schweisssekretion, Durst.
Augenerkrankungen
Mydriasis, Photophobie, Erhöhung des Augeninnendrucks, Akkomodationsstörungen.
Herzerkrankungen
Transitorische Bradykardie gefolgt von einer Tachykardie mit einer leichten Blutdruckerhöhung.
Erkrankungen der Haut und des Unterhautzellgewebes
Allergische Reaktionen mit Hautausschlägen und Schleimhautreizungen (Konjunktivitis) sind nicht selten.
Erkrankungen der Nieren und Harnwege
Miktionsstörungen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Kinder reagieren empfindlicher auf Thermoregulationsstörungen, die durch Atropin hervorgerufen werden (mögliche deutliche Erhöhung der Körpertemperatur), selten allergische Reaktionen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
ZNS: Erregung, Schläfrigkeit, Exzitationszustände, Dyskinesie, Ataxie, Verwirrtheit, Delir, Halluzinationen, Krampfanfälle, Koma und terminale Atemlähmung.
Herz: Rhythmusstörungen, Veränderungen der Herzfrequenz.
Harnwege: Harnverhaltung.
Bronchialbaum: Hemmung der Selbstreinigung, ansteigendes Infektionsrisiko.
Gastrointestinaltrakt: Übelkeit, Erbrechen, Obstipation.
Haut: trockene und brennende Haut, Erhöhung der Körpertemperatur, Erythem im Gesicht.
Behandlung
Anwendung von Massnahmen zur Reduktion der Resorption und zur Senkung der Körpertemperatur und Gabe von Physiostigminsalicylat als Antidot. Die Dosierung (Erwachsene: 1–4 mg; Kinder: 0,02 mg/kg Körpergewicht als langsame i.v.-Injektion) muss dem Schweregrad der Intoxikation angepasst und aufgrund einer raschen Metabolisierung wiederholt werden.
Weitere Massnahmen sind symptomatisch, z.B. Gabe von Barbituraten mit kurzer Wirkungsdauer sowie bestimmten Benzodiazepinen, z.B. Diazepam (keine Phenothiazine!) gegen Exzitationszustände. Es muss jedoch bedacht werden, dass das Auftreten einer Atemlähmung im Spätstadium der Intoxikation mit Atropin durch diese Massnahmen begünstigt wird. Die Vorbereitung einer künstlichen Beatmung ist aufgrund des Risikos einer Atemlähmung erforderlich.
Eine Hyperthermie muss mit einer Temperatursenkung (z.B. Bad) und Antipyretika behandelt werden.
Die Schleimhäute von Augen und Mund müssen mit einer 0,5–2%igen Pilocarpinlösung befeuchtet oder gespült werden.
Eigenschaften/WirkungenATC-Code
A03BA01
Wirkungsmechanismus/Pharmakodynamik
Atropin wirkt in der üblichen Dosis durch einen kompetitiven Antagonismus des Neurotransmitters Acetylcholin an Muskarinrezeptoren parasympathikolytisch. In höheren Dosierungen hemmt Atropin auch die nikotinergen Wirkungen von Acetylcholin an den parasympathischen und sympathischen Ganglien sowie der motorischen Endplatte (kurarisierende Wirkung). Die Atropinwirkungen bestehen wegen der Hemmung des Parasympathikus vor allem in einer Verringerung der Tränen-, Speichel-, Schweiss-, Bronchial- und Magensäuresekretion, Verringerung des Tonus und der Beweglichkeit der glatten Muskulatur des Gastrointestinaltrakts und der Blase, einer Bronchodilatation und einer Steigerung der Herzfrequenz (eine paradoxe Verminderung der Herzfrequenz kann ebenfalls zu Beginn der Behandlung und bei geringen Atropindosierungen auftreten). Atropin führt auch zu einer Pupillendilatation und einer Akkomodationshemmung.
Da es sich um ein tertiäres Amin handelt, durchdringt Atropin die Blut-Hirn-Schranke und kann zu zentralen Wirkungen wie Hemmung der extrapyramidalen Bewegungen und in höheren Dosierungen (Intoxikation) zu einer zentral bedingten Exzitation führen.
Klinische Wirksamkeit
Keine verfügbaren Daten.
PharmakokinetikAbsorption
Atropin wird nach i.m.- und s.c.-Gabe rasch und vollständig resorbiert. Die maximalen Plasmakonzentrationen werden bei einer i.m.-Injektion nach etwa 8–13 Minuten und bei einer s.c.-Injektion nach etwa 10 Minuten erreicht.
Die klinischen Wirkungen setzen etwa 30 Minuten nach der Injektion (i.m. und s.c.) ein. Nach einer i.v.-Injektion ist die maximale periphere Wirkung nach 12–16 Minuten zu beobachten und die Beschleunigung der Herzfrequenz erreicht häufig bereits nach 2–4 Minuten ihr Maximum.
Distribution
Die Plasmaproteinbindung ist variabel und wird mit 2 bis 40% angegeben, das Verteilungsvolumen beträgt 2 bis 4 l/kg.
Atropin durchdringt die Blut-Hirn-Schranke und die Plazentaschranke und geht in die Muttermilch über.
Metabolismus/Elimination
Bis zu 50% der verabreichten Atropindosis werden unverändert über die Nieren ausgeschieden. Atropin wird teilweise in der Leber metabolisiert und die Metaboliten, die teilweise noch unbekannt sind, werden ebenfalls weitgehend über die Nieren ausgeschieden.
Die Eliminationshalbwertzeit beträgt bei Gesunden 3 bis 4 Stunden.
Die Elimination von Atropin scheint in zwei Phasen zu verlaufen, mit Eliminationshalbwertzeiten von 2–3 und 12–38 Stunden.
Kinetik spezieller Patientengruppen
Kinder und ältere Personen
Eine Verlängerung der Eliminationshalbwertzeit wurde hingegen bei Kindern und älteren Personen beobachtet.
Präklinische DatenEs gibt keine Hinweise auf mutagene oder onkogene Wirkungen.
Die Beobachtung von 400 Mutter-Kind-Paaren, die im ersten Schwangerschaftstrimenon mit Atropin behandelt wurden, ergab keinen Hinweis auf ein embryotoxisches Potenzial.
In tierexperimentellen Studien (Ratte) führte die subkutane Injektion von 50 mg Atropinsulfat/kg Körpergewicht zu Skelettfehlbildungen beim Embryo.
Sonstige HinweiseInkompatibilitäten
Die Fertigspritzen sind gebrauchsfertig und dürfen nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Die Zubereitung enthält kein Konservierungsmittel. Aus mikrobiologischen Gründen ist die gebrauchsfertige Zubereitung unmittelbar nach Öffnung der Blisterverpackung zu verwenden.
Besondere Lagerungshinweise
In der Originalverpackung, vor Licht geschützt und bei Raumtemperatur (15-25 °C) aufbewahren. Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Die Fertigspritze ist zum einmaligen Gebrauch für einen Patienten bestimmt.
Der Inhalt einer ungeöffneten und unbeschädigten Blisterverpackung ist steril. Die Blisterverpackung soll erst unmittelbar vor dem Gebrauch geöffnet werden.
Die äussere Oberfläche der Spritze ist bis zur Öffnung der Blisterverpackung steril. Vor Gebrauch die Blisterverpackung auf Beschädigungen prüfen.
|
1) Nehmen Sie die Fertigspritze aus der Blisterverpackung.
| |
2
|
|
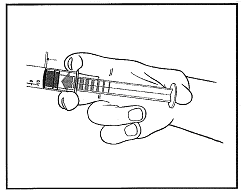
2) Drücken Sie den Stempel um den Gummistopfen zu entsichern.
| |
3
|
|
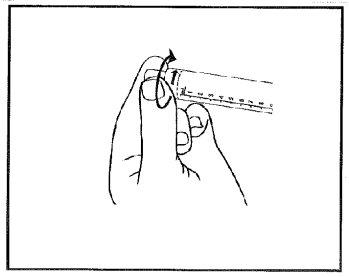
3) Entfernen Sie durch drehen die Schutzkappe
| |
4
|
|
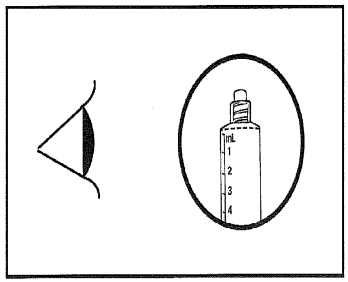
4) Überprüfen Sie, ob die Spitzendichtung der Spritze vollständig entfernt wurde
| |
5
|

|
5) Entleeren Sie die Luft mit einem leichten Druck auf den Kolben.
| |
6) Verbinden Sie die Spritze mit dem intravenösen Zugang oder mit der Nadel. Langsam schieben Sie den Kolben, um das gewünschte Volumen zu verabreichen
|
Für eine i.v. Anwendung der Fertigspritze soll eine Nadel von 23 bis 20 Gauge benutzt werden.
Für eine i.m. Anwendung der Fertigspritze soll eine Nadel von 23 bis 21 Gauge benutzt werden.
Zulassungsnummer65276 (Swissmedic).
PackungenAtropin Sulfat Aguettant 0,5 mg/5 mL, Fertigspritze 5 ml : 1 (B)
Atropin Sulfat Aguettant 0,5 mg/5 mL, Fertigspritze 5 ml : 5 (B)
Atropin Sulfat Aguettant 0,5 mg/5 mL, Fertigspritze 5 ml : 10 (B)
Atropin Sulfat Aguettant 1 mg/5 mL, Fertigspritze 5 ml : 1 (B)
Atropin Sulfat Aguettant 1 mg/5 mL, Fertigspritze 5 ml : 5 (B)
Atropin Sulfat Aguettant 1 mg/5 mL, Fertigspritze 5 ml : 10 (B)
ZulassungsinhaberinAguettant Suisse SA
Route de Jussy 35
1226 Thônex
Schwein
Stand der InformationSeptember 2022
| 



