Eigenschaften/WirkungenATC-Code
A10BD20
Pharmakotherapeutische Gruppe:
Kombinationen mit oralen Antidiabetika.
Wirkungsmechanismus / Pharmakodynamik
Empagliflozin ist ein reversibler, stark wirksamer und selektiver kompetitiver SGLT2-Inhibitor mit einer IC50 von 1,3 nM. Es zeigt eine 5000fach höhere Selektivität für SGLT2 gegenüber dem für die Glukose-Resorption im Darm verantwortlichen humanen SGLT1 (IC50: 6278 nM).
Weiter konnte keine hemmende Wirkung auf Glukosetransporter GLUTs gezeigt werden, welche für die Glukoseversorgung in verschiedenen Geweben verantwortlich sind.
SGLT-2 wird vorwiegend in der Niere exprimiert. Es ist als wichtigster Transporter für die Rückresorption der Glukose aus dem glomerulären Filtrat in den Blutkreislauf verantwortlich.
Empagliflozin reduziert insulinunabhängig die renale Glucose-Rückresorption. Die durch diesen Mechanismus über den Urin ausgeschiedene Menge an Glucose ist abhängig von der Blutzuckerkonzentration sowie der glomerulären Filtrationsrate.
Die erhöhte renale Glucoseausscheidung führt zu einer osmotischen Diurese und über diesen diuretischen Effekt zu einer Senkung des Blutdrucks (im Mittel rund 4-5 mmHg systolisch und 1-2 mmHg diastolisch) und zu einem Anstieg des Hämatokrits (rund 2-3%). Zudem wirkt Empagliflozin urikosurisch und reduziert so den Plasma-Harnsäurespiegel (rund 50µmol/L). Durch die renale Glucoseausscheidung ist das Risiko für urogenitale Infektionen insbesondere bei Frauen und älteren Menschen erhöht.
Die renale Glucose-Ausscheidung nach 10mg Empagliflozin beträgt ca. 64g pro Tag (entspricht rund 256 kcal). Nach 25 mg Empagliflozin beträgt die renale Glucose-Ausscheidung ca. 78g pro Tag (entspricht rund 312 kcal).
Bei T2DM-Patienten steigt die renale Ausscheidung von Zucker im Urin nach der ersten Dosis Empagliflozin an und bleibt über das gesamte 24stündige Dosierungsintervall auf dem gleichen Niveau.
Die erhöhte Ausscheidung von Zucker im Urin führte bei T2DM-Patienten zu einer Reduktion der Plasmaglukosespiegel.
Die blutzuckersenkende Wirkung von Empagliflozin ist unabhängig von der Betazellfunktion und dem Insulinweg.
Metformin ist ein Biguanid mit antihyperglykämischen Wirkungen, das sowohl den basalen als auch den postprandialen Blutzuckerspiegel senkt. Es stimuliert nicht die Insulinsekretion und führt daher nicht zu Hypoglykämie.
Metformin kann über drei Mechanismen wirken:
(1) Reduktion der Glukoseproduktion in der Leber durch Hemmung der Glukoneogenese und Glykogenolyse
(2) moderate Erhöhung der Insulinsensitivität in der Muskulatur mit daraus folgender Verbesserung der peripheren Glukoseaufnahme und -verwertung
(3) Verzögerung der intestinalen Glukoseresorption.
Metformin stimuliert die intrazelluläre Glykogensynthese durch Wirkung auf die Glykogensynthase.
Metformin steigert die Transportkapazität aller bisher bekannten membranständigen Glukosetransporter (GLUTs). In klinischen Studien war Metformin mit einem Stabilen Körpergewicht und einer leichten Gewichtsabnahme verbunden.
Beim Menschen wirkt sich Metformin unabhängig von seinem antiglykämischen Effekt, günstig auf den Fettstoffwechsel aus. Dies wurde bei therapeutischen Dosen in kontrollierten klinischen Studien mit mittlerer und langer Dauer gezeigt: Metformin senkt die Gesamtcholesterin-, LDL-Cholesterin- und Triglyzeridspiegel.
Klinische Wirksamkeit
Insgesamt 10224 Patienten mit Typ 2 Diabetes mellitus wurden mindestens 24 Wochen lang in 9 doppelblinden, placebo- oder wirkstoffkontrollierten klinischen Studien behandelt; von diesem Patienten erhielten 2947 Empagliflozin 10 mg und 3703 Empagliflozin 25 mg als Zusatz zur Metformin-Therapie. Insgesamt 2978 dieser Patienten wurden mit Metformin plus Insulin behandelt, davon erhielten 988 Empagliflozin 10 mg und 990 Empagliflozin 25 mg als Zusatztherapie.
Die Behandlung mit Empagliflozin in Kombination mit Metformin mit oder ohne eine weitere Basistherapie (Sulfonylharnstoff, DPP-4-Inhibitoren und Insulin) bewirkte eine klinisch relevante Verbesserung der HbA1c- und Nüchternplasmaglukosewerte (NPG), des Körpergewichts sowie des systolischen und diastolischen Blutdrucks.
Bei Patienten ab 75 Jahren wurden unter Empagliflozin numerisch geringere Reduktionen des HbA1c-Werts beobachtet. Höhere HbA1c-Werte zu Baseline waren mit einer stärkeren Reduktion des HbA1c assoziiert.
Kombinationstherapie
Empagliflozin als Add-on-Therapie zu Metformin und Sulfonylharnstoff
Empagliflozin führte als Add-on-Therapie zu Metformin oder zu Metformin und einem Sulfonylharnstoff im Vergleich zu Placebo zu einer statistisch signifikanten (p < 0,0001) Abnahme des HbA1c-Werts und des Körpergewichts (Tabelle 2). Zudem führte es im Vergleich zu Placebo zu einer klinischen bedeutsamen Abnahme der NPG sowie des systolischen und diastolischen Blutdrucks.
In der doppelblinden. Placebokontrollierten Verlängerungsperiode dieser Studien blieben die Reduktionen von HbA1c, Körpergewicht und Blutdruck bis Woche 52 bestehen.
Tabelle 2: Ergebnisse einer 24wöchigen (LOCF) Placebokontrollierten Studie mit Empagliflozin als Zusatz zu Metformin bzw. zu Metformin und einem Sulfonylharnstoff (Full Analysis Set)
|
Empagliflozin
als Zusatz zu Metformin
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
207
|
217
|
213
| |
HbA1c (%)
| |
Baseline (Mittelwert)
|
7,90
|
7,94
|
7,86
| |
Veränderung gegenüber Baseline1
|
-0,13
|
-0,70
|
-0,77
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,57* (-0,72, -0,42)
|
-0,64* (-0,79, -0,48)
| |
N
|
184
|
199
|
191
| |
Patienten (%), die HbA1c <7% erreichen (HbA1c-Ausgangswert ≥7%)2
|
12,5
|
37,7
|
38,7
| |
N
|
207
|
217
|
213
| |
Körpergewicht (kg)
| |
Baseline (Mittelwert)
|
79,73
|
81,59
|
82,21
| |
Veränderung gegenüber Baseline1
|
-0,45
|
-2,08
|
-2,46
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-1,63* (-2,17, -1,08)
|
-2,01* (-2,56, -1,46)
| |
N
|
207
|
217
|
213
| |
Patienten (%) mit einem Gewichtsverlust von >5%
|
4,8
|
21,2
|
23,0
| |
N
|
207
|
217
|
213
| |
SBD (mmHg)2
| |
Baseline (Mittelwert)
|
128,6
|
129,6
|
130,0
| |
Veränderung gegenüber Baseline1
|
-0,4
|
-4,5
|
-5,2
| |
Unterschied zu Placebo1
(95% KI)
|
|
-4,1* (-6,2, -2,1)
|
-4.8* (-6.9, -2.7)
|
|
Empagliflozin
als Zusatz zu Metformin und einem Sulfonylharnstoff
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
225
|
225
|
216
| |
HbA1c (%)
| |
Baseline (Mittelwert)
|
8,15
|
8,07
|
8,10
| |
Veränderung gegenüber Baseline1
|
-0,17
|
-0,82
|
-0,77
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,64* (-0,79, -0,49)
|
-0,59* (-0,74, -0,44)
| |
N
|
216
|
209
|
202
| |
Patienten (%), die HbA1c <7% erreichen (HbA1c-Ausgangswert ≥7%)2
|
9,3
|
26,3
|
32,2
| |
N
|
224
|
225
|
215
| |
NPG (mg/dl) [mmol/l]
| |
Baseline (Mittelwert)
|
151,7 [8,42]
|
151,0 [8,38]
|
156,5 [8,68]
| |
Veränderung gegenüber Baseline1
|
5,5 [0,31]
|
-23,3 [-1,29]
|
-23,3 [-1,29]
| |
Unterschied zu Placebo1
(95% KI)
|
|
-28,8* (-34,3, -23,4)
[-1,60 (-1,90, -1,30)]
|
-28,8* (-34,3, -23,3)
[-1,60 (-1,90, -1,29)]
| |
N
|
225
|
225
|
216
| |
Körpergewicht (kg)
| |
Baseline (Mittelwert)
|
76,23
|
77,08
|
77,50
| |
Veränderung gegenüber Baseline1
|
-0,39
|
-2,16
|
-2,39
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-1,76* (-2,25, -1,28)
|
-1,99* (-2,48, -1,50)
| |
N
|
225
|
225
|
216
| |
Patienten (%) mit einem Gewichtsverlust von >5%
|
5,8
|
27,6
|
23,6
| |
N
|
225
|
225
|
216
| |
SBD (mmHg)2
| |
Baseline (Mittelwert)
|
128,8
|
128,7
|
129,3
| |
Veränderung gegenüber Baseline1
|
-1,4
|
-4,1
|
-3,5
| |
Unterschied zu Placebo1
(95% KI)
|
|
-2,7 (-4,6, -0,8)
|
-2,1 (-4,0, -0,2)
|
1 für Ausgangswert adjustierter Mittelwert
2 aufgrund des sequentiellen konfirmatorischen Testverfahrens nicht im Hinblick auf statistische Signifikanz beurteilt
* p<0,0001
Add-on-Therapie zu Insulin
Empagliflozin als Add-on-Therapie zu Basalinsulin
Die Wirksamkeit und Sicherheit von Empagliflozin als Add-on-Therapie zu Basalinsulin mit oder ohne Metformin und/oder einem Sulfonylharnstoff wurde in einer doppelblinden, Placebokontrollierten Studie mit einer Dauer von 78 Wochen untersucht. In den ersten 18 Wochen wurde die Insulindosis stabil gehalten, in den folgenden 60 Wochen konnte die Dosis angepasst werden, um einen NPG-Wert < 110 mg/dl zu erreichen.
Bis zur Woche 18 führte Empagliflozin zu einer statistisch signifikanten Verbesserung des HbA1c (Tabelle 3).
Nach 78 Wochen führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Abnahme des HbA1c sowie zu einer Insulin-Ersparnis. Zudem führte Empagliflozin zu einer Abnahme von NPG, des Körpergewichts und des Blutdrucks.
Tabelle 3: Ergebnisse einer Placebokontrollierten Studie mit Empagliflozin als Zusatz zu Basalinsulin mit oder ohne Metformin oder einem Sulfonylharnstoff (Full Analysis Set – Completer) nach 18 bzw. 78 Wochen (LOCF)
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
125
|
132
|
117
| |
HbA1c (%) in Woche 18
| |
Baseline (Mittelwert)
|
8,10
|
8,26
|
8,34
| |
Veränderung gegenüber Baseline1
|
-0,01
|
-0,57
|
-0,71
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,56* (-0,78, -0,33)
|
-0,70* (-0,93, -0,47)
| |
N
|
112
|
127
|
110
| |
HbA1c (%) in Woche 78
| |
Baseline (Mittelwert)
|
8,09
|
8,27
|
8,29
| |
Veränderung gegenüber Baseline1
|
-0,02
|
-0,48
|
-0,64
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,46* (-0,73, -0,19)
|
-0,62* (-0,90, -0,34)
| |
N
|
112
|
127
|
110
| |
Dosis Basalinsulin (IE/Tag) in Woche 78
| |
Baseline (Mittelwert)
|
47,84
|
45,13
|
48,43
| |
Veränderung gegenüber Baseline1
|
5,45
|
-1,21
|
-0,47
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-6,66** (-11,56, -1,77)
|
-5,92** (-11,00, -0,85)
|
1 für Ausgangswert adjustierter Mittelwert
* p <0,0001
** p < 0,01
Empagliflozin als Add-on-Therapie zu multiplen täglichen Insulininjektionen
Die Wirksamkeit und Sicherheit von Empagliflozin als Add-on-Therapie zu mehrmals täglich verabreichtem Insulin mit oder ohne begleitende Metformin-Therapie wurde in einer doppelblinden, Placebokontrollierten Studie mit einer Dauer von 52 Wochen untersucht. In den ersten 18 Wochen und den letzten 12 Wochen wurde die Insulindosis stabil gehalten, zwischen Woche 19 und 40 jedoch angepasst, um präprandiale Glucosewerte < 100 mg/dl (5,5 mmol/l) und postprandiale Glucosewerte < 140 mg/dl (7,8 mmol/l) zu erreichen.
Bis zur Woche 18 führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Verbesserung des HbA1c (Tabelle 4).
Nach 52 Wochen führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Abnahme des HbA1c sowie zu einer Insulin-Ersparnis. Zudem führte Empagliflozin zu einer Abnahme der NPG und des Körpergewichts.
Tabelle 4: Ergebnisse zur Wirksamkeit in den Wochen 18 und 52 einer Placebokontrollierten Studie zu Empagliflozin als Add-on-Therapie zu mehreren täglichen Dosen Insulin mit oder ohne Metformin
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
188
|
186
|
189
| |
HbA1c (%) in Woche 18
| |
Baseline (Mittel)
|
8,33
|
8,39
|
8,29
| |
Veränderung gegenüber Baseline1
|
-0,50
|
-0,94
|
-1,02
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-0,44* (-0,61, -0,27)
|
-0,52* (-0,69, -0,35)
| |
N
|
115
|
119
|
118
| |
HbA1c (%) in Woche 522
| |
Baseline (Mittel)
|
8,25
|
8,40
|
8,37
| |
Veränderung gegenüber Baseline1
|
-0,81
|
-1,18
|
-1,27
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-0,38*** (-0,62, -0,13)
|
-0,46* (-0,70, -0,22)
| |
N
|
113
|
118
|
118
| |
Patienten (%), die HbA1c <7% mit Baseline HbA1c ≥7% in Woche 52 erreichen
|
26,5
|
39,8
|
45,8
| |
N
|
115
|
118
|
117
| |
Insulindosis (IU/Tag) in Woche 522
| |
Baseline (Mittel)
|
89,94
|
88,57
|
90,38
| |
Veränderung gegenüber Baseline1
|
10,16
|
1,33
|
-1,06
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-8,83# (-15,69, -1,97)
|
-11,22** (-18,09, -4,36)
| |
N
|
115
|
119
|
118
| |
Körpergewicht (kg) in Woche 522
| |
Baseline (Mittel)
|
96,34
|
96,47
|
95,37
| |
Veränderung gegenüber Baseline1
|
0,44
|
-1,95
|
-2,04
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-2,39* (-3,54, -1,24)
|
-2,48* (-3,63, -1,33)
|
1 für Ausgangswert adjustierter Mittelwert
2 Woche 19-40: Treat-to-Target-Regime für Insulindosisanpassung, um vordefinierte Blutzucker-Zielwerte (präprandial <100 mg/dl (5,5 mmol/l), postprandial <140 mg/dl (7,8 mmol/l) zu erreichen
* p-Wert <0,0001
** p-Wert = 0,0003
*** p-Wert = 0,0005
# p-Wert = 0,0040
Empagliflozin zweimal täglich versus einmal täglich als Zusatz zu Metformin
Die Wirksamkeit und Sicherheit von Empagliflozin zweimal täglich versus einmal täglich (Tagesdosis von 10 mg und 25 mg) als Zusatzbehandlung bei Patienten, deren Blutzucker mit Metformin allein nicht ausreichend kontrolliert werden konnte, wurde in einer doppelblinden, placebokontrollierten 16wöchigen Studie beurteilt. Alle Behandlungen mit Empagliflozin bewirkten eine signifikante Reduktion des HbA1c ab Baseline (Gesamtmittelwert 7,8%) nach 16 Behandlungswochen im Vergleich zu Placebo. Bei zweimal täglicher Gabe von Empagliflozin wurden vergleichbaren Reduktionen des HbA1c wie bei Therapieregimes mit einmal täglicher Gabe erreicht, der Behandlungsunterschied bezüglich der HbA1c-Reduktion zwischen Baseline und Woche 16 betrug -0,02% (95% KI -0,16; 0,13) für Empagliflozin 5 mg zweimal täglich versus 10 mg einmal täglich und -0,11% (95% KI -0,26; 0,03) für Empagliflozin 12,5 mg zweimal täglich versus 25 mg einmal täglich.
Kardiovaskuläre Ergebnisse in Patienten mit manifester kardiovaskulärer Erkrankung
Die EMPA-REG Studie verglich das Risiko kardiovaskulärer Ereignisse in Patienten mit Typ 2 Diabetes mellitus und kardiovaskulärer Vorerkrankung unter Empagliflozin-Behandlung versus Placebo. In diese Studie wurden insgesamt 7020 Patienten mit koronarer Herzkrankheit (Ein- oder Mehrgefässerkrankung), Zustand nach Myokardinfarkt (MI), Zustand nach Schlaganfall und/oder peripherer arterieller Verschlusskrankheit eingeschlossen und für bis zu 4,5 Jahre (mediane Behandlungsdauer 3,1 Jahre) zusätzlich zur vorbestehenden Therapie entweder mit Empagliflozin 10 mg (n=2.345), Empagliflozin 25 mg (n=2.342) oder Plazebo (n=2.333) behandelt.
Die Population war zu 72,4 % kaukasisch, zu 21,6 % asiatisch und zu 5,1 % schwarz. Das Durchschnittsalter betrug 63 Jahre (9,3 % der Patienten ≥75 Jahre), 71,5 % der Patienten waren männlich. Zu Studienbeginn erhielten etwa 81 % der Patienten einen Hemmer des Renin-Angiotensin-Systems, 65 % Betablocker, 43 % Diuretika, 89 % Antikoagulantien und 81 % eine lipidsenkende Medikation. Etwa 74 % der Patienten nahmen bei Studienbeginn Metformin ein, 48 % wendeten Insulin an und 43 % erhielten einen Sulfonylharnstoff. In den ersten 12 Wochen erfolgte die Behandlung grundsätzlich ohne weitere Anpassungen. Ab diesem Zeitpunkt konnte die Behandlung (inklusive Hypertonie und Dyslipidämie) gemäss den aktuellen Therapierichtlinien angepasst werden.
Primärer Endpunkt (bestimmt für beide Empagliflozin-Arme zusammen) war die Zeit bis zum ersten Ereignis des kombinierten Endpunkts aus kardiovaskulären Todesfällen, nicht-tödlichen MI und nicht-tödlichen Schlaganfällen (3-point MACE [Major Adverse Cardiovascular Events]). Alle kardiovaskulären Todesfälle wurden durch ein verblindetes Expertengremium (CEC) als tödlicher MI, tödlicher Schlaganfall, Tod aufgrund von Herzinsuffizienz (durch Progression oder kardiogenen Schock), plötzlicher Tod oder andere tödliche kardiovaskuläre Ereignisse kategorisiert.
Subgruppen-Analysen für 3P-MACE und kardiovaskulärer Tod nach Antidiabetika zu Studienbeginn (einschliesslich Metformin und Insulin) zeigten Behandlungseffekte, welche mit jenen der Gesamtpopulation in Einklang standen, bei einer Punktschätzung für die Hazard Ratio der Gesamtpopulation innerhalb der Konfidenzintervalle der Subgruppen für jeden Endpunkt.
Reduktion des Risikos für kardiovaskuläre Todesfälle und Gesamtmortalität
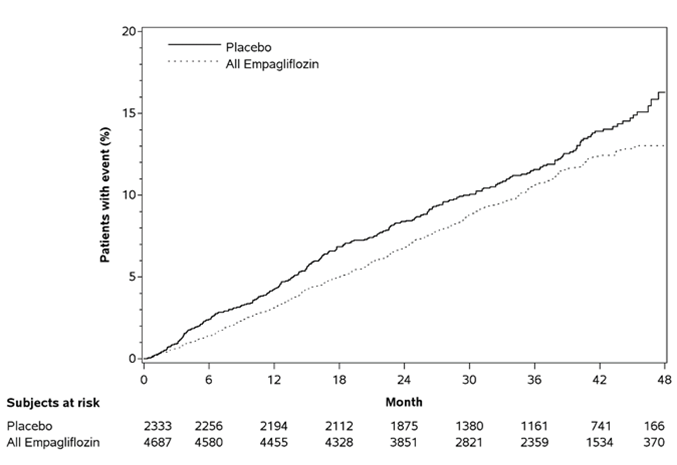
Empagliflozin war Plazebo hinsichtlich des primären Endpunkts überlegen (d.h. bewirkte eine Senkung des Risikos kardiovaskulärer Ereignisse). Dieser Effekt konnte nicht allein durch den Unterschied zwischen den Behandlungsgruppen in der glykämischen Kontrolle erklärt werden und beruhte weitgehend auf der ausgeprägten Senkung der Inzidenz kardiovaskulärer Todesfälle (Tabelle 5 und Abbildung 1). Ein präventiver Effekt wurde für alle Kategorien kardiovaskulärer Todesfälle beobachtet und war am deutlichsten für Tod aufgrund fortschreitender Herzinsuffizienz. Gleichzeitig wurde das Risiko nicht-tödlicher Myokardinfarkte nicht statistisch signifikant gesenkt. Empagliflozin hatte auch keinen präventiven Effekt für Schlaganfälle und bewirkte sogar einen numerischen Anstieg des Risikos (HR [95% Konfidenzintervall] für tödliche/nicht-tödliche Ereignisse: 1,18 [0,89, 1,56]). Ausserdem gab es keine Reduktion des primären Endpunkts in Patienten, welche ausschliesslich aufgrund einer zerebrovaskulären Vorgeschichte in die Studie eingeschlossen wurden. Die grösste Senkung der kardiovaskulären Mortalität wurde in Patienten mit 2 oder 3 Risikofaktoren beobachtet.
Resultierend hauptsächlich aus der Reduktion kardiovaskulärer Todesfälle (Empagliflozin bewirkte keine statistisch signifikante Reduktion der nicht-kardiovaskulären Mortalität) verbesserte sich unter Empagliflozin-Behandlung auch die Gesamtmortalität
Tabelle 5: Behandlungseffekt in Bezug auf den zusammengesetzten primären Endpunkt, seine Komponenten und die Mortalität (Behandelte Population*)
|
|
Placebo
|
Empagliflozin
(10 und 25 mg, gepoolt)
| |
N
|
2333
|
4687
| |
Zeit bis zum ersten Eintreten eines kardiovaskulären Todesfalls, nicht-tödlichen MI oder nicht-tödlichen Schlaganfalls
|
282 (12,1)
|
490 (10,5)
| |
Hazard Ratio vs. Plazebo (95,02%-KI)**
|
|
0,86 (0,74; 0,99)
| |
p−Wert für Überlegenheit
|
|
0,0382
| |
Kardiovaskuläre Todesfälle N (%)
|
137 (5,9)
|
172 (3,7)
| |
Hazard Ratio vs. Plazebo (95%-KI)
|
|
0,62 (0,49; 0,77)
| |
p-Wert
|
|
<0,0001
| |
Nicht-tödliche MI N (%)
|
121 (5,2)
|
213 (4,5)
| |
Hazard Ratio vs. Plazebo (95%-KI)
|
|
0,87 (0,70; 1,09)
| |
p−Wert
|
|
0,2189
| |
Nicht-tödliche Schlaganfälle N (%)
|
60 (2,6)
|
150 (3,2)
| |
Hazard Ratio vs. Plazebo (95%-KI)
|
|
1,24 (0,92; 1,67)
| |
p−Wert
|
|
0,1638
| |
Gesamtmortalität N (%)
|
194 (8,3)
|
269 (5,7)
| |
Hazard Ratio vs. Plazebo (95%-KI)
|
|
0,68 (0,57; 0,82)
| |
p-Wert
|
|
<0,0001
| |
Nicht-kardiovaskuläre Mortalität N (%)
|
57 (2,4)
|
97 (2,1)
| |
Hazard Ratio vs. Plazebo (95%-KI)
|
|
0,84 (0,60; 1,16)
|
* d.h. Patienten, die mindestens eine Dosis der Studienmedikation erhalten hatten
** Da Daten der Studie in einer Interim-Analyse berücksichtigt wurden, gilt ein zweiseitiges 95,02-%-Konfidenzintervall, das einem p-Wert von kleiner 0,0498 für Signifikanz entspricht.
Abbildung 1: Zeit bis zum erstmaligen Auftreten eines Ereignisses des zusammengesetzten primären Endpunkts (kardiovaskulärer Tod/nicht-tödlicher MI/nicht-tödlicher Schlaganfall)
In einer randomisierten, plazebokontrollierten, wirkstoffkontrollierten Crossover-Studie an 30 gesunden Probanden wurde unter 25 mg bzw. 200 mg Empagliflozin kein Anstieg der QTc beobachtet.
Postprandialer Glukosewert (2-Stunden-Wert)
Die Behandlung mit Empagliflozin als Add-on-Therapie zu Metformin oder zu Metformin und einem Sulfonylharnstoff führte nach 24 Wochen zu einer klinisch relevanten Abnahme des postprandialen 2-Stunden-Glukosewertes (Mahlzeittoleranztest) (Add-on-Therapie zu Metformin: Placebo +5,9 mg/dl [+0,33 mmol/l], Empagliflozin 10 mg: -46,0 mg/dl [-2,56 mmol/l]. Add-on-Therapie zu Metformin und einem Sulfonylharnstoff: Placebo -2,3 mg/dl [-0,13 mmol/l], Empagliflozin 10 mg: -35,7 mg/dl [1,98 mmol/l].
Patienten mit HbA1c-Ausgangswert ≥9%
In einer präspezifizierten Analyse von Patienten mit einem HbA1c-Ausgangswert ≥9,0%, führte die Behandlung mit Empagliflozin 10 mg als Zusatz zu Metformin zu einer statistisch signifikanten Reduktion des HbA1c in Woche 24 (korrigierte mittlere Veränderung gegenüber Baseline von -1,40% für Empagliflozin 10 mg und -0,44% für Placebo).
Körpergewicht
In einer präspezifizierten, gepoolten Analyse von 4 placebokontrollierten Studien führte die Behandlung mit Empagliflozin (68% aller Patienten erhielten Metformin als Basistherapie) nach 24 Woche zu einer Abnahme des Körpergewichts (-2,04 kg für Empagliflozin 10 mg und -0,24 kg für Placebo), die bis Woche 52 bestehen blieb (-1,96 kg für Empagliflozin 10 mg und -0,16 kg für Placebo).
Blutdruck
Die Wirksamkeit und Sicherheit von Empagliflozin wurde in einer 12-wöchigen doppelblinden, Placebokontrollierten Studie bei Patienten mit Typ 2 Diabetes mellitus und Bluthochdruck untersucht, die mit verschiedenen Antidiabetika und bis zu 2 Antihypertensiva behandelt wurden. Die Behandlung mit Empagliflozin einmal täglich führte zu einer statistisch signifikanten Verbesserung des HbA1c und des mit einem 24-Stunden-Monitoring gemessenen mittleren systolischen und diastolischen Blutdrucks (Tabelle 6). Die Behandlung mit Empagliflozin senkte den SBD und DBD im Sitzen.
Tabelle 6: Ergebnisse einer Placebokontrollierten Studie mit Empagliflozin an Patienten mit Typ 2 Diabetes mellitus und unkontrolliertem Blutdruck (Full Analysis Set) nach 12 Wochen (LOCF)
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
271
|
276
|
276
| |
HbA1c (%) in Woche 12
| |
Baseline (Mittelwert)
|
7,90
|
7,87
|
7,92
| |
Veränderung gegenüber Baseline1
|
0,03
|
-0,59
|
-0,62
| |
Unterschied zu Placebo1
(95% KI)
|
|
-0,62* (-0,72, -0,52)
|
-0,65* (-0,75, -0,55)
| |
24-Stunden-SBD in Woche 12
| |
Baseline (Mittelwert)
|
131,72
|
131,34
|
131,18
| |
Veränderung gegenüber Baseline1
|
0,48
|
-2,95
|
-3,68
| |
Unterschied zu Placebo1
(95% KI)
|
|
-3,44* (-4,78, -2,09)
|
-4,16* (-5,50, -2,83)
| |
24-Stunden-DBD in Woche 12
| |
Baseline (Mittelwert)
|
75,16
|
75,13
|
74,64
| |
Veränderung gegenüber Baseline1
|
0,32
|
-1,04
|
-1,40
| |
Unterschied zu Placebo1
(95% KI)
|
|
-1,36** (-2,15, -0,56)
|
-1,72* (-2,51, -0,93)
|
1 für Ausgangswert adjustierter Mittelwert
* p <0,0001
** p < 0,001
In einer präspezifizierten gepoolten Analyse von vier Placebokontrollierten Studien führte die Behandlung mit Empagliflozin in Woche 24 zu einer Senkung des systolischen Blutdrucks (Empagliflozin 10 mg: -3,9 mmHg) im Vergleich zu Placebo (-0,5 mmHg) und zu einer Senkung des diastolischen Blutdrucks (Empagliflozin 10 mg: -1,8 mmHg) im Vergleich zu Placebo (-0,5 mmHg); diese Verbesserungen blieben bis Woche 52 bestehen.
Laborparameter
Erhöhter Hämatokrit
In einer gepoolten Sicherheitsanalyse aller Studien mit Metformin als Basistherapie betrugen die mittleren Veränderungen des Hämatokrits gegenüber dem Ausgangswert 3,6% für Empagliflozin 10 mg und 4,0% für Empagliflozin 25 mg im Vergleich zu 0% für Plazebo. In der EMPA-REG-Outcome-Studie sanken die Hämatokritwerte nach einer Nachbeobachtungsphase von 30 Tagen nach Absetzen der Medikation auf die Ausgangswerte.
Erhöhte Serumlipide
In einer gepoolten Sicherheitsanalyse aller Studien mit Metformin als Basistherapie betrug der mittlere prozentuelle Anstieg gegenüber dem Ausgangswert für Empagliflozin 10 mg bzw. 25 mg im Vergleich zu Plazebo bei Gesamtcholesterin 5,0% bzw. 5,2% versus 3,7%; bei HDL-Cholesterin 4,6% bzw. 2,7% versus -0,5%; bei LDL-Cholesterin 9,1% bzw. 8,7% versus 7,8%; bei Triglyzeriden 5,4% bzw. 10,8% versus 12,1%.
Kinder und Jugendliche
Die klinische Wirksamkeit und Sicherheit von Empagliflozin 10 mg einmal täglich (mit einer möglichen Dosiserhöhung auf 25 mg einmal täglich) oder Linagliptin 5 mg einmal täglich wurde bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit Typ 2 Diabetes mellitus im Rahmen einer doppelblinden, randomisierten, placebokontrollierten Parallelgruppenstudie (DINAMO) über einen Zeitraum von 26 Wochen untersucht, mit einer doppelblinden sicherheitsbezogenen Verlängerungsphase der aktiven Behandlung zur Beurteilung der Sicherheit bis zu 52 Wochen.
Insgesamt 157 Patienten wurden entweder mit Empagliflozin (10 mg oder 25 mg; N = 52), Linagliptin (N = 52) oder Placebo (N = 53) behandelt. Zu den Hintergrundtherapien als Ergänzung zu diätetischen Massnahmen und körperlicher Aktivität gehörten Metformin allein (51 %), eine Kombination aus Metformin und Insulin (40,1 %), Insulin (3,2 %) oder aber es wurde keine Hintergrundtherapie verabreicht (5,7 %). Der mittlere HbA1c-Baselinewert lag bei 8,03 %. Die Studienpopulation umfasste 38,2 % männliche und 61,8 % weibliche Patienten bei einem Durchschnittsalter von 14,5 Jahren (Spanne: 10 bis 17 Jahre); 51,6 % waren mindestens 15 Jahre alt. Die Studienpopulation setzte sich ausserdem wie folgt zusammen: 49,7 % waren kaukasischer, 5,7 % asiatischer und 31,2 % afrikanischer/afroamerikanischer Herkunft. Der mittlere BMI betrug 36,04 kg/m², das mittlere Körpergewicht 99,92 kg. In die DINAMO-Studie wurden ausschliesslich Patienten mit einer eGFR ≥60 ml/min/1,73 m² aufgenommen.
Empagliflozin war Placebo hinsichtlich des primären Endpunkts – HbA1c-Reduktion nach 26 Wochen gegenüber Baseline – unabhängig von einer Rescue-Therapie oder einem Behandlungsabbruch, überlegen. Darüber hinaus führte die Behandlung mit Empagliflozin zu einer klinisch bedeutsamen FPG-Reduktion (Tabelle 7).
Tabelle 7: Ergebnisse einer 26-wöchigen, placebokontrollierten Studie zu Empagliflozin bei Kindern und Jugendlichen mit Typ 2 Diabetes mellitus (modifiziertes Intention-To-Treat-Set)
|
|
Placebo
|
Empagliflozin
(10 und 25 mg einmal täglich, gepoolt)
| |
N
|
53
|
52
| |
HbA1c (%)¹
| |
Baseline (Mittelwert)
|
8,05
|
8,00
| |
Veränderung gegenüber Baseline²
|
0,68
|
-0,17
| |
Unterschied zu Placebo² (95%-KI)
|
|
-0,84
(-1,50, -0,19)
| |
p-Wert für Überlegenheit
|
|
0,0116
| |
N
|
52
|
48
| |
FPG (mg/dl) [mmol/l] 3,4
| |
Baseline (Mittelwert)
|
158,6 [8,80]
|
154,4 [8,57]
| |
Veränderung gegenüber Baseline²
|
15,7 [0,87]
|
-19,5 [-1,08]
| |
Unterschied zu Placebo² (95%-KI)
|
|
-35,2 (-58,6, -11,7)
[-1,95 (-3,25, -0,65)]
| |
nominaler p-Wert
|
|
0,0035
|
¹ Mehrfachimputation mit 500 Iterationen für fehlende Daten
² Im Hinblick auf Baseline und Stratifizierung adjustierter Mittelwert
³ Last Observation Carried Forward (LOCF), einschliesslich Baseline-Werte
4 nicht im Hinblick auf statistische Signifikanz beurteilt; nicht Teil des sequenziellen Testverfahrens
|

