ZusammensetzungWirkstoffe
Isoleucin, Leucin, Lysin als Lysinmonohydrat, Methionin, Phenylalanin, Threonin, Tryptophan, Valin, Arginin, Histidin, Alanin, Aspartinsäure, Glutaminsäure, Glycin, Prolin, Serin, Glucose als Glucose-Monohydrat, Sojaöl, mittelkettige Triglyceride, Omega-3-Säurentriglyceride.
Hilfsstoffe
Citronensäure-Monohydrat, Eilecithin, Glycerol, Natriumoleat corresp. Natrium 4,5 mg/Liter, allracα-Tocopherol (E 307), Natriumhydroxid corresp. Natrium bis max. 6,9 mg/Liter (zur pH-Anpassung), Wasser für Injektionszwecke.
1000 ml Emulsion enthalten zusätzlich 0,49 mmol Natrium (als Natriumoleat und Natriumhydroxid).
Indikationen/AnwendungsmöglichkeitenZufuhr von Energie, essentiellen Fettsäuren einschliesslich Omega-3- und Omega-6-Fettsäuren, Aminosäuren und Flüssigkeiten im Rahmen einer parenteralen Ernährung bei Patienten mit mittelschwerem bis schwerem Katabolismus, wenn eine orale oder enterale Ernährung nicht möglich, unzureichend oder nicht angewendet werden darf.
Dosierung/AnwendungZur zentralvenösen Infusion.
Die Dosierung sollte an die individuellen Bedürfnisse der Patienten angepasst werden.
Es wird empfohlen, Omegaflex special ohne Elektrolyte kontinuierlich zu verabreichen.
Eine stufenweise Steigerung der Infusionsrate über die ersten 30 Minuten auf die gewünschte Infusionsrate beugt möglichen Komplikationen vor.
Erwachsene
Die Tageshöchstdosis beträgt 35 ml/kg KG entsprechend:
2,0 g Aminosäuren/kg KG und Tag,
5,04 g Glucose/kg KG und Tag,
1,4 g Fett/kg KG und Tag.
Die maximale Infusionsrate beträgt 1,7 ml/kg KG und Stunde entsprechend:
0,1 g Aminosäuren/kg KG und Stunde,
0,24 g Glucose/kg KG und Stunde,
0,07 g Fett/kg KG und Stunde.
Für einen Patienten mit 70 kg KG entspricht dies einer maximalen Infusionsrate von 119 ml pro Stunde. Die verabreichte Menge pro Stunde beträgt dann 6,8 g Aminosäuren, 17,1 g Glucose und 4,8 g Fett.
Patienten mit Leberfunktionsstörungen
Bei Patienten mit Leberinsuffizienz sollten die Dosen individuell angepasst werden (Siehe auch “Warnhinweise und Vorsichtsmassnahmen”).
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit Niereninsuffizienz sollten die Dosen individuell angepasst werden (Siehe auch “Warnhinweise und Vorsichtsmassnahmen”).
Patient mit intradialytischer parenteraler Ernährung (IDPN)
Die intradialytische parenterale Ernährung ist für nicht akut erkrankte, mangelernährte Dialysepatienten vorgesehen, bei denen eine Ernährungsberatung oder eine Behandlung mit oralen Nahrungsergänzungsmitteln unwirksam war. Die Auswahl des geeigneten Volumens Nutriflex Omega special ohne Elektrolyte für die IDPN sollte sich an der Diskrepanz zwischen der spontanen Zufuhr und der empfohlenen Zufuhr orientieren. Ausserdem muss die metabolische Toleranz berücksichtigt werden.
Für Nutriflex Omega special ohne Elektrolyte bei Patienten mit IDPN beträgt die maximale stündliche Infusionsgeschwindigkeit 2,3 ml/kg/Stunde, entsprechend
0,13 g/kg/Stunde Aminosäuren,
0,33 g/kg/Stunde Glukose,
0,092 g/kg/Stunde Lipide
über 4 Stunden.
Unter Berücksichtigung der bekannten Aminosäuren- (Retentionsrate 73 %) und Glucoseverluste (25 g/ 4 Stunden Dialysesitzung) während der Dialyse erhält der Patient 0,095 g/kg KG/h Aminosäuren, 0,24 g/kg KG/h Glucose und 0,095 g/kg KG/h Lipide. Dies entspricht für einen 70 kg (40 kg) schweren Patienten und eine vierstündige Dialysesitzung 27 g (15 g) Aminosäuren, 67 g (38 g) Glukose, 26 g (15 g) Lipide und 644 ml (368 ml) Flüssigkeit.
Kinder und Jugendliche
Neugeborene, Säuglinge und Kleinkindern im Alter von < 2 Jahren
Omegaflex special ohne Elektrolyte darf bei Neugeborenen, Säuglingen und Kleinkindern im Alter von < 2 Jahren nicht angewendet werden, bei denen die Aminosäure Cystein als bedingt essentiell angesehen wird (Siehe “Kontraindikationen”).
Kinder > 2 Jahre und Jugendliche
Es wurden keine klinischen Studien in der pädiatrischen Bevölkerungsgruppe durchgeführt.
Omegaflex special ohne Elektrolyte kann nur eine Grundversorgung mit Nährstoffen und Energie für pädiatrische Patienten bieten. Abhängig vom individuellem Bedarf kann eine Carnitin-Supplementierung bei pädiatrischen Patienten in Betracht gezogen werden, die voraussichtlich über mehr als 4 Wochen parenterale Ernährung erhalten. Die genaue Dosierung hängt vom Energieverbrauch des Patienten und seiner Fähigkeit, die Wirkstoffe von Omegaflex special ohne Elektrolyte zu verstoffwechseln, ab und muss individuell nach Alter, Körpergewicht, klinischem Zustand und Grunderkrankung angepasst werden.
Infolge des unterschiedlichen individuellen Bedarfs von Kindern und Jugendlichen reicht die Gabe von Omegaflex special ohne Elektrolyte bei manchen Patienten nicht aus, um den gesamten Energie-, Nährstoff-, Elektrolyt- und Flüssigkeitsbedarf zu decken. In solchen Fällen müssen zusätzlich Aminosäuren und/oder Kohlenhydrate und/oder Lipide und/oder Mineralstoffe und/oder Flüssigkeit in geeigneter Form zugeführt werden.
Bei der Berechnung der Dosierung muss der Hydratationszustand des pädiatrischen Patienten berücksichtigt werden.
Bei Kindern kann es erforderlich sein, die Ernährungstherapie mit der Hälfte der Zieldosierung zu beginnen. Die Dosierung sollte schrittweise entsprechend der individuellen Stoffwechselkapazität bis zum Maximalwert gesteigert werden.
Der tägliche Flüssigkeits-, Glukose- und Energiebedarf nimmt mit zunehmendem Alter ab. Daher werden zwei Altersgruppen, 2 bis 12 Jahre und 12 bis 18 Jahre, berücksichtigt.
Maximale Tagesdosis
Die maximale Tagesdosis hängt vom Alter und dem klinischen Zustand (akute Phase, stabile Phase und Erholungsphase) des Patienten ab.
Für Omegaflex special ohne Elektrolyte ist in der Altersgruppe von 2 bis ≤12 Jahren die Glucosekonzentration der begrenzende Faktor für die Tageshöchstdosis in der akuten Phase, die Aminosäurenkonzentration in der stabilen Phase und der Erholungsphase.
Bei Patienten im Alter von 12 bis 18 Jahren ist die Glukosekonzentration der begrenzende Faktor in allen klinischen Phasen.
Die sich daraus ergebenden Tageshöchstdosen sind in der nachstehenden Tabelle aufgeführt.
|
|
2 - ≤12 Jahre
|
12 - 18 Jahre
| |
|
Empfeh-lung
|
Omegaflex special ohne Elektrolyte
|
Empfeh-lung
|
Omegaflex special ohne Elektrolyte
| |
|
|
Phase
|
|
Phase
| |
|
|
akut
|
stabil
|
Erholung
|
|
akut
|
stabil
|
Erholung
| |
Maximale Tagesdosis (ml/kg/d)
|
|
25
|
35,5
|
|
9,5
|
20
|
24
| |
|
|
entsprechend
|
|
entsprechend
| |
Flüssigkeit (ml/kg/d)
|
60 - 100
|
25
|
35,5
|
35,5
|
50 - 70
|
9,5
|
20
|
24
| |
Aminosäuren (g/kg/d)
|
1,0 - 2,0
(2,5)
|
1,4
|
1,99
|
1,99
|
1,0 - 2,0
|
0,53
|
1,12
|
1,68
| |
Glukose (g/kg/d)
|
|
|
|
|
|
| |
akute Phase
|
1,4 - 3,6
|
3,6
|
-
|
-
|
0,7 - 1,4
|
1,37
|
-
|
-
| |
stabile Phase
|
2,2 - 5,8
|
-
|
5,11
|
1,4 - 2,9
|
-
|
2,88
|
-
| |
Erholungsphase
|
4,3 - 8,6
|
-
|
2,9 - 4,3
|
-
|
-
|
4,32
| |
Lipide (g/kg/d)
|
≤ 3
|
1,0
|
1,42
|
≤ 3
|
0,38
|
0,8
|
1,2
| |
Energie (kcal/kg/d)
|
|
|
|
|
|
| |
akute Phase
|
30 – 45
|
29,5
|
-
|
-
|
20 – 30
|
11,2
|
-
|
-
| |
stabile Phase
|
40 – 60
|
-
|
41,9
|
25 – 30
|
-
|
23,6
|
-
| |
Erholungsphase
|
55 - 75
|
-
|
30 - 55
|
-
|
-
|
35,4
|
Akute Phase = Reanimationsphase, während der der Patient lebensnotwendige Organunterstützung benötigt (Sedierung, mechanische Beatmung, Vasopressoren, Flüssigkeitsersatz); Stabile Phase = Der Patient ist stabil oder die lebensnotwendige Organunterstützung kann abgesetzt werden; Erholungsphase = Patient wird mobilisiert.
Maximale Infusionsgeschwindigkeit
Die maximale Infusionsgeschwindigkeit hängt vom Alter und dem klinischen Zustand (akute, stabile und Erholungsphase) des Patienten ab.
Für Omegaflex special ohne Elektrolyte ist in beiden Altersgruppen und allen klinischen Zuständen die Glucose-Infusionsgeschwindigkeit der begrenzende Faktor.
Die sich daraus ergebenden maximalen stündlichen Infusionsgeschwindigkeiten sind in der nachstehenden Tabelle aufgeführt.
|
|
|
2 - ≤12 Jahre
|
|
12 - 18 Jahre
| |
|
Empfeh-lung
|
Omegaflex special ohne Elektrolyte
|
Empfeh-lung
|
Omegaflex special ohne Elektrolyte
| |
|
|
Phase
|
|
Phase
| |
|
|
akut
|
stabil
|
Erholung
|
|
akut
|
stabil
|
Erholung
| |
Maximale Infusions-geschwindig-keit (ml/kg/h)
|
|
0,63
|
1,25
|
1,67
|
|
0,42
|
0,83
|
1,25
| |
|
|
entsprechend
|
|
entsprechend
| |
Aminosäuren (g/kg/h)
|
≤ 0,1
|
0,035
|
0,07
|
0,094
|
≤ 0,1
|
0,024
|
0,046
|
0,07
| |
Glukose (g/kg/h)
|
|
|
|
|
|
|
|
| |
akute Phase
|
0,09
|
0,09
|
-
|
-
|
0,03 – 0,06
|
0,06
|
-
|
-
| |
stabile Phase
|
0,09 – 0,18
|
-
|
0,18
|
-
|
0,06 – 0,12
|
-
|
0,12
|
-
| |
Erholungsphase
|
0,18 – 0,24
|
-
|
-
|
0,24
|
0,12 – 0,18
|
-
|
-
|
0,18
| |
Lipide (g/kg/h)
|
≤ 0,15
|
0,025
|
0,05
|
0,067
|
≤ 0,15
|
0,017
|
0,033
|
0,05
|
Therapiedauer
Die Therapiedauer im Rahmen der genannten Indikationen ist nicht begrenzt.
Bei Verabreichung von Omegaflex special ohne Elektrolyte ist die Zufuhr einer ausreichenden Menge an Elektrolyten, Spurenelementen und Vitaminen erforderlich.
Art der Anwendung
Intravenöse Anwendung.
Bei intradialytischer parenteraler Ernährung (IDPN) sollte der Beutel über die venöse Tropfkammer der extrakorporalen Kreislaufleitungen verabreicht werden.
Kontraindikationen·Überempfindlichkeit gegen die Wirkstoffe, gegenüber Ei-, Fisch-, Erdnuss oder Sojaprotein oder einen anderen der Hilfsstoffe gemäss Zusammensetzung
·Angeborene Aminosäurenstoffwechselstörungen
·Schwere Hypertriglyzeridämie (≥ 1000 mg/dl oder 11,4 mmol/l)
·Schwere Gerinnungsstörung
·Hyperglykämie, die nicht auf Insulindosen von bis zu 6 Einheiten Insulin/Stunde anspricht
·Azidose
·Intrahepatische Cholestase
·Schwere Leberinsuffizienz
·Schwere Niereninsuffizienz, wenn keine Dialyseeinrichtungen vorhanden sind
·Gravierende hämorrhagische Diathesen
·Nicht behandelter Diabetes insipidus
·Akute thromboembolische Ereignisse, Fettembolie
Auf Grund seiner Zusammensetzung darf Omegaflex special ohne Elektrolyte nicht bei Neugeborenen, Säuglingen und Kleinkindern bis zu einem Alter von 2 Jahren angewendet werden.
Allgemeine Gegenanzeigen einer parenteralen Ernährung sind unter anderem:
·Instabile Kreislaufverhältnisse mit vitaler Bedrohung (Kollaps- und Schockzustände)
·Akutphasen von Herzinfarkt und Schlaganfall
·Instabiler Stoffwechsellage (z.B. schweres Postaggressionssyndrom, Koma ungeklärter Ursache, entgleiste diabetische Stoffwechsellage)
·Unzureichende zelluläre Sauerstoffversorgung
·Störungen des Elektrolyt- und Flüssigkeitshaushalts (z.B. Hypokaliämie, Hyponatriämie)
·Akutes Lungenödem
·Dekompensierte Herzinsuffizienz
Warnhinweise und VorsichtsmassnahmenBei erhöhter Osmolarität des Serums ist Vorsicht geboten.
Störungen des Flüssigkeits-, Elektrolyt- oder Säuren-Basen-Haushalts müssen vor Infusionsbeginn behoben werden.
Eine zu schnelle Infusion kann zu einer Flüssigkeitsüberladung mit pathologischen Serumelektrolytkonzentrationen, Hyperhydratation und Lungenödem führen.
Jedes Anzeichen oder Symptome einer anaphylaktischen Reaktion (wie Fieber, Schüttelfrost, Hautausschlag oder Dyspnoe) sollte zu einer sofortigen Unterbrechung der Infusion führen.
Kontrollen der Serumelektrolyte, des Wasserhaushalts, des Säure-Basen-Gleichgewichts und des Blutbilds, des Gerinnungsstatus sowie der Leberund Nierenfunktion sind erforderlich.
Omegaflex special ohne Elektrolyte ist nahezu elektrolytfrei und wird daher insbesondere bei Patienten mit eingeschränkten und/oder speziellen Elektrolytanforderungen angewendet.
Natrium, Calcium, Magnesium und Phosphat sollten gemäss den mit dem klinischen Zustand verbundenen spezifischen Anforderungen ersetzt werden. Eine engmaschige Überwachung der Elektrolytspiegel ist erforderlich.
Das Refeeding-Syndrom oder die Repletion von mangel- oder unterernährten Patienten kann eine Hypokaliämie, Hypophosphatämie und Hypomagnesiämie verursachen. Eine engmaschige Überwachung der Serumelektrolyte ist unbedingt erforderlich. Bei Abweichung der Elektrolytkonzentrationen von den Normwerten ist eine entsprechende Supplementierung notwendig.
Während der Infusion von Omegaflex special ohne Elektrolyte sollte der Serumtriglyceridspiegel überwacht werden.
Abhängig von der Stoffwechsellage des Patienten kann gelegentlich eine Hypertriglyceridämie auftreten. Wenn die Triglyceridkonzentration im Plasma während der Verabreichung von Lipiden 4,6 mmol/l (400 mg/dl) übersteigt, wird empfohlen, die Infusionsrate zu reduzieren. Bei weiter ansteigenden Werten muss ein Abbruch der Infusion erwogen werden, da ab 11,4 mmol/l das Risiko einer Pankreatitis ansteigt.
Patienten mit Fettstoffwechselstörungen
Omegaflex special ohne Elektrolyte sollte bei Patienten mit Störungen des Fettstoffwechsels mit erhöhten Serumtriglyceriden, z.B. Niereninsuffizienz, Diabetes mellitus, Pankreatitis, beeinträchtigter Leberfunktion, Hypothyreose (mit Hypertriglyzeridämie), Sepsis und metabolischem Syndrom (Kombination von Diabetes, hohem Blutdruck und Übergewicht) vorsichtig angewendet werden. Wenn Omegaflex special ohne Elektrolyte an Patienten mit diesen Erkrankungen verabreicht wird, ist eine häufigere Überwachung der Serumtriglyceride notwendig, um die Triglyceridelimination und stabile Triglyceridspiegel unter 4,6 mmol/l (400 mg/dl) sicherzustellen.
Bei kombinierten Hyperlipidämien und beim metabolischen Syndrom reagieren die Triglyceridwerte auf Glucose, Fette und Überernährung. Die Dosis ist in diesen Fällen entsprechend anzupassen. Andere Fett- und Glucosequellen sowie Drogen und Arzneimittel, die den Stoffwechsel des Patienten beeinträchtigen, müssen bestimmt und überwacht werden.
Das Auftreten einer Hypertriglyzeridämie 12 Stunden nach Verabreichung von Lipiden ist ebenfalls ein Hinweis auf eine Fettstoffwechselstörung.
Wie bei allen kohlenhydrathaltigen Lösungen kann die Verabreichung von Omegaflex special ohne Elektrolyte zu einer Hyperglykämie führen. Der Blutzuckerspiegel sollte daher überwacht werden. Bei Auftreten einer Hyperglykämie sollte die Infusionsrate reduziert oder Insulin verabreicht werden. Wenn der Patient begleitend andere intravenöse Glucoselösungen erhält, muss die Menge der zusätzlich verabreichten Glucose berücksichtigt werden.
Eine Unterbrechung der Infusion der Emulsion kann angezeigt sein, wenn der Blutzuckerspiegel während der Verabreichung auf über 14 mmol/l (250 mg/dl) steigt.
Spurenelemente und Vitamine sollten gemäss den Ernährungs- und klinischen Anforderungen ergänzt werden.
Omegaflex special ohne Elektrolyte sollte wegen der Gefahr einer Pseudoagglutination nicht zusammen mit Blut über dasselbe Infusionssystem verabreicht werden.
Omegaflex special ohne Elektrolyte ist ein komplex zusammengesetztes Präparat.
Es wird daher dringend angeraten, keine anderen Lösungen zuzugeben (sofern deren Kompatibilität nicht erwiesen ist, siehe Rubrik “sonstige Hinweise, Kompatibität”).
Wie bei allen Lösungen zur intravenösen Anwendung, insbesondere Lösungen zur parenteralen Ernährung, sind bei der Infusion von Omegaflex special ohne Elektrolyte streng aseptische Bedingungen einzuhalten.
Ältere Patienten:
Grundsätzlich gilt die gleiche Dosierung wie für Erwachsene, jedoch ist bei Patienten mit weiteren Erkrankungen wie Herz- oder Niereninsuffizienz, die häufig mit fortgeschrittenem Lebensalter verbunden sein können, Vorsicht geboten.
Patienten mit Diabetes mellitus, beeinträchtigter Herz- oder Nierenfunktion
Wie alle grossvolumigen Infusionslösungen sollte Omegaflex special ohne Elektrolyte bei Patienten mit eingeschränkter Herz- oder Nierenfunktion mit Vorsicht verabreicht werden.
Es liegen nur begrenzte Erfahrungen zur Anwendung bei Patienten mit Diabetes mellitus oder Niereninsuffizienz vor.
Bei Patienten mit Niereninsuffizienz ist eine engmaschige Überwachung der Phosphatspiegel erforderlich, um eine Hyperphosphatämie zu verhindern. Im Gegensatz dazu ist bei Patienten mit kontinuierlicher Nierenersatztherapie eine regelmässige Überwachung und eine adäquate Substitution von Phosphat notwendig, um eine Hypophosphatämie zu verhindern.
InteraktionenEinige Arzneimittel wie z.B. Insulin können das Lipasesystem des Körpers beeinflussen.
Diese Wechselwirkung ist jedoch nur von untergeordneter klinischer Bedeutung.
In klinischen Dosen verabreichtes Heparin führt zu einer vorübergehenden Freisetzung von Lipoproteinlipase in den Blutkreislauf. Dies kann anfänglich zu einem Anstieg der Plasmalipolyse führen, gefolgt von einer vorübergehenden Abnahme der Triglycerid-Clearance.
Sojaöl hat einem natürlichen Gehalt an Vitamin K1. Dies kann die therapeutische Wirkung von Cumarin-Derivaten beeinflussen, die bei mit solchen Arzneimitteln behandelten Patienten engmaschig überwacht werden sollte.
Schwangerschaft, StillzeitSchwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von Omegaflex special ohne Elektrolyte bei Schwangeren vor. Es liegen keine ausreichenden tierexperimentellen Studien in Bezug auf eine Reproduktionstoxizität vor (siehe “Präklinische Daten”).
Eine parenterale Ernährung kann während der Schwangerschaft notwendig werden. Omegaflex special ohne Elektrolyte sollte an Schwangere nur nach sorgfältiger Abwägung verabreicht werden.
Stillzeit
Bestandteile/Metabolite werden in die Muttermilch ausgeschieden, aber bei therapeutischen Dosen von Omegaflex special ohne Elektrolyte sind keine Auswirkungen auf gestillte Neugeborene/Kinder zu erwarten. Dennoch wird das Stillen nicht empfohlen, wenn Mütter eine parenterale Ernährung erhalten.
Fertilität
Es liegen keine Daten zur Anwendung von Omegaflex special ohne Elektrolyte vor.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenNicht zutreffend.
Unerwünschte WirkungenMögliche Frühreaktionen bei Applikation von Fettemulsionen sind: geringer Temperaturanstieg, Hitzegefühl, Kältegefühl, Schüttelfrost, Appetitlosigkeit, Übelkeit, Erbrechen, Atemnot, Kopf-, Rücken-, Knochen-, Brust- und Lendenschmerzen, Blutdruckabfall oder -anstieg (Hypotonie, Hypertonie), Überempfindlichkeitsreaktionen (z.B. anaphylaktoide Reaktionen, Hautausschlag).
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
„sehr häufig“ (≥1/10)
„häufig“ (≥1/100, <1/10)
„gelegentlich“ (≥1/1‘000, <1/100)
„selten“ (≥1/10‘000, <1/1‘000)
„sehr selten“ (<1/10‘000)
„nicht bekannt“ (kann aus den verfügbaren Daten nicht abgeschätzt werden)
Die folgende Auflistung enthält eine Reihe systemischer Reaktionen, die mit der Anwendung von Omegaflex special ohne Elektrolyte im Zusammenhang stehen können. Bei Bestimmungsgemässer Anwendung bezüglich der Dosierungsüberwachung und Beachtung der Sicherheitshinweise und Anwendungsbeschränkungen treten diese meistens selten auf (≥ 1/10.000 bis < 1/1.000).
Erkrankungen des Blut- und Lymphsystems
Selten: Hyperkoagulation.
Nicht bekannt: Leukopenie, Thrombocytopenie.
Erkrankungen des Immunsystems
Selten: Allergische Reaktionen (z.B. anaphylaktische Reaktionen, Hautausschläge, Larynxödem, Mund- und Gesichtsödem).
Stoffwechsel- und Ernährungsstörungen
Sehr selten: Hyperlipämie, Hyperglykämie, metabolische Azidose. Die Häufigkeit dieser unerwünschten Wirkungen ist dosisabhängig und kann bei absoluter oder relativer Fettüberdosierung erhöht sein.
Erkrankungen des Nervensystems
Selten: Kopfschmerz, Benommenheit.
Gefässerkrankungen
Selten: Hypertonie oder Hypotonie, Hautrötung (Flush).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Selten: Dyspnoe, Zyanose.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Übelkeit, Erbrechen, Appetitlosigkeit.
Leber- und Gallenerkrankungen
Nicht bekannt: Cholestase.
Erkrankungen der Haut und des Unterhautzellgewebes
Selten: Erythem, Schwitzen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Selten: Schmerzen im Rücken, Knochen, Brustkorb und Lumbalbereich.
Erkrankungen der Nieren und Harnwege
Dosisabhängig: osmotische Diurese.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Selten: erhöhte Körpertemperatur, Kältegefühl, Schüttelfrost.
Sehr selten: Fettüberladungssyndrom (siehe Beschreibung unten).
Bei Auftreten von unerwünschten Wirkungen muss die Infusion beendet werden.
Bei Werten über 4,6 mmol/l (400 mg/dl) muss die Infusion mit einer reduzierten Dosierung fortgesetzt werden. Bei weiter ansteigenden Werten muss ein Abbruch der Infusion erwogen werden, da ab 11.4 mmol/l das Risiko einer Pankreatitis ansteigt.
Wenn die Infusion wiederaufgenommen wird, sollte der Patient besonders zu Beginn sorgfältig überwacht werden und die Serumtriglyceride sollten in kurzen Zeitabständen bestimmt werden.
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Übelkeit, Erbrechen und Appetitlosigkeit sind Symptome, die oft mit Erkrankungen in Zusammenhang stehen, bei denen eine parenterale Ernährung durchgeführt wird, und können gleichzeitig mit der parenteralen Ernährung assoziiert sein.
Fettüberladungssyndrom
Die eingeschränkte Fähigkeit zur Elimination von Triglyceriden kann ein Fettüberladungssyndrom zur Folge haben, das durch eine Überdosierung verursacht werden kann. Auf mögliche Anzeichen einer Stoffwechselüberlastung muss geachtet werden. Die Ursache kann genetisch bedingt sein (individuell unterschiedlicher Stoffwechsel) oder der Fettstoffwechsel kann durch aktuelle oder frühere Erkrankungen beeinträchtigt sein. Dieses Syndrom kann auch bei schwerer Hypertriglyceridämie auftreten, sogar bei der empfohlenen Infusionsrate, sowie in Zusammenhang mit einer plötzlichen Veränderung des klinischen Zustandes des Patienten wie z.B. Beeinträchtigung der Nierenfunktion oder Infektion. Das Fettüberlastungssyndrom ist charakterisiert durch Hyperlipidämie, Fieber, Fetteinlagerung, Hepatomegalie mit oder ohne Ikterus, Splenomegalie, Anämie, Leukopenie, Thrombozytopenie, Gerinnungsstörungen, Hämolyse und Retikulozytose, anormale Leberfunktionswerte und Koma.
Die Symptome sind in der Regel nach Absetzen der Infusion der Fettemulsion reversibel.
Bei Anzeichen eines Fettüberladungssyndroms ist die Infusion von Omegaflex special ohne Elektrolyte sofort zu beenden.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Flüssigkeitsüberdosierung:
Hyperhydration, Störungen des Elektrolythaushalts und Lungenödem.
Aminosäurenüberdosierung:
Renaler Aminosäurenverlust mit nachfolgenden Störungen des Aminosäurenhaushalts, Übelkeit, Erbrechen und Schüttelfrost.
Glucoseüberdosierung:
Hyperglykämie, Glucosurie, Dehydration, Hyperosmolarität, hyperglykämisch-hyperosmolares Koma.
Fettüberdosierung:
Siehe “Unerwünschte Wirkungen”.
Behandlung
Bei einer Überdosierung muss die Infusion sofort beendet werden. Weitere therapeutische Massnahmen hängen von den jeweiligen Symptomen und deren Schweregrad ab. Bei Wiederaufnahme der Infusion nach Abklingen der Symptome wird empfohlen, die Infusionsrate unter häufiger Überwachung langsam zu erhöhen.
Eigenschaften/WirkungenATC-Code
B05BA10
Lösungen zur parenteralen Ernährung, Kombinationen.
Wirkungsmechanismus
Eine parenterale Ernährung dient zur Zufuhr aller notwendigen Nährstoffe und von Energie für das Wachstum und/oder die Regeneration der Gewebe sowie für die Aufrechterhaltung sämtlicher Körperfunktionen.
Fette sind aufgrund ihrer hohen Energiedichte effiziente Energielieferanten. Langkettige Triglyceride versorgen den Organismus mit essentiellen Fettsäuren für die Synthese von Zellbestandteilen. Für diese Zwecke enthält die Fettemulsion mittelkettige und langkettige Triglyceride (aus Sojaöl und Fischöl).
Der Anteil der langkettigen Triglyceride enthält Omega-6 und Omega-3-Triglyceride für die Zufuhr von mehrfach ungesättigten Fettsäuren. Sie dienen primär zur Prävention und Behandlung eines Mangels an essentiellen Fettsäuren, aber auch als Energielieferant.
Omegaflex special ohne Elektrolyte enthält Omega-6-Fettsäuren, hauptsächlich in Form von Linolsäure, und Omega-3 Fettsäuren in Form von alpha-Linolensäure, Eicosapentaensäure und Docosahexaensäure. Das Verhältnis von Omega-6- zu Omega-3-Fettsäuren in Omegaflex special ohne Elektrolyte beträgt etwa 2,5:1.
Pharmakodynamik
Keine Angaben
Klinische Wirksamkeit
Keine Angaben
PharmakokinetikAbsorption
Keine Angaben.
Distribution
Dosis, Infusionsrate, Stoffwechsellage und individuelle Faktoren des Patienten (Dauer der Nahrungskarenz) sind von entscheidender Bedeutung für die erreichten maximalen Triglyceridkonzentrationen. Bei bestimmungsgemässer Anwendung und Beachtung der Dosierungsrichtlinien überschreiten die Triglyceridkonzentrationen im Allgemeinen 4,6 mmol/l (400 mg/dl) nicht.
Mittelkettige Fettsauren weisen eine geringe Affinität zu Albumin auf
Metabolismus
Keine Angaben.
Elimination
Sowohl Triglyceride aus Sojaöl als auch die mittelkettige Triglyceride werden vollständig zu CO2 und H2O abgebaut. Es findet nahezu keine Ausscheidung über die Nieren statt.
Kinetik spezieller Patientengruppen
Keine Angaben.
Präklinische DatenEs wurden keine präklinischen Studien mit Omegaflex special ohne Elektrolyte durchgeführt.
Bei Nährstoffmischungen, die zur Substitutionstherapie in der empfohlenen Dosierung verabreicht werden, sind keine toxischen Wirkungen zu erwarten.
Reproduktionstoxizität
In verschiedenen Pflanzenölen, besonders in Sojaöl, können Phytoöstrogene wie ß-Sitosterol enthalten sein. Bei Ratten und Kaninchen wurde nach subkutaner und intravaginaler Verabreichung von ß-Sitosterol eine Beeinträchtigung der Fertilität beobachtet. Nach Verabreichung von reinem ß-Sitosterol wurde eine Abnahme des Hodengewichts und eine Reduktion der Spermienkonzentration bei männlichen Ratten sowie eine geringere Schwangerschaftsrate bei weiblichen Kaninchen festgestellt. Nach dem gegenwärtigen Erkenntnisstand scheinen die bei Tieren beobachteten Wirkungen jedoch keine Relevanz für die klinische Anwendung zu haben.
Sonstige HinweiseInkompatibilitäten
Omegaflex special ohne Elektrolyte ist ein komplex zusammengesetztes Präparat. Es wird daher grundsätzlich von der Zugabe von Zusätzen abgeraten.
Es sind verschiedene Mischungen mit Zusätzen (z.B. Vitamine, Spurenelemente, Elektrolyte) unter bestimmten Bedingungen geprüft worden. Genauere Angaben dazu sind beim Hersteller zu erfragen.
Beeinflussung diagnostischer Methoden
Der Fettgehalt kann bestimmte Laborwertmessungen beeinflussen (z.B. Bilirubin, Laktatdehydrogenase, Sauerstoffsättigung), wenn Blutproben entnommen werden, bevor das Fett ausreichend aus dem Blut entfernt wurde.
Haltbarkeit
Omegaflex special ohne Elektrolyte darf nur bis zu dem auf dem Behälter mit „Exp” bezeichneten Verfalldatum verwendet werden.
Haltbarkeit nach Anbruch
Nach Entfernen der Schutzhülle und Mischen des Beutelinhalts
Die Stabilität der gebrauchsfertigen Mischung von Aminosäuren, Glucose und Fett wurde über 7 Tage bei 2-8 °C und zusätzlich über 2 Tage bei 25 °C geprüft und nachgewiesen.
Nach Beimischung von kompatiblen Zusatzstoffen:
Aus mikrobiologischer Sicht sollte das Produkt nach Beimischung von Zusatzstoffen sofort verwendet werden. Wenn es nicht sofort nach der Beimischung von Zusatzstoffen verwendet wird, liegen die Aufbewahrungszeiten und –Bedingungen vor der Anwendung in der Verantwortung des Anwenders.
Nach Anbruch des Behältnisses (Durchstechen des Infusionsports)
Nach Anbruch des Behältnisses muss die Emulsion sofort verwendet werden.
Besondere Lagerungshinweise
Nicht über 25 °C lagern. Nicht einfrieren. Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Hinweise für die Handhabung
Keine besonderen Anforderungen für die Beseitigung.
Produkte für die parenterale Ernährung sollten vor der Anwendung visuell auf Beschädigung, Verfärbung und Instabilität der Emulsion geprüft werden. Nur unbeschädigte Beutel verwenden; weder Schutzhülle noch Innenbeutel dürfen beschädigt sein. Nur verwenden, wenn die Peelnähte zwischen den Kammern intakt sind, die Aminosäuren- und Glucoselösungen klar und farblos bis schwach gelblich sind und die Emulsion eine milchig-weisse homogene Flüssigkeit ist. Nicht verwenden, wenn die Lösungen verfärbt sind oder Partikel enthalten. Nicht verwenden, wenn die Emulsion Anzeichen einer Phasentrennung (Öltropfen, Ölschicht) aufweist.
Vor Öffnen der Schutzhülle die Farbe des Sauerstoffindikators kontrollieren (siehe Abbildung A).
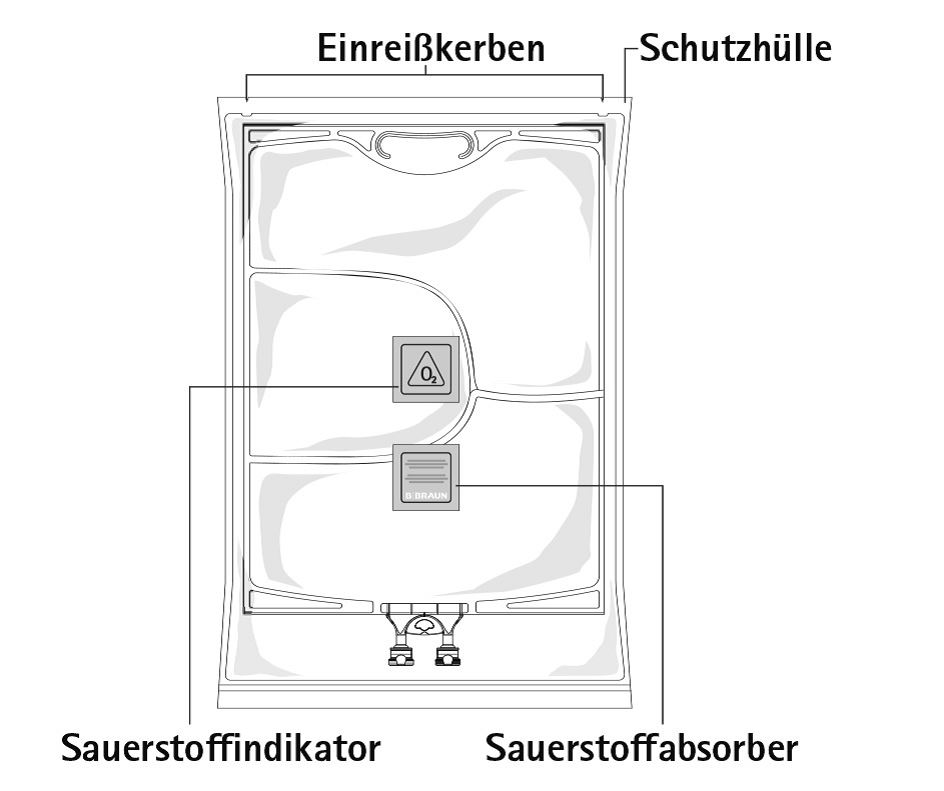
Abb. A
Nicht verwenden, wenn der Sauerstoffindikator rosa gefärbt ist. Nur verwenden, wenn der Sauerstoffindikator gelb gefärbt ist.
Herstellung der Mischemulsion
Die Regeln der aseptischen Handhabung müssen strikt eingehalten werden.
Zum Öffnen: Die Schutzhülle beginnend an den Einreisskerben aufreissen (Abb. 1). Den Beutel aus der Schutzhülle nehmen. Schutzhülle, Sauerstoffindikator und Sauerstoffabsorber verwerfen.
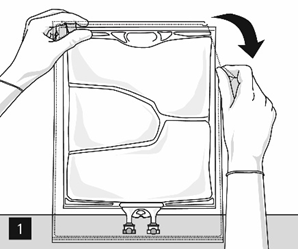
Den Innenbeutel visuell auf Undichtigkeiten prüfen. Undichte Beutel müssen verworfen werden, da die Sterilität nicht gewährleistet werden kann.
Mischen des Beutelinhalts und Zugabe von Zusatzstoffen
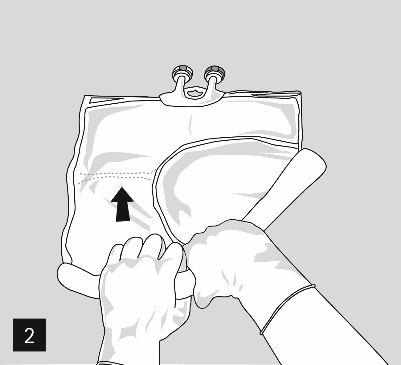
Um die Kammern der Reihe nach zu öffnen und ihren Inhalt zu mischen, den Beutel mit beiden Händen aufrollen; dabei mit dem Öffnen der Peelnaht beginnen, welche die obere Kammer (Glucose) und die untere Kammer (Aminosäuren) trennt (Abb. 2).
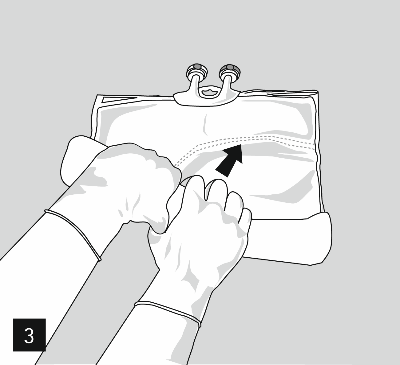
Danach weiterhin Druck ausüben, so dass sich die Peelnaht, welche die mittlere Kammer (Fette) und die untere Kammer trennt, öffnet (Abb. 3).
Nach Mischen aller Kammern und Entfernen des Aluminiumverschlusses (Abb. 3A) können über den Medikationsport kompatible Zusatzstoffe hinzugefügt werden (Abb. 4).
Den Inhalt des Beutels gründlich mischen (Abb. 5) und die Mischung visuell prüfen (Abb. 6).
Es dürfen keine Anzeichen einer Phasentrennung der Emulsion erkennbar sein.
Die Mischung ist eine milchig-weisse homogene Öl-in-Wasser-Emulsion.
Vorbereitung zur Infusion
Die Emulsion sollte vor der Infusion stets auf Raumtemperatur gebracht werden.
Die Aluminiumfolie vom Infusionsport entfernen (Abb. 7) und das Infusionsbesteck befestigen (Abb. 8). Ein unbelüftetes Infusionsbesteck verwenden oder bei Verwendung eines belüfteten Infusionsbestecks das Entlüftungsventil schliessen.
Den Beutel an einen Infusionsständer hängen (Abb. 9) und die Infusion entsprechend der Standardtechnik durchführen.
Nur zum Einmalgebrauch bestimmt. Das Behältnis und nicht verbrauchte Reste müssen nach der Verwendung verworfen werden.
Teilweise verbrauchte Behältnisse nicht wieder an ein Infusionssystem anschliessen.
Wenn Filter verwendet werden, müssen diese lipiddurchlässig sein (Porengrösse ≥ 1,2 μm).
Zulassungsnummer65726 (Swissmedic)
PackungenOmegaflex special ohne Elektrolyte wird in flexiblen Mehrkammer-Polypropylenbeuteln geliefert:
5 x 625 ml (B),
5 x 1250 ml (B)
5 x 1875 ml (B)
ZulassungsinhaberinB. Braun Medical AG
Sempach.
Stand der InformationJanuar 2025
|









