ZusammensetzungWirkstoffe:
Mutter- und Tochternuklid:
Mutterradionuklid: 99Mo
Tochterradionuklid: 99mTc
Hilfsstoffe:
Material der Chromatographiesäule:
·Chromatographiesäule aus Glas, die Aluminiumoxid enthält
·Salpetersäure zur pH-Wert-Einstellung
·Natriumhydroxid zur pH-Wert-Einstellung
1 ml Natrium[99mTc]pertechnetat-Lösung enthält 3,6 mg Natrium.
Abhängig vom Zeitpunkt der Verabreichung der Injektion kann der dem Patienten verabreichte Natriumgehalt in manchen Fällen grösser als 1 mmol (23 mg) sein. Bei Patienten, die eine kochsalzarme Diät einhalten müssen, ist dies zu berücksichtigen.
Durchstechflaschen mit antibakterieller Lösung:
·Benzododeciniumbromid
·Wasser für Injektionszwecke
Durchstechflaschen mit Elutionslösung:
·Natriumchlorid
·Wasser für Injektionszwecke
evakuierte Durchstechflaschen
Spezifikationen
Reinheit des Radionuklids (Monographie 0124 „Natrium[99mTc]pertechnetat-Injektionslösung aus Kernspaltprodukten“ der Europäischen Pharmakopöe, aktuelle Ausgabe):
• Jod-131: maximal 5 × 10-3 Prozent der Gesamtradioaktivität
• Molybdän-99: maximal 0,1 Prozent der Gesamtradioaktivität corresp. Max. 1 kBq 99Mo/MBq 99mTc
• Ruthenium-103: maximal 5 × 10-3 Prozent der Gesamtradioaktivität
• Strontium-89: maximal 6 × 10-6 Prozent der Gesamtradioaktivität
• Strontium-90: maximal 6 × 10-6 Prozent der Gesamtradioaktivität
• Andere Gammastrahlen emittierende Radionuklide: maximal 0,01 Prozent der Gesamtradioaktivität
• Alphastrahlen emittierende Radionuklide: maximal 1 × 10 -7Prozent der Gesamtradioaktivität
Radiochemische Reinheit (Monographie 0124 „Natrium[99mTc]pertechnetat-Injektionslösung aus Kernspaltprodukten“ der Europäischen Pharmakopöe, aktuelle Ausgabe)
[99mTc]Pertechnetat-Ion: mindestens 95 % der Gesamtradioaktivität durch Technetium-99m
Indikationen/AnwendungsmöglichkeitenDieses Arzneimittel ist ein Diagnostikum.
Das Eluat (Natrium[99mTc]pertechnetat-Injektionslösung) aus dem Radionuklidgenerator wird angewendet zur
·Radiomarkierung von Kits für radioaktive Arzneimittel, die speziell für die radioaktive Markierung mit einer derartigen Lösung entwickelt und zugelassen wurden.
·Schilddrüsen-Szintigraphie: Direkte Darstellung und Messung der Schilddrüsenaufnahme, zum Erhalt von Informationen über Größe, Lage, Nodularität und Funktion der Drüse bei Schilddrüsenerkrankungen.
·Speicheldrüsen-Szintigraphie: Diagnostik chronischer Sialadenitiden (z. B. Sjögren Syndrom) sowie Beurteilung der Speicheldrüsenfunktion und der Durchgängigkeit des Speichelganges bei Erkrankungen der Speicheldrüsen
·Lokalisation ektopischer Magenschleimhaut (Meckel-Divertikel).
·Tränenweg-Szintigraphie: zur Beurteilung funktioneller Störungen des Tränenflusses und Erfolgskontrolle nach therapeutischen Massnahmen.
Dosierung/AnwendungDieses Arzneimittel darf nur in nuklearmedizinischen Einrichtungen durch befugtes Personal angewendet werden.
Dosierung
Wenn Natrium[99mTc]pertechnetat intravenös verabreicht wird, können die (verabreichten) Aktivitäten in Abhängigkeit von der erforderlichen klinischen Information und den verwendeten Geräten breit variieren. Die Injektion von Aktivitäten, die über den lokalen diagnostischen Referenzwerten liegen, ist für die betreffende Indikation zu rechtfertigen. Folgende Aktivitäten werden empfohlen:
Erwachsene (70 kg) und ältere Patienten
·Schilddrüsen-Szintigraphie: 20-80 MBq (1MBq/kg)
·Speicheldrüsen-Szintigraphie: 30-150 MBq (2MBq/kg)
·Szintigraphie des Meckel-Divertikels: 200 MBq (2MBq/kg)
·Tränenweg-Szintigraphie: 2-4 MBq pro Tropfen pro Auge
Tabelle DRW gemäss L-08-01 (BAG)
|
Untersuchung
|
DRW (Aktivität) für 70 kg [MBq]
| |
Schilddrüse
|
75
| |
Meckel-Divertikel
|
180
|
Eingeschränkte Nierenfunktion
Bei diesen Patienten ist eine sorgfältige Abwägung der zu verabreichenden Aktivität erforderlich, da bei diesen Patienten ein erhöhtes Strahlenexpositionsrisiko besteht.
Kinder und Jugendliche
Die Anwendung bei Kindern und Jugendlichen sollte unter Berücksichtigung der klinischen Notwendigkeit und Beurteilung des Nutzen-Risiko-Verhältnisses in dieser Patientengruppe sorgfältig abgewogen werden.
Bei Kindern und Jugendlichen muss die zu verabreichende Aktivität angepasst werden und kann gemäß den Empfehlungen der Dosierungskarte für Kinder der Europäischen Gesellschaft für Nuklearmedizin (EANM, 1.2.2014und „joint EANM/SNM recommendations) berechnet werden. Die minimal verwendeten Aktivitäten können je nach verwendeter Kamera und Kollimator gesenkt werden. Die bei Kindern und Jugendlichen zu verabreichenden Aktivitäten können durch Multiplikation der Basisaktivitäten (für Kalkulationszwecke) mit dem entsprechenden gewichtsabhängigen Korrekturfaktor errechnet werden (siehe Tabelle 2).
A[MBq]verabreicht = Basisaktivität × Faktor
Schilddrüsen-Szintigraphie: verabreichte Aktivität [MBq] = 5,6 MBq x Korrekturfaktor (Tabelle 2). Die minimal verwendete Aktivität (10MBq) sollte gesenkt werden können, wenn die richtige Ausrüstung verwendet wird und Diagnosebilder mit 4 MBq bei Neugeborenen erhalten werden.
Nachweis/Lokalisierung ektopischer Magenschleimhaut: Verabreichte Aktivität [MBq] = 10,5 MBq x Korrekturfaktor (Tabelle 2). Eine Mindestaktivität von 20 MBq ist erforderlich, um eine ausreichende Bildqualität zu erzielen.
Tabelle 1:
Baseline Activity für die Anwendung bei Kindern (für Schilddrüsen-Szintigraphie und Nachweis/Lokalisierung ektopischer Magenschleimhaut) entsprechend EANM-Richtlinie (Februar 2014)
|
Indikation
|
Baseline Activity
|
Minimal empfohlene Aktivität
| |
Ektopische Magenschleimhaut
|
10.5
|
20
| |
Schilddrüse
|
5.6
|
10
|
Tabelle 2: Gewichtsabhängige Korrekturfaktoren für die Anwendung bei Kindern (für Schilddrüsen-Szintigraphie und Nachweis/Lokalisierung ektopischer Magenschleimhaut) entsprechend EANM-Richtlinie (Februar 2014)
|
Gewicht
[kg]
|
Faktor
|
Gewicht [kg]
|
Faktor
|
Gewicht [kg]
|
Faktor
| |
3
|
1
|
22
|
5,29
|
42
|
9,14
| |
4
|
1,14
|
24
|
5,71
|
44
|
9,57
| |
6
|
1,71
|
26
|
6,14
|
46
|
10,00
| |
8
|
2,14
|
28
|
6,43
|
48
|
10,29
| |
10
|
2,71
|
30
|
6,86
|
50
|
10,71
| |
12
|
3,14
|
32
|
7,29
|
52-54
|
11,29
| |
14
|
3,57
|
34
|
7,72
|
56-58
|
12,00
| |
16
|
4,00
|
36
|
8,00
|
60-62
|
12,71
| |
18
|
4,43
|
38
|
8,43
|
64-66
|
13,43
| |
20
|
4,86
|
40
|
8,86
|
68
|
14,00
|
A[MBq]Administered = BaselineActivity x Faktor
Für die Berechnung der zu verabreichenden Aktivität in Abhängigkeit vom Gewicht, wird die „Baseline Activity mit dem entsprechenden Faktor multipliziert. Ist die berechnete Aktivität kleiner als die minimal empfohlene Aktivität, ist die minimal empfohlene Aktivität zu verabreichen.
Die diagnostischen Referenzwerte dürfen nicht überschritten werden.
Szintigraphie der Tränenwege: Die Dosisempfehlungen gelten sowohl für Erwachsene als auch für Kinder.
Anwendung zur Markierung von Kits
Für die Anwendung von Natrium [99mTc]pertechnetatlösung zur Radiomarkierung von Kits sind die Angaben zur Dosierung in der jeweiligen Fachinformation zu beachten.
Art der Anwendung
Bei der Schilddrüsen-Szintigraphie, Speicheldrüsen-Szintigraphie und zum Nachweis ektopischer Magenschleimhaut wird Natrium[99mTc]pertechnetat-Lösung als intravenöse Injektion verabreicht.
Bei der Tränengang-Szintigraphie wird in jedes Auge getropft (Anwendung am Auge).
Für Hinweise zur Zubereitung des Arzneimittels vor der Anwendung, siehe Kapitel Sonstige Hinweise: Hinweise für die Handhabung, Hinweise für die Zubereitung von Radiopharmazeutika. Zur Vorbereitung der Patienten, siehe Kapitel Warnhinweise und Vorsichtsmassnahmen.
Bildaufnahme
Schilddrüsen-Szintigraphie: 20 Minuten nach intravenöser Injektion.
Speicheldrüsen-Szintigraphie: Dynamische Acquisition ab Injektion für 30 Minuten mit Provokationstest (Zitronensaft) in 15 Minuten oder dynamische Erfassung und statische Ansichten vor und nach dem Provokationstest (Zitronensaft)
Nachweis/Lokalisierung ektopischer Magenschleimhaut: unmittelbar nach der intravenösen Injektion und in regelmäßigen Abständen bis zu 30 Minuten.
Tränengang-Szintigraphie: dynamische Aufnahmen innerhalb von 2 Minuten nach dem Eintropfen, anschließend statische Aufnahmen in regelmäßigen Abständen innerhalb von 20 Minuten.
Strahlenexposition
Die Strahlenexposition hängt von einer Vorbehandlung mit blockierenden Substanzen sowie vom Ausmaß körperlicher Aktivität ab. Die geschätzten absorbierten Strahlendosen einzelner Organe nach direkter Anwendung von Natrium[99mTc]pertechnetat bei gesunden Personen sind in den folgenden Tabellen angegeben. Die Werte beziehen sich auf Anwendungen ohne/mit vorab verabreichten blockierenden Substanzen. Die Daten wurden der Veröffentlichung ”Radiation Dose to Patients from Radiopharmaceuticals” ICRP Publication 80 (Addendum 2 to ICRP Publication 53) entnommen.
Tabelle 3: Pertechnetat ohne Vorbehandlung mit einer blockierenden Substanz
|
Organ
|
Aufgenommene Dosis je Einheit verabreichter Aktivität (µGy/MBq)
| |
|
Erwachsener
|
15 Jahre
|
10 Jahre
|
5 Jahre
|
1 Jahr
| |
Nebennieren
|
3,7
|
4,7
|
7,2
|
11
|
19
| |
Blase
|
18
|
23
|
30
|
33
|
60
| |
Knochenoberfläche
|
5,4
|
6,6
|
9,7
|
14
|
26
| |
Gehirn
|
2,0
|
2,5
|
4,1
|
6,6
|
12
| |
Brust
|
1,8
|
2,3
|
3,4
|
5,6
|
11
| |
Gallenblase
|
7,4
|
9,9
|
16
|
23
|
35
| |
Magen-Darm-Trakt
|
|
|
|
|
| |
Magen
|
26
|
34
|
48
|
78
|
160
| |
Dünndarm
|
16
|
20
|
31
|
47
|
82
| |
Dickdarm
|
42
|
54
|
88
|
140
|
270
| |
Oberer Dickdarm
|
57
|
73
|
120
|
200
|
380
| |
Unterer Dickdarm
|
21
|
28
|
45
|
72
|
130
| |
Herz
|
3,1
|
4,0
|
6,1
|
9,2
|
17
| |
Nieren
|
5,0
|
6,0
|
8,7
|
13
|
21
| |
Leber
|
3,8
|
4,8
|
8,1
|
13
|
22
| |
Lunge
|
2,6
|
3,4
|
5,1
|
7,9
|
14
| |
Muskeln
|
3,2
|
4,0
|
6,0
|
9,0
|
16
| |
Speiseröhre
|
2,4
|
3,2
|
4,7
|
7,5
|
14
| |
Ovarien
|
10
|
13
|
18
|
26
|
45
| |
Bauchspeicheldrüse
|
5,6
|
7,3
|
11
|
16
|
27
| |
Rotes Knochenmark
|
3,6
|
4,5
|
6,6
|
9
|
15
| |
Speicheldrüse
|
9,3
|
12
|
17
|
24
|
39
| |
Haut
|
1,8
|
2,2
|
3,5
|
5,6
|
10
| |
Milz
|
4,3
|
5,4
|
8,1
|
12
|
21
| |
Testes
|
2,8
|
3,7
|
5,8
|
8,7
|
16
| |
Thymus
|
2,4
|
3,2
|
4,7
|
7,5
|
14
| |
Schilddrüse
|
22
|
36
|
55
|
120
|
220
| |
Uterus
|
8,1
|
10
|
15
|
22
|
37
| |
Sonstige Gewebe
|
3,5
|
4,3
|
6,4
|
9,6
|
17
| |
Effektive Dosis
µSv/MBq
|
13
|
17
|
26
|
42
|
79
|
Die effektive Dosis, die sich aus der intravenösen Anwendung intravenöser Verabreichung von 400 MBq Natrium[99mTc]pertechnetat an Erwachsene mit einem Gewicht von 70 kg liegt bei etwa 5,2 mSv.
Tabelle 4: Pertechnetat nach Vorbehandlung mit einer blockierenden Substanz
|
Organ
|
Aufgenommene Dosis je Einheit verabreichter Aktivität (µGy/MBq)
| |
|
Erwachsener
|
15 Jahre
|
10 Jahre
|
5 Jahre
|
1 Jahr
| |
Nebennieren
|
2,9
|
3,7
|
5,6
|
8,6
|
16
| |
Blase
|
30
|
38
|
48
|
50
|
91
| |
Knochenoberfläche
|
4,4
|
5,4
|
8,1
|
12
|
22
| |
Gehirn
|
2,0
|
2,6
|
4,2
|
7,1
|
12
| |
Brust
|
1,7
|
2,2
|
3,2
|
5,2
|
10
| |
Gallenblase
|
3,0
|
4,2
|
7,0
|
10
|
13
| |
Magen-Darm-Trakt
|
|
|
|
|
| |
Magen
|
2,7
|
3,6
|
5,9
|
8,6
|
15
| |
Dünndarm
|
3,5
|
4,4
|
6,7
|
10
|
18
| |
Dickdarm
|
3,6
|
4,8
|
7,1
|
10
|
18
| |
Oberer Dickdarm
|
3,2
|
4,3
|
6,4
|
10
|
17
| |
Unterer Dickdarm
|
4,2
|
5,4
|
8,1
|
11
|
19
| |
Herz
|
2,7
|
3,4
|
5,2
|
8,1
|
14
| |
Nieren
|
4,4
|
5,4
|
7,7
|
11
|
19
| |
Leber
|
2,6
|
3,4
|
5,3
|
8,2
|
15
| |
Lunge
|
2,3
|
3,1
|
4,6
|
7,4
|
13
| |
Muskeln
|
2,5
|
3,1
|
4,7
|
7,2
|
13
| |
Speiseröhre
|
2,4
|
3,1
|
4,6
|
7,5
|
14
| |
Ovarien
|
4,3
|
5,4
|
7,8
|
11
|
19
| |
Bauchspeicheldrüse
|
3,0
|
3,9
|
5,9
|
9,3
|
16
| |
Rotes Knochenmark
|
2,5
|
3,2
|
4,9
|
7,2
|
13
| |
Haut
|
1,6
|
2,0
|
3,2
|
5,2
|
9,7
| |
Milz
|
2,6
|
3,4
|
5,4
|
8,3
|
15
| |
Testes
|
3,0
|
4,0
|
6,0
|
8,7
|
16
| |
Thymus
|
2,4
|
3,1
|
4,6
|
7,5
|
14
| |
Schilddrüse
|
2,4
|
3,1
|
5,0
|
8,4
|
15
| |
Uterus
|
6,0
|
7,3
|
11
|
14
|
23
| |
Sonstige Gewebe
|
2,5
|
3,1
|
4,8
|
7,3
|
13
| |
Effektive Dosis µSv/MBq
|
4,2
|
5,4
|
7,7
|
11
|
19
|
Wird dem Patienten vor der Anwendung eine blockierende Substanz verabreicht, beträgt die effektive Dosis nach Anwendung von 400 MBq Natrium[99mTc]pertechnetat 1,68 mSv. Die Strahlendosis, die nach Anwendung von Natrium[99mTc]pertechnetat zur Szintigraphie des Tränenganges von der Augenlinse aufgenommen wird, beträgt schätzungsweise 38 µGy/MBq. Dies entspricht einer effektiven Dosis von weniger als 10 µSv bei einer verabreichten Aktivität von 4 MBq.
Externe Strahlenexposition
Tabelle 5:
|
Pertector
|
Dosisrate 99Mo-99mTc auf der Oberfläche des Generators (µSv/Std/GBq)
|
Dosisrate 99Mo-99mTc
in 1 m Abstand vom Generator (µSv/Std/GBq)
| |
50 mm Bleiabschirmung
|
31
|
0,3
|
Messungen am Arbeitsplatz und während der Arbeit sind von wesentlicher Bedeutung und sollten zur genaueren und aufschlussreicheren Bestimmung der Dosis der Gesamt-Strahlenbelastung für das Personal durchgeführt werden. Aus strahlenschutzrechtlichen Gründen muss der Pertector in einer zusätzlichen Abschirmung entsprechend der Strahlenschutzverordnung aufbewahrt werden.
Bei Anlieferung von Pertector vor dem Kalibrierzeitpunkt ist im Rahmen der Umgangsgenehmigung auf die entsprechend höhere Aktivität zu achten (siehe Tabelle 7).
Die beim Kunden stationär vorhandene, zusätzliche Abschirmung muss die im Zeitpunkt der Anlieferung des Generators vorhandene Ortsdosisleistung in 1 m Abstand von der Oberfläche auf maximal 0,01 mSv/h reduzieren.
Die Fingerdosisraten auf der Oberfläche der Abschirmung einer Durchstechflasche zum Eluieren, die ein typisches Eluat enthält, betragen:
|
Messpunkt
|
Oberflächendosisrate 99mTc
(µSv/Std/GBq)
| |
Bleiabschirmung
|
< 0,1
| |
Bleiglasabschirmung
|
< 0,6
|
Kontraindikationen·Überempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe
·Schwangerschaft
·Stillzeit
Warnhinweise und VorsichtsmassnahmenRadiopharmazeutisches Arzneimittel
Radioaktive Arzneimittel sind mit besonderer Sorgfalt und unter strengen Strahlenschutzmassnahmen zu handhaben, um die Strahlenbelastung sowohl bei den Patienten als auch beim Personal möglichst niedrig zu halten.
Jede Anwendung von Radiopharmazeutika an Patienten liegt ausschliesslich in der Kompetenz und Verantwortung eines Nuklearmediziners. Untersuchungen sind nur dann angezeigt, wenn der Nutzen einer solchen das mit der Strahlenexposition verbundene Risiko übersteigt. Dies gilt insbesondere bei der Anwendung an Kindern oder Jugendlichen. In jedem Fall hat die Verabreichung unter den Kautelen des Strahlenschutzes stattzufinden. Bei fertilen Frauen ist eine mögliche Schwangerschaft auszuschliessen. Schwangerschaft siehe Abschnitt Schwangerschaft und Stillzeit
Potenzielle Überempfindlichkeit oder anaphylaktische Reaktionen
Wenn Überempfindlichkeits- oder anaphylaktische Reaktionen auftreten, ist die Anwendung des Arzneimittels sofort abzubrechen und, falls erforderlich, eine intravenöse Behandlung einzuleiten. Um im Notfall unverzüglich reagieren zu können, sollten entsprechende Arzneimittel und Instrumente, u. a. Trachealtubus und Beatmungsgerät, griffbereit sein. Ein venöser Zugang muss während dem ganzen Verfahren vorhanden sein.
Eingeschränkte Nierenfunktion
Bei diesen Patienten ist eine sorgfältige Abwägung des Nutzen-Risiko-Verhältnisses erforderlich, da ein erhöhtes Strahlenexpositionsrisiko vorliegen kann.
Kinder und Jugendliche
Information zur Anwendung bei Kindern, siehe Kapitel Dosierung und Art der Anwendung. Da die effektive Dosis pro MBq höher ist als bei Erwachsenen, ist eine besonders sorgfältige Indikationsstellung erforderlich (siehe Kapitel Strahlenexposition).
Eine Blockade der Schilddrüse ist bei der Anwendung bei Kindern von besonderer Bedeutung, ausgenommen bei Schilddrüsen - und Speicheldrüsen Szintigraphie.
Patientenvorbereitung
Allfällige Schilddrüsenblockade
Bei bestimmten Indikationen ist unter Umständen eine Vorbehandlung der Patienten mit Schilddrüsenblockern bzw. Thyreostatika erforderlich.
Die Patienten sollten vor der Untersuchung gut hydriert sein und aufgefordert werden, in den ersten Stunden nach der Untersuchung so oft wie möglich die Blase zu entleeren, um die Strahlenexposition zu vermindern. Eine forcierte Diurese kann in Betracht gezogen werden.
Schilddrüsen-, Nebenschilddrüsen- und Speicheldrüsen-Szintigraphie
Es soll keine Schilddrüsenblockade erfolgen.
Bei der Speicheldrüsenszintigraphie muss mit einer Spezifität der Methode im Vergleich zur MR-Sialographie gerechnet werden.
Meckel-Divertikels
Es soll eine Schilddrüsenblockade erfolgen.
Vor Anwendung der Natrium[99mTc]pertechnetat-Lösung zur Szintigraphie eines Meckel-Divertikels sollte der Patient 3 bis 4 Stunden nüchtern bleiben, um die Darmperistaltik gering zu halten. Medikamente, die mit Natriumiodid-Symporter stören können, sollten ausgeschlossen werden, da sie die Pertechnetat-Aufnahme durch die Magenschleimhaut verringern.
Tränengang-Szintigraphie
Zur Vermeidung falsch positiver Ergebnisse oder zur Minimierung der Strahlung durch Verringerung der Anreicherung von [99mTc]pertechnetat in der Schild- oder Speicheldrüse sollte ein Schilddrüsenblocker verabreicht werden.
Minimierung der Markierung von Erythrozyten
Nach einer in vivo-Markierung von Erythrozyten mit Zinnionen als Reduktionsmittel wird Natrium[99mTc]pertechnetat primär in Erythrozyten eingebaut. Daher sollte eine i.v.-Verabreichung von 99mTc vor oder erst einige Tage nach einer in vivo-Markierung von Erythrozyten erfolgen.
Nach vorausgegangenen nuklearmedizinischen Untersuchungen mit einem Zinn(II)-haltigen Kit für ein radioaktives Arzneimittel ist eine Wartezeit von mindestens 8 Tagen angezeigt, da es sonst zu einer unerwünschten Markierung von roten Blutzellen kommen kann.
Nach der Untersuchung
Enger Kontakt mit kleinen Kindern und Schwangeren sollte in den ersten 12 Stunden vermieden werden.
Besondere Warnhinweise
Natrium[99mTc]pertechnetat-Lösung enthält 3,6 mg/ml Natrium. Abhängig vom Zeitpunkt der Verabreichung der Injektion kann der dem Patienten verabreichte Natriumgehalt in manchen Fällen größer als 1 mmol (23 mg) sein. Bei Patienten, die eine kochsalzarme Diät einhalten müssen, ist dies zu berücksichtigen.
Bei der Kit-Markierung mit Natrium[99mTc]pertechnetat-Lösung ist der Gesamt-Natriumgehalt der verabreichten Dosis zu beachten und das aus dem Eluat und dem Kit stammende Natrium zu berücksichtigen. Siehe Fachinformation und Packungsbeilage des betreffen
den Kits.
InteraktionenAtropin, Adrenalin, Isoprenalin und Analgetika können eine Verzögerung der Magenentleerung verursachen und dadurch bei Abdomendarstellungen eine Umverteilung des [99mTc]Pertechnetats bewirken.
Laxanzien sind abzusetzen, da sie zu einer Reizung des Gastrointestinaltrakts führen können.
Kontrastmitteluntersuchungen (z. B. mit Barium) und Untersuchungen des oberen Gastrointestinaltrakts sind innerhalb von 48 Stunden vor Verabreichung von [99mTc]Pertechnetat zur Szintigraphie eines Meckel-Divertikels zu vermeiden.
Viele pharmakologische Substanzen sind dafür bekannt, die Aufnahme in die Schilddrüse zu beeinflussen:
·Thyreostatika (z. B. Carbimazol oder andere Imidazolderivative wie Propylthiouracil), Salizylate, Steroide, Natrium-Nitroprussid, Natrium-Sulfobromophthalein, Perchlorat sollten 1 Woche vor der Schilddrüsen-Szintigraphie abgesetzt werden.
·Phenylbutazon und Expektoranzien sollten 2 Wochen zuvor abgesetzt werden.
·Natürliche oder synthetische Schilddrüsenhormone (z. B. Natriumthyroxin, Natriumliothyronin, Schilddrüsenextrakt) sollten 2-3 Wochen zuvor abgesetzt werden.
·Amiodaron, Benzodiazepine, Lithium sollten 4 Wochen zuvor abgesetzt werden.
·Intravenöse jodhaltige Kontrastmittel sollten innerhalb von 1-2 Monaten vor der Untersuchung nicht verabreicht worden sein.
Zinn(II)-Ionen und Sulfonamide können zu erhöhten Natrium[99mTc]pertechnetat-Konzentrationen in den roten Blutzellen führen, d. h. zu verminderter Anreicherung im Plasma. Entsprechende Medikamente sollten mindestens 8 Tage vor der Behandlung abgesetzt werden.
Zu Informationen über Wechselwirkungen bei einer Verwendung zur Markierung von einem Kit für ein radioaktives Arzneimittel, wird der Anwender auf die Produktinformationen der Hersteller der jeweiligen Kits verwiesen.
Schwangerschaft/StillzeitFrauen im gebärfähigen Alter
Wenn bei einer Frau im gebärfähigen Alter die Anwendung eines radioaktiven Arzneimittels beabsichtigt ist, ist es wichtig festzustellen, ob sie schwanger ist oder nicht. Jede Frau, deren Periode ausgeblieben ist, muss als schwanger angesehen werden, solange das Gegenteil nicht bewiesen ist. Bei Zweifeln hinsichtlich einer möglichen Schwangerschaft (bei Ausbleiben der Periode, unregelmäßiger Periode etc.) sollten der Patientin (wenn möglich) alternative Techniken, die keine Strahlenbelastung beinhalten, angeboten werden.
Schwangerschaft
Es hat sich gezeigt, dass Natrium[99mTc]pertechnetat plazentagängig ist. Natrium[99mTc]pertechnetat darf bei schwangeren Frauen nicht angewendet werden (s. Kontraindikationen). Alternativ sollten nicht radiologische Verfahren zur Diagnostik in Betracht gezogen werden.
Stillzeit
Vor der Anwendung von Radiopharmaka bei einer stillenden Mutter ist zu prüfen, ob eine Verschiebung der Untersuchung auf einen Zeitpunkt nach Beendigung der Stillperiode klinisch zu verantworten ist und welche Radiopharmaka unter Berücksichtigung der Abgabe von Radioaktivität in die Muttermilch am besten eingesetzt werden. Falls eine Anwendung unbedingt erforderlich ist, muss das Stillen für mindestens 12 Stunden unterbrochen und die Muttermilch verworfen werden. In den ersten 12 Stunden nach der Injektion muss enger Kontakt zwischen Mutter und Säugling eingeschränkt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien zum Einfluss auf die Fahrtüchtigkeit und die Befähigung zum Bedienen von Maschinen durchgeführt.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Es liegen Angaben zu unerwünschten Wirkungen aus Spontanmeldungen vor. Bei den berichteten Wirkungen handelte es sich um anaphylaktoide Reaktionen, vegetative Reaktionen sowie verschiedene Arten von Reaktionen am Verabreichungsort der Injektion. Natrium[99mTc]pertechnetat aus dem Pertector-Generator wird zur radioaktiven Markierung verschiedener Substanzen verwendet. Welche Arten von Nebenwirkungen nach intravenöser Verabreichung des [99mTc]pertechnetat -markierten Präparates auftreten können, hängt von der jeweiligen Substanz ab. Die entsprechenden Angaben sind in der Fachinformation des zur Zubereitung des radioaktiven Arzneimittels verwendeten Kits enthalten.
Tabellarische Liste der Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (≥1/10)Häufig (≥1/100 bis <1/10)Gelegentlich (≥1/1.000 bis <1/100)Selten (≥1/10.000 bis <1/1.000)Sehr selten (<1/10.000)Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
MedDRA Systemorganklassen
|
Unerwünschte Wirkungen
|
Häufigkeit
| |
Erkrankungen des Immunsystems
|
anaphylaktoide Reaktionen (z. B. Dyspnoe, Koma, Urtikaria, Erythem, Hautausschlag, Pruritus, Ödembildung an verschiedenen Stellen, z. B. im Gesicht)
|
Häufigkeit nicht bekannt*
| |
Erkrankungen des Nervensystems
|
vasovagale Reaktionen (z. B. Synkope, Tachykardie, Bradykardie, Schwindelgefühl, Kopfschmerzen, verschwommenes Sehen, Gesichtsrötung/Hitzegefühl (Flushing))
|
Häufigkeit nicht bekannt*
| |
Erkrankungen des Gastrointestinaltrakts
|
Erbrechen, Übelkeit, Diarrhoe
|
Häufigkeit nicht bekannt*
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Reaktionen am Verabreichungsort der Injektion aufgrund von Paravasation (z. B. Cellulitis, Schmerzen, Erythem, Schwellung)
|
Häufigkeit nicht bekannt*
|
* Nebenwirkungen aus Spontanmeldungen
Ionisierende Strahlen können Krebs und Erbgutveränderungen verursachen. Da die effektive Strahlendosis bei Gabe der maximalen empfohlenen Aktivität von 400 MBq ohne Schilddrüsenblockade bei 5,2 mSv liegt, sind diese Effekte mit geringer Wahrscheinlichkeit zu erwarten.
Beschreibung ausgewählter Nebenwirkungen
Anaphylaktische Reaktionen (z.B. Dyspnoe, Koma, Urtikaria, Erythem, Hautausschlag, Pruritus, Ödembildung an verschiedenen Stellen [z.B. im Gesicht]). Anaphylaktoide Reaktionen wurden nach intravenöser Injektion von Natrium[99mTc]perchtechnetat berichtet und beinhalten verschiedene Haut- oder Atemwegsymptome wie Hautreizungen, Ödeme oder Dyspnoe.
Vegetative Reaktionen (Erkrankungen des Nervensystems und des Gastrointestinaltrakts)
Einzelfälle schwerer vegetativer Reaktionen wurden berichtet, jedoch handelte es sich bei den meisten berichteten Nebenwirkungen um gastrointestinale Reaktionen wie Übelkeit oder Erbrechen. Andere Berichte beinhalten vasovagale Reaktionen wie Kopfschmerzen oder Schwindelgefühl. Vegetative Wirkungen werden eher auf die Untersuchungssituation als auf [99mTc]Technetium zurückgeführt, vor allem bei ängstlichen Patienten.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Andere Berichte beschreiben lokale Reaktionen am Verabreichungsort der Injektion. Solche Reaktionen werden durch Extravasation des radioaktiven Materials während der Injektion verursacht. Die beobachten Reaktionen reichen von lokaler Schwellung bis hin zur Cellulitis. Abhängig von der verabreichten Radioaktivität und der markierten Substanz kann eine größere Paravasation eine chirurgische Behandlung erfordern.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungIm Fall einer Strahlenüberdosis mit Natrium[99mTc]pertechnetat sollte die vom Patienten absorbierte Strahlendosis, wenn möglich durch beschleunigte Ausscheidung des Radionuklids aus dem Körper, durch Defäkation, Förderung der Diurese und möglichst häufiges Entleeren der Blase, verringert werden.
Die Aufnahme in die Schilddrüse, Speicheldrüsen und die Magenschleimhaut kann deutlich vermindert werden, wenn Natriumperchlorat 400mg und Natriumiodid 2 x 100mg/Tag unmittelbar nach einer versehentlichen zu hohen Dosis von Natrium[99mTc]pertechnetat verabreicht wird.
Eigenschaften/WirkungenATC-Code
V09FX01
Wirkungsmechanismus
Keine Angaben vorhanden
Pharmakodynamik
Bei Dosierungen in den für diagnostische Zwecke üblichen Bereichen wurden keine pharmakodynamischen Wirkungen beobachtet.
Klinische Wirksamkeit
Keine Angaben vorhanden
PharmakokinetikAbsorbtion
Keine Angaben vorhanden
Distribution
Das Pertechnetat-Ion hat eine ähnliche biologische Verteilung wie Iodid- und Perchlorat-Ionen und reichert sich vorübergehend in den Speicheldrüsen, im Plexus chorioideus, im Magen (in der Magenschleimhaut) und der Schilddrüse an, aus der es unverändert wieder ausgeschieden wird. Das Pertechnetat-Ion weist auch eine Tendenz zur Anreicherung in Gebieten erhöhter Vaskularisierung oder mit abnormer Gefäßpermeabilität auf, vor allem wenn es durch Vorbehandlung mit Schilddrüsenblockern zur Hemmung der Aufnahme in Drüsenstrukturen kommt. Bei intakter Blut-Hirn-Schranke tritt [99mTc]Pertechnetat nicht in Hirngewebe über.
Organaufnahme
Im Blut liegen 70-80 % des intravenös injizierten Natrium[99mTc]pertechnetats an Proteine, hauptsächlich unspezifisch an Albumin, gebunden vor. Der ungebundene Anteil (20-30 %) reichert sich vorübergehend in Schilddrüse, Speicheldrüsen, Magen- und Nasenschleimhaut sowie Plexus chorioidei an.
Im Gegensatz zu Iod wird Natrium[99mTc]pertechnetat weder in Schilddrüsenhormone eingebaut (Organifizierung) noch im Dünndarm resorbiert. In der Schilddrüse wird die maximale Anreicherung, abhängig von Funktionszustand und Iodsättigung (bei Euthyreose ca. 0,3-3 %, bei Hyperthyreose und Iodmangel bis zu 25 %) etwa 20 min nach Injektion erreicht und nimmt danach rasch wieder ab. Ähnliches gilt für die Belegzellen der Magenschleimhaut und die Azinuszellen der Speicheldrüsen.
Im Gegensatz zur Schilddrüse, die Natrium[99mTc]pertechnetat wieder in die Blutbahn abgibt, erfolgt die Sekretion aus der Speicheldrüse und dem Magen in den Speichel bzw. Magensaft. Die Anreicherung durch die Speicheldrüse liegt in der Größenordnung von 0,5 % der applizierten Aktivität, wobei das Maximum nach etwa 20 Minuten erreicht wird. Eine Stunde nach Injektion liegt die Konzentration im Speichel um das 10-30fache höher als im Plasma. Die Exkretion kann durch Zitronensaft beschleunigt werde, die Aufnahme wird durch Perchlorat vermindert.
Metabolismus
Nicht zutreffend
Elimination
Die Halbwertszeit der Plasmaclearance beträgt ungefähr 3 Stunden. Natrium[99mTc]pertechnetat wird im Organismus nicht metabolisiert. Ein Teil wird sehr schnell renal, der Rest langsamer über Faeces, Speichel- und Tränenflüssigkeit eliminiert. Die Ausscheidung erfolgt während der ersten 24 Stunden nach Injektion hauptsächlich über die Nieren (ca. 25 %), und während der folgenden 48 Stunden über die Faeces. Etwa 50 % der verabreichten Aktivität werden innerhalb der ersten 50 Stunden ausgeschieden. Wenn die selektive Natrium[99mTc]pertechnetat-Aufnahme in die Drüsenstrukturen durch Vorbehandlung mit Blockern gehemmt ist, erfolgt die Ausscheidung auf dem gleichen Wege, aber die Nierenclearance ist erhöht.
Die oben genannten Informationen sind nicht gültig, wenn Natrium[99mTc]pertechnetat zur Markierung anderer Radiopharmaka verwendet wird.
Kinetik spezieller Patientengruppen
Keine Angaben vorhanden
Präklinische DatenEs liegen keine Daten zur akuten, subakuten und chronischen Toxizität nach Einmalverabreichung oder wiederholter Verabreichung vor. Die bei klinischen Diagnoseverfahren verabreichte Menge an Natrium[99mTc]pertechnetat ist sehr klein. Dieses Arzneimittel ist nicht zur regelmässigen oder kontinuierlichen Anwendung bestimmt. Mutagenitätsstudien und Langzeit-Karzinogenitätsstudien wurden nicht durchgeführt.
Reproduktionstoxizität
Der Übertritt von [99mTc] aus intravenös verabreichtem Natrium[99mTc]pertechnetat in die Plazenta wurde bei Mäusen untersucht. Ohne vorherige Gabe von Perchlorat wurde bei Mäusen im trächtigen Uterus bis zu 60 % der injizierten [99mTc]-Dosis nachgewiesen. Die Gabe an Mäuse während der Trächtigkeit und/oder Laktation führte bei den Nachkommen zu vermindertem Gewicht, Haarlosigkeit und Sterilität.
Sonstige HinweiseInkompatibilitäten
Das Arzneimittel darf, ausser mit den mit den im Abschnitt Indikationen genannten, nicht mit anderen Arzneimitteln gemischt werden.
Radioaktive Arzneimittel, die mit Natrium[99mTc]pertechnetat markiert sind, dürfen nicht mit anderen Arzneimitteln gemischt werden.
Nach einer vorausgegangenen nuklearmedizinischen Untersuchung mit einem Zinn-Ionen enthaltendem Kit für ein radioaktives Arzneimittel, wird eine Wartezeit von mindestens 8 Tagen vor der Verabreichung von Natrium[99mTc] empfohlenBeeinflussung diagnostischer Methoden
Haltbarkeit
Generator:
14 Tage ab dem Kalibierzeitpunkt. Kalibrierzeitpunkt und Verfallszeitpunkt sind auf dem Etikett angegeben. Nicht über 30 °C lagern. Das Gerät darf nach Ablauf des Verfalldatums nicht mehr angewendet werden.
Natrium[99mTc]pertechnetat-Eluat:
nach der Elution sofort, spätestens aber innerhalb von 12 Stunden verwenden. Bei Raumtemperatur (15- 25 °C ) lagern.
Durchstechflaschen mit 0,9 %ige Natriumchloridlösung sowie evakuierte Durchstechflaschen: 3 Monate.
Besondere Lagerungshinweise
Generator:
Es sind keine besonderen Aufbewahrungsbedingungen in Bezug auf die Temperatur erforderlich.
Eluat:
Lagerungsbedingungen nach Elution des Arzneimittels, siehe Kapitel Haltbarkeit.
Die Lagerung muss in Übereinstimmung mit den nationalen Vorschriften für radioaktive Produkte erfolgen.
Hinweise für die Handhabung
Beschreibung des Generators
Der Pertectorgenerator besteht aus (vgl. Abbildung):
·Sterile Glassäule gefüllt mit Aluminiumoxid (1), an dem das primäre Radionuklid 99Mo adsorbiert ist. Die Säule ist am oberen Ende und am Boden jeweils mit einem durch eine Metallkappe gesicherten Gummistopfen verschlossen.
·Edelstahlnadel-Set (2), das die Verbindung der Generatorsäule mit den Eluent-Durchstechflaschen und den evakuierten Durchstechflaschen ermöglicht. Die Nadeln sind während des Transportes und der Elutionspausen durch zwei Durchstechflaschen mit bakteriostatischer Lösung (0,02 %ige wässrige Benzododeciniumbromid-Lösung) geschützt.
·Bleiabschirmung (3) mit einer Dicke von 50 mm, in der sich die Säule und die Nadeln des Generators befinden.
·Sterilfilter (4 und 9) für das Eluat und die in die Eluat-Durchstechflasche eingesaugte Luft.
·Eluatvolumen-Kontrolle (5), mit der das gewünschte Eluatvolumen (4 bis 8 ± 0,5 ml) und damit die gewünschte radioaktive Konzentration des Eluates einzustellen ist. Die Einstellung erfolgt durch Drehen der oberen Hülse (7) entsprechend der dargestellten Skala.
Zusammen mit dem Generator wird das folgende Material geliefert:
·16 Durchstechflaschen Elutionslösung (0,9 %ige NaCl Lösung) und 16 evakuierte Durchstechflaschen (zur Aufnahme des Eluates).
·Abschirmbehälter (8) zur Aufnahme der Elutionsdurchstechflasche
Die Durchstechflaschen (Natriumchloridlösung und Vakuum) sind 10-ml-Glasflaschen mit Gummistopfen und Verschlusskappe.
Elutionslösung (0,9 %ige NaCl Lösung) und evakuierte Durchstechflaschen (Flaschen für das Eluat) können separat als Zubehör bezogen werden.
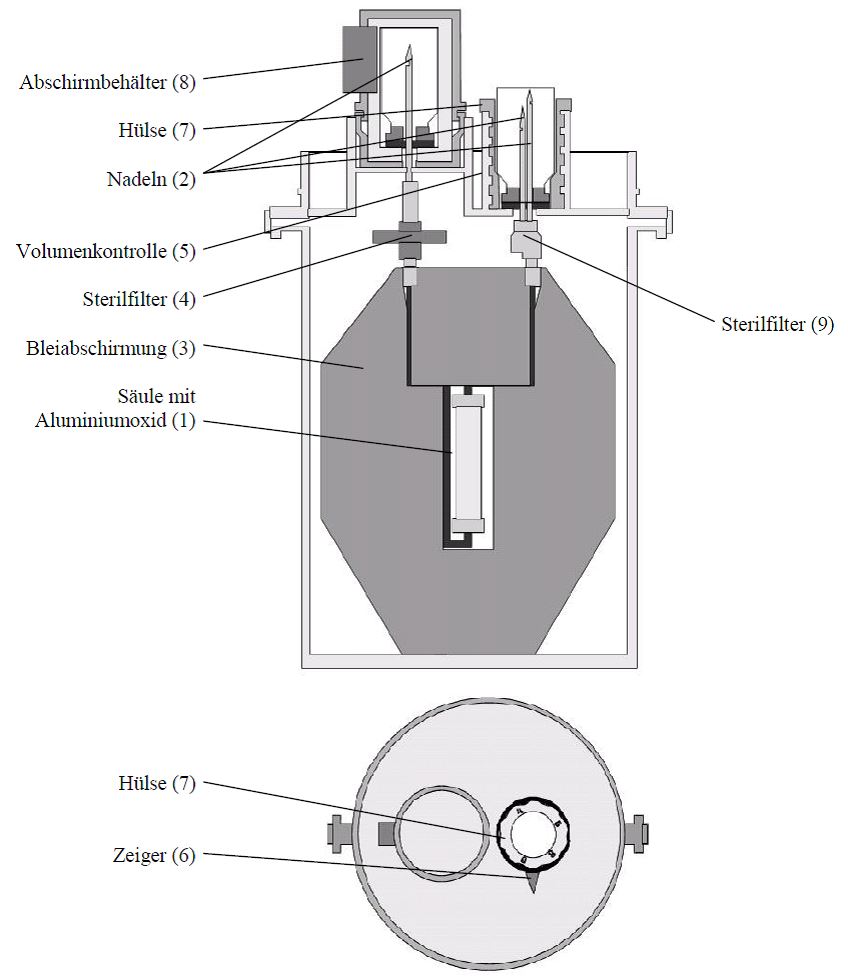
Abbildung: Aufbau des Generators
Inverkehrbringen des Generators:
Es wird empfohlen, die Elution des Generators und alle weiteren Arbeitsschritte mit der Natrium Lösung hinter einer zusätzlichen adäquatenAbschirmung (z.B. 50mm Bleiwand) durchzuführen. Die Dosisleistung an der Oberfläche bwz. In 1m Abstand soll 1mSv/h bzw. 10 uSv/h nicht überschreiben. Auch die für die Herstellung des Radiopharmakons verwendten Spritzen sollten mit Bleischutz versehen sein (Code OS-2, OS-5, OS-10 und OS-P-10).
·Öffnen Sie den Transportbehälter
·Entnehmen Sie den Eluat-Abschirmbehälter, der sich im oberen Boden des Behälters befindet (bei Erstlieferung)
·Entnehmen Sie den oberen Boden des Behälters
·Entnehmen Sie die Packungen mit den Elutions-Kits
·Entnehmen Sie den Generator und stellen Sie ihn in die vorhandene Zusatzabschirmung
Hinweise für die Zubereitung von Radiopharmazeutika
Die Elution durch den Generator muss in Einrichtungen stattfinden, die hinsichtlich der Sicherheit der Anwendung von radioaktiven Produkten die nationalen Bestimmungen erfüllen.
Hinweise zur Markierung von Kits
Bei einer Verwendung von Natrium[99mTc]pertechnetat-Lösungen zur Markierung von einem Kit für ein radioaktives Arzneimittel beachten Sie bitte die Produktinformationen zu dem jeweiligen Kit. Spezifikationen des Eluates, insbesondere die Dauer zwischen zwei Elutionen, sind der entsprechenden Fachinformation zu entnehmen.
Elutionsanleitung
Während der Handhabung und der Anwendung des Arzneimittels müssen die Bestimmungen des Strahlenschutzes eingehalten werden. Elutionen dürfen nur in dementsprechenden Räumen durchgeführt werden. Während der Elution des Generators muss strikt aseptisch gearbeitet werden, damit die Sterilität des Generatoreluats erhalten bleibt. Für eine optimale Leistung und sichere Handhabung des Generators müssen die Arbeitsschritte in der nachstehend beschriebenen Reihenfolge eingehalten werden.
Achtung:
Spülen Sie Nadeln und Flaschenstopfen nicht mit Ethanol, Ethylether oder Detergentien.
Für die Elution des Radionuklidgenerators dürfen ausschliesslich die zu diesem Radionuklidgenerator gehörende Elutionslösung (0,9 %ige Natriumchloridlösung) und die mit einem Unterdruck versehenen Durchstechflaschen verwendet werden.
Elution
-Drehen Sie den Generatordeckel ab.
-Platzieren Sie den Generator so, dass sich beide Fläschchen mit bakteriostatischem Mittel auf den Generatoranschlüssen in einer parallelen Linie
mit dem Anwender befinden und die Einstellung der Eluatvolumenkontrolle gut sichtbar ist.
-Entfernen Sie die Fläschchen mit dem bakteriostatischen Mittel von den Generatornadeln.
-Stellen Sie die Eluatvolumenkontrolle wunschgemäß ein.
Vorsicht: Drehen Sie dabei die Buchse nicht vom Generatorsockel ab!
Entfernen Sie die Versiegelung vom Fläschchen mit dem Eluenten, desinfizieren Sie den Stopfen und setzen Sie das Fläschchen auf die Nadel
im Sockel mit der Volumenkontrolle. Durchstechen Sie es so, dass die Flasche den Boden des Sockels berührt.
-Entfernen Sie die Versiegelung vom Vakuumfläschchen, desinfizieren Sie den Stopfen und setzen Sie das Vakuumfläschchen in den Abschirmbehälter. Drücken Sie diesen vorsichtig auf die Nadel im Elutionssockel, bis der Abschirmbehälter den Boden des Elutionssockels berührt.
-Warten Sie, bis die Elution beendet ist. Die Zeit hängt vom Eluatvolumen ab und variiert zwischen 2, 3 und 4 Minuten um 4, 6 bzw. 8 ml Eluatvolumen zu erhalten.
-Entfernen Sie den Abschirmbehälter, entnehmen Sie die Durchstechflasche mit dem Eluat und messen Sie die eluierte Aktivität mit einem geeigneten kalibrierten Aktivimeter.
-Entfernen Sie die Durchstechflasche mit Elutionslösung. Dieses ist leicht zu fassen, wenn Sie die Volumenkontrolle auf „0“ stellen.
Decken Sie die Nadeln des Generators wieder mit den Durchstechflaschen ab, die das Bakteriostatikum enthalten.
-Verschließen Sie den Generator mit dem Deckel.
Berechnung der Generator-Aktivität
Die nominale Aktivität des Generators ist angegeben als Aktivität von Natrium[99mTc]pertechnetat 12:00 MEZ am Kalibriertag (Tag 0, Tabelle 5).
Die zwischen 08:00 und 12:00 Uhr eluierbare Aktivität ist praktisch konstant zwischen einem Wert von 96 bis 100 % der nominalen Aktivität des entsprechenden Tages.
Die höchsten Aktivitäten werden erhalten, wenn die Pause zwischen den Elutionen nicht kürzer als 23 bis 24 Stunden ist.
Tabelle 7: Theoretisch eluierbare Natrium[99mTc]pertechnetat-Aktivität für den entsprechenden Tag
|
99
Mo-Generatoraktivität [GBq]
| |
|
2,3
|
4,6
|
5,7
|
6,9
|
8,5
|
9,1
|
11,4
|
13,7
|
14,9
|
17,1
|
19,4
|
21,1
|
22,9
|
26,3
|
28,6
|
34,3
|
40
|
45,7
|
57,1
| |
99m
Tc-Generatoraktivität [GBq]
| |
Tag
|
| |
Tag vor dem Kalibriertag
|
-5
|
7,1
|
14,1
|
17,6
|
21,2
|
26,4
|
28,2
|
35,3
|
42,3
|
45,8
|
52,9
|
59,9
|
65,2
|
70,5
|
81,1
|
88,2
|
105,8
|
123,4
|
141,1
|
176,3
| |
-4
|
5,5
|
11,0
|
13,7
|
16,4
|
20,6
|
21,9
|
27,4
|
32,9
|
35,6
|
41,1
|
46,6
|
50,7
|
54,8
|
63,0
|
68,5
|
82,2
|
95,9
|
109,6
|
137,0
| |
-3
|
4,3
|
8,5
|
10,7
|
12,8
|
16,0
|
17,0
|
21,3
|
25,6
|
27,7
|
32,0
|
36,2
|
39,4
|
42,6
|
49,0
|
53,3
|
63,9
|
74,6
|
85,2
|
106,5
| |
-2
|
3,3
|
6,6
|
8,3
|
9,9
|
12,4
|
13,2
|
16,6
|
19,9
|
21,5
|
24,8
|
28,1
|
30,6
|
33,1
|
38,1
|
41,4
|
49,7
|
57,9
|
66,2
|
82,8
| |
-1
|
2,6
|
5,1
|
6,4
|
7,7
|
9,6
|
10,3
|
12,9
|
15,4
|
16,7
|
19,3
|
21,9
|
23,8
|
25,7
|
29,6
|
32,2
|
38,6
|
45,0
|
51,5
|
64,3
| |
Kalibriertag
|
2,00
|
4,00
|
5,00
|
6,00
|
7,50
|
8,00
|
10,00
|
12,00
|
13,00
|
15,00
|
17,00
|
18,50
|
20,00
|
23,00
|
25,00
|
30,00
|
35,00
|
40,00
|
50,00
| |
Tag nach dem Kalibriertag
|
1
|
1,55
|
3,11
|
3,89
|
4,66
|
5,83
|
6,22
|
7,77
|
9,33
|
10,10
|
11,66
|
13,21
|
14,38
|
15,54
|
17,88
|
19,43
|
23,32
|
27,20
|
31,09
|
38,86
| |
2
|
1,21
|
2,42
|
3,02
|
3,62
|
4,53
|
4,83
|
6,04
|
7,25
|
7,85
|
9,06
|
10,27
|
11,17
|
12,08
|
13,89
|
15,10
|
18,12
|
21,14
|
24,16
|
30,20
| |
3
|
0,94
|
1,88
|
2,35
|
2,82
|
3,52
|
3,76
|
4,69
|
5,63
|
6,10
|
7,04
|
7,98
|
8,69
|
9,39
|
10,80
|
11,74
|
14,08
|
16,43
|
18,78
|
23,47
| |
4
|
0,73
|
1,46
|
1,82
|
2,19
|
2,74
|
2,92
|
3,65
|
4,38
|
4,74
|
5,47
|
6,20
|
6,75
|
7,30
|
8,39
|
9,12
|
10,95
|
12,77
|
14,59
|
18,24
| |
5
|
0,57
|
1,13
|
1,42
|
1,70
|
2,13
|
2,27
|
2,84
|
3,40
|
3,69
|
4,25
|
4,82
|
5,25
|
5,67
|
6,52
|
7,09
|
8,51
|
9,93
|
11,34
|
14,18
| |
6
|
0,44
|
0,88
|
1,10
|
1,32
|
1,65
|
1,76
|
2,20
|
2,64
|
2,87
|
3,31
|
3,75
|
4,08
|
4,41
|
5,07
|
5,51
|
6,61
|
7,71
|
8,82
|
11,02
| |
7
|
0,34
|
0,69
|
0,86
|
1,03
|
1,28
|
1,37
|
1,71
|
2,06
|
2,23
|
2,57
|
2,91
|
3,17
|
3,43
|
3,94
|
4,28
|
5,14
|
6,00
|
6,85
|
8,56
| |
8
|
0,27
|
0,53
|
0,67
|
0,80
|
1,00
|
1,07
|
1,33
|
1,60
|
1,73
|
2,00
|
2,26
|
2,46
|
2,66
|
3,06
|
3,33
|
3,99
|
4,66
|
5,33
|
6,66
| |
9
|
0,21
|
0,41
|
0,52
|
0,62
|
0,78
|
0,83
|
1,03
|
1,24
|
1,35
|
1,55
|
1,76
|
1,91
|
2,07
|
2,38
|
2,59
|
3,10
|
3,62
|
4,14
|
5,17
| |
10
|
0,16
|
0,32
|
0,40
|
0,48
|
0,60
|
0,64
|
0,80
|
0,96
|
1,05
|
1,21
|
1,37
|
1,49
|
1,61
|
1,85
|
2,01
|
2,41
|
2,81
|
3,22
|
4,02
| |
11
|
0,13
|
0,25
|
0,31
|
0,38
|
0,47
|
0,50
|
0,63
|
0,75
|
0,81
|
0,94
|
1,06
|
1,16
|
1,25
|
1,44
|
1,56
|
1,88
|
2,19
|
2,50
|
3,13
| |
12
|
0,10
|
0,19
|
0,24
|
0,29
|
0,36
|
0,39
|
0,49
|
0,58
|
0,63
|
0,73
|
0,83
|
0,90
|
0,97
|
1,12
|
1,21
|
1,46
|
1,70
|
1,94
|
2,43
| |
13
|
0,08
|
0,15
|
0,19
|
0,23
|
0,28
|
0,30
|
0,38
|
0,45
|
0,49
|
0,57
|
0,64
|
0,70
|
0,76
|
0,87
|
0,94
|
1,13
|
1,32
|
1,51
|
1,89
| |
14
|
0,06
|
0,12
|
0,15
|
0,18
|
0,22
|
0,23
|
0,29
|
0,35
|
0,38
|
0,44
|
0,50
|
0,54
|
0,59
|
0,67
|
0,73
|
0,88
|
1,03
|
1,17
|
1,47
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabelle 8: Korrekturfaktoren für die Berechnung der Natrium[99mTc]pertechnetat-Aktivität in Abhängigkeit von den Elutionsintervallen
|
Zeit seit der letzten Elution [Std.]
|
0
|
2
|
4
|
6
|
8
|
10
|
12
|
14
|
16
|
18
|
20
|
23
| |
Korrekturfaktor: Zerfall von 99Mo
|
1,0
|
0,979
|
0,960
|
0,940
|
0,919
|
0,900
|
0,881
|
0,863
|
0,845
|
0,828
|
0,811
|
0,785
| |
Korrekturfaktor: Zunahme von 99mTc
|
0,0
|
0,21
|
0,39
|
0,51
|
0,62
|
0,71
|
0,79
|
0,85
|
0,89
|
0,93
|
0,96
|
1,0
|
Beispiele für die Berechnung
·Ein Generator mit einer nominalen Aktivität von 15 GBq wird am Tag „+2“ um 08:00 Uhr eluiert und am gleichen Tag um 12:00 Uhr ein weiteres Mal, das ist 4 Stunden nach der vorherigen Elution.
Die Aktivität der ersten Elution ist 9,06 GBq (siehe Tabelle 5).
Die Aktivität der zweiten Elution ist 9,06 * 0,960 * 0,39 = 3,39 GBq
(Korrekturfaktoren aus Tabelle 8).
·Ein Generator mit einer nominalen Aktivität von 23 GBq wird am Tag „+4“ um 08:00 Uhr eluiert und am gleichen Tag um 1400 Uhr ein zweites Mal, das ist 6 Stunden nach der vorherigen Elution.
Die Aktivität der ersten Elution ist 8,39 GBq (siehe Tabelle 5).
Die Aktivität der zweiten Elution ist 8,39 * 0,940 * 0,51 = 4,02 GBq
(Korrekturfaktoren aus Tabelle 8).
Qualitätskontrolle:
Jedes Eluat muss vor der Verwendung durch das Bleiglasfenster des Elutionsbehälters visuell überprüft werden. Falls eine Trübung oder Färbung beobachtet wird, darf es nicht verwendet werden und der Zulassungsinhaber ist unverzüglich zu informieren. Beim ersten Eluat eines Generators nach der Anlieferung muss der 99Mo-Durchbruch geprüft werden, um eine Beeinträchtigung durch Transportschäden auszuschliessen. Beim ersten Eluat eines Tages wird die Prüfung empfohlen.
Charakteristika des Eluates aus dem Generator
Entspricht Monographie 0124 „Natrium[99mTc]pertechnetat-Injektionslösung aus Kernspaltprodukten“ der Europäischen Pharmakopöe.
Die Lösung eluiert als klare und farblose Natrium[99mTc]pertechnetat-Lösung mit den folgenden Eigenschaften:
Elutionsausbeute 90 - 110 %Radiochemische Reinheit des Eluates > 98 %Gehalt an 99Mo im Eluat < 0,1 % corresp. 1 kBq 99Mo/MBq 99m TcGehalt an Al3+ im Eluat < 5 mg/mlpH des Eluates 5,5 - 7,5
Üblicherweise kann das erste Eluat aus dem Generator verwendet werden, sofern nicht anders angegeben. Zur Kitmarkierung kann das Eluat auch 24 Stunden nach der letzten Elution verwendet werden, sofern in der Fachinformation des betreffenden Kits nicht die Verwendung eines frischen Eluats spezifiziert ist.
Tabelle 9: Molybdän-99: Zerfallsfaktoren in zeitlichem Abstand zum Kalibrierzeitpunkt (99Mo Halbwertszeit: 66 Stunden)
|
GMT
|
Tage vor/nach dem Kalibrierzeitpunkt
| |
(Std.)
|
-10
|
-9
|
-8
|
-7
|
-6
|
-5
|
-4
|
-3
|
-2
|
-1
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
| |
2,00
|
13,8123
|
10,7349
|
8,3432
|
6,4844
|
5,0397
|
3,9169
|
3,0442
|
2,3660
|
1,8388
|
1,4291
|
1,1107
|
0,8633
|
0,6709
|
0,5215
|
0,4053
|
0,3150
|
0,2448
|
0,1903
|
0,1479
|
0,1149
|
0,0893
|
0,0694
|
0,0540
|
0,0419
|
0,0326
| |
4,00
|
13,5252
|
10,5118
|
8,1698
|
6,3496
|
4,9349
|
3,8354
|
2,9809
|
2,3168
|
1,8006
|
1,3994
|
1,0876
|
0,8453
|
0,6570
|
0,5106
|
0,3969
|
0,3084
|
0,2397
|
0,1863
|
0,1448
|
0,1125
|
0,0875
|
0,0680
|
0,0528
|
0,0411
|
0,0319
| |
6,00
|
13,2441
|
10,2933
|
8,0000
|
6,2176
|
4,8324
|
3,7557
|
2,9190
|
2,2686
|
1,7632
|
1,3704
|
1,0650
|
0,8278
|
0,6433
|
0,5000
|
0,3886
|
0,3020
|
0,2347
|
0,1824
|
0,1418
|
0,1102
|
0,0856
|
0,0666
|
0,0517
|
0,0402
|
0,0313
| |
8,00
|
12,9688
|
10,0794
|
7,8337
|
6,0884
|
4,7319
|
3,6777
|
2,8583
|
2,2215
|
1,7265
|
1,3419
|
1,0429
|
0,8105
|
0,6300
|
0,4896
|
0,3805
|
0,2957
|
0,2299
|
0,1786
|
0,1388
|
0,1079
|
0,0839
|
0,0652
|
0,0507
|
0,0394
|
0,0306
| |
10,00
|
12,6992
|
9,8699
|
7,6709
|
5,9618
|
4,6336
|
3,6012
|
2,7989
|
2,1753
|
1,6906
|
1,3140
|
1,0212
|
0,7937
|
0,6169
|
0,4794
|
0,3726
|
0,2896
|
0,2251
|
0,1749
|
0,1360
|
0,1057
|
0,0821
|
0,0638
|
0,0496
|
0,0386
|
0,0300
| |
12,00
|
12,4353
|
9,6647
|
7,5114
|
5,8379
|
4,5373
|
3,5264
|
2,7407
|
2,1301
|
1,6555
|
1,2867
|
1,0000
|
0,7772
|
0,6040
|
0,4695
|
0,3649
|
0,2836
|
0,2204
|
0,1713
|
0,1331
|
0,1035
|
0,0804
|
0,0625
|
0,0486
|
0,0378
|
0,0293
| |
14,00
|
12,1768
|
9,4638
|
7,3553
|
5,7166
|
4,4429
|
3,4531
|
2,6837
|
2,0858
|
1,6211
|
1,2599
|
0,9792
|
0,7610
|
0,5915
|
0,4597
|
0,3573
|
0,2777
|
0,2158
|
0,1677
|
0,1304
|
0,1013
|
0,0787
|
0,0612
|
0,0476
|
0,0370
|
0,0287
| |
16,00
|
11,9237
|
9,2671
|
7,2024
|
5,5978
|
4,3506
|
3,3813
|
2,6280
|
2,0425
|
1,5874
|
1,2337
|
0,9589
|
0,7452
|
0,5792
|
0,4502
|
0,3499
|
0,2719
|
0,2113
|
0,1642
|
0,1277
|
0,0992
|
0,0771
|
0,0599
|
0,0466
|
0,0362
|
0,0281
| |
18,00
|
11,6758
|
9,0745
|
7,0527
|
5,4814
|
4,2602
|
3,3110
|
2,5733
|
2,0000
|
1,5544
|
1,2081
|
0,9389
|
0,7297
|
0,5672
|
0,4408
|
0,3426
|
0,2663
|
0,2069
|
0,1608
|
0,1250
|
0,0972
|
0,0755
|
0,0587
|
0,0456
|
0,0354
|
0,0275
| |
20,00
|
11,4332
|
8,8859
|
6,9061
|
5,3675
|
4,1716
|
3,2422
|
2,5198
|
1,9584
|
1,5221
|
1,1830
|
0,9194
|
0,7146
|
0,5554
|
0,4316
|
0,3355
|
0,2607
|
0,2026
|
0,1575
|
0,1224
|
0,0951
|
0,0739
|
0,0575
|
0,0447
|
0,0347
|
0,0270
| |
22,00
|
11,1955
|
8,7012
|
6,7626
|
5,2559
|
4,0849
|
3,1748
|
2,4675
|
1,9177
|
1,4905
|
1,1584
|
0,9003
|
0,6997
|
0,5438
|
0,4227
|
0,3285
|
0,2553
|
0,1984
|
0,1542
|
0,1199
|
0,0932
|
0,0724
|
0,0563
|
0,0437
|
0,0340
|
0,0264
| |
24,00
|
10,9628
|
8,5203
|
6,6220
|
5,1467
|
4,0000
|
3,1088
|
2,4162
|
1,8779
|
1,4595
|
1,1343
|
0,8816
|
0,6852
|
0,5325
|
0,4139
|
0,3217
|
0,2500
|
0,1943
|
0,1510
|
0,1174
|
0,0912
|
0,0709
|
0,0551
|
0,0428
|
0,0333
|
0,0259
|
Tabelle 10: Faktoren für die Zunahme von Technetium-99m zu verschiedenen Zeitpunkten nach der vorherigen Elution (99mTc Halbwertszeit: 6,02 Stunden)
|
Stunden
|
Faktor
|
Stunden
|
Faktor
|
Stunden
|
Faktor
|
Stunden
|
Faktor
|
Stunden
|
Faktor
|
Stunden
|
Faktor
| |
1
|
0,094
|
9
|
0,579
|
17
|
0,788
|
25
|
0,879
|
33
|
0,918
|
41
|
0,935
| |
2
|
0,179
|
10
|
0,615
|
18
|
0,804
|
26
|
0,884
|
34
|
0,921
|
42
|
0,937
| |
3
|
0,256
|
11
|
0,648
|
19
|
0,818
|
27
|
0,892
|
35
|
0,924
|
43
|
0,938
| |
4
|
0,324
|
12
|
0,678
|
20
|
0,831
|
28
|
0,898
|
36
|
0,926
|
44
|
0,940
| |
5
|
0,386
|
13
|
0,705
|
21
|
0,843
|
29
|
0,903
|
37
|
0,929
|
45
|
0,941
| |
6
|
0,442
|
14
|
0,729
|
22
|
0,853
|
30
|
0,907
|
38
|
0,930
|
46
|
0,941
| |
7
|
0,492
|
15
|
0,751
|
23
|
0,863
|
31
|
0,911
|
39
|
0,932
|
47
|
0,941
| |
8
|
0,538
|
16
|
0,771
|
24
|
0,871
|
32
|
0,915
|
40
|
0,934
|
48
|
0,942
|
Wenn zu irgendeiner Zeit der Anwendung die Integrität des Generators oder der Durchstechflaschen zweifelhaft ist, sollten sie nicht verwendet werden. Die Verabreichung ist so durchzuführen, dass das Risiko einer Kontamination des Arzneimittels und einer Strahlenexposition der Anwender so gering wie möglich bleibt. Eine geeignete Abschirmung ist zwingend erforderlich.
Die Anwendung von radioaktiven Arzneimitteln setzt andere Personen einem Risiko durch externe Strahlung oder Kontamination durch Urin, Erbrochenes usw. aus. Daher müssen Strahlenschutzmaßnahmen gemäß nationalen Bestimmungen eingehalten werden.
Sichere Handhabung
Das Gewicht eines Generators beträgt ungefähr 16 kg. Beim Heben und Tragen des Generators ist auf Sicherheit zu achten. Um das Risiko von Verletzungen einzuschränken, sind die jeweils gültigen Vorschriften für eine sichere Handhabung zu beachten.
Entsorgung von Generatoren nach Ablauf der Verwendbarkeitsdauer:
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Genaue Anweisungen für die Rückgabe der Generatoren an den Hersteller sind jedem Generator beigepackt. Die Anwender werden darauf hingewiesen, dass Verpackung, Dokumentation und Transportart den internationalen Transportvorschriften und örtlich gültigen Vorschriften oder diesbezüglich zu beachtenden Verhaltenskodizes entsprechen müssen.
Rechtliche Bestimmungen
Strahlenschutzhinweis:
Die Anwendung radioaktiver Stoffe an Menschen ist durch die Strahlenschutzverordnung (SR 814.501) sowie die Verordnung über den Umgang mit offenen radioaktiven Strahlenquellen (SR 814.554) gesetzlich geregelt. Für den Umgang mit den radioaktiven Stoffen ist eine Bewilligung des Bundesamtes für Gesundheitswesen erforderlich. Beim Umgang mit radioaktiven Stoffen sowie der Beseitigung aller anfallenden radioaktiven Abfälle sind die Schutzvorkehrungen der obenerwähnten Verordnung zu beachten, um jede unnötige Strahlenbelastung von Patienten und Personal zu vermeiden.
Die nicht verbrauchten radioaktiven Lösungen und die mit diesen kontaminierten Gegenstände müssen, bis zum Abklingen der Aktivität auf die Freigrenze des Radionuklids, in einem für diese Zwecke eingerichteten Abklingraum aufbewahrt werden.
Zulassungsnummer65778 (A)
PackungenPackungsgrößen:
Radionuklidgenerator mit Aktivitäten von 2,3, 4,6, 5,7, 6,9, 8,5, 9,1, 11,4, 13,7, 14,9, 17,1, 19,4, 21,1, 22,9, 26,3, 28,6, 34,3, 40,0, 45,7 oder 57,1 GBq Molybdän-99 und entsprechenden variablen Technetium-99m-Aktivitäten am Kalibrierzeitpunkt. Die Aktivität des Generators zum Zeitpunkt der Kalibrierung ist auf jeder Packung angegeben.
Abgabekategorie A
Hersteller
National Centre for Nuclear Research, Polen
Zulassungsinhaberinmedeo AG, Schöftland, Schweiz
Stand der InformationDezember 2015
|

