ZusammensetzungWirkstoffe
Brivaracetam.
Hilfsstoffe
Filmtabletten:
Tablettenkern (alle Wirkstärken): Croscarmellose-Natrium, Lactose-Monohydrat, Betadex, Lactose, Magnesiumstearat.
Jede 10 mg Filmtablette enthält 0.6 mg Natrium.
Jede 25 mg Filmtablette enthält 0.75 mg Natrium.
Jede 50 mg Filmtablette enthält 1.5 mg Natrium.
Jede 75 mg Filmtablette enthält 2.25 mg Natrium.
Jede 100 mg Filmtablette enthält 3 mg Natrium.
Jede 10 mg Filmtablette enthält 87.85 mg Lactose.
Jede 25 mg Filmtablette enthält 94.57 mg Lactose.
Jede 50 mg Filmtablette enthält 188.15 mg Lactose.
Jede 75 mg Filmtablette enthält 282.97 mg Lactose.
Jede 100 mg Filmtablette enthält 377.3 mg Lactose.
Tablettenmantel (alle Wirkstärken): Polyvinylalkohol (40%), Titandioxid (E171), Macrogol 3350, Talkum und
25 mg: Eisenoxid gelb (E172), Eisenoxid schwarz (E172).
50 mg: Eisenoxid gelb (E172), Eisenoxid rot (E172).
75 mg: Eisenoxid gelb (E172), Eisenoxid rot (E172), Eisenoxid schwarz (E172).
100 mg: Eisenoxid gelb (E172), Eisenoxid schwarz (E172).
Lösung zum Einnehmen:
Natriumcitrat, Zitronensäure, Carmellose-Natrium, Sucralose, Sorbitol-Lösung (entspricht Sorbitol (E420) 167.9 mg/ml), Glycerol (E422), gereinigtes Wasser, Himbeeraroma, Methylparahydroxybenzoat (E218; 1 mg/ml).
Maximaler Natriumgehalt pro ml Lösung zum Einnehmen: 1.16 mg.
Injektionslösung:
Natriumacetat (-Trihydrat), Eisessig, Natriumchlorid, Wasser für Injektionszwecke
Maximaler Natriumgehalt pro ml Injektionslösung: 3.8175 mg.
Indikationen/AnwendungsmöglichkeitenBriviact wird angewendet zur Zusatzbehandlung fokaler Anfälle mit oder ohne sekundäre Generalisierung bei Erwachsenen, Jugendlichen und Kindern ab 2 Jahren mit Epilepsie.
Dosierung/AnwendungDie empfohlenen Dosierungen für Erwachsene, Jugendliche und Kinder ab 2 Jahren sind in der folgenden Tabelle zusammengefasst. Die Dosis soll zweimal täglich in zwei gleich grossen Dosen mit einem Abstand von etwa 12 Stunden verabreicht werden.
|
Empfohlene Anfangsdosis
|
Empfohlene Erhaltungsdosis
|
Therapeutischer Dosisbereich*
| |
Jugendliche und Kinder mit einem Körpergewicht ab 50 kg sowie Erwachsene
| |
50 mg/Tag (oder 100 mg/Tag)**
|
100 mg/Tag
|
50 – 200 mg/Tag
| |
Jugendliche und Kinder mit einem Körpergewicht ab 20 kg bis unter 50 kg
| |
1 mg/kg/Tag (bis zu 2 mg/kg/Tag)**
|
2 mg/kg/Tag
|
1 – 4 mg/kg/Tag
| |
Kinder mit einem Körpergewicht ab 10 kg bis unter 20 kg
| |
1 mg/kg/Tag (bis zu 2,5 mg/kg/Tag)**
|
2,5 mg/kg/Tag
|
1 – 5 mg/kg/Tag
|
* Je nach Ansprechen des einzelnen Patienten kann die Dosis in diesem effektiven Dosisbereich angepasst werden.
** Basierend auf der ärztlichen Beurteilung der benötigten Anfallskontrolle
Erwachsene
Die empfohlene Anfangsdosis beträgt 50 mg/Tag. Basierend auf der ärztlichen Beurteilung der benötigten Anfallsreduktion und unter Berücksichtigung möglicher unerwünschter Wirkungen kann auch mit 100 mg/Tag begonnen werden.
Je nach klinischem Ansprechen und Verträglichkeit kann die effektive Dosis im Dosierungsbereich von 50 mg/Tag bis 200 mg/Tag angepasst werden.
Jugendliche und Kinder mit einem Körpergewicht ab 50 kg
Die empfohlene Anfangsdosis beträgt 50 mg/Tag. Basierend auf der ärztlichen Beurteilung der benötigten Anfallskontrolle kann auch mit 100 mg Brivaracetam/Tag begonnen werden. Die empfohlene Erhaltungsdosis beträgt 100 mg/Tag. Je nach Ansprechen des einzelnen Patienten kann die Dosis im effektiven Dosisbereich von 50 mg/Tag bis 200 mg/Tag angepasst werden.
Jugendliche und Kinder mit einem Körpergewicht ab 20 kg bis unter 50 kg
Die empfohlene Anfangsdosis beträgt 1 mg/kg/Tag. Basierend auf der ärztlichen Beurteilung der benötigten Anfallskontrolle kann auch mit Dosen bis zu 2 mg Brivaracetam/kg/Tag begonnen werden. Die empfohlene Erhaltungsdosis beträgt 2 mg/kg/Tag. Je nach Ansprechen des einzelnen Patienten kann die Dosis im effektiven Dosisbereich von 1 mg/kg/Tag bis 4 mg/kg/Tag angepasst werden.
Kinder mit einem Körpergewicht ab 10 kg bis unter 20 kg
Die empfohlene Anfangsdosis beträgt 1 mg/kg/Tag. Basierend auf der ärztlichen Beurteilung der benötigten Anfallskontrolle kann auch mit Dosen bis zu 2,5 mg Brivaracetam/kg/Tag begonnen werden. Die empfohlene Erhaltungsdosis beträgt 2,5 mg/kg/Tag. Je nach Ansprechen des einzelnen Patienten kann die Dosis im effektiven Dosisbereich von 1 mg/kg/Tag bis 5 mg/kg/Tag angepasst werden.
Filmtabletten:
Der Arzt sollte die nach Körpergewicht und Dosis am besten geeignete Darreichungsform und Stärke verordnen.
Lösung zum Einnehmen:
Der Arzt sollte die nach Körpergewicht und Dosis am besten geeignete Darreichungsform und Stärke verordnen. Es wird empfohlen, dass Eltern oder Betreuer Briviact Lösung zum Einnehmen mit der in der Faltschachtel befindlichen Dosierhilfe (10ml- oder 5ml-Applikationsspritze für Zubereitungen zum Einnehmen) verabreichen.
Die Dosis pro Einnahme sollte für den jeweiligen Patienten nach folgender Formel berechnet werden:
Volumen je Anwendung (ml) = [Gewicht (kg) x Tagesdosis (mg/kg/Tag)] x 0,05
Briviact Lösung zum Einnehmen wird geliefert mit:
·einer 5-ml-Applikationsspritze (blaue Skala) mit Messstrichen in 0,1 ml-Abstufungen (jeder 0,1 ml-Messstrich entspricht 1 mg Brivaracetam). Ab 0,25 ml sind bis 5 ml weitere Abstufungen (bei 0,25 ml und 0,75 ml) markiert.
·einer 10-ml-Applikationsspritze (schwarze Skala) mit Messstrichen in 0,25 ml-Abstufungen (jeder 0,25 ml-Messstrich entspricht 2,5 mg Brivaracetam).
Der Arzt soll dem Patienten mitteilen, welche Spritze er am besten verwendet.
Wenn die berechnete Dosis pro Einnahme 5 mg (0,5 ml) oder mehr und bis zu 50 mg (5 ml) beträgt, ist die 5-ml-Applikationsspritze zu verwenden.
Wenn die berechnete Dosis pro Einnahme mehr als 50 mg (5 ml) beträgt, ist die grössere 10-ml-Applikationsspritze zu verwenden.
Die berechnete Dosis soll auf den nächsten Messstrich gerundet werden. Wenn das berechnete Volumen genau zwischen zwei Messstrichen liegt, ist der höhere Messstrich zu verwenden.
Die folgende Tabelle enthält Beispiele für das Volumen der Lösung zum Einnehmen pro Einnahme in Abhängigkeit von der verordneten Dosis und dem Körpergewicht. Das genaue Volumen der Lösung zum Einnehmen ist nach dem genauen Körpergewicht des Kindes zu berechnen.
Bitte beachten: Die Dosierung muss sich an der Skala der Spritzen orientieren. Beispiel: Wenn ein Patient eine Dosis von 2,15 ml benötigt, muss das zu verabreichende Volumen auf 2,2 ml aufgerundet werden, weil die 5-ml-Applikationsspritze nur 2,1 ml oder 2,2 ml abgeben kann. Ebenso würde ein Volumen von 1,13 ml auf ein zu verabreichendes Volumen von 1,1 ml abgerundet werden.
|
|
Volumen der Lösung zum Einnehmen pro Einnahme für Jugendliche und Kinder mit einem Gewicht ab 50 kg sowie Erwachsene
| |
Verordnete Dosis
|
Dosis von 50 mg/Tag
25 mg/
Einnahme
|
Dosis von 100 mg/Tag
50 mg/
Einnahme
|
Dosis von 150 mg/Tag
75 mg/ Einnahme
|
Dosis von 200 mg/Tag
100 mg/ Einnahme
| |
Empfohlene Spritze
|
5 ml
|
10 ml
| |
Körpergewicht
|
Verabreichtes Volumen
|
Verabreichtes Volumen
| |
Ab 50 kg
|
2,5 ml
(25 mg)
|
5 ml
(50 mg)
|
7,5 ml
(75 mg)
|
10 ml
(100 mg)
|
|
|
Volumen der Lösung zum Einnehmen pro Einnahme für Jugendliche und Kinder mit einem Gewicht ab 20 kg bis unter 50 kg
| |
Verordnete Dosis
|
Dosis von 1 mg/kg/Tag
0,05 ml/kg/Einnahme
(entspricht 0,5 mg/kg/Einnahme)
|
Dosis von 2 mg/kg/Tag
0,1 ml/kg/ Einnahme
(entspricht 1 mg/kg/ Einnahme)
|
Dosis von 3 mg/kg/Tag
0,15 ml/kg/ Einnahme
(entspricht 1,5 mg/kg/ Einnahme)
|
Dosis von 4 mg/kg/Tag
0,2 ml/kg/ Einnahme
(entspricht 2 mg/kg/ Einnahme)
| |
Empfohlene Spritze
|
5 ml
|
5 ml oder 10 ml*
| |
Körpergewicht
|
Verabreichtes Volumen
|
Verabreichtes Volumen
| |
20 kg
|
1 ml
(10 mg)
|
2 ml
(20 mg)
|
3 ml
(30 mg)
|
4 ml
(40 mg)
| |
25 kg
|
1,25 ml
(12,5 mg)
|
2,5 ml
(25 mg)
|
3,75 ml
(37,5 mg)
|
5 ml
(50 mg)
| |
30 kg
|
1,5 ml
(15 mg)
|
3 ml
(30 mg)
|
4,5 ml
(45 mg)
|
6 ml*
(60 mg)
| |
35 kg
|
1,75 ml
(17,5 mg)
|
3,5 ml
(35 mg)
|
5,25 ml*
(52,5 mg)
|
7 ml*
(70 mg)
| |
40 kg
|
2 ml
(20 mg)
|
4 ml
(40 mg)
|
6 ml*
(60 mg)
|
8 ml*
(80 mg)
| |
45 kg
|
2,25 ml
(22,5 mg)
|
4,5 ml
(45 mg)
|
6,75 ml*
(67,5 mg)
|
9 ml*
(90 mg)
| |
* Für Volumen über 5 ml und bis zu 10 ml soll der Patient angewiesen werden, die 10-ml-Applikationsspritze zu verwenden.
|
|
|
Volumen der Lösung zum Einnehmen pro Einnahme für Kinder mit einem Gewicht ab 10 kg bis unter 20 kg
| |
Verordnete Dosis
|
Dosis von 1 mg/kg/Tag
0,05 ml/kg/ Einnahme
(entspricht 0,5 mg/kg/ Einnahme)
|
Dosis von 2,5 mg/kg/Tag
0,125 ml/kg/ Einnahme
(entspricht 1,25 mg/kg/ Einnahme)
|
Dosis von 3 mg/kg/Tag
0,15 ml/kg/ Einnahme
(entspricht 1,5 mg/kg/ Einnahme)
|
Dosis von 4 mg/kg/Tag
0,2 ml/kg/ Einnahme
(entspricht 2 mg/kg/ Einnahme)
|
Dosis von 5 mg/kg/Tag
0,25 ml/kg/ Einnahme
(entspricht 2,5 mg/kg/ Einnahme)
| |
Empfohlene Spritze 5 ml
| |
Gewicht
|
Verabreichtes Volumen
| |
10 kg
|
0,5 ml
(5 mg)
|
1,25 ml
(12,5 mg)
|
1,5 ml
(15 mg)
|
2 ml
(20 mg)
|
2,5 ml
(25 mg)
| |
12 kg
|
0,6 ml
(6 mg)
|
1,5 ml
(15 mg)
|
1,8 ml
(18 mg)
|
2,4 ml
(24 mg)
|
3,0 ml
(30 mg)
| |
14 kg
|
0,7 ml
(7 mg)
|
1,75 ml
(17,5 mg)
|
2,1 ml
(21 mg)
|
2,8 ml
(28 mg)
|
3,5 ml
(35 mg)
| |
15 kg
|
0,75 ml
(7,5 mg)
|
1,9 ml
(19,0 mg)
|
2,25 ml
(22,5 mg)
|
3 ml
(30 mg)
|
3,75 ml
(37,5 mg)
|
Injektions-/Infusionslösung
Brivaracetam Injektions-/Infusionslösung ist eine alternative Art der Anwendung für Patienten, bei denen eine orale Anwendung vorübergehend nicht möglich ist. Es liegen keine Erfahrungen für eine zweimal tägliche intravenöse Anwendung von Brivaracetam für einen Zeitraum von mehr als 4 Tagen vor.
Versäumte Dosen
Patienten, die eine oder mehrere Dosen versäumt haben, sollten eine Einzeldosis einnehmen, sobald sie sich daran erinnern und im Anschluss daran die Behandlung mit der gewohnten Morgen- oder Abenddosis fortführen.
Absetzen der Behandlung
Falls Brivaracetam bei Patienten ab 16 Jahren abgesetzt werden muss, sollte dies ausschleichend erfolgen, mit einer Verringerung der Tagesdosis um 50 mg pro Woche.
Falls Brivaracetam bei Patienten unter 16 Jahren abgesetzt werden muss, sollte die Dosis pro Woche maximal um die Hälfte reduziert werden, bis eine Dosis von 1 mg/kg/Tag (bei Patienten mit einem Körpergewicht unter 50 kg) beziehungsweise 50 mg/Tag (bei Patienten mit einem Körpergewicht ab 50 kg) erreicht ist.
Nach 50 mg/Tag über eine Woche sollte eine weitere Woche mit 20 mg/Tag folgen, ehe gänzlich sistiert wird.
Anwendung
Brivaracetam kann mit oder ohne Nahrung eingenommen werden.
Die Dosis soll zweimal täglich in zwei gleich grossen Dosen mit einem Abstand von etwa 12 Stunden verabreicht werden.
Brivaracetam kann anfänglich intravenös oder oral verabreicht werden. Bei einem Wechsel der Verabreichungsform von oral zu intravenös oder umgekehrt sollte die gesamte Tagesdosis sowie die Häufigkeit der Verabreichung beibehalten werden. Die Brivaracetam-Injektionslösung ist eine Alternative für Patienten, bei denen die orale Gabe zeitweilig nicht möglich ist.
Filmtabletten:
Die Filmtabletten sind oral und unzerkaut mit Flüssigkeit einzunehmen.
Patienten, die die Tabletten nicht als Ganzes schlucken können, oder Patienten, für die, die passende Dosis nicht mit ganzen Tabletten zusammengestellt werden kann, sollten Briviact 10 mg/ml Lösung zum Einnehmen verwenden.
Lösung zum Einnehmen:
Brivaracetam Lösung zum Einnehmen kann kurz vor der Einnahme in Wasser oder Saft verdünnt und kann mit oder ohne Nahrung eingenommen werden (siehe Abschnitt «Pharmakokinetik»).
Eine Magen- oder PEG-Sonde kann zur Verabreichung der Lösung zum Einnehmen verwendet werden.
Die Briviact Lösung zum Einnehmen wird mit einer 5-ml- und 10-ml-Applikationsspritze mit zugehörigem Adapter bereitgestellt.
Injektionslösung:
Intravenöser Bolus:
Brivaracetam kann unverdünnt als intravenöser Bolus verabreicht werden.
Intravenöse Infusion:
Brivaracetam kann mit einer verträglichen Infusionslösung verdünnt [siehe «Hinweise für die Handhabung»] und als 15-minütige intravenöse Infusion verabreicht werden.
Nach intravenöser Applikation kann ein bitterer Geschmack auftreten.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Bei Patienten mit chronischen Lebererkrankungen wurde die Brivaracetam-Exposition entsprechend den Child-Pugh-Stadien A, B und C um 50%, 57% und 59% gegenüber den gesunden Kontrollgruppen erhöht.
Bei Patienten mit eingeschränkter Leberfunktion in allen Stadien werden folgende angepasste Dosen empfohlen, die aufgeteilt in 2 Dosen mit einem Abstand von etwa 12 Stunden eingenommen werden sollen (siehe Abschnitte «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik»). Es liegen keine klinischen Daten für pädiatrische Patienten mit eingeschränkter Leberfunktion vor.
|
Alter und Körpergewicht
|
Empfohlene Anfangsdosis
|
Empfohlene maximale Tagesdosis
| |
Jugendliche und Kinder mit einem Körpergewicht ab 50 kg sowie Erwachsene
|
50 mg/Tag
|
150 mg/Tag
| |
Jugendliche und Kinder mit einem Körpergewicht ab 20 kg bis unter 50 kg
|
1 mg/kg/Tag
|
3 mg/kg/Tag
| |
Kinder mit einem Körpergewicht ab 10 kg bis unter 20 kg
|
1 mg/kg/Tag
|
4 mg/kg/Tag
|
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit mild eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich. Patienten mit moderat oder schwer eingeschränkter Nierenfunktion sollen nicht mit Brivaracetam behandelt werden [siehe «Warnhinweise und Vorsichtsmassnahmen»].
Aufgrund fehlender Daten wird Brivaracetam nicht bei Dialyse-Patienten mit terminaler Niereninsuffizienz empfohlen. Es liegen keine klinischen Daten für pädiatrische Patienten mit eingeschränkter Nierenfunktion vor.
Ältere Patienten
Bei älteren Patienten ist keine Dosisanpassung erforderlich, solange sie eine ausreichend gute Nierenfunktion haben (Kreatinin-Clearance >50 ml/min) [siehe «Pharmakokinetische Eigenschaften»].
Die klinische Erfahrung mit Brivaracetam in älteren Patienten ≥65 Jahre ist limitiert. Eine Erstbehandlung von älteren Patienten ≥75 Jahre sollte nicht erfolgen [siehe «Klinische Wirksamkeit»].
Pädiatrische Patienten unter 2 Jahren
Die Wirksamkeit von Brivaracetam bei pädiatrischen Patienten jünger als 2 Jahre ist bisher noch nicht erwiesen. Zurzeit vorliegende Daten werden in den Abschnitten «Unerwünschte Wirkungen», «Eigenschaften/Wirkungen» und «Pharmakokinetik» beschrieben, eine Dosierungsempfehlung kann jedoch nicht gegeben werden.
KontraindikationenHypersensitivität gegenüber Brivaracetam bzw. verwandten Substanzen oder einem der Hilfsstoffe.
Warnhinweise und VorsichtsmassnahmenSuizidale Gedanken und Verhaltensweisen
Bei Patienten, die mit Antiepileptika behandelt werden, einschliesslich Brivaracetam, wurde von suizidalen Gedanken und suizidalem Verhalten bei verschiedenen Indikationen berichtet. Eine Metaanalyse randomisierter placebokontrollierter klinischer Studien mit antiepileptischen Arzneimitteln zeigte ebenfalls eine leichte Zunahme des Risikos für suizidale Gedanken und Verhaltensweisen. Der Risikomechanismus ist hier unbekannt und die verfügbaren Daten schliessen für Brivaracetam die Möglichkeit eines erhöhten Risikos nicht aus.
Aus diesem Grund sind die Anzeichen für suizidale Gedanken und Verhaltensweisen zu überwachen und eine angemessene Behandlung ist in Betracht zu ziehen. Die Patienten (und deren Betreuer) sind darauf hinzuweisen, beim Auftreten suizidaler Gedanken oder Verhaltensweisen sofort ärztlichen Rat zu suchen. Siehe Abschnitt «Unerwünschte Wirkungen», pädiatrische Daten.
Leberfunktionsstörung
Es liegen nur begrenzte klinische Daten bezüglich der Anwendung von Brivaracetam bei Patienten mit vorbestehenden Leberfunktionsstörungen vor.
Dosisanpassungen werden bei Patienten mit Leberfunktionsstörung empfohlen [siehe «Dosierung/Anwendung»].
Nierenfunktionsstörung
Es liegen nur begrenzte klinische Daten bezüglich der Anwendung von Brivaracetam bei Patienten mit moderat oder schwer eingeschränkter Nierenfunktion vor. Brivaracetam sollte bei Patienten mit moderat oder schwer eingeschränkter Nierenfunktion nicht verwendet werden [siehe «Pharmakokinetik/Nierenfunktionsstörung»].
Filmtabletten
Jede Filmtablette mit 10 mg, 25 mg, 50 mg, 75 mg und 100 mg Brivaracetam enthält entsprechend 88 mg, 95 mg, 188 mg, 283 mg bzw. 377 mg Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose- Malabsorption sollten dieses Arzneimittel nicht einnehmen.
Briviact Filmtabletten enthalten weniger als 1 mmol Natrium (23 mg) pro Tablette, d.h. es ist nahezu «natriumfrei».
Lösung zum Einnehmen
Die Lösung zum Einnehmen enthält Methylparahydroxybenzoat (E218), welches allergische Reaktionen, auch Spätreaktionen, auslösen kann.
Briviact Lösung zum Einnehmen enthält 167.9 mg Sorbitol pro 1 ml. Patienten mit hereditärer Fructoseintoleranz (HFI) dürfen dieses Arzneimittel nicht einnehmen.
Briviact Lösung zum Einnehmen enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d.h. es ist nahezu «natriumfrei».
Injektionslösung
Briviact Injektionslösung enthält weniger als 1 mmol (23 mg) Natrium pro Stechampulle (5 ml), d.h. es ist nahezu «natriumfrei».
InteraktionenIn-vitro Daten
Die Hydrolyse von Brivaracetam wird durch CYP-unabhängige Amidase vermittelt. Die Hydroxylierung von Brivaracetam scheint ein geringerer, hauptsächlich durch CYP2C19 vermittelter Eliminationsweg zu sein. CYP-vermittelte Oxidation ist für einen begrenzten Teil der Elimination von Brivaracetam verantwortlich. Aus diesem Grund ist es unwahrscheinlich, dass die Brivaracetam-Disposition durch CYP-Inhibitoren (z.B. CYP1A, 2C8, 2C9, 2C19, 2D6 und 3A4) signifikant beeinflusst wird.
Limitierte klinische Daten weisen darauf hin, dass bei gleichzeitiger Verabreichung von Cannabidiol, die Plasma Exposition von Brivaracetam erhöht sein kann. Dies ist möglicherweise, zumindest teilweise, durch eine Inhibition von CYP2C19 zu erklären. Die klinische Relevanz ist unklar.
Arzneimittelmetabolisierende Enzyminhibition
Es ist nicht zu erwarten, dass Brivaracetam die Clearance anderer, durch CYP450-Isoformen metabolisierte Arzneimittel hemmt oder induziert. Untersuchungen in vitro haben gezeigt, dass Brivaracetam bei therapeutischen Plasmakonzentrationen die CYP450-Isoformen (CYP1A2, 2A6, 2B6, 2C8, 2C9, 2D6, 3A4) geringfügig oder gar nicht hemmt.
Brivaracetam ist ein Epoxidhydrolase-Hemmer (IC50 = 8.2 µM), was annehmen lässt, dass Brivaracetam das Enzym in vivo hemmen kann.
Arzneimittelmetabolisierende Enzyminduktion
Brivaracetam hat bei einer Konzentration von bis zu 10 µM geringfügige oder keine Änderung der mRNA-Expression von CYP1A2, 2B6, 2C9, 2C19, 3A4 und der Epoxidhydrolase verursacht. Eine Induktion dieser Enzyme bei therapeutischen Brivaracetam-Konzentrationen (Cmax = 13 µM) kann nicht ausgeschlossen werden.
Transporter
Brivaracetam ist kein Substrat für PGP, MRP1 oder MRP2.
Brivaracetam hemmte nicht PGP, BCRP, BSEP, MRP2, MATE1, MATE2/K, OATP1B1, OATP1B3, OAT1, OCT1, OCT2 in vitro. Brivaracetam hemmte OAT3 mit einer halbmaximalen Hemmkonzentration, die 42-mal höher als das Cmax der höchsten klinischen Dosis war. Der Hauptmetabolit (Hydroxy-Metabolit) führte bei supratherapeutischen Konzentrationen zu einer statistisch signifikanten Hemmung von BCRP und OCT1 (15 bzw. 39% Hemmung) in vitro.
In-vivo Daten
Interaktionsstudien wurden nur mit Erwachsenen durchgeführt.
Wechselwirkung zwischen Brivaracetam und anderen Arzneimitteln
Tabelle 1 enthält eine Auflistung der nachgewiesenen oder potenziell klinisch bedeutsamen Wechselwirkungen, charakterisiert durch die Änderungen für AUC und Cmax mit dem Symbol «↔» (innerhalb), «↑» (oberhalb) oder «↓» (unterhalb) der vorbestimmten Äquivalenzgrenzen, das Verhältnis der geometrischen Mittelwerte der kleinsten Quadrate [geometrisches Mittel] mit und ohne interagierendem Arzneimittel sowie dem zugehörigen 90%-Konfidenzintervall.
Die beschriebenen Arzneimittelwechselwirkungen wurden entweder in Phase-1-Studien oder in einer gepoolten Analyse von Plasmawirkstoffkonzentrationen oder in populations-pharmakokinetischen Analysen von Phase-2/3-Studiendaten beobachtet.
Es ist keine Dosisanpassung erforderlich, wenn Brivaracetam gleichzeitig mit den in der Tabelle genannten Arzneimitteln angewendet wird, ausgenommen Rifampicin, Rifabutin und Rifapentin (siehe Tabelle 1).
Tabelle 1: Interaktionen zwischen Brivaracetam und anderen Arzneimitteln
Verhältnis der geometrischen Mittel von AUC und Cmax mit/ohne interagierendem Arzneimittel (90%-Konfidenzintervall)
|
Arzneimittel nach therapeutischer Anwendung
|
Auswirkungen des Arzneimittels auf die Plasmakonzentration von Brivaracetam
|
Auswirkungen von Brivaracetam auf die Plasmakonzentration des Arzneimittels
|
Empfehlung hinsichtlich der gleichzeitigen Anwendung mit Brivaracetam
| |
ANTIKONVULSIVA
| |
Carbamazepin
|
Carbamazepin
600 mg/Tag
AUC ↓ 0.74 (0.71; 0.77)
Cmax ↓ 0.87 (0.74; 1.02)
Carbamazepin
200-2400 mg/Tag
AUC ↓ 0.74 (0.72; 0.76)
|
Brivaracetam 400 mg/Tag
AUC ↔ 0.88 (0.85; 0.90)
Cmax ↔ 0.89 (0.86; 0.93)
Brivaracetam 50-200 mg/Tag
Css ↔ 0.94 (0.92; 0.96)
|
Keine Dosisanpassung erforderlich
| |
Carbamazepin-Epoxid
|
Nicht zutreffend
|
Brivaracetam
400 mg/Tag
AUC ↑ 2.57 (2.42; 2.74)
Cmax ↑ 2.64 (2.41; 2.89)
Brivaracetam
50-200 mg/Tag
Css ↑ 1.63 (1.58; 1.67)
|
Keine Dosisanpassung erforderlich.
Es wurde keine Toxizität in kontrollierten Studien festgestellt.
| |
Clobazam
|
Interaktion nicht untersucht
Erwartet: ↔
|
Brivaracetam
100-200 mg/Tag
Css ↔ 0.95 (0.85; 1.05)
|
Keine Dosisanpassung erforderlich
| |
Clonazepam
|
Interaktion nicht untersucht
Erwartet: ↔
|
Brivaracetam
100-200 mg/Tag
Css ↔ 0.98 (0.87; 1.11)
|
Keine Dosisanpassung erforderlich
| |
Lacosamid
|
Interaktion nicht untersucht
Erwartet: ↔
|
Brivaracetam
50-200 mg/Tag
Css ↔ 0.95 (0.90; 1.00)
|
Keine Dosisanpassung erforderlich
| |
Lamotrigin
|
Keine Interaktion
AUC ↔
|
Brivaracetam
50-200 mg/Tag
Css ↔ 1.08 (1.05; 1.11)
Brivaracetam 400 mg
AUC ↔ 1.17 (1.09; 1.25)
Cmax ↔ 1.10 (1.03; 1.17)
|
Keine Dosisanpassung erforderlich
| |
Levetiracetam
|
Keine Interaktion
AUC ↔
|
Brivaracetam
50-200 mg/Tag
Css ↔ 1.06 (0.99; 1.13)
|
Keine Dosisanpassung erforderlich
| |
Oxcarbazepin
|
Keine Interaktion
AUC ↔
|
Brivaracetam
50-200 mg/Tag
Css ↔ 1.01 (0.98; 1.05)
|
Keine Dosisanpassung erforderlich
| |
Phenobarbital
|
AUC ↓ 0.81 (0.76; 0.86)
|
Brivaracetam
50-200 mg/Tag
Css ↔ 1.02 (0.99; 1.05)
|
Keine Dosisanpassung erforderlich
| |
Phenytoin
|
Phenytoin
250-600 mg/Tag
AUC ↓ 0.79 (0.75; 0.83)
|
Brivaracetam
50-200 mg/Tag
Css ↔ 1.02 (0.91; 1.14)
Brivaracetam
400 mg/Tag
AUC ↑ 1.20 (1.01; 1.42)
Cmax ↑ 1.20 (1.03; 1.40)
|
Keine Dosisanpassung erforderlich
| |
Pregabalin
|
Interaktion nicht untersucht
Erwartet: ↔
|
Brivaracetam
50-200 mg/Tag
Css ↔ 1.12 (0.99; 1.27)
|
Keine Dosisanpassung erforderlich
| |
Topiramat
|
Keine Interaktion
AUC ↔
|
Brivaracetam
50-200 mg/Tag
Css ↔ 0.98 (0.94; 1.03)
Brivaracetam 400 mg
AUC ↔ 0.95 (0.89; 1.01)
Cmax ↔ 0.98 (0.93; 1.03)
|
Keine Dosisanpassung erforderlich
| |
Valproinsäure
|
Keine Interaktion
AUC ↔
|
Brivaracetam
50-200 mg/Tag
Css ↔ 1.00 (0.97; 1.03)
|
Keine Dosisanpassung erforderlich
| |
Zonisamid
|
Interaktion nicht untersucht
Erwartet: ↔
|
Brivaracetam
50-200 mg/Tag
Css ↔ 1.01 (0.95; 1.07)
|
Keine Dosisanpassung erforderlich
| |
BLUTFETTSENKENDE MITTEL/FIBRATE
| |
Gemfibrozil
|
Gemfibrozil 1200 mg/Tag
AUC ↔ 0.95 (0.93; 0.97)
Cmax ↔ 1.01 (0.94; 1.08)
|
Interaktion nicht untersucht
Erwartet: ↔
|
Keine Dosisanpassung erforderlich
| |
ANTIBIOTIKA GEGEN MYKOBAKTERIEN
| |
Rifampicin
|
Rifampicin 600 mg/Tag
AUC ↓ 0.55 (0.53; 0.58)
Cmax ↔ 0.89 (0.83; 0.95)
|
Interaktion nicht untersucht
Erwartet: ↔
|
Eine Erhöhung der Brivaracetam-Dosis sollte berücksichtigt werden.
| |
Rifabutin
Rifapentin
|
Interaktionen nicht untersucht
Erwartet: ↓
|
Interaktionen nicht untersucht
Erwartet: ↔
|
Eine Erhöhung der Brivaracetam-Dosis sollte berücksichtigt werden.
| |
PFLANZLICHE PRÄPARATE
| |
Johanniskraut
(Hypericum perforatum)
|
Interaktion nicht untersucht
Erwartet: ↓
|
Interaktion nicht untersucht
Erwartet: ↔
|
Eine Behandlung mit Johanniskraut sollte mit Vorsicht begonnen bzw. beendet werden.
| |
ORALE KONTRAZEPTIVA
| |
Levonorgestrel (LVN) Ethinylestradiol (EES)
|
LVN 150 µg/Tag
EES 30 µg/Tag
Ctrough ↔ 1.10 (1.01-1.20)
|
Brivaracetam
100 mg/Tag
EES AUC ↔ 0.90 (0.86; 0.95)
EES Cmax ↔ 0.96 (0.88; 1.04)
LVN AUC ↔ 0.92 (0.88; 0.97)
LVN Cmax ↔ 0.95 (0.91; 0.99)
Brivaracetam
400 mg/Tag
EES AUC ↓ 0.73 (0.69; 0.78)
EES Cmax ↓ 0.86 (0.79; 0.94)
LVN AUC ↓ 0.78 (0.72; 0.83)
LVN Cmax ↔ 0.90 (0.85; 0.95)
Keine Änderungen wurden in den endogenen Markern Estradiol, Progesteron, Luteinisierendes Hormon, Follikelstimulierendes Hormon und Sex Hormone Binding Globuline beobachtet.
|
Keine Dosisanpassung erforderlich.
Ein Wirkungsverlust oraler Kontrazeptiva nach Gabe von 200 mg Brivaracetam
pro Tag kann nicht ausgeschlossen werden.
| |
SCHLAFMITTEL
| |
Midazolam
|
Interaktion nicht untersucht
Erwartet: ↔
|
Brivaracetam
150 mg/Tag
AUC ↔1.08 (0.97; 1.21)
Cmax ↑ 1.49 (1.18; 1.87)
|
Keine Dosisanpassung erforderlich
|
Fussnoten:
·Die Effekte von Carbamazepin, Phenobarbital und Phenytoin auf Brivaracetam wurden in einer retrospektiven populations-pharmakokinetischen Analyse untersucht und waren statistisch signifikant.
·Die Effekte von Lamotrigin, Levetiracetam, Oxcarbazepin, Topiramat und Valproinsäure wurden in einer retrospektiven populations-pharmakokinetischen Analyse untersucht und waren statistisch nicht signifikant.
·Css = Steady-State-Plasmakonzentrationen aus dem therapeutischen Arzneimittel-Monitoring in Patienten; die Daten beziehen sich auf therapeutische Brivaracetam-Dosen von 50 bis 200 mg/TagCtrough = Konzentration vor Dosisgabe im Steady State
Sonstiges
Das Ausmass der Resorption von Brivaracetam wird von der Nahrung nicht beeinflusst.
Eine pharmakokinetische und pharmakodynamische Interaktionsstudie zwischen Brivaracetam 200 mg als Einzeldosis und Ethanol 0.6 g/l kontinuierliche Infusion in gesunden Probanden zeigt, dass Brivaracetam die Wirkung von Alkohol auf die psychomotorische Funktion, die Aufmerksamkeit und das Gedächtnis nahezu verdoppelt. Es gab keine gegenseitigen pharmakokinetischen Interaktionen. Eine Einnahme von Brivaracetam mit Alkohol wird nicht empfohlen.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter
Ärzte sollten die Familienplanung sowie die Empfängnisverhütung mit Frauen im gebärfähigen Alter, die Brivaracetam einnehmen, besprechen.
Da ein Wirkungsverlust oraler Kontrazeptiva nicht ausgeschlossen werden kann, sollten nicht-hormonelle Verhütungsmethoden verwendet werden.
Entscheidet sich eine Frau dazu schwanger zu werden, sollte die Anwendung von Brivaracetam sorgfältig neu bewertet werden.
Schwangerschaft
Es liegen keine ausreichenden Daten bezüglich der Anwendung von Brivaracetam bei Schwangeren vor.
Es gibt keine Daten bezüglich der Plazentagängigkeit im Menschen, aber es wurde in Ratten gezeigt, dass Brivaracetam durch die Plazenta geht (siehe «Präklinische Daten»). Das potenzielle Risiko für den Menschen ist unbekannt.
Bei Tierversuchen wurde weder bei Ratten noch bei Kaninchen ein teratogenes Potenzial von Brivaracetam nachgewiesen (siehe «Präklinische Daten»).
Brivaracetam wurde als Zusatztherapie in klinischen Studien verwendet und führte bei gleichzeitiger Einnahme von Carbamazepin zu einer dosisabhängigen Erhöhung der Konzentration des aktiven Metaboliten Carbamazepin-Epoxid (siehe «Interaktionen»). Es gibt keine ausreichenden Daten, um die klinische Bedeutung dieser Wirkung in der Schwangerschaft zu bestimmen.
Während der Schwangerschaft darf Brivaracetam nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Brivaracetam tritt in die menschliche Muttermilch über. Es muss daher eine Entscheidung getroffen werden, ob unter Berücksichtigung des Nutzens des Arzneimittels für die Mutter das Stillen oder die Gabe von Brivaracetam abgebrochen wird. Im Fall einer gleichzeitigen Anwendung von Brivaracetam und Carbamazepin kann sich der Gehalt an Carbamazepinepoxid, der in die Muttermilch abgegeben wird, erhöhen. Es liegen keine hinreichenden Daten vor, um die klinische Signifikanz zu bestimmen.
Fertilität
Es liegen keine Humandaten zur Wirkung von Brivaracetam auf die Fertilität vor. Bei Ratten gab es unter Brivaracetam keine Auswirkungen auf die Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien bezüglich der Wirkung auf die Fahrtüchtigkeit und das Bedienen von Maschinen durchgeführt.
Brivaracetam kann einen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen, haben.
Aufgrund einer möglichen individuell unterschiedlichen Empfindlichkeit können bei einigen Patienten zu Behandlungsbeginn oder nach einer Dosissteigerung Somnolenz, Schwindel und andere zentralnervöse Störungen auftreten. Patienten sollte nahegelegt werden, solange nicht Auto zu fahren und keine anderen potenziell gefährlichen Maschinen zu bedienen, bis sie die Auswirkung von Brivaracetam auf ihre Fähigkeit, solche Handlungen durchzuführen, kennen.
Unerwünschte WirkungenIn den kontrollierten und unkontrollierten Studien in Patienten mit Epilepsie haben insgesamt 2388 Patienten Brivaracetam erhalten. Von diesen Patienten, wurden 1740 ≥6 Monate, 1363 ≥12 Monate, 923 ≥24 Monate, 733 ≥36 Monate und 569 ≥60 Monate (5 Jahre) behandelt.
In gepoolten placebokontrollierten Zusatztherapie-Studien mit 1558 erwachsenen Patienten mit fokalen Anfällen (1099 Patienten erhielten Brivaracetam, 459 ein Placebo) traten bei 68.3% der mit Brivaracetam und bei 62.1% der mit Placebo behandelten Patienten unerwünschte Wirkungen auf.
Die am häufigsten berichteten unerwünschten Wirkungen (>10%) bei Brivaracetam waren Somnolenz (14.3%) und Schwindel (11.0%). Die Intensität war in der Regel leicht bis mässig. Somnolenz und Müdigkeit (8.2%) wurden bei höherer Dosis häufiger berichtet. Die Art der in den ersten 7 Behandlungstagen berichteten unerwünschten Wirkungen ähnelte der des gesamten Behandlungszeitraums.
Die Abbruchrate aufgrund von unerwünschten Wirkungen lag bei 6.0%, 7.4% bzw. 6.8% bei den Patienten, die 50 mg/Tag, 100 mg/Tag bzw. 200 mg/Tag Brivaracetam erhielten, und bei 3.5% bei den Patienten, die Placebo erhielten. Die unerwünschten Wirkungen, die am häufigsten zum Abbruch der Brivaracetam-Behandlung führten, waren Schwindel (0.8%) und Anfall (0.8%).
Die folgende Liste zeigt die unerwünschten Wirkungen in den gepoolten placebokontrollierten klinischen Studien bei Patienten ≥16 Jahre mit Brivaracetam nach Organsystemklasse und Häufigkeit.
Die Häufigkeiten sind wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100 bis <1/10), gelegentlich (≥1/1000 bis <1/100). In den einzelnen Häufigkeitsgruppen sind die Nebenwirkungen absteigend nach Schweregrad angegeben.
Infektionen und parasitäre Erkrankungen
Häufig: Grippe.
Erkrankungen des Immunsystems
Gelegentlich: Allergie vom Soforttyp I.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Neutropenie.
Stoffwechsel- und Ernährungsstörungen
Häufig: Verminderter Appetit.
Psychiatrische Erkrankungen
Häufig: Depression, Angst, Schlaflosigkeit, Reizbarkeit.
Gelegentlich: Suizidalität, Aggressivität, Agitation, psychotische Störungen.
Erkrankungen des Nervensystems
Sehr häufig: Schwindel, Somnolenz.
Häufig: Anfall, Vertigo.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Infektionen der oberen Atemwege, Husten.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Erbrechen, Konstipation.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Müdigkeit.
Beschreibung ausgewählter Nebenwirkungen
0.5% (6/1099) der Brivaracetam-Patienten und 0% (0/459) der Placebo-Patienten berichteten über Neutropenie. Vier dieser Patienten hatten eine verminderte Neutrophilenzahl bei Baseline, mit einer zusätzlichen Verminderung nach Beginn der Brivaracetam-Behandlung. Keiner dieser 6 Fälle war schwer, benötigte eine spezifische Behandlung, führte zu einem Therapieabbruch mit Brivaracetam oder war begleitet von Infektionen.
0.3% (3/1099) der Brivaracetam-Patienten und 0.7% (3/459) der Placebo-Patienten berichteten über suizidale Gedanken. Bei den klinischen Brivaracetam-Kurzzeitstudien mit Epilepsie-Patienten gab es keine Fälle von vollendetem Selbstmord oder Selbstmordversuchen. Von beidem wird jedoch in Open-Label-Extension-Studien (offenen Verlängerungsstudien) berichtet.
Bei einer kleinen Anzahl von Brivaracetam-Patienten (9/3022) sind während der klinischen Entwicklung Reaktionen aufgetreten, die auf Allergien vom Soforttyp (Typ I) schliessen lassen.
Pädiatrische Population
Das bei Kindern ab 1 Monat beobachtete Sicherheitsprofil von Brivaracetam stimmte mit dem bei Erwachsenen beobachteten Sicherheitsprofil überein. In offenen, nicht-kontrollierten Langzeitstudien wurden Suizidgedanken bei 4,7 % der pädiatrischen Patienten (untersucht ab 6 Jahren, häufiger bei Jugendlichen) im Vergleich zu 2,4 % bei Erwachsenen berichtet. Darüber hinaus wurden Verhaltensstörungen bei 24,8 % der pädiatrischen Patienten im Vergleich zu 15,1 % bei Erwachsenen berichtet. Die Mehrheit der unerwünschten Wirkungen war von leichter oder mittelschwerer Ausprägung, nicht schwerwiegend und führte nicht zum Absetzen der Medikation. Eine zusätzliche bei Kindern berichtete unerwünschte Wirkung war die psychomotorische Hyperaktivität (4,7 %). Darüber hinaus wurde in der pädiatrischen Patientenpopulation über eine Häufung von Appetitminderungen (10,1 %) berichtet, die mit der bei Erwachsenen beobachteten Häufigkeit vergleichbar ist.
Es wurde kein spezifisches Muster unerwünschter Ereignisse (UE) bei Kindern ab 1 Monat bis unter 4 Jahren im Vergleich zu älteren pädiatrischen Patientengruppen entdeckt. Es gab keine signifikanten Sicherheitsinformationen, die auf eine höhere Inzidenz eines bestimmten UE in dieser Altersgruppe hindeuten.
Da nur begrenzte Daten bei Kindern im Alter unter 2 Jahren vorliegen, ist Brivaracetam für diesen Altersbereich nicht indiziert. Es liegen nur sehr begrenzte klinische Daten zu Neugeborenen vor.
Intravenöse Verabreichung
Die Nebenwirkungen bei intravenöser Verabreichung ähnelten im Allgemeinen denen bei oraler Gabe. Bei der intravenösen Verabreichung kam es bei 2.8% der Patienten zu Schmerzen an der Infusionsstelle.
Open-Label-Extension-Studien
Das Sicherheitsprofil in den offenen Verlängerungsstudien (bis zu 8 Jahren) ähnelte dem, das bei den placebokontrollierten Kurzzeitstudien beobachtet wurde.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Es gibt nur begrenzte klinische Erfahrungen bei der Überdosierung von Brivaracetam beim Menschen. Ein gesunder Proband, der eine Einzeldosis von 1400 mg Brivaracetam bekam, berichtete über Somnolenz und Schwindel.
Behandlung
Es gibt kein spezifisches Gegenmittel zur Behandlung einer Brivaracetam-Überdosierung. Die Behandlung einer Überdosierung sollte allgemein unterstützende Massnahmen umfassen. Da Brivaracetam zu weniger als 10% mit dem Urin ausgeschieden wird, ist von einer Hämodialyse keine signifikante Verbesserung der Brivaracetam-Ausscheidung zu erwarten [siehe «Pharmakokinetische Eigenschaften»].
Eigenschaften/WirkungenATC-Code
N03AX23
Wirkungsmechanismus
Brivaracetam zeigt eine hohe und selektive Affinität zum synaptischen Vesikelprotein 2A (SV2A), ein Transmembranglykoprotein, welches präsynaptisch in Neuronen und in Endokrinzellen gefunden wird. Die Bindung an SV2A wird als der Hauptmechanismus für die antikonvulsive Aktivität von Brivaracetam angesehen.
Pharmakodynamik
Auswirkung auf das QT-Intervall
Es gab keine Hinweise in gesunden Probanden, dass Brivaracetam in den Dosen 150 mg/Tag und 800 mg/Tag (4-fache der empfohlenen täglichen Maximaldosis) das QTc-Intervall verlängert.
Klinische Wirksamkeit
Die Wirksamkeit von Brivaracetam in der Zusatztherapie fokal beginnender Anfälle wurde in 3 randomisierten, placebokontrollierten multizentrischen klinischen Doppelblindstudien (N01252, N01253 und N01358) mit fester Dosierung untersucht. Die tägliche Brivaracetam-Dosis lag bei diesen Studien zwischen 5 und 200 mg/Tag. Alle Studien hatten einen 8-wöchigen Baseline-Zeitraum, gefolgt von einer 12-wöchigen Behandlungsperiode ohne Hochtitrierung. Von den 1558 an der Studie teilnehmenden Patienten erhielten 1099 Brivaracetam. Die Teilnahmekriterien an der Studie erforderten, dass die Patienten trotz Behandlung mit 1 oder 2 begleitenden Antiepileptika an unkontrollierbaren fokal beginnenden Anfällen litten. Die Patienten mussten wenigstens 8 fokal beginnende Anfälle während des Baseline-Zeitraums haben.
Die am häufigsten genommenen Antiepileptika zum Studienbeginn waren Carbamazepin (40.6%), Lamotrigin (25.2%), Valproat (20.5%), Oxcarbazepin (16.0%), Topiramat (13.5%), Phenytoin (10.2%) und Levetiracetam (9.8%) [siehe «Klinische Wirksamkeit/Behandlung mit Levetiracetam»]. Die mediane Anfallsfrequenz im Baseline-Zeitraum über die drei Studien hinweg betrug 9 Anfälle in 28 Tagen. Die Patienten hatten eine mittlere Epilepsiedauer von ca. 23 Jahren.
Die Wirksamkeitsergebnisse sind in Tabelle 2 zusammengefasst.
Die Ergebnisse der prozentualen Reduzierung gegenüber dem Placebo in N01252 und N01253 basieren auf der Häufigkeit fokal beginnender Anfälle innerhalb von 28 Tagen, um einen Vergleich mit den Ergebnissen für N01358 zu ermöglichen, wenngleich die primäre Wirksamkeitsanalyse für N01252 und N01253 auf der Häufigkeit fokal beginnender Anfälle innerhalb von 7 Tagen beruhte. Die Ergebnisse bezüglich statistischer Signifikanzen wurden durch die Änderung der Dauer, auf die die Häufigkeit fokal beginnender Anfälle für N01252 und N01253 standardisiert wurde, nicht beeinflusst.
Tabelle 2: Die wichtigsten Wirksamkeitsergebnisse für die Häufigkeit fokal beginnender Anfälle innerhalb von 28 Tagen
|
Studie
|
Placebo
|
Brivaracetam
*Statistisch signifikant (p-Wert)
| |
50
mg/Tag
|
100 mg/Tag
|
200 mg/Tag
| |
Studie N01253(1)
| |
|
n = 96
|
n = 101
|
|
| |
Prozentuale Reduzierung gegenüber dem Placebo (%)
|
NA
|
22.0* (p=0.004)
|
~
|
~
| |
50% Ansprechrate** (%)
|
16.7
|
32.7* (p=0.008)
|
~
|
~
| |
Mediane prozentuale Reduktion ab Baseline (%)
|
17.8
|
30.5* (p=0.003)
|
~
|
~
| |
Studie N01252(1)
| |
|
n = 100
|
n = 99
|
n = 100
|
| |
Prozentuale Reduzierung gegenüber dem Placebo (%)
|
NA
|
9.2
(p=0.274)
|
20.5(2) (p=0.01)
|
~
| |
50% Ansprechrate** (%)
|
20.0
|
27.3
(p=0.372)
|
36.0(2) (p=0.023)
|
~
| |
Mediane prozentuale Reduktion ab Baseline (%)
|
17.0
|
26.8
(p=0.092)
|
32.5(2) (p=0.004)
|
~
| |
Studie N01358
| |
|
n = 259
|
|
n = 252
|
n = 249
| |
Prozentuale Reduzierung gegenüber dem Placebo (%)
|
NA
|
~
|
22.8* (p<0.001)
|
23.2* (p<0.001)
| |
50% Ansprechrate** (%)
|
21.6
|
~
|
38.9 (p<0.001)
|
37.8 (p<0.001)
| |
Mediane prozentuale Reduktion ab Baseline (%)
|
17.6
|
~
|
37.2* (p<0.001)
|
35.6* (p<0.001)
|
n = randomisierte Patienten, die mindestens eine Dosis der Studienmedikation erhalten haben
~ Dosis nicht getestet
* Statistisch signifikant
** 50% Ansprechrate: der prozentuale Anteil der Patienten, bei denen eine Reduktion der Häufigkeit fokal beginnender Anfälle von mindestens 50% innerhalb von 28 Tagen ab Baseline zur Behandlungsperiode stattgefunden hat
(1) etwa 20% der Patienten nahmen gleichzeitig Levetiracetam
(2) Das Primärergebnis von N01252 erreichte keine statistische Signifikanz auf Basis des sequenziellen Testverfahrens, das für 50 mg/Tag Brivaracetam eine statistische Signifikanz bei 0.050 gegenüber Placebo vor Tests mit 100 mg/Tag Brivaracetam erforderte. Die Dosis von 100 mg/Tag war nominell signifikant.
Abbildung 1 zeigt den prozentualen Anteil der Patienten (mit Ausnahme der Patienten mit zusätzlicher Levetiracetam-Behandlung) nach Kategorie der Reduktion der Häufigkeit fokal beginnender Anfälle innerhalb von 28 Tagen ab Baseline für alle drei Studien. Patienten mit einem Anstieg fokal beginnender Anfälle von mehr als 25% sind links mit «schlechte» (worse) ausgewiesen. Patienten mit einer prozentualen Verbesserung bei der Senkung der Häufigkeit fokal beginnender Anfälle ab Baseline sind in den vier rechten Kategorien dargestellt. Die prozentualen Anteile von Patienten mit einer Reduktion der Anfallshäufigkeit von mindestens 50% lagen bei 20.3%, 34.2%, 39.5% bzw. 37.8% bei Placebo, 50 mg/Tag, 100 mg/Tag bzw. 200 mg/Tag.
Abbildung 1: Prozentualer Anteil der Patienten nach Kategorie der Reduktion der Anfallshäufigkeit ab Baseline für Brivaracetam und Placebo über 12 Wochen in den drei doppelblinden pivotalen klinischen Studien
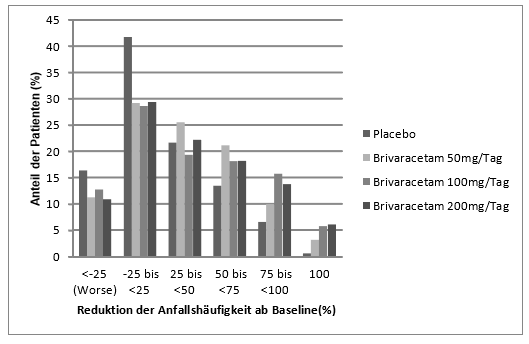
Die gepoolte Analyse der drei pivotalen Studien zeigt keine Unterschiede in der Wirksamkeit (gemessen an der 50% Ansprechrate), wenn Brivaracetam mit induzierenden oder nicht-induzierenden Antiepileptika kombiniert wurde.
In den klinischen Studien waren 2.5% (4/161), 5.1% (17/332) bzw. 4.0% (10/249) der Patienten, die 50 mg/Tag, 100 mg/Tag bzw. 200 mg/Tag Brivaracetam erhielten, während der 12-wöchigen Behandlungsperiode anfallsfrei im Vergleich zu 0.5% (2/418) beim Placebo.
Die Wirksamkeit von Brivaracetam als Monotherapie wurde nicht untersucht. Brivaracetam darf nicht in Monotherapie verabreicht werden.
Behandlung mit Levetiracetam
In den klinischen Studien N01252 und N01253 wurde bei ca. 20% der Patienten als begleitendes Antiepileptikum Levetiracetam verabreicht. Bei Patienten, die begleitend Levetiracetam erhielten, konnte kein signifikanter Nutzen von Brivaracetam gegenüber dem Placebo beobachtet werden. Keine zusätzlichen Bedenken bezüglich Sicherheit und Verträglichkeit wurden beobachtet.
In der dritten Studie (N01358) durfte Levetiracetam nicht als begleitendes Antiepileptikum gegeben werden. Eine zuvor festgelegte Analyse zeigte eine klinisch relevante Wirksamkeit von Brivaracetam gegenüber Placebo. Bei Patienten, die zuvor Levetiracetam erhalten hatten, war diese jedoch geringer als bei Patienten ohne vorangegangene Levetiracetam-Behandlung. Die an diesen Patienten beobachtete geringere Wirksamkeit im Vergleich zu Patienten, die Levetiracetam-naiv waren, ist wahrscheinlich auf die grössere Zahl vorheriger eingesetzter Antiepileptika und die höhere Anfallsfrequenz bei Baseline zurückzuführen.
In den gepoolten Daten zur Wirksamkeit wurden Patienten mit begleitender Levetiracetam-Einnahme ausgeschlossen.
Open-Label-Extension-Studien
Über alle Studien nahmen 81.7% der Patienten, die die randomisierten Studien abgeschlossen hatten, an den offenen Langzeit-Verlängerungsstudien teil. Ab Einschluss in die randomisierten Studien waren 5.3% der Probanden, die über einen Zeitraum von 6 Monaten Brivaracetam erhielten (n=1500), anfallsfrei im Vergleich zu 4.6% bzw. 3.7% der Probanden in einem Zeitraum von 12 (n=1188) bzw. 24 Monaten (n=847).
Missbrauchspotential
Zwar zeigte eine mit Brivaracetam durchgeführte Studie kein Missbrauchspotential, es kann jedoch noch nicht vollständig ausgeschlossen werden.
Abhängigkeit
In einer gepoolten Bewertung placebokontrollierter Zusatztherapiestudien gab es keine Hinweise auf körperliches Abhängigkeitspotential bzw. Entzugserscheinungen durch Brivaracetam.
Sicherheit und Wirksamkeit bei älteren Patienten
Ältere Menschen
An den drei placebokontrollierten klinischen Doppelblindstudien nahmen 38 (2.4%) ältere Menschen ≥65 Jahre teil. Davon wurden 30 Patienten ≥65 Jahre mit Brivaracetam behandelt. Insgesamt wurden 2 Patienten ≥75 Jahre mit Brivaracetam behandelt [siehe «Spezielle Dosierungsanweisungen/Ältere Patienten»].
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Kinder und Jugendliche
Bei Kindern ab 2 Jahren zeigen fokale Anfälle eine ähnliche Pathophysiologie wie bei Jugendlichen und Erwachsenen. Die Erfahrungen mit Antiepileptika legen nahe, dass die Ergebnisse von Wirksamkeitsstudien bei Erwachsenen auf Kinder ab einem Alter von 2 Jahren extrapoliert werden können, sofern die pädiatrischen Dosisanpassungen bestätigt wurden und die Sicherheit nachgewiesen wurde (siehe Abschnitte «Pharmakokinetik» und «Unerwünschte Wirkungen»). Die Dosierungen bei Patienten ab 2 Jahren wurden durch gewichtsbezogene Dosisanpassungen definiert, um ähnliche Plasmakonzentrationen zu erreichen, wie sie bei Erwachsenen unter wirksamen Dosen beobachtet wurden (siehe Abschnitt «Pharmakokinetik»).
Eine unkontrollierte, offene Langzeit-Sicherheitsstudie schloss Kinder (von 1 Monat bis unter 16 Jahren) ein, die nach Abschluss der PK-Studie (siehe Abschnitt «Pharmakokinetik») die Behandlung fortsetzten, Kinder, die nach Abschluss der IV-Sicherheitsstudie die Behandlung fortsetzten, sowie Kinder, die direkt in die Sicherheitsstudie aufgenommen wurden. Kinder, die direkt aufgenommen wurden, erhielten eine Anfangsdosis Brivaracetam von 1 mg/kg/Tag. Je nach Ansprechen und Verträglichkeit wurde die Dosis auf bis zu 5 mg/kg/Tag erhöht, indem sie in wöchentlichen Abständen verdoppelt wurde. Kein Kind erhielt eine Dosis von mehr als 200 mg/Tag. Bei Kindern mit einem Körpergewicht ab 50 kg betrug die Anfangsdosis Brivaracetam 50 mg/Tag. Je nach Ansprechen und Verträglichkeit wurde die Dosis in wöchentlichen Schritten von 50 mg/Tag bis auf maximal 200 mg/Tag erhöht.
Aus den gepoolten offenen Sicherheits- und PK-Studien zur Zusatztherapie erhielten 186 Kinder mit fokalen Anfällen im Alter von 1 Monat bis unter 16 Jahren Brivaracetam. Von diesen wurden 149 über einen Zeitraum von ≥3 Monaten, 138 über einen Zeitraum von ≥6 Monaten, 123 über einen Zeitraum von ≥12 Monaten, 107 über einen Zeitraum von ≥24 Monaten und 90 über einen Zeitraum von ≥36 Monaten behandelt.
PharmakokinetikAbsorption
Brivaracetam wird nach oraler Einnahme schnell und vollständig absorbiert. Die absolute Bioverfügbarkeit der Filmtablette beträgt 103%. Der mittlere tmax liegt bei den Filmtabletten nach nüchterner Gabe bei 1 Stunde (tmax-Bereich 0.25 bis 3 Std.).
Die gleichzeitige Einnahme einer fettreichen Mahlzeit verlangsamte die Absorptionsgeschwindigkeit von Brivaracetam, wobei der Absorptionsgrad unverändert blieb.
Die Filmtabletten, die Lösung zum Einnehmen und die Injektionslösung sind bioäquivalent.
Nach Gabe von Einzeldosen von 10 mg bis 600 mg steigt die Brivaracetam AUC proportional zur verabreichten Dosis an. Nach Gabe höherer Einzeldosen kommt es zu einem leicht überproportionalen Anstieg der AUC.
Nach Gabe von 2.5 mg bis 200 mg zweimal täglich (Tagesdosis 5 mg - 400 mg) über 10 bis 14 Tage steigt die Brivaracetam AUC ebenfalls proportional zur verabreichten Dosis an. Bei 400 mg zweimal täglich kommt es nach Mehrfachdosierung zu einem etwas weniger als dosisproportionalen Anstieg der Brivaracetam-Exposition.
Bei zweimal täglicher Dosierung wird der Steady State innerhalb von 2 Tagen erreicht.
Distribution
Brivaracetam ist schwach (≤20%) an Plasmaproteine gebunden. Das Verteilungsvolumen liegt bei 0.5 l/kg, nahe am Wert des Gesamtkörperwassers.
Metabolismus
Brivaracetam wird primär durch Hydrolyse der Amidgruppe zur Bildung der entsprechenden Carbonsäure umgewandelt und sekundär durch Hydroxylierung an der Propylseitenkette. Die Hydrolyse der Amidgruppe, die zum Carbonsäure-Metaboliten führt, wird durch hepatische und extrahepatische Amidase (EC3.5.1.4) unterstützt. In vitro wird die Hydroxylierung von Brivaracetam hauptsächlich durch CYP2C19 vermittelt. In vivo ist die Produktion des Hydroxy-Metaboliten bei menschlichen Probanden mit unwirksamen CYP2C19-Mutationen um das Zwei- oder Zehnfache verringert, wobei die Brivaracetam AUC bei Personen mit einem oder beiden Allelen mit Funktionsverlust um 22% bzw. 42% im Vergleich zu Probanden mit wild-Typen Enzym erhöht ist. Daher haben CYP2C19-Inhibitoren wahrscheinlich keine signifikante Auswirkung auf die Pharmakokinetik von Brivaracetam. Ein weiterer Metabolit (der Hydroxy-Säure-Metabolit) entsteht überwiegend durch Hydroxylierung der Propylseitenkette des Carbonsäure-Metaboliten (hauptsächlich durch CYP2C9). Die AUC der Hydroxy-, Säure- und Hydroxysäure-Metaboliten entsprechen bis 10%, 8% bzw. 2% der Muttersubstanz. Die 3 Metaboliten sind pharmakologisch inaktiv.
Elimination
Brivaracetam wird hauptsächlich über den Stoffwechsel und über den Urin ausgeschieden. Nach Gabe einer 14C-markierten Einzeldosis wurden 96.8% der verabreichten radioaktiven Dosis im Urin und 0.7% im Stuhl ausgeschieden. Im Urin wurde 34% der radioaktiven Dosis innerhalb von 48 Stunden als Carbonsäure-Metaboliten ausgeschieden. Der Anteil von unverändert im Urin ausgeschiedenem Brivaracetam lag bei 9%.
Die Plasmahalbwertzeit (t1/2) beträgt ca. 9 Stunden.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Eine pharmakokinetische Studie bei Patienten mit Leberzirrhose (Child-Pugh-Stadien A, B und C) zeigte eine ähnliche Zunahme der Brivaracetam-Exposition unabhängig von der Schwere der Erkrankung (50%, 57% und 59%) gegenüber gesunden Probanden. Dosisanpassungen werden bei Patienten mit Leberfunktionsstörung empfohlen [siehe «Dosierung/Anwendung»].
Nierenfunktionsstörungen
Eine Studie bei Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance <30 ml/min/1.73 m² und nicht dialysepflichtig) ergab, dass die Fläche unter der Plasma-Konzentrations-Zeit-Kurve für Brivaracetam verglichen mit den gesunden Kontrollpersonen leicht erhöht war (+21%), während die Fläche unter der Konzentrations-Zeit-Kurve der Säure-, Hydroxy- und Hydroxysäure-Metaboliten um das 3-, 4- bzw. 21-Fache gestiegen war. Die renale Clearance dieser nicht aktiven Metaboliten sank um das 10-Fache. Dosisanpassungen sind bei Patienten mit leichter Nierenfunktionsstörung nicht notwendig [siehe «Dosierung/Anwendung»]. Bei mittelschwerer bzw. schwerer Nierenfunktionsstörung soll Brivaracetam nicht verabreicht werden.
Brivaracetam wurde nicht bei Patienten unter Hämodialyse untersucht.
Ältere Patienten
Bei einer Studie mit älteren Patienten (65 bis 79 Jahre alt; mit einer Kreatinin-Clearance von 53 bis 98 ml/min/1.73 m²), die 400 mg/Tag Brivaracetam in zwei Tagesdosen erhielten, betrug die Plasmahalbwertzeit von Brivaracetam 7.9 Stunden bzw. 9.3 Stunden in den Altersgruppen 65 bis 75 bzw. >75 Jahre. Die Steady-State-Plasmaclearance von Brivaracetam lag etwas niedriger (0.76 ml/min/kg) als bei gesunden, jungen, männlichen Probanden (0.83 ml/min/kg). Dosisanpassungen sind nicht notwendig [siehe «Dosierung und Art der Verabreichung»].
Geschlecht
Es gibt für Brivaracetam keine geschlechtsspezifischen Unterschiede in der Pharmakokinetik.
Ethnische Herkunft
Die Pharmakokinetik von Brivaracetam wurde bei einer populations-pharmakokinetischen Modellierung der Daten von Epilepsie-Patienten durch die ethnische Herkunft nicht signifikant beeinflusst (weiss, schwarz/afroamerikanisch, asiatisch, indianisch [USA bzw. Alaska], spanisch/lateinamerikanisch).
Pädiatrische Population
In einer pharmakokinetischen Studie mit einem 3-wöchigen Evaluierungszeitraum und einer wöchentlich festgelegten 3stufigen Auftitration mit Brivaracetam Lösung zum Einnehmen wurden 99 Patienten im Alter von 1 Monat bis < 16 Jahren untersucht. Brivaracetam wurde bei wöchentlich steigenden Dosen von ungefähr 1 mg/kg/Tag, 2 mg/kg/Tag und 4 mg/kg/Tag verabreicht. Alle Dosen waren dem jeweiligen Körpergewicht angepasst und betrugen höchstens 50 mg/Tag, 100 mg/Tag und 200 mg/Tag. Am Ende des Evaluierungszeitraums konnten die Patienten für die Teilnahme an einer Langzeit-Nachbeobachtungsstudie geeignet sein, in der sie die Behandlung mit ihrer zuletzt erhaltenen Dosis fortsetzten (siehe Abschnitt «Unerwünschte Wirkungen»). Die Plasmakonzentrationen verhielten sich in allen Altersgruppen proportional zur Dosis. Basierend auf wenigen Plasmakonzentrationsdaten, die in der 3-wöchigen PK-Studie und der laufenden Langzeit-Follow-up-Studie gesammelt wurden, wurden Populations-Pharmakokinetik-Modelle erstellt. 232 pädiatrische Patienten mit Epilepsie im Alter von 2 Monaten bis 17 Jahren wurden in die Analyse aufgenommen. Die Analyse zeigte, dass Dosen von 5,0 mg/kg/Tag (Körpergewicht 10 kg bis 20 kg) und 4,0 mg/kg/Tag (Körpergewicht 20 kg bis 50 kg) dieselbe durchschnittliche Steady-State-Konzentration im Plasma ergeben wie bei Erwachsenen, die 200 mg/Tag erhalten. Die geschätzte Plasma-Clearance betrug 0,96 l/h, 1,61 l/h, 2,18 l/h bzw. 3,19 l/h bei Kindern mit einem Körpergewicht von 10 kg, 20 kg, 30 kg bzw. 50 kg. Im Vergleich dazu wurde die Plasma-Clearance bei erwachsenen Patienten (70 kg Körpergewicht) auf 3,58 l/h geschätzt. Zu Neugeborenen liegen derzeit keine klinischen Daten vor.
Präklinische DatenSicherheitspharmakologie
In konventionellen Studien zur Sicherheitspharmakologie waren die vorherrschenden Wirkungen ZNS-bezogen (vor allem transiente ZNS-Depression und verringerte spontane Bewegungsaktivität). Diese Auswirkungen wurden ab 100 mg/kg, einem Vielfachen (mehr als dem 50-Fachen) der pharmakologisch wirksamen Dosis von 2 mg/kg beobachtet. Darüber hinaus beeinträchtigte Brivaracetam nicht die Lern- und Gedächtnisfunktion.
Akute Toxizität
Die maximale nicht-tödliche orale Dosis bei Ratten nach einmaliger Verabreichung lag bei >1000 mg/kg. Bei einer Dosis von 500 mg/kg wurden keine Toxizitätssignale identifiziert.
Langzeittoxizität (bzw. Toxizität bei wiederholter Verabreichung)
In Ratten und Affen wurden keine unerwünschten Leberveränderungen nach chronischer Gabe von Brivaracetam bei Expositionen beobachtet, die deutlich über (5- bis 42-fach) der menschlichen Exposition bei einer klinischen Dosis von 200 mg/Tag waren. Bei Hunden führte die Verabreichung von Brivaracetam zu hepatotoxischen Effekten, vor allem Porphyrie, bei einer Exposition, die ähnlich war wie die menschliche Exposition bei einer klinischen Dosis von 200 mg/Tag. Die zu Brivaracetam und einer strukturell verwandten Verbindung gesammelten Daten zeigen jedoch, dass die Leberveränderungen (vor allem die Porphyrie) bei Hunden offenbar durch Mechanismen hervorgerufen wurden, die für den Menschen nicht relevant sind.
Mutagenität
Untersuchungen in vitro an Bakterien und Säugerzellen und in vivo in Ratten und Mäusen ergaben keine Hinweise auf Mutagenität oder Klastogenität.
Karzinogenität
Eine Kanzerogenitätsstudie an Ratten ergab keinen Hinweis auf ein karzinogenes Potenzial. Eine Untersuchung in Mäusen zeigte einen leichten Anstieg der Häufigkeit von Lebertumoren bei männlichen Mäusen, der als das Ergebnis eines nicht-genotoxischen Wirkmechanismus in Zusammenhang mit einer Phenobarbital-ähnlichen Leberenzyminduktion, einem bekannten Nagetier-spezifischen Phänomen, betrachtet wurde.
Reproduktionstoxizität
Brivaracetam hatte keine Auswirkungen auf die männliche oder weibliche Fruchtbarkeit und zeigte weder bei Ratten noch bei Kaninchen ein teratogenes Potenzial. In Kaninchen wurde eine Embryotoxizität bei maternaltoxischen Dosen beobachtet, die dem 8-Fachen der klinischen Exposition entsprachen. Es wurde in Ratten gezeigt, dass Brivaracetam durch die Plazenta geht und in die Muttermilch übertritt.
Toxizitätsprüfungen mit juvenilen Tieren
Bei jungen Ratten (höchste Dosis: 600 mg/kg/Tag) führte Brivaracetam bei 6- bis 15-facher Exposition im Vergleich zur klinischen Exposition (AUC) bei maximal empfohlener Dosis zu Entwicklungsstörungen (d.h. Mortalität, klinische Zeichen, reduziertes Körpergewicht und geringeres Gehirngewicht). Nebenwirkungen auf die ZNS-Funktion oder die Ergebnisse neuropathologischer und hirn-histopathologischer Untersuchungen wurden nicht beobachtet. Der NOAEL wurde bei 300 mg/kg/Tag angesetzt (entsprechend dem 3- bis 20-Fachen der menschlichen Exposition bei einer klinischen Dosis von 200 mg/Tag).
Bei jungen Hunden führte eine Dosis von 100 mg/kg/Tag zu unerwünschten Leberveränderungen ähnlich wie bei erwachsenen Tieren. Es gab keine negativen Auswirkungen auf die Standardparameter von Wachstum und Entwicklung. Der NOAEL wurde bei 30 mg/kg/Tag angesetzt (entsprechend dem 1- bis 3-Fachen der menschlichen Exposition bei einer klinischen Dosis von 200 mg/Tag). Eine ähnliche Brivaracetam-Exposition wurde bei jungen und erwachsenen Tieren beim NOAEL erreicht, ausser am Tag 4 nach der Geburt (PND4), an dem die Exposition höher war als bei erwachsenen Tieren.
Weitere Daten
Studien an Ratten zeigten kein Missbrauchs- oder Abhängigkeitspotential.
Sonstige HinweiseInkompatibilitäten
Die Briviact Injektionslösung darf nicht mit weiteren Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Lösung zum Einnehmen:
Nach dem ersten Öffnen: innert 5 Monaten aufbrauchen.
Besondere Lagerungshinweise
Filmtabletten:
Nicht über 30 °C lagern.
Lösung zum Einnehmen und Injektionslösung:
Bei 15-30 °C lagern.
Lösung zum Einnehmen:
Im Originalbehälter lagern.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Injektionslösung
Da die Briviact Injektionslösung für Einmalgebrauch ist und kein Konservierungsmittel enthält, ist die Lösung unmittelbar nach dem Brechen des Siegels der Durchstechflasche zu verwenden und die ungebrauchte Lösung ist zu verwerfen. Die Injektionslösung soll bei erkennbaren Schwebstoffen oder Verfärbung nicht verwendet werden.
Verdünnung mit Infusionslösungen:
Briviact Injektionslösung kann mit Natriumchlorid Infusionslösung 9 mg/ml (0.9%), Glukose Infusionslösung 50 mg/ml (5%) und Ringer-Laktat Infusionslösung verdünnt werden. Die physikalische und chemische Stabilität der verdünnten Lösungen, gelagert in PVC- oder Polyolefin-Beuteln bei Raumtemperatur, wurde für 24 Stunden im Konzentrationsbereich von 0.1 bis 1.5 mg Brivaracetam pro Milliliter gezeigt.
Die verdünnten Lösungen sind nicht konserviert und sollten aus mikrobiologischen Gründen unmittelbar nach der Verdünnung verwendet werden, ausser die Methode der Verdünnung schliesst das Risiko einer mikrobiologischen Kontamination aus. Falls die verdünnte Lösung nicht unmittelbar nach der Verdünnung verwendet wird, liegen Aufbrauchsfristen und Lagerungsbedingungen in der Verantwortung des Anwenders.
Zulassungsnummer65830, 65831, 65832 (Swissmedic).
PackungenFilmtabletten:
10 mg: Packungen mit 14 Filmtabletten [B]
25 mg, 50 mg, 75 mg und 100 mg: Packungen mit 56 Filmtabletten [B]
Spitalpackungen mit 14 einzelnen Filmtabletten à 25 mg, 50 mg, 75 mg und 100 mg [B]
Lösung zum Einnehmen (10 mg/ml):
Packung mit 300 ml Lösung mit einer 5 ml- (blaue Skala) und einer 10 ml Applikationsspritze (schwarze Skala) aus Polypropylen/Polyethylen und Adapter aus Polyethylen [B]
Injektionslösung (50 mg/5 ml):
Packung mit 10 Durchstechflaschen à 5 ml [B]
ZulassungsinhaberinUCB-Pharma AG, Bulle.
Stand der InformationNovember 2023
|

