ZusammensetzungWirkstoffe
Cholecalciferol
Hilfsstoffe
Raffiniertes Olivenöl
Indikationen/Anwendungsmöglichkeiten-Prophylaxe einer Rachitis oder Osteomalazie bei Kindern und Erwachsenen
-Prophylaxe einer Rachitis bei Frühgeborenen
-Prophylaxe eines Vitamin-D-Mangels bei ansonsten Gesunden ohne Resorptionsstörung mit entsprechendem Risiko
-Prophylaxe eines Vitamin-D-Mangels bei Patienten mit Malabsorption
-Therapie einer Rachitis oder Osteomalazie bei Kindern und Erwachsenen
Dosierung/AnwendungBei nachgewiesener Rachitis bzw. Osteomalazie sowie bei Patienten mit nachgewiesenem schwerem Vitamin D-Mangel (d.h. 25(OH)D-Konzentration <25nmol/l bzw. <10ng/ml) sollte die Behandlung nur unter ärztlicher Aufsicht erfolgen.
DIBASE sollte vorzugsweise zusammen mit einer Mahlzeit eingenommen werden.
Zur Art der Anwendung siehe „Sonstige Hinweise“, Abschnitt „Hinweise für die Handhabung“. Das Produkt sollte vor dem Gebrauch geschüttelt werden.
DIBASE schmeckt nach Olivenöl. DIBASE kann direkt eingenommen oder unmittelbar vor dem Einnehmen mit einer kleinen Menge einer kalten oder lauwarmen Speise gemischt werden, um die Einnahme zu erleichtern. Der Patient sollte darauf achten, die gesamte Dosis einzunehmen.
Kindern, die nicht gestillt werden, sollte die verordnete Dosis mit einer Mahlzeit verabreicht werden. Dabei kann DIBASE mit einer kleinen Menge Kindernahrung, Joghurt, Milch, Käse oder anderen Milchprodukten gemischt werden. Die Eltern sollten sicherstellen, dass das Kind die vollständige Dosis einnimmt.
DIBASE sollte nicht in eine Milchflasche oder in ein Behältnis mit weichen Speisen gegeben werden, da das Kind möglicherweise nicht die ganze Portion zu sich nimmt und dann nicht die vollständige Dosis erhält.
Prophylaxe
Frühgeborene:
2-4 Tropfen (entsprechend 400-800 I.E.) pro Tag bis zum Ende des ersten Lebensjahres
Säuglinge von 0-1 Jahren:
2 Tropfen (entsprechend 400 I.E.) pro Tag
Kinder und Jugendliche im Alter von 1-18 Jahren:
3 Tropfen (entsprechend 600 I.E.) pro Tag
Erwachsene von 19-59 Jahren:
3 Tropfen (entsprechend 600 I.E.) pro Tag
Erwachsene ≥60 Jahre:
4 Tropfen (entsprechend 800 I.E.) pro Tag
Schwangere und stillende Frauen:
2 Tropfen (entsprechend 400 I.E.) pro Tag
Erwachsene mit Malabsorption:
15-20 Tropfen (entsprechend 3000-4000 I.E.) pro Tag
Therapie
Säuglinge von 0-1 Jahren:
2-5 Tropfen (entsprechend 400-1000 I.E.) pro Tag
Kinder und Jugendliche im Alter von 1-18 Jahren:
Therapie der Rachitis:
5-25 Tropfen (entsprechend 1000-5000 I.E.) pro Tag während der ersten 6 Wochen, gefolgt von 3-5 Tropfen (entsprechend 600-1000 I.E.) pro Tag
Erwachsene:
Therapie des schweren Vitamin D-Mangels mit erkennbarem Risiko einer Vitamin D-Mangelerkrankung:
7-10 Tropfen (entsprechend 1400-2000 I.E.) pro Tag
Therapie der Osteomalazie:
5-20 Tropfen (entsprechend 1000-4000 I.E.) pro Tag
Schwangere:
7-10 Tropfen (entsprechend 1400-2000 I.E.) pro Tag (siehe auch „Schwangerschaft / Stillzeit“)
Patienten mit Leberfunktionsstörungen
Zur Pharmakokinetik, Wirksamkeit und Sicherheit von Vitamin D3 bei Patienten mit eingeschränkter Leberfunktion liegen keine Daten vor. Aufgrund der vorliegenden Erfahrungen ist jedoch keine Dosisanpassung erforderlich.
Patienten mit Nierenfunktionsstörungen
Die Behandlung sollte mit Vorsicht und unter regelmässiger Kontrolle der Kalzium- und Phosphatspiegel erfolgen (siehe „Warnhinweise und Vorsichtsmassnahmen“).
Kontraindikationen-Hyperkalzämie, Hyperkalziurie
-Hypervitaminose D
-Neigung zur Bildung kalziumhaltiger Nierensteine
-Pseudo-Hypoparathyreoidismus
gestörte renale Kalzium- und Phosphatausscheidung
akute Lungentuberkulose
-Rachitisprophylaxe beim Säugling und Kleinkind bei Vorliegen einer Hypothyreose oder idiopathischen Hyperkalzämie
längerfristig immobilisierte Patienten (z.B. nach orthopädischen Korrektur-Operationen oder bei Skelettaffektionen mit Bettlägrigkeit)
gleichzeitige Behandlung mit Benzothiadiazin-Derivaten
gleichzeitige Gabe von Vitamin D-Analoga
-Überempfindlichkeit gegenüber dem Wirkstoff Cholecalciferol (Vitamin D3) oder einem der sonstigen Bestandteile des Produktes
Warnhinweise und VorsichtsmassnahmenVitamin D bewirkt eine erhebliche Steigerung der Kalziumresorption. In hohen Dosen sind alle D-Vitamine toxisch. Im Falle einer Langzeitbehandlung mit Tagesdosen über 1'000 IE Vitamin D3 müssen daher die Kalzium- und Phosphatkonzentrationen im Serum sowie die Nierenfunktion überwacht werden. Dies gilt insbesondere bei älteren Patienten.
Im Falle einer Hyperkalzämie oder Anzeichen einer verminderten Nierenfunktion muss die Dosis verringert oder die Behandlung abgebrochen werden. Eine Dosisreduktion (bzw. ein vorübergehendes Absetzen) empfiehlt sich, wenn die Kalzium-Konzentration im Urin 7.5mmol/ 24 Stunden (entsprechend 300mg/24 Std.) überschreitet.
Bei Patienten mit Sarkoidose sollte DIBASE aufgrund einer möglichen Steigerung der Metabolisierung von Vitamin D3 zu seiner aktiven Form nur mit Vorsicht verordnet werden. Bei diesen Patienten muss die Kalziumkonzentration in Serum und Urin regelmässig überwacht werden.
Bei Patienten mit eingeschränkter Nierenfunktion sollte Vitamin D3 mit Vorsicht angewendet werden. Bei diesen Patienten muss der Kalzium- und Phosphatspiegel sowie die Nierenfunktion überwacht werden. Das Risiko einer Weichteil-Kalzifizierung sollte berücksichtigt werden.
Der ursächliche Zusammenhang zwischen einer ergänzenden Zufuhr von Vitamin D3 und einer Nephrolithiasis ist nicht eindeutig belegt, das Risiko ist aber plausibel, vor allem im Kontext einer begleitenden Kalziumsupplementierung. Die Notwendigkeit einer zusätzlichen Kalziumsupplementierung sollte für jeden Patienten individuell abgewogen werden. Die Gabe von Kalzium-Ergänzungspräparaten sollte unter engmaschiger ärztlicher Überwachung erfolgen.
Bei gleichzeitiger Anwendung von Herzglykosiden ist aufgrund eines erhöhten Risikos für Arrhythmien Vorsicht geboten (siehe „Interaktionen“).
Vorsicht ist ausserdem geboten bei Patienten mit Störungen des Kalziumstoffwechsels, Arteriosklerose, Koronarer Herzerkrankung oder Nephrolithiasis.
Bei der Einnahme von DIBASE ist darauf zu achten, dass keine anderen Vitamin-D-haltigen Arzneimittel angewendet werden. Die Vitamin D3-Menge, die in Form von mit Vitamin D3 angereicherten Lebensmitteln (z.B. Milch, Fetten, Säuglingspräparaten) zugeführt wird, muss bei der Festlegung der Dosis berücksichtigt werden. Insbesondere kann bei Verwendung von Säuglingspräparaten, welche mit Vitamin D3 angereichert sind, die zusätzliche prophylaktische Vitamin D-Zufuhr entsprechend reduziert werden.
Die Patienten, insbesondere solche unter einer Dauertherapie mit höheren Dosen, sollten auf die möglichen Symptome einer Überdosierung (wie Müdigkeit, Schläfrigkeit, Kopfschmerzen, Appetitlosigkeit, Übelkeit, Erbrechen, Diarrhoe gefolgt von Obstipation, Muskel- und Gelenkschmerzen, Muskelschwäche, Polydipsie, Polyurie) hingewiesen werden.
InteraktionenPharmakokinetische Interaktionen
Bei gleichzeitiger Anwendung von Arzneimitteln, welche Leberenzyme induzieren, wie Antikonvulsiva (z.B. Phenytoin) oder Barbiturate, kann die Wirkung von Vitamin D3 aufgrund eines beschleunigten Metabolismus reduziert sein.
Bei gleichzeitiger Behandlung mit Ionenaustauscherharzen wie Cholestyramin, Colestipolhydrochlorid oder Orlistat sowie mit Laxantien wie Paraffinöl kann die Absorption von Vitamin D3 im Gastrointestinaltrakt reduziert sein.
Imidazol-Antimykotika beeinflussen die Aktivität von Vitamin D3 durch Hemmung der Umwandlung von 25-Hydroxy-Vitamin D3 zu 1,25-Dihydroxy-Vitamin D3 durch das Nierenenzym 25-Hydroxy-Vitamin D3 -1-Hydroxylase.
Pharmakodynamische Interaktionen
Bei gleichzeitiger Behandlung mit Digitalis oder anderen Herzglykosiden kann das Risiko einer Digitalis-Toxizität (Arrhythmien) erhöht sein. Der Patient ist von ärztlicher Seite streng zu überwachen, ggf. mit Kontrollmessungen der Kalziumkonzentration im Serum und EKG.
Bei gleichzeitiger Behandlung mit Thiazid-Diuretika ist die Kalzium-Ausscheidung mit dem Urin reduziert.
Bei gleichzeitiger Anwendung von Glukokortikoiden kann die Wirkung von Vitamin D3 reduziert sein.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen nur limitierte Daten zur Anwendung von Cholecalciferol (Vitamin D3) bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe „Präklinische Daten“). Langanhaltende Überdosierungen von Vitamin D müssen in der Schwangerschaft vermieden werden, da die daraus resultierende Hyperkalzämie beim Kind zu einer supravalvulären Aortenstenose und einer Retinopathie sowie zu körperlicher und geistiger Retardierung führen kann.
Während einer Schwangerschaft sollte DIBASE daher nur nach strenger Indikationsstellung und unter ärztlicher Überwachung angewendet und nur so niedrig dosiert werden, wie dies zum Beheben des Vitamin D-Mangels unbedingt notwendig ist. Zur Prophylaxe sollte bei Schwangeren eine Tagesdosis von 400 IE nicht überschritten werden. Zur Behandlung eines bereits manifesten Vitamin D-Mangels können, je nach Grunderkrankung und Schwere des Vitamin D-Mangels, unter entsprechender Überwachung des Kalzium- und Phosphat-Haushalts Tagesdosen bis 2000 I.E. (entsprechend 10 Tropfen) angewendet werden (siehe „Dosierung / Anwendung“). Eine Überdosierung muss vermieden werden.
Stillzeit
Vitamin D3 und seine Metaboliten treten in die Muttermilch über. Fälle einer Überdosierung bei Säuglingen über die Muttermilch sind jedoch nicht bekannt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt. Eine Auswirkung auf die Verkehrstüchtigkeit ist jedoch unwahrscheinlich.
Unerwünschte WirkungenListe der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
„sehr häufig“ (≥1/10)
„häufig“ (≥1/100, <1/10),
„gelegentlich“ (≥1/1‘000, <1/100)
„selten“ (≥1/10‘000, <1/1‘000)
„sehr selten“ (<1/10‘000)
Stoffwechsel- und Ernährungsstörungen:
Gelegentlich: Hyperkalzämie, Hyperkalzurie
Erkrankungen der Haut und des Unterhautgewebes:
Selten: Hautausschlag, Pruritus, Urtikaria.
Die übrigen unerwünschten Wirkungen stellen Folge einer Überdosierung dar (siehe „Überdosierung“).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Eine Überdosierung von Vitamin D führt zu einer Hyperkalzämie und Hyperkalziurie. Die Symptome einer Vitamin D-Überdosierung sind uncharakteristisch. Es kann zu Müdigkeit, Schwäche, Schläfrigkeit, Reizbarkeit, Appetitlosigkeit, Kopfschmerzen, Schwindel, Tinnitus, Ataxie, Arrhythmien, Mundtrockenheit bzw. Durstgefühl, metallischem Geschmack, Bauchkrämpfen, Übelkeit, Erbrechen, Diarrhoe, Obstipation, Exanthemen, Polyurie, Azidose, Muskel- und Knochenschmerzen sowie bei Kindern zu Hypotonie kommen. In schweren Fällen sind auch psychische Veränderungen sowie Bewusstseinsstörungen möglich.
Eine chronische Überdosierung kann mit einer Verschlechterung der Nierenfunktion, Nephrocalcinose, Gewichtsveränderungen, Pankreatitis, Anämie und Krampfanfällen einhergehen. Bei Kindern kann es zu einem verzögerten Wachstum, bei Erwachsenen zu einer Osteoporose kommen. Darüber hinaus kann die Hyperkalzämie zu Kalzifikationen in Gefässen und Organen führen.
Die Anwendung von DIBASE ist zu beenden, wenn die Kalzium-Konzentration 10,6 mg/dl (2,65 mmol/l) im Serum und/oder 300 mg/24 Stunden im Urin bei Erwachsenen bzw. 4-6 mg/kg/Tag bei Kindern überschreitet.
Da Cholecalciferol im Körper gespeichert wird, kann eine Hyperkalzämie infolge chronischer Vitamin D-Überdosierung über mehrere Wochen bis Monate anhalten.
Behandlung
Es existiert kein spezifisches Antidot. Im Vordergrund steht die Behandlung der Hyperkalzämie.
Als erste Massnahme ist das Präparat (sowie sämtliche zusätzlichen Kalziumpräparate) abzusetzen. Die weitere Behandlung ist abhängig vom Schweregrad der Symptomatik und kann folgende Massnahmen umfassen: kalziumarme bzw. kalziumfreie Ernährung, reichliche Flüssigkeitszufuhr, forcierte Diurese (Furosemid), Gabe von Glukokortikoiden und eventuell Diuretika, ggf. Hämo- oder Peritonealdialyse. Bei chronischer Überdosierung kann auch die Gabe von Calcitonin indiziert sein.
Bei akuter Intoxikation (z.B. bei akzidenteller Überdosierung) können das Auslösen von Erbrechen, eine Magenspülung oder die Gabe von Mineralöl-Präparaten angezeigt sein.
Eigenschaften/WirkungenATC-Code: A11CC05 - Vitamin D3 und Analoga, Cholecalciferol
Wirkungsmechanismus
Vitamin D ist eine im menschlichen Organismus natürlicherweise vorkommende Substanz. In der Haut wird 7-Dehydrocholesterin unter der Einwirkung von UV-Strahlung (Sonnenlicht) in Vitamin D3 (Cholecalciferol) umgewandelt. In geringem Umfang wird Vitamin D3 auch mit der Nahrung (Milch, Butter, Eigelb, Leber) zugeführt. Cholecalciferol wird in zwei Hydroxylierungsschritten zunächst in der Leber (Position 25) und dann im Nierengewebe (Position 1) in seine biologisch aktive Form, das 1,25-Dihydroxycholecalciferol (Calcitriol), überführt.
Calcitriol reguliert zusammen mit Parathormon und Calcitonin den Kalzium- und Phosphat-Stoffwechsel. Es fördert die Absorption von Kalzium im Darm, den Einbau von Kalzium in das Osteoid und die Freisetzung von Kalzium aus Knochengewebe. Ausserdem werden der passive und der aktive Phosphattransport stimuliert. In der Niere hemmt Calcitriol die Ausscheidung von Kalzium und Phosphat durch Förderung der tubulären Rückresorption. Die Bildung von Parathormon (PTH) in den Nebenschilddrüsen wird durch die biologisch aktive Form von Vitamin D3 direkt gehemmt. Darüber hinaus wird die PTH-Sekretion durch die erhöhte Kalziumaufnahme im Dünndarm gehemmt. Der Mindestbedarf an Vitamin D liegt je nach Lebensalter zwischen 400 und 800 I.E. pro Tag. Gesunde Erwachsene können bei ausreichender Sonnenexposition ihren Bedarf durch Eigensynthese decken.
Bei einem Mangel an Vitamin D bleibt die Verkalkung des Skeletts aus (Rachitis) bzw. es kommt zu einer Entkalkung des Knochens (Osteomalazie). Mögliche Ursachen für einen Vitamin D-Mangel beim Erwachsenen sind unter anderem ungenügende UV-Exposition, Malabsorption bzw. Maldigestion (z.B. bei Zöliakie), Leberzirrhose und Niereninsuffizienz sowie eine Behandlung mit Antikonvulsiva oder Glukokortikoiden.
PharmakokinetikAbsorption
Vitamin D3 wird in Gegenwart von Nahrungsfetten rasch und fast vollständig aus dem Gastrointestinaltrakt absorbiert.
Distribution
Cholecalciferol und seine Metaboliten sind an spezifische Alpha-Globuline gebunden. Hauptspeicherorte sind Leber und Fettgewebe.
Metabolismus
Nach Hydroxylierung in der Leber zu 25-Hydroxycholecalciferol erfolgt in den Nieren eine weitere Hydroxylierung zum aktiven Metaboliten 1,25-Dihydroxycholecalciferol (Calcitriol).
Elimination
Vitamin D3 und seine Metaboliten werden überwiegend über die Galle und die Fäzes ausgeschieden.
Kinetik spezieller Patientengruppen
Nierenfunktionsstörungen
Bei Patienten mit eingeschränkter Nierenfunktion wurde im Vergleich zu nierengesunden Probanden eine um 57 % geringere metabolische Clearance beschrieben.
Malabsorption
Bei Malabsorptions-Syndromen ist die Absorption von Vitamin D3 reduziert und die Elimination erhöht.
Präklinische DatenToxizität bei wiederholter Gabe
Bei verschiedenen Tier-Species durchgeführte präklinische Studien haben gezeigt, dass bei Dosen, welche die für die therapeutische Anwendung beim Menschen erforderlichen Dosen bei Weitem übersteigen, toxische Effekte auftreten.
In Studien zur Toxizität bei wiederholter Gabe wurden als häufigste Effekte verstärkte Kalzurie und verringerte Phosphaturie sowie Proteinurie beschrieben.
Bei hohen Dosen kam es zum Auftreten von Hyperkalzämie. Bei länger anhaltender Hyperkalzämie wurden histologische Veränderungen (Kalzifizierung) festgestellt, die häufiger die Nieren, das Herz, die Aorta, die Hoden, den Thymus und die Darmschleimhaut betrafen.
Reproduktionstoxizität
Bei Tieren erwies sich Cholecalciferol (Vitamin D3) in hohen Dosen als teratogen.
In Dosen, die den therapeutisch angewendeten Dosen entsprechen, hat Cholecalciferol (Vitamin D3) keine teratogene Aktivität.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit „EXP“ bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach Anbruch 6 Monate haltbar.
Besondere Lagerungshinweise
Nicht über 30 °C lagern.
Nicht im Kühlschrank lagern.
Nicht einfrieren.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Flasche mit separatem Tropfer
DIBASE sollte vorzugsweise zusammen mit einer Mahlzeit eingenommen werden (siehe „Dosierung und Anwendung“). Produkte oder Speisen, denen DIBASE beigemischt worden ist, nicht zur späteren Anwendung bzw. zur Einnahme bei einer nächsten Mahlzeit aufbewahren.
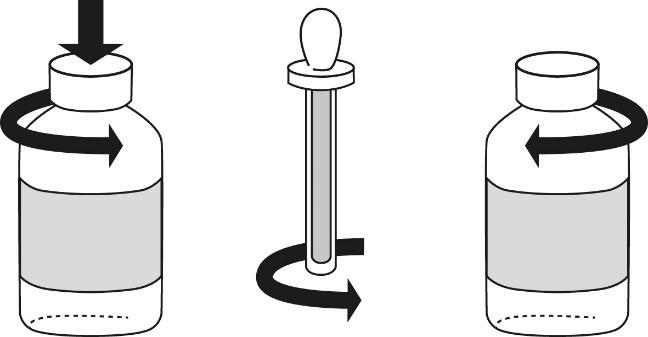
Die Packungen enthalten 1 Flasche und einen Verschluss mit Pipette. Die Flasche ist mit einem kindersicheren Kunststoffdeckel verschlossen. Die Pipette ist durch einen Kunststoffzylinder geschützt. Zur Anwendung sind die folgenden Anweisungen zu befolgen:
a.Vor Gebrauch schütteln.
b.Zum Öffnen der Flasche den Deckel gleichzeitig nach unten drücken und drehen (siehe Abb. 1).
c.Vor der Anwendung des Verschlusses mit Pipette muss der Kunststoffzylinder vom Verschluss mit Pipette abgeschraubt werden (siehe Abb. 2).
d.Den Verschluss mit Pipette in die Flasche einführen, um den Inhalt aufzunehmen. Die verordnete Anzahl an Tropfen auf einen Löffel geben.
e.Die Flasche mit dem Deckel verschliessen (siehe Abb. 3). Die Pipette in den Kunststoffzylinder zurückstellen und zuschrauben.
f.Die Arzneimittelflasche und die Pipette wieder in der Originalverpackung verstauen.
|
|
| |
Abbildung 1
|
Abbildung 2
|
Abbildung 3
|
Tropfflasche
Die Faltschachtel enthält eine Tropfflasche. Die Tropfflasche ist mit einem kindersicheren Kunststoffdeckel verschlossen. Die Anweisungen zum Öffnen und zur Verwendung sind unten aufgeführt:
a. Zum Öffnen der Tropfflasche den Deckel gleichzeitig nach unten drücken und drehen.
b. Stellen Sie die Tropfflasche senkrecht auf den Kopf und geben Sie die vorgeschriebene Anzahl Tropfen auf einen Löffel.
c. Nach der Verabreichung der Tropfen die Tropfflasche wieder aufrecht stellen.
d. Die Flasche mit dem Deckel verschliessen.
e. Die Tropfflasche wieder im Originalkarton verstauen.
Zulassungsnummer65856 (Swissmedic)
PackungenDIBASE 10‘000 IE, Lösung zum Einnehmen:
10 ml mit separatem Tropfer (D)
10 ml in einer Tropfflasche (D)
ZulassungsinhaberinEffRx Pharmaceuticals SA, 8807 Freienbach
Stand der InformationNovember 2022
| 
