ZusammensetzungWirkstoffe
Eplerenon.
Hilfsstoffe
Lactose-Monohydrat, Mikrokristalline Cellulose, Crospovidon, Natriumdodecylsulfat (E487), Talk, Magnesiumstearat.
Filmtablettenüberzug: Polyvinylalkohol, Titandioxid (E171), Macrogol 3350, Talk, rotes und gelbes Eisenoxid (E172).
1 Filmtablette à 25 mg enthält 38.20 mg Lactose-Monohydrat und 0.07 mg Natrium pro Filmtablette.
1 Filmtablette à 50 mg enthält 76.40 mg Lactose-Monohydrat und 0.14 mg Natrium pro Filmtablette.
Indikationen/AnwendungsmöglichkeitenEplerenon ist indiziert:
·zusätzlich zu einer Standardtherapie, welche Betablocker einschliesst, zur Verringerung des Risikos der kardiovaskulären Mortalität und Morbidität bei stabilen Patienten mit linksventrikulärer Dysfunktion (LVEF ≤40%) und klinischen Zeichen einer Herzinsuffizienz nach kürzlich aufgetretenem Myokardinfarkt;
·zusätzlich zu einer optimalen Standardtherapie zur Verringerung des Risikos kardiovaskulär bedingter Mortalität und Morbidität bei Patienten mit (chronischer) Herzinsuffizienz der NYHA-Klasse II und linksventrikulärer systolischer Dysfunktion (LVEF ≤30%) (siehe «Eigenschaften/Wirkungen»).
Dosierung/AnwendungEplerenon kann unabhängig von den Mahlzeiten eingenommen werden. Zur individuellen Dosisanpassung stehen die Dosierungen 25 mg und 50 mg zur Verfügung, die Einnahme erfolgt einmal täglich. Die Tageshöchstdosis kann 25 mg oder 50 mg betragen (siehe «Spezielle Dosierungsanweisungen»).
Übliche Dosierung
Bei Patienten mit einem Serumkaliumwert über 5.0 mmol/l oder einer eGFR <30 ml/min/1.73 m2 darf keine Behandlung mit Eplerenon begonnen werden (siehe «Kontraindikationen»).
Die Serumkaliumwerte müssen vor Beginn der Therapie mit Eplerenon, innerhalb der ersten Behandlungswoche, des ersten Monats nach Therapiebeginn sowie jeweils nach einer Dosisanpassung bestimmt werden. Danach müssen die Kaliumwerte je nach Bedarf in regelmässigen Abständen kontrolliert werden. Dies gilt vor allem für ältere Patienten, Patienten mit Diabetes mellitus und Patienten mit eingeschränkter Nierenfunktion.
Die Dosierung von Eplerenon muss jeweils in Abhängigkeit des Serum-Kaliums überprüft werden (siehe Tabelle 1).
Übliche Dosierung bei Patienten mit einer eGFR ≥50 ml/min/1.73 m2
Patienten mit Herzinsuffizienz der Klasse NYHA II sowie Patienten mit Herzinsuffizienz nach Myokardinfarkt, welche Serum-Kalium von ≤5 mmol/l aufweisen, sollen eine Anfangsdosis von 25 mg, verabreicht 1x täglich, erhalten. In Abhängigkeit des Serum-Kaliums (siehe Tabelle 1) soll die Dosis innerhalb von 4 Wochen nach Therapiebeginn auf die Zieldosis von 50 mg, verabreicht 1x täglich, erhöht werden.
Die maximale Dosis für diese Patienten beträgt 50 mg/Tag.
Bei Patienten nach Myokardinfarkt sollte die Therapie 3-14 Tage nach dem Ereignis begonnen werden.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Bei Patienten mit leichter bis mittelstarker Leberinsuffizienz ist keine Anpassung der Anfangsdosis erforderlich. Da es jedoch bei Patienten mit leichter bis mittelstarker Leberinsuffizienz zu einer erhöhten systemischen Wirkstoffbelastung mit Eplerenon kommt, wird eine häufige und regelmässige Kontrolle der Serumkaliumwerte empfohlen, insbesondere bei älteren Patienten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Anwendung von Eplerenon bei Patienten mit schwerer Leberinsuffizienz (Child-Pugh C) ist kontraindiziert (siehe «Kontraindikationen»).
Tabelle 1: Dosisanpassung nach Behandlungsbeginn
|
Serumkaliumwerte
(mmol/l)
|
Änderung der Dosierung
|
Dosisanpassung
| |
<5.0
|
Erhöhung
|
Von Behandlungspause auf 25 mg jeden 2. Tag.
Von 25 mg jeden 2. Tag auf 25 mg täglich.
Von 25 mg 1x täglich auf 50 mg 1x täglich, ausser bei:
Patienten mit einer eGFR von 30-49 ml/min/1.73 m2.
Patienten, welche einen schwachen bis mittelstarken CYP3A4-Inhibitor einnehmen.
| |
5.0-5.4
|
Keine
|
Keine Veränderung.
| |
5.5-5.9
|
Verringerung
|
Von 50 mg 1x täglich auf 25 mg einmal täglich.
Von 25 mg 1x täglich auf 25 mg jeden 2. Tag.
Von 25 mg jeden 2. Tag auf Behandlungspause.
| |
≥6.0
|
Behandlungspause
|
Mit 25 mg jeden 2. Tag wieder beginnen, wenn Kalium <5.0 mmol/l.
|
Patienten mit Nierenfunktionsstörungen
Patienten mit mittelstarker Niereninsuffizienz (eGFR zwischen 30 und 49 ml/min/1.73 m2)
Patienten mit Herzinsuffizienz der Klasse NYHA II, welche ein Serum-Kalium von ≤5 mmol/l aufweisen, sollen eine Anfangsdosis von 25 mg jeden 2. Tag erhalten. Diese soll innerhalb von 4 Wochen nach Therapiebeginn auf die Zieldosis von 25 mg/Tag erhöht werden, in Abhängigkeit des Serum-Kaliums (siehe Tabelle 1).
Die maximale Dosis beträgt 25 mg/Tag.
Für Patienten mit Herzinsuffizienz nach Myokardinfarkt und einer Kreatininclearance von <50 ml/min liegen keine Erfahrungen vor. Die Anwendung von Eplerenon bei diesen Patienten sollte mit Vorsicht erfolgen.
Patienten mit schwerer Niereninsuffizienz (eGFR <30 ml/min/1.73 m2)
Für diese Patienten ist die Anwendung von Eplerenon kontraindiziert.
Eplerenon ist nicht dialysierbar.
Ältere Patienten
In Studie EMPHASIS-HF wurden n=330 Patienten ≥75 Jahre mit Eplerenon behandelt. Die Behandlungsdosis richtete sich hierbei nach der Nierenfunktion (siehe «Eigenschaften/Wirkungen»). Ältere Patienten zeigten ein erhöhtes Hyperkaliämie-Risiko im Vergleich zu jüngeren Vergleichspersonen. Eine besonders regelmässige Kontrolle des Serum-Kaliums wird empfohlen.
Kinder und Jugendliche
Zur Anwendung von Eplerenon bei Kindern und Jugendlichen unter 18 Jahren liegen keine Daten vor. Die Anwendung bei dieser Patientengruppe wird daher nicht empfohlen.
Patienten, welche CYP3A4-Inhibitoren erhalten
Bei der gleichzeitigen Einnahme von schwachen bis mittelstarken CYP3A4-Inhibitoren beträgt die Höchstdosis von Eplerenon 25 mg/Tag.
Die gleichzeitige Einnahme von starken CYP3A4-Inhibitoren mit Eplerenon ist kontraindiziert (siehe «Kontraindikationen»).
Kontraindikationen·Überempfindlichkeit gegenüber Eplerenon oder einem der Hilfsstoffe gemäss Zusammensetzung.
·Alle Patienten mit Serumkaliumwerten >5.0 mmol/l vor Behandlungsbeginn.
·Alle Patienten mit schwerer Niereninsuffizienz (eGFR <30 ml/min/1.73 m2).
·Alle Patienten mit schwerer Leberinsuffizienz (Child-Pugh C).
·Alle Patienten, die kaliumsparende Diuretika (z.B. Spironolacton) oder starke CYP3A4-Inhibitoren (z.B. Itraconazol, Ketoconazol, Ritonavir, Nelfinavir, Clarithromycin) erhalten (siehe «Interaktionen»).
·Hypertonie-Patienten, die kaliumhaltige Präparate/Salzersatzprodukte erhalten.
·Kombination von Eplerenon mit einer bestehenden dualen Blockade des Renin-Angiotensin-Aldosteron-Systems (ACE-Inhibitor PLUS Angiotensin II-Rezeptor-Blocker).
Warnhinweise und VorsichtsmassnahmenHyperkaliämie
Aufgrund des Wirkungsmechanismus von Eplerenon können Hyperkaliämien auftreten. Die Serum-Kalium-Werte sollten daher bei allen Patienten zu Beginn einer Behandlung sowie bei einer Dosisanpassung überwacht werden. Ausserdem wird eine periodische Kontrolle bei Patienten mit einem erhöhten Risiko zur Entwicklung einer Hyperkaliämie empfohlen (Patienten mit Niereninsuffizienz, Diabetes mellitus, ältere Patienten). Bei Kaliumwerten ≥6.0 mmol/l sollte die Behandlung mit Eplerenon abgebrochen werden (siehe «Dosierung/Anwendung»).
Das Risiko einer Hyperkaliämie kann erhöht sein, wenn Eplerenon in Kombination mit einem ACE-Inhibitor oder einem Angiotensin-Rezeptor Blocker verwendet wird. Die Kombination eines ACE-Inhibitoren und eines Angiotensin-Rezeptor Blockers darf zusammen mit Eplerenon nicht verwendet werden (siehe «Kontraindikationen» und «Interaktionen»).
Niereninsuffizienz
Bei Patienten mit eingeschränkter Nierenfunktion, einschliesslich diabetischer Mikroalbuminurie, müssen die Kaliumspiegel regelmässig überwacht werden. Nach Behandlungsbeginn soll die Dosis abhängig vom Serumkaliumspiegel angepasst werden (siehe Tabelle 1 unter «Dosierung/Anwendung»). Das Risiko einer Hyperkaliämie nimmt mit abnehmender Nierenfunktion zu. Patienten mit einer geschätzten glomerulären Filtrationsrate (eGFR) <30 ml/min/1.73 m2 dürfen nicht mit Eplerenon behandelt werden. Obwohl die Daten aus der EPHESUS-Studie zu Patienten mit einem Typ-2 Diabetes und Mikroalbuminurie begrenzt sind, wurde bei dieser kleinen Anzahl von Patienten ein erhöhtes Auftreten einer Hyperkaliämie beobachtet. Daher sollten diese Patienten mit Vorsicht behandelt werden. Eplerenon ist nicht hämodialysierbar (siehe «Dosierung/Anwendung» und «Kontraindikationen»).
Leberinsuffizienz
Bei Patienten mit leichter bis mittelstarker Leberinsuffizienz (Child-Pugh A und B) wurde kein Anstieg der Serumkaliumwerte über 5.5 mmol/l beobachtet. Eine häufige und regelmässige Kontrolle der Serumkaliumwerte wird jedoch empfohlen, insbesondere bei älteren Patienten. Die Anwendung von Eplerenon bei Patienten mit schwerer Leberinsuffizienz (Child-Pugh C) wurde nicht untersucht (siehe «Dosierung/Anwendung» und «Kontraindikationen»).
Nichtsteroidale Antirheumatika (NSAR)
Die gleichzeitige Verabreichung von anderen kaliumsparenden Substanzen mit NSAR führte zu einer Verminderung des antihypertensiven Effekts sowie bei Patienten mit Niereninsuffizienz zu einer Hyperkaliämie (siehe «Interaktionen»).
CYP3A4-Induktoren
Die Gabe von Eplerenon zusammen mit starken CYP3A4 Induktoren wird nicht empfohlen (siehe «Interaktionen»).
Andere Arzneimittel
Lithium, Ciclosporin und Tacrolimus müssen unter der Behandlung mit Eplerenon vermieden werden (siehe «Interaktionen»).
Alpha-Blocker, Amifostin, Trimethoprim, ACE-Inhibitoren und Angiotensin-II-Rezeptor-Antagonisten (siehe oben: «Hyperkaliämie»), trizyklische Antidepressiva, Neuroleptika, Baclofen, Glukokortikoide, Tetracosactid siehe «Interaktionen».
Hilfsstoffe von besonderem Interesse
Eplerenon-Mepha 25 bzw. 50 mg Filmtabletten enthalten den Hilfsstoff Laktose-Monohydrat (38.20 mg bzw. 76.40 mg pro Filmtablette).
Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Filmtablette, d.h. es ist nahezu «natriumfrei».
InteraktionenPharmakokinetische Interaktionen
In-vitro-Studien weisen darauf hin, dass Eplerenon kein Inhibitor der CYP1A2-, CYP2C19-, CYP2C9-, CYP2D6- oder CYP3A4-Isoenzyme ist. Eplerenon ist weder ein Substrat noch ein Inhibitor von P-Glycoprotein.
CYP3A4-Inhibitoren
·Starke CYP3A4-Inhibitoren: Aufgrund pharmakokinetischer Wechselwirkung ist die gleichzeitige Anwendung von Eplerenon mit starken CYP3A4-Inhibitoren wie z.B. Ketoconazol, Itraconazol, Ritonavir, Nelfinavir oder Clarithromycin kontraindiziert (siehe «Kontraindikationen»).
·Schwache bis mittelstarke CYP3A4-Inhibitoren: Die gleichzeitige Gabe mit Erythromycin, Saquinavir, Amiodaron, Diltiazem, Verapamil oder Fluconazol führte zu signifikanten pharmakokinetischen Interaktionen und einem Anstieg der AUC auf bis das 2-fache. Bei gleichzeitiger Gabe von schwachen bis mittelstarken CYP3A4-Inhibitoren mit Eplerenon sollte die Dosierung von Eplerenon daher 25 mg/Tag nicht überschreiten.
CYP3A4-Induktoren
Die gleichzeitige Gabe von Johanniskraut (einem starken CYP3A4-Induktor) mit Eplerenon führte zu einer Verringerung der AUC von Eplerenon um 30%. Bei stärkeren CYP3A4-Induktoren wie z.B. Rifampicin, dürfte eine ausgeprägtere Verringerung der AUC von Eplerenon auftreten. Aufgrund des Risikos einer verringerten Wirksamkeit von Eplerenon wird die gleichzeitige Gabe von starken CYP3A4-Induktoren (Rifampicin, Carbamazepin, Phenytoin, Phenobarbital, Johanniskraut) mit Eplerenon nicht empfohlen.
CYP3A4-Substrate
Die Ergebnisse von Pharmakokinetikstudien mit CYP3A4-Testsubstraten, z.B. Midazolam und Cisaprid, ergaben keine signifikanten pharmokokinetischen Interaktionen, wenn diese Wirkstoffe zusammen mit Eplerenon angewendet wurden.
Digoxin
Die gleichzeitige Gabe mit Eplerenon erhöht die AUC von Digoxin um 16% (90% Konfidenzintervall: 4-30%). Vorsicht ist geboten, wenn Digoxin nahe dem oberen Limit des therapeutischen Bereichs eingesetzt wird.
Warfarin
Vorsicht ist geboten, wenn Warfarin nahe dem oberen Limit des therapeutischen Bereichs eingesetzt wird.
Pharmakodynamische Interaktionen
Kaliumsparende Diuretika, kaliumhaltige Präparate/Salzersatzprodukte
Wegen des erhöhten Hyperkaliämie-Risikos darf Eplerenon nicht angewendet werden bei allen Patienten, welche andere kaliumsparende Diuretika erhalten sowie bei Hypertonie-Patienten, welche kaliumhaltige Präparate/Salzersatzprodukte erhalten (siehe «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»). Kaliumsparende Diuretika können auch die Wirkung von Antihypertonika und anderen Diuretika potenzieren.
ACE-Inhibitoren, Angiotensin-Rezeptor Blocker (ARB)
Das Risiko einer Hyperkaliämie kann erhöht sein, wenn Eplerenon in Kombination mit einem ACE-Inhibitor oder einem Angiotensin-Rezeptor Blocker verwendet wird. Eine strenge Überwachung der Serumkaliumwerte und der Nierenfunktion wird vor allem bei Patienten mit vorbestehender Einschränkung der Nierenfunktion empfohlen. Die Dreifachkombination eines ACE-Inhibitoren und eines Angiotensin-Rezeptor Blockers mit Eplerenon darf nicht angewendet werden (siehe «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Lithium
Es wurden keine Arzneimittelinteraktions-Studien mit Lithium und Eplerenon durchgeführt. Bei Patienten, die Lithium zusammen mit Diuretika und ACE-Inhibitoren erhielten, wurde jedoch von einer Lithium-Toxizität berichtet. Die gemeinsame Gabe von Eplerenon und Lithium muss vermieden werden. Wenn eine Kombination notwendig erscheint, müssen die Plasmakonzentrationen von Lithium engmaschig überwacht werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Ciclosporin, Tacrolimus
Ciclosporin und Tacrolimus können zu Nierenfunktionsstörungen führen und erhöhen das Hyperkaliämie-Risiko. Die gemeinsame Gabe von Eplerenon mit Ciclosporin oder Tacrolimus muss vermieden werden. Wenn Ciclosporin und Tacrolimus während einer Behandlung mit Eplerenon gegeben werden müssen, wird eine enge Überwachung von Serumkalium und Nierenfunktion empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Nichtsteroidale Antiphlogistika (NSAR)
Speziell bei Risikopatienten (ältere und/oder dehydrierte Patienten) kann eine Behandlung mit NSAR durch direkte Beeinflussung der glomerulären Filtration zu akutem Nierenversagen führen. Vor Beginn einer Behandlung müssen Patienten, die Eplerenon und NSAR erhalten, einen ausgeglichenen Flüssigkeitshaushalt aufweisen und deren Nierenfunktion muss überprüft werden.
Trimethoprim
Die gleichzeitige Gabe von Trimethoprim und Eplerenon erhöht das Hyperkaliämie- Risiko. Besonders bei Patienten mit eingeschränkter Nierenfunktion und bei älteren Patienten muss das Serumkalium und die Nierenfunktion überwacht werden.
Alphablocker (z.B. Alfuzosin)
Bei Kombination von Alphablockern mit Eplerenon besteht die Möglichkeit, dass die antihypertensive Wirkung und/oder eine orthostatische Hypotonie verstärkt werden. Bei Begleittherapie mit Alphablockern wird eine klinische Überwachung bezüglich einer orthostatischen Hypotonie empfohlen.
Trizyklische Antidepressiva, Neuroleptika, Amifostin, Baclofen
Die Begleitmedikation mit diesen Arzneimitteln kann möglicherweise die antihypertensive Wirkung und die Gefahr einer orthostatischen Hypotonie verstärken.
Glukokortikoide, Tetracosactid
Die zusätzliche Gabe dieser Wirkstoffe zu Eplerenon kann möglicherweise die antihypertensive Wirkung verringern (Natrium- und Flüssigkeitsretention).
Schwangerschaft, StillzeitSchwangerschaft
Zur Anwendung von Eplerenon in der Schwangerschaft sind nur unzureichende Daten vorhanden. Eplerenon sollte während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Es ist unbekannt, ob Eplerenon nach oraler Einnahme in die Muttermilch übergeht. Bei eindeutiger Indikation für die Anwendung von Eplerenon soll nicht gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDa während der Behandlung Schwindel oder Synkope auftreten können, ist beim Autofahren oder Bedienen von Maschinen Vorsicht geboten, bis die individuelle Therapieantwort bekannt ist.
Unerwünschte WirkungenSowohl in der EPHESUS- als auch in der EMPHASIS-HF-Studie waren die Gesamtinzidenz unerwünschter Wirkungen sowie die Abbruchrate aufgrund von unerwünschten Wirkungen, die im Zusammenhang mit Eplerenon berichtet wurden, ähnlich wie unter Placebo. Die häufigste in der EPHESUS- und der EMPHASIS-HF-Studie gemeldete unerwünschte Wirkung war Hyperkaliämie mit einer Inzidenzrate von 3.4% bzw. 8.7% unter Eplerenon.
Die unerwünschten Wirkungen sind nach Organsystemen und ihrer absoluten Häufigkeit geordnet. Die Häufigkeiten werden wie folgt definiert:
sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000), sehr selten (<1/10'000).
Infektionen und parasitäre Erkrankungen
Häufig: Infektion.
Gelegentlich: Pyelonephritis, Pharyngitis.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Eosinophilie.
Endokrine Erkrankungen
Gelegentlich: Hypothyreose.
Stoffwechsel- und Ernährungsstörungen
Häufig: Hyperkaliämie, Dehydrierung.
Gelegentlich: Hypercholesterinämie, Hypertriglyceridämie, Hyponatriämie.
Psychiatrische Erkrankungen
Gelegentlich: Schlaflosigkeit.
Erkrankungen des Nervensystems
Häufig: Schwindel, Synkope.
Gelegentlich: Kopfschmerzen, Hypästhesie.
Herzerkrankungen
Häufig: Myokardinfarkt.
Gelegentlich: Vorhofflimmern, Linksherzinsuffizienz.
Gefässerkrankungen
Häufig: Hypotonie.
Gelegentlich: Orthostatische Hypotonie, Thrombose der Beinarterien.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten.
Erkrankungen des Gastrointestinaltrakts
Häufig: Durchfall, Übelkeit, Obstipation.
Gelegentlich: Blähungen, Erbrechen.
Leber- und Gallenerkrankungen
Gelegentlich: Cholezystitis.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Juckreiz.
Gelegentlich: Hyperhidrosis.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Muskelkrämpfe, muskuloskelettale Schmerzen.
Gelegentlich: Rückenschmerzen.
Erkrankungen der Nieren und Harnwege
Häufig: Nierenfunktionsstörungen.
Allgemeine Erkrankungen
Gelegentlich: Kraftlosigkeit, Unwohlsein.
Untersuchungen
Häufig: Erhöhter Blutharnstoffwert.
Gelegentlich: Erhöhter Serumkreatininwert, verminderter EGFR-Wert (epidermal growth factor receptor), erhöhter Blutzuckerwert.
In der Ephesus-Studie kam es bei älteren Patienten (≥75 Jahre) zu einer numerisch höheren Anzahl von Schlaganfällen (Eplerenon 4.9%, Placebo 3.1%, p=0.10). In der EMPHASIS-HF Studie betrug die Anzahl von Schlaganfällen bei älteren Patienten (≥75 Jahre) n=9 (2.7%) in der Eplerenon-Gruppe und n=8 (2.4%) in der Placebo-Gruppe.
Unerwünschte Wirkungen nach Markteinführung
Post–Marketing Erfahrungen
Nach Markteinführung wurden zusätzlich folgende Nebenwirkungen beobachtet:
Erkrankungen der Haut und des Unterhautgewebes
Angioödem, Ausschlag.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gynäkomastie.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs sind noch keine Fälle von unerwünschten Wirkungen im Zusammenhang mit einer Überdosierung von Eplerenon beim Menschen bekannt geworden. Es ist anzunehmen, dass eine Überdosierung beim Menschen zu Hypotension und Hyperkaliämie führt. Eplerenon ist nicht hämodialysierbar. Es bindet jedoch stark an Aktivkohle. Hypotension muss symptomatisch behandelt werden. Beim Auftreten einer Hyperkaliämie müssen die üblichen Therapiemassnahmen eingeleitet werden.
Eigenschaften/WirkungenATC-Code C03DA04
Wirkungsmechanismus
Siehe «Pharmakodynamik».
Pharmakodynamik
Eplerenon bindet relativ selektiv an rekombinante menschliche Mineralokortikoid- Rezeptoren verglichen mit seiner Bindungsaffinität zu rekombinanten menschlichen Glukokortikoid-, Progesteron- und Androgen-Rezeptoren. Eplerenon verhindert die Bindung von Aldosteron.
Klinische Wirksamkeit
Eplerenon wurde in der Eplerenone post-acute myocardial infarction heart failure efficacy and survival study (EPHESUS) untersucht. EPHESUS war eine doppelblinde, placebokontrollierte Multizenter-Studie an n=6632 Patienten (mittleres Follow-up 16 Monate) mit akutem Myokardinfarkt, linksventrikulärer Dysfunktion (gemessen als linksventrikuläre Ejektionsfraktion [LVEF] <40%), und klinischen Anzeichen einer Herzinsuffizienz. Die Patienten wurden 3 bis 14 Tage nach der Diagnose Myokardinfarkt randomisiert in die EPHESUS Studie aufgenommen. Die durchschnittliche Dauer bis zur Aufnahme betrug 7 Tage. Aufgrund des erhöhten kardiovaskulären Risikos assoziiert mit Diabetes, wurden Patienten mit Diabetes und einer linksventrikulären Dysfunktion in Abwesenheit von Symptomen einer Herzinsuffizienz in die Studie aufgenommen; 10% der Studienpopulation entsprachen diesem Kriterium. Zusätzlich zur Standardtherapie erhielten die Patienten entweder Eplerenon oder Placebo in einer Initialdosierung von 25 mg einmal täglich mit anschliessender Erhöhung auf die Erhaltungsdosis von 50 mg einmal täglich innerhalb von 4 Wochen bei Serumkaliumwerten <5.0 mEq/l. Während der Studie erhielten die Patienten zusätzlich eine Standardtherapie, bestehend aus Aspirin (92%), ACE-Inhibitor (90%), Betablockern (83%), Nitraten (72%), Schleifendiuretika (66%) oder HMG-CoA-Reduktase Inhibitoren (60%).
In der EPHESUS-Studie waren die co-primären Endpunkte Gesamtmortalität und der kombinierte Endpunkt aus kardiovaskulärer Mortalität oder kardiovaskulärer Hospitalisierung. Unter Eplerenon verstarben 14.4% der Patienten und unter Placebo 16.7% (alle Ursachen), während 26.7% der Patienten mit Eplerenon und 30.0% unter Placebo den kombinierten Studienendpunkt aus kardiovaskulärer Mortalität oder kardiovaskulärer Hospitalisierung erfüllten. Somit verringerte Eplerenon in der EPHESUS-Studie im Vergleich zu Placebo das Risiko der Gesamtsterblichkeit um 15% (absolute Risikoreduktion 2.3%, RR 0.85; 95% Konfidenzintervall, 0.75–0.96; p=0.008; NNT: 43), hauptsächlich durch die Reduktion der kardiovaskulären Mortalität. Das Risiko eines kardiovaskulären Todes bzw. einer kardiovaskulären Hospitalisierung wurde durch Eplerenon um 13% verringert (absolute Risikoreduktion 3.3%; RR 0.87; 95% Konfidenzintervall, 0.79–0.95; p=0.002; NNT: 31).
Die klinische Wirksamkeit einer Behandlung mit Eplerenon zeigte sich bei Patienten <75 Jahren. Der therapeutische Nutzen bei Patienten ≥75 Jahren ist unklar. Bei einem signifikant grösseren Anteil der mit Eplerenon behandelten Patienten (n=2372 Patienten, 75.3%) verbesserte sich verglichen mit Placebo (n=2242 Patienten, 71.3%) die NYHA-Klassifikation oder blieb unverändert (p<0.001).
Abbildung 1: Hazard Ratios aller Todesursachen geordnet nach Subgruppen
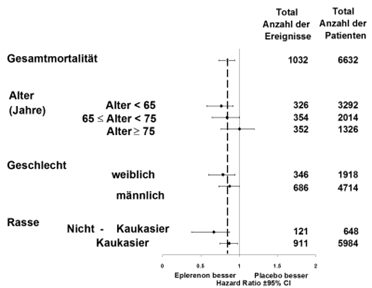



In Studie EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure) wurde Eplerenon zusätzlich zu einer Standardtherapie bei Patienten mit systolischer Herzinsuffizienz und milden Symptomen (NYHA-Funktionsklasse II) untersucht. Patienten der NYHA-Funktionsklassen- III und IV wurden in der Studie nicht untersucht.
In die Studie aufgenommen wurden Patienten im Alter von ≥55 Jahren mit einer linksventrikulären Ejektionsfraktion (LVEF) von ≤30% oder einer LVEF ≤35% und zusätzlich einer QRS-Dauer von >130 msec. Zusätzlich mussten die Studienteilnehmer entweder innerhalb der vorangegangenen 6 Monate aufgrund einer kardiovaskulären (KV) Ursache hospitalisiert worden sein oder einen BNP-Plasmaspiegel ≥250 pg/ml oder einen Pro-BNP-Spiegel von ≥500 pg/ml (Männer) bzw. ≥750 pg/ml (Frauen) aufweisen. Die Behandlung mit Eplerenon wurde mit einer Dosis von 25 mg einmal täglich begonnen, welche nach 4 Wochen auf 50 mg einmal täglich erhöht wurde, sofern die Serumkaliumwerte bei <5.0 mmol/l und die eGFR bei ≥50 ml/min lagen. Alternativ wurde, wenn die geschätzte glomeruläre Filtrationsrate bei 30-49 ml/min/1.73 m2 lag, die Behandlung mit Eplerenon mit einer Dosis von 25 mg jeden 2. Tag begonnen, welche auf 25 mg einmal täglich erhöht werden konnte.
Die häufigsten kardiovaskulären Begleitmedikationen zusätzlich zu Eplerenon oder Plazebo bei den insgesamt n=2737 Studienteilnehmern waren Diuretika (85%), ACE-Inhibitor (78%), Angiotensin-II-Rezeptor-Antagonisten (19%), Betablocker (87%), antithrombotisch wirksame Arzneimittel (88%), Lipidsenker (63%) und Digitalisalkaloide (27%). Die mittlere LVEF betrug 26% und die mittlere QRS-Dauer lag bei 122 msec. Die meisten Patienten (83.4%) waren innerhalb der letzten 6 Monate vor der Randomisierung aufgrund kardiovaskulärer Ursachen hospitalisiert worden, ca. 50% wegen Herzinsuffizienz. Etwa 20% der Patienten hatten implantierbare Defibrillatoren oder eine kardiale Resynchronisationsbehandlung.
Der primäre Endpunkt (kardiovaskuläre Todesfälle oder Hospitalisierung wegen Herzinsuffizienz) ereignete sich bei n=249 Patienten (18.3%) der Eplerenon-Gruppe und n=356 (25.9%) der Placebo-Gruppe (RR 0.63, 95% CI, 0.54-0.74; p<0.001). Das Ergebnis war in allen untersuchten Subgruppen konsistent.
Der sekundäre Endpunkt Gesamtmortalität ereignete sich bei n=171 Patienten (12.5%) der Eplerenon-Gruppe und n=213 Patienten (15.5%) der Placebo-Gruppe (RR 0.76; 95% CI, 0.62-0.93; p=0.008). Kardiovaskuläre Todesfälle wurden bei n=147 (10.8%) Patienten der Eplerenon-Gruppe und bei n=185 (13.5%) der Placebo-Gruppe berichtet (RR 0.76; 95% CI, 0.61-0.94; p=0.01).
Während der Studie wurde bei n=158 Patienten (11.8%) der Eplerenon-Gruppe und bei n=96 Patienten (7.2%) der Placebo-Gruppe über Hyperkaliämie (Serumkaliumwerte >5.5 mmol/l) berichtet (p<0.001). Eine Hypokaliämie, definiert als Serumkaliumwerte <4.0 mmol/l, ereignete sich seltener mit Eplerenon als mit Placebo (38.9% mit Eplerenon im Vergleich zu 48.4% mit Placebo, p<0.0001).
PharmakokinetikAbsorption
Die absolute Bioverfügbarkeit von Eplerenon beträgt 69%. Maximale Plasmakonzentrationen werden ungefähr 1.5-2 h nach oraler Einnahme von Eplerenon erreicht. Die Resorption im terminalen Ileum und Colon erfolgt mit einer Verzögerung von 3-4 h. Die maximalen Plasmakonzentrationen (Cmax) wie auch die AUC-Werte sind dosisproportional in Dosierungen von 10 bis 100 mg und weniger proportional in Dosierungen über 100 mg. Die Absorption wird durch gleichzeitige Nahrungsaufnahme nicht beeinflusst.
Distribution
Die Plasmaproteinbindung von Eplerenon beträgt ca. 50%, wobei die Bindung hauptsächlich an Alpha-1-Säureglykoproteine erfolgt. Das apparente Verteilungsvolumen im Steady State wird auf 42–90 l geschätzt. Eplerenon bindet nicht bevorzugt an Erythrozyten.
Metabolismus
Die Metabolisierung von Eplerenon erfolgt hauptsächlich durch Cytochrom P450 (CYP) 3A4. Im menschlichen Plasma wurden keine aktiven Metaboliten gefunden.
Elimination
Die Eliminationshalbwertszeit beträgt 4-6 h. Die apparente Plasmaclearance beträgt ca. 10 l/h. Der Steady State wird innerhalb von 2 Tagen erreicht. Weniger als 5% der verabreichten Eplerenon-Dosis werden als unveränderte Substanz im Urin und in den Faeces gefunden. Nach oraler Einmalgabe von radioaktiv markiertem Eplerenon werden ungefähr 32% der Dosis mit den Faeces und ungefähr 67% mit dem Urin ausgeschieden.
Kinetik spezieller Patientengruppen
Alter, Geschlecht und Rasse
Die Pharmakokinetik bei Frauen und Männern unterschied sich nicht signifikant. Im Steady State wiesen ältere Probanden verglichen mit jüngeren Probanden (18 bis 45 Jahre) erhöhte Cmax- (22%) und AUC-Werte (45%) auf. Bei Menschen mit schwarzer Hautfarbe waren im Steady State die Cmax um 19% und die AUC um 26% erniedrigt (siehe «Dosierung/Anwendung»).
Leberfunktionsstörungen
Die Pharmakokinetik von 400 mg Eplerenon wurde bei Patienten mit mittelstarker Leberinsuffizienz (Child-Pugh B) untersucht und mit derjenigen von gesunden Probanden verglichen. Im Steady State waren die Cmax und AUC von Eplerenon um 3.6% resp. 42% erhöht (siehe «Dosierung/Anwendung»).
Nierenfunktionsstörungen
Die Pharmakokinetik von Eplerenon wurde bei Patienten mit unterschiedlich schwerer Niereninsuffizienz und bei Hämodialyse-Patienten untersucht. Verglichen mit gesunden Probanden, waren bei Patienten mit schwerer Niereninsuffizienz im Steady State die AUC und Cmax um 38% resp. 24% erhöht, bei Hämodialyse-Patienten um 26% resp. 3% erniedrigt. Es wurde keine Korrelation zwischen der Plasmaclearance von Eplerenon und der Kreatininclearance beobachtet. Eplerenon ist nicht hämodialysierbar (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Herzinsuffizienz
Die Pharmakokinetik von 50 mg Eplerenon wurde bei Patienten mit Herzinsuffizienz (NYHA Klassifikation II-IV) untersucht. Verglichen mit gesunden Probanden des gleichen Alters, Gewichts und Geschlechts waren die AUC und Cmax bei den Patienten mit Herzinsuffizienz um 38% resp. 30% höher. In Übereinstimmung mit den oben genannten Resultaten ergab eine pharmakokinetische Analyse basierend auf einer Subpopulation aus der EPHESUS Studie, dass die Clearance von Eplerenon bei Patienten mit Herzinsuffizienz vergleichbar mit derjenigen von gesunden älteren Probanden ist.
Präklinische DatenPräklinische Untersuchungen zur pharmakologischen Sicherheit, Toxizität bei wiederholter Einnahme, Genotoxizität, Karzinogenität und Reproduktionstoxizität zeigten keine besonderen Risiken für den Menschen.
Studien an Ratten und Kaninchen zeigten keine teratogenen Effekte. Bei den Kaninchen-Muttertieren wurden jedoch unter der höchsten applizierten Dosis herabgesetztes Körpergewicht und erhöhte fetale Resorptionen sowie Abortrate (Verlust nach der Nidation) festgestellt. Das potentielle Risiko für den Menschen ist unbekannt.
Daten aus präklinischen Studien zeigen, dass Eplerenon und/oder seine Metaboliten in der Muttermilch von Ratten vorhanden sind.
In Studien zur chronischen Toxizität kam es bei Ratten und Hunden bei Expositionen, die mehrfach über der klinischen Dosierung lagen, zu Prostata-Atrophie. Die Veränderungen der Prostata gingen nicht mit einer negativen Funktionsveränderung einher. Die klinische Bedeutung dieser Befunde ist unklar.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, vor Licht und Feuchtigkeit geschützt und nicht über 30°C lagern. Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer66107 (Swissmedic).
PackungenEplerenon-Mepha 25 mg: Packungen zu 30 und 100 Filmtabletten. [B]
Eplerenon-Mepha 50 mg: Packungen zu 30 und 100 Filmtabletten. [B]
ZulassungsinhaberinMepha Pharma AG, Basel.
Stand der InformationSeptember 2020.
Interne Versionsnummer: 3.3
|




