ZusammensetzungWirkstoff: Insulinum Aspartum 100 E/ml; schnell wirkendes Humaninsulin-Analog (B28 Asp) hergestellt aus Saccharomyces cerevisiae mittels rekombinanter DNA-Technologie.
Hilfsstoffe:
Conserv.: Phenol 1,50 mg/ml, Metacresol 1,72 mg/ml.
Übrige Hilfsstoffe: Glycerol, Zinkacetat, Dinatriumphosphatdihydrat, Argininhydrochlorid, Niacinamid (Vitamin B3), Wasser für Injektionszwecke 1 ml.
Galenische Form und Wirkstoffmenge pro EinheitInjektionslösung. Klare, farblose, wässrige Lösung.
1 ml der Lösung enthält 100 Einheiten Insulin Aspart (entspricht 3,5 mg).
Indikationen/AnwendungsmöglichkeitenDiabetes mellitus bei Erwachsenen, sofern eine Insulinbehandlung notwendig ist.
Dosierung/AnwendungDosierung
Die Dosierung von Fiasp ultra-fast-acting ist flexibel und muss dem individuellen Bedarf des Patienten angepasst werden. Dazu wird eine routinemässige Überwachung des Blutzuckerspiegels gemäss der Richtlinien empfohlen. Fiasp ultra-fast-acting wird mittels subkutaner Injektion verabreicht. Darüber hinaus kann Fiasp ultra-fast-acting auch zur kontinuierlichen subkutanen Insulininfusion (CSII) in Pumpensystemen angewendet werden.
In der Regel liegt der individuelle Insulinbedarf bei Erwachsenen zwischen 0,5 und 1,0 Einheiten/kg/Tag. Bei einer Basal-Bolus-Therapie mittels Injektion entfallen rund 50% - 60% des täglichen Insulinbedarfs auf das Bolus-Insulin, d.h. müssen durch Fiasp ultra-fast-acting abgedeckt werden. Bei einer Basal-Bolus-Therapie mittels CSII kommt ausschliesslich das schnell wirksame Fiasp ultra-fast-acting zum Einsatz, und dient zur Abdeckung des Bedarfs an Bolus- und Basal-Insulin.
Bei erhöhter körperlicher Aktivität, einer Änderung der Ernährungsgewohnheiten oder Begleiterkrankungen kann eine Anpassung der Dosierung notwendig sein. Der Blutzuckerspiegel sollte insbesondere unter diesen Umständen angemessen überwacht werden.
Spezielle Dosierungsanweisungen
Nieren- und Leberinsuffizienz
Bei Nieren- oder Leberinsuffizienz kann der Insulinbedarf des Patienten reduziert sein. Bei Patienten mit Nieren- oder Leberinsuffizienz soll die Kontrolle des Blutzuckers intensiviert und die Dosierung individuell angepasst werden (siehe unter «Pharmakokinetik»).
Kinder und Jugendliche
Es wurden keine Studien zur Wirksamkeit und Sicherheit von Fiasp ultra-fast-acting bei Kindern und Jugendlichen unter 18 Jahren durchgeführt. Daten zur Pharmakokinetik und –dynamik in dieser Altersgruppe sind im Abschnitt «Eigenschaften/Wirkungen» beschrieben.
Umstellung von anderen Insulinprodukten
Fiasp ultra-fast-acting hat einen schnelleren Wirkungseintritt als NovoRapid, welches einen schnelleren Wirkungseintritt als Humanisulin hat. Aufgrund des rascheren Wirkungseintritts kann Fiasp ultra-fast-acting unmittelbar (0-2 Minuten) vor Beginn einer Mahlzeit und in Ausnahmefällen auch kurz nach Beginn der Mahlzeit verabreicht werden. Die Umstellung eines Patienten von einer anderen Insulinart, einer anderen Marke oder einem anderen Hersteller auf Fiasp ultra-fast-acting muss unter medizinischer Aufsicht erfolgen und kann eine Anpassung der Dosis erfordern.
Zusätzlich kann die Anpassung der Dosis und des Verabreichungszeitpunktes von gleichzeitig verabreichten intermediär und lang wirkenden Insulinpräparaten oder anderen gleichzeitig verabreichten antidiabetischen Arzneimitteln erforderlich sein.
Anwendungshinweise
Subkutane Injektion
Fiasp ultra-fast-acting wird subkutan in die Bauchdecke, den Oberarm oder den Oberschenkel injiziert. Die Einstichstelle sollte bei jeder Injektion innerhalb derselben Körperregion gewechselt werden, um das Risiko einer Lipodystrophie zu reduzieren.
Die Wirkungsdauer von Fiasp ultra-fast-acting variiert abhängig von Dosis, Injektionsstelle, Durchblutung, Temperatur und dem Ausmass der körperlichen Betätigung.
Fiasp ultra-fast-acting, FlexTouch 100 Einheiten/ml Injektionslösung im Fertigpen
Verabreichung mit einem Fertigpen (FlexTouch)
Fiasp ultra-fast-acting ist in einem Fertigpen (FlexTouch), der mit NovoFine, NovoFine Autocover oder NovoTwist Injektionsnadeln zu verwenden ist, erhältlich. Der Fertigpen mit 100 Einheiten/ml verabreicht 1–80 Einheiten in Schritten von 1 Einheit.
Fiasp ultra-fastacting, FlexTouch ist farbkodiert und eine Packungsbeilage mit detaillierten Instruktionen, die zu befolgen sind, liegt bei.
Fiasp ultra-fast-acting, Penfill 100 Einheiten/ml Injektionslösung in einer Patrone
Verabreichung mit einem Insulin Injektionsgerät
Fiasp ultra-fast-acting ist in einer Patrone (Penfill) erhältlich und ist zur Verwendung mit Novo Nordisk Insulin Injektionssystemen und NovoFine, NovoFine Autocover oder NovoTwist Injektionsnadeln vorgesehen.
Fiasp ultra-fast-acting 100 Einheiten/ml Injektionslösung in einer Durchstechflasche
Verabreichung mit einer Spritze
Fiasp ultra-fast-acting ist in einer Durchstechflasche erhältlich, die für den Gebrauch mit Insulinspritzen mit der entsprechenden Dosierskala (U-100 oder 100 E/ml) vorgesehen ist.
Kontinuierliche subkutane Insulininfusion (CSII)
Fiasp ultra-fast-acting kann zur kontinuierlichen subkutanen Insulininfusion (CSII) in Insulin-Pumpensystemen, die für die Insulininfusion geeignet sind, verwendet werden. Fiasp ultra-fast-acting kann gemäss den Anweisungen des Pumpenherstellers, vorzugsweise in die Bauchdecke, verabreicht werden. Die Infusionsstelle sollte bei jeder Anwendung gewechselt werden, um das Risiko einer Lipodystrophie zu reduzieren. Wird Fiasp ultra-fast-acting mittels einer Insulininfusionspumpe verabreicht, darf es nicht verdünnt und mit keinem anderen Insulin gemischt werden.
Patienten, die eine CSII anwenden, müssen umfassend über den Gebrauch der Pumpe instruiert werden und das richtige Reservoir sowie den richtigen Schlauch für die Pumpe benutzen (siehe unter «Weitere Informationen»). Das Infusionsset (Schlauch und Kanüle) muss gemäss den Anweisungen in der Bedienungsanleitung des Infusionssets gewechselt werden.
Patienten, die Fiasp ultra-fast-acting mittels CSII verabreichen, müssen gleichzeitig für die Insulin-Injektion geschult sein und ein entsprechendes Insulin-Applikationssystem zur Verfügung haben, um im Falle eines Versagens des Pumpensystems die Insulintherapie fortführen zu können.
Kontraindikationen·Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenHypoglykämie
Beim insulinbehandelten Diabetiker besteht grundsätzlich das Risiko leichter oder schwerer Hypoglykämien.
Dies gilt besonders zu Beginn der Behandlung, bei Präparatewechsel, unregelmässigen Injektionen oder unregelmässiger Nahrungsaufnahme sowie allgemein bei nicht optimaler Stoffwechseleinstellung, wo es zu starken Blutzuckerschwankungen u.a. Hypoglykämien kommen kann. Ebenso ist bei früher durchgemachten schweren Hypoglykämien das Risiko grösser, dass sich solche wiederholen. Um einer Hypoglykämie frühzeitig begegnen zu können, ist der Patient zu instruieren, immer Traubenzucker, Würfelzucker o.ä. mit sich zu führen. Er soll auch seinen Diabetikerausweis bei sich haben.
Das Auslassen einer Mahlzeit oder nicht geplante, körperliche Anstrengung können eine Hypoglykämie verursachen.
Eine Hypoglykämie kann auftreten, wenn die Insulindosis im Verhältnis zum Insulinbedarf zu hoch ist (siehe unter «Unerwünschte Wirkungen»).
Wechseln Patienten zwischen verschiedenen Insulinarten, können sich die Frühwarnsymptome einer Hypoglykämie verändern oder weniger ausgeprägt sein als dies bei ihrem vorherigen Insulin der Fall war.
Bei Patienten mit deutlich gebesserter Stoffwechsellage (z.B. aufgrund einer intensiven Insulintherapie) können unter Umständen einige oder sämtliche Warnsymptome entfallen, mit denen sich eine Hypoglykämie ankündigt. Diese Patienten sind entsprechend vorzuwarnen. Bei Patienten mit schon lange bestehendem Diabetes verschwinden möglicherweise die üblichen Warnsymptome.
Der Zeitpunkt einer Hypoglykämie reflektiert generell das Wirkprofil des verabreichten Insulinpräparates. Fiasp ultrafast-acting hat ein spezielles Wirkungsprofil (siehe unter «Eigenschaften/Wirkungen»), das sich auf den Zeitpunkt der Hypoglykämie auswirkt. Aufgrund der pharmakodynamischen Eigenschaften von Fiasp ultra-fast-acting treten Hypoglykämien im Vergleich zu anderen Bolus-Insulinen vermehrt innerhalb der ersten beiden Stunden nach Injektion auf.
Der schnellere Wirkungseintritt von Fiasp ultra-fast-acting ist bei der Behandlung von Patienten mit verzögerter Magenentleerung zu berücksichtigen.
Das Hypoglykämierisiko kann durch Begleiterkrankungen der Nieren, der Leber oder eine Unterfunktion der Nebennieren, der Hypophyse bzw. der Schilddrüse erhöht werden.
Hyperglykämie
Eine nicht ausreichende Dosierung oder die Unterbrechung der Behandlung kann, insbesondere bei Typ 1 Diabetes, zu potenziell lebensgefährlichen Hyperglykämien und zur diabetischen Ketoazidose führen.
Kontinuierliche subkutane Insulininfusion (CSII)
Fehlfunktionen der Pumpe oder des Infusionssets können zu einer schnell einsetzenden Hyperglykämie und zur Ketose führen. Bei Hyperglykämie oder Ketose muss die Ursache rasch erkannt und behoben werden. Zwischenzeitlich kann eine Therapie mit subkutanen Injektionen erforderlich sein.
Kombination von Fiasp ultra-fast-acting mit Pioglitazon
Es gibt Spontanmeldungen von Herzinsuffizienz, wenn Pioglitazon in Kombination mit Insulin insbesondere Patienten mit Risikofaktoren für die Entwicklung von Herzinsuffizienz verabreicht wurde. Dies sollte beachtet werden, falls eine Behandlung mit der Kombination von Pioglitazon und Insulinpräparaten erwogen wird. Falls die Kombination angewendet wird, sollten die Patienten hinsichtlich Anzeichen und Symptomen von Herzinsuffizienz, Gewichtszunahme und Ödemen beobachtet werden. Pioglitazon muss beim Auftreten jeder Verschlechterung kardialer Symptome abgesetzt werden.
Mit der Intensivierung der Blutzuckerkontrolle assoziierte Risiken
Bei Beginn/Intensivierung der Insulintherapie, insbesondere bei zu rascher Senkung des Blutzuckers, können ophthalmologische Störungen (z.B. transiente reversible Refraktionsanomalien, Verschlechterung der diabetischen Retinopathie), akute schmerzhafte periphere Neuropathien und periphere Ödeme auftreten. Längerfristig wird das Risiko für diabetische Retinopathie und Neuropathie durch eine adäquate Blutzuckerkontrolle aber gesenkt.
Insulin-Antikörper
Die Anwendung von Insulin kann die Bildung von Insulin-Antikörpern verursachen. In seltenen Fällen kann das Vorhandensein solcher Insulin-Antikörper eine Anpassung der Insulindosis zur Korrektur einer Tendenz zu Hyper- oder Hypoglykämien erforderlich machen.
Hilfsstoffe
Fiasp ultra-fast-acting enthält Metacresol, das in seltenen Fällen allergische Reaktionen hervorrufen kann.
Reisen zwischen Zeitzonen
Bevor der Patient in andere Zeitzonen reist, muss er sich mit seinem Arzt beraten, da dies bedeuten kann, dass er das Insulin und die Mahlzeiten zu anderen Uhrzeiten anwenden bzw. einnehmen muss.
Vermeidung von Verwechslungen/Medikationsfehlern
Patienten müssen instruiert werden, die Etikette des Insulins vor jeder Injektion zu überprüfen, um Verwechslungen von Fiasp ultra-fast-acting mit anderen Insulinpräparaten zu vermeiden.
Patienten müssen die Einheiten der Dosis vor der Verabreichung von Fiasp ultra-fast-acting visuell überprüfen. Daher können die Patienten sich das Medikament nur eigenständig verabreichen, wenn sie die Dosierskala lesen können. Blinde oder sehbehinderte Patienten müssen instruiert werden, dass sie stets die Hilfe einer anderen Person, die über gutes Sehvermögen verfügt und hinsichtlich der Applikation von Insulinen geschult wurde, angewiesen sind.
InteraktionenDer Glucosestoffwechsel wird von einigen Arzneimitteln beeinflusst.
1. Der Insulinbedarf kann vermindert sein in Gegenwart von Substanzen, welche die Insulinwirkung verbessern (Insulinsensitivität erhöhen), die Insulinsekretion steigern, die hepatische Gluconeogenese hemmen oder die intestinale Glucoseaufnahme beeinflussen. Bei gleichbleibender Insulinmenge besteht somit erhöhte Hypoglykämie-Gefahr durch gleichzeitige Einnahme von:
oralen Antidiabetika, Alkohol, ACE-Hemmern (z.B. Captopril und Enalapril), antiarrhytmischen Substanzen wie Disopyramid; α-Blockern und Clonidin, SSRI; Fenfluramin, MAO-Hemmern; trizyklischen Antidepressiva; Salicylaten und (selten) anderen NSAIDs; Fibraten; Tetracyclinen; Pentamidin (Hypoglykämie; gelegentlich mit nachfolgender Hyperglykämie), Antimalariamitteln (Chinin, Chloroquin, Mefloquin), Sulfonamiden (z.B. Cotrimoxazol), Cimetidin, Ranitidin, GLP-1-Rezeptor-Agonisten und anabolen Steroiden.
2. Der Insulinbedarf kann erhöht sein bei gleichzeitiger Einnahme/Anwendung der folgenden Substanzen bzw. Substanzgruppen:
Orale Kontrazeptiva und andere Oestrogen- oder Progestagen-Präparate, Kortikoide und ACTH, GH (Somatotropin), Danazol, Schilddrüsenhormone, Sympathikomimetika (vor allem β2-Sympathikomimetika wie Ritodrin, Salbutamol, Terbutalin, aber auch α-selektive, sowie nicht selektive Sympathikomimetika wie Epinephrin), Diazoxid, Nikotinsäure und -derivate; Chlorpromazin (vor allem in hohen Dosen) und andere Phenothiazin-Derivate; Diuretika (z.B. Thiazid-Diuretika, Indapamid und Furosemid); anti-retrovirale Substanzen, immunsuppressive Substanzen (Ciclosporin, Tacrolismus, Sirolimus), atypische Antipsychotika.
3. Bei Anwendung der folgenden Substanzen kann die Insulinwirkung je nach Dosis verstärkt bzw. abgeschwächt werden:
Octreotid-, Lanreotid-, Salicylsäure-Derivate, Lithium-Salze (selten).
β-Blocker können zu einer Verstärkung der Insulinresistenz aber auch, in gewissen Fällen, zu einer Hypoglykämie führen. Ausserdem können die Hypoglykämie-Warnsymptome abgeschwächt bzw. maskiert werden.
Schwangerschaft/StillzeitFür Fiasp ultra-fast-acting liegen bisher keine Daten zur Anwendung während der Schwangerschaft vor.
Daten aus zwei randomisierten kontrollierten klinischen Studien mit insgesamt 171 NovoRapid-exponierten Schwangerschaften lassen nicht auf Nebenwirkungen von Insulin Aspart auf die Schwangerschaft oder auf die Gesundheit des Fetus/Neugeborenen im Vergleich mit Humaninsulin schliessen.
Schwangeren Frauen mit Diabetes (Typ 1 Diabetes, Typ 2 Diabetes oder Gestationsdiabetes) und Frauen mit Diabetes, die eine Schwangerschaft planen, wird eine intensivierte Blutzuckereinstellung und eine engmaschige Blutzuckerkontrolle empfohlen.
Sowohl Hypoglykämie als auch Hyperglykämie, die bei einer nicht ausreichend kontrollierten Diabetestherapie auftreten können, erhöhen das Risiko von Missbildungen und Fruchttod in utero. Daher sollten Frauen, die an Diabetes erkrankt sind und eine Schwangerschaft planen bzw. bereits schwanger sind, intensiver überwacht werden.
Im ersten Trimenon fällt gewöhnlich der Insulinbedarf, steigt aber anschliessend im Verlauf des zweiten und dritten Trimenon wieder an.
Nach der Geburt fällt der Insulinbedarf innerhalb kurzer Zeit auf die Werte zurück, wie sie vor der Schwangerschaft bestanden haben.
Die Insulinbehandlung der stillenden Mutter stellt kein Risiko für das Neugeborene dar. Es kann jedoch erforderlich werden, die Dosierung von Fiasp ultra-fast-acting, die Ernährungsgewohnheiten oder beides anzupassen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEine Hypoglykämie kann die Konzentrations- und Reaktionsfähigkeit eines Patienten herabsetzen. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z.B. beim Fahren eines Autos oder beim Bedienen von Maschinen) ein Risiko darstellen.
Dem Patienten sollte geraten werden, Vorsichtsmassnahmen zur Vermeidung von Hypoglykämien beim Führen von Fahrzeugen zu treffen. Dies ist bei Patienten mit häufigen Hypoglykämieepisoden oder verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnsymptomen besonders wichtig. In diesen Fällen sollte überlegt werden, ob das Führen eines Fahrzeuges ratsam ist.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die häufigste während der Behandlung berichtete unerwünschte Wirkung ist Hypoglykämie (siehe unter «Beschreibung ausgewählter unerwünschten Wirkungen» weiter unten).
Unerwünschte Wirkungen aus klinischen Studien
Die unten aufgelisteten UWs basieren auf den Daten von klinischen Phase 3 Studien, bestehend aus vier abgeschlossenen klinischen Studien, in denen Fiasp ultra-fast-acting in drei Studien mit NovoRapid und in einer Studie mit der alleinigen Anwendung von Basalinsulin verglichen wurde. In den Studien wurden 1'244 Patienten mit Fiasp ultra-fast-acting behandelt; 788 dieser Patienten hatten Typ 1 Diabetes mellitus, von denen 25 eine CSII verwendeten, und 456 Patienten hatten Typ 2 Diabetes mellitus. Siehe Abschnitt Eigenschaften/Wirkungen für weitere Details zu den Studien. Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen dargestellt: Die Häufigkeit der unerwünschten Wirkungen ist wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100).
Tabelle 1: Unerwünschte Wirkungen aus klinischen Studien
|
MedDRA-Systemorganklassen
|
Sehr häufig
|
Häufig
|
Gelegentlich
| |
Erkrankungen des Immunsystems
|
|
|
Überempfindlichkeit
| |
Stoffwechsel- und Ernährungsstörungen
|
Hypoglykämie
|
|
| |
Erkrankungen der Haut und des Unterhautzellgewebes
|
|
Allergische Hautreaktionen*
|
Lipodystrophie
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
|
Reaktionen an der Injektions-/Infusionsstelle
|
|
* Allergische Hautreaktionen representieren eine Zusammenfassung der folgenden Begriffe: Ekzem, Ausschlag, juckender Ausschlag, Urtikaria und Dermatitis
Beschreibung ausgewählter unerwünschten Wirkungen
Erkrankungen des Immunsystems
Allergische Reaktionen
Über folgende allergische Hautreaktionen wurden unter Fiasp ultra-fast-acting berichtet (1,5% vs. 1,4% beim Vergleichspräparat): Ekzem, Ausschlag, juckender Ausschlag, Urtikaria und Dermatitis.
Über Generalisierte Überempfindlichkeitsreaktionen (generalisierter Hautausschlag und Gesichtsödeme) wurden mit Fiasp ultra-fast-acting gelegentlich berichtet (0,2% vs. 0,1% beim Vergleichspräparat). Über anaphylaktische Reaktionen wurden mit Fiasp ultra-fast-acting nicht berichtet. Anaphylaktische Reaktionen können mit Insulinpräparaten prinzipiell auftreten. Allergische Reaktionen vom Soforttyp auf Insulin oder Hilfsstoffe können potenziell lebensbedrohlich sein.
Stoffwechsel- und Ernährungsstörungen
Hypoglykämie
Eine Hypoglykämie kann auftreten, wenn die Insulindosis im Verhältnis zum Insulinbedarf zu hoch ist. Schwere Hypoglykämien können zu Bewusstlosigkeit und/oder zu Krämpfen mit vorübergehenden oder dauerhaften Störungen der Gehirnfunktion oder sogar zum Tod führen. Die Symptome der Hypoglykämie treten üblicherweise plötzlich auf. Sie umfassen kalten Schweiss, kalte blasse Haut, Erschöpfung, Nervosität oder Tremor, Ängstlichkeit, ungewöhnliche Müdigkeit oder Schwäche, Verwirrtheit, Konzentrationsstörungen, Benommenheit, übermässiger Hunger, Sehstörungen, Kopfschmerzen, Übelkeit und Palpitation.
In klinischen Studien war die Gesamtrate der Hypoglykämien bei mit Fiasp ultra-fast-acting und mit NovoRapid behandelten Patienten vergleichbar. Aufgrund der Pharmakodynamik von Fiasp ultra-fast-acting kann jedoch, falls eine Hypoglykämie auftritt, diese rascher nach Injektion/Infusion im Vergleich zu NovoRapid auftreten. Für Informationen aus klinischen Studien über die Hypoglykämieraten während den ersten 2 Stunden nach der Mahlzeit, siehe unter «Eigenschaften/Wirkungen».
Erkrankungen der Haut und des Unterhautzellgewebes
Lipodystrophie
Über Lipodystrophien (einschliesslich Lipohypertrophie, Lipoatrophie) an der Injektions-/Infusionsstelle wurde bei mit Fiasp ultra-fast-acting behandelten Patienten (0,2% vs. 0% beim Vergleichspräparat) berichtet. Das kontinuierliche Wechseln der Injektionsstelle innerhalb eines bestimmten Bereiches kann dabei helfen, das Risiko für diese Reaktionen zu reduzieren.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Reaktionen an der Injektions-/Infusionsstelle
Es wurden über Reaktionen an der Injektions-/Infusionsstelle (einschliesslich Ausschlag, Rötung, Entzündung, Hämatom und Juckreiz) bei Patienten, die mit Fiasp ultra-fast-acting behandelt wurden (1,0% vs. 0,7% beim Vergleichspräparat), berichtet. Diese Reaktionen sind normalerweise mild und vorübergehend. In der Regel verschwinden sie bei weiterer Behandlung.
Sonstige besondere Populationen
Basierend auf Ergebnissen klinischer Studien geben die Häufigkeit, die Art und der Schweregrad von unerwünschten Wirkungen, die bei älteren Patienten und bei Patienten mit Nieren- oder Leberinsuffizienz beobachtet wurden, keine Hinweise auf Unterschiede zu der umfassenderen Erfahrung in der Gesamtpopulation. Fiasp ultra-fast-acting wurde bei älteren Patienten verabreicht, um die pharmakokinetischen Eigenschaften zu untersuchen (siehe unter «Pharmakokinetik»).
ÜberdosierungFür Insulin kann keine spezifische Überdosierung definiert werden. Eine Hypoglykämie kann sich jedoch stufenweise entwickeln, wenn zu hohe Insulindosen im Vergleich zum Insulinbedarf verabreicht werden.
·Milde hypoglykämische Vorfälle können durch orale Verabreichung von Glucose oder anderen zuckerhaltigen Lebensmitteln behandelt werden. Es wird empfohlen, dass der Diabetiker immer einige Würfelzucker oder andere zuckerhaltige Lebensmittel (z.B. einige Biskuits) bei sich hat.
·Bei schweren hypoglykämischen Vorfällen, bei welchen der Patient bewusstlos ist, kann 0,5 bis 1,0 mg Glucagon intramuskulär oder subkutan durch eine geübte Person oder Glucose intravenös durch einen Arzt verabreicht werden. Falls der Patient nach 10 bis 15 Minuten auf eine Glucagon-Verabreichung nicht reagiert, muss zudem Glucose intravenös appliziert werden.
Sobald der Patient wieder bei Bewusstsein ist, empfiehlt sich die Verabreichung von Kohlenhydraten, um einen Rückfall zu vermeiden.
Eigenschaften/WirkungenATC-Code: A10AB05
Wirkmechanismus
Die blutzuckersenkende Wirkung von Insulin Aspart beruht auf der Fähigkeit des Moleküls, die Aufnahme von Glucose durch Bindung an Insulinrezeptoren von Muskel- und Fettzellen, zu erhöhen. Gleichzeitig wird die Ausschüttung von Glucose aus der Leber inhibiert.
Pharmakodynamische Wirksamkeit
Fiasp ultra-fast-acting ist eine Insulin Aspart Formulierung mit Niacinamid (Vitamin B3) als Hilfsstoff, was im Vergleich zu NovoRapid eine schnellere initiale Insulinabsorption, und eine stärkere frühe blutzuckersenkende Wirkung bewirkt.
Bei Patienten mit Diabetes Typ 1 (gepoolte Daten aus 3 Studien) war die mittlere Zeit bis zum Einsetzen der blutzuckersenkenden Wirkung bei Fiasp ultra-fast-acting im Vergleich zu NovoRapid um 4,9 Minuten früher (geschätzter Behandlungsunterschied: -4,9 Minuten [ -6,9; -3,0]95-%-KI) und die geschätzte mittlere Zeit bis zur maximalen Wirkung (Zeit bis GIRmax) bei Fiasp ultra-fast-acting im Vergleich zu NovoRapid um 10,5 Minuten früher (geschätzter Behandlungsunterschied: -10,5 Minuten [ -17,0; -4,0]95-%-KI). Die mittlere blutzuckersenkende Wirkung während der ersten 30 Minuten (AUC GIR, 0-30min) für Dosierungen von 0,2 E/kg war mit Fiasp ultra-fast-acting um 74% gegenüber NovoRapid signifikant erhöht (geschätztes Verhältnis: 1,74 [1,47; 2.10] 95-%-KI). Ein schnellerer Eintritt der glukosesenkenden Wirkung wurde für Dosierungen von 0.1 E/kg bis 0.4 E/kg beobachtet. Die mittlere blutzuckersenkende Wirkung insgesamt (GIR0-12h) und die maximale blutzuckersenkende Wirkung (GIRmax) von Fiasp ultra-fast-acting und NovoRapid waren vergleichbar. Beide Parameter zeigten eine annähernd lineare Dosisabhängigkeit innerhalb des therapeutischen Bereichs.
Über den Verlauf einer Phase 3 Studie (3852) bei Patienten mit Diabetes Typ 1 (N=1143), zeigte sich für Fiasp ultra-fast-acting im Vergleich zu NovoRapid (beide vor Beginn einer standardisierten Mahlzeit verabreicht) eine signifikant grössere Senkung des postprandialen Blutzuckeranstiegs (geschätzter Behandlungsunterschied für die Änderung des Blutzuckeranstiegs 2 Stunden nach einer Mahlzeit relativ zur Baseline: -0,67 mmol/l [-1,29; -0,04]95-%-KI). In einer analogen Phase 3 Studie (3853) bei Patienten mit Diabetes Typ 2 (N=689) zeigte sich ein numerischer Unterschied (-0,36 mmol/l [-0,81; 0,08]95-%-KI).
Die Tag-zu-Tag-Variabilität für die pharmakodynamischen Endpunkte AUCGIR, 0-1h, AUCGIR, 0-12h und GIRmax war mit der von NovoRapid vergleichbar.
Kontinuierliche subkutane Insulininfusion (CSII)
Fiasp ultra-fast-acting verbesserte im Vergleich zu NovoRapid die Blutzuckereinstellung in Patienten mit Typ 1 Diabetes innerhalb der ersten 2 Stunden nach einem standardisierten Mahlzeitentest (Behandlungsdifferenz für den mittleren postprandialen Blutzuckeranstieg: -0,99 mmol/l [-1,95; -0,03]95% CI).
Ältere Patienten
Die Pharmakokinetik/dynamik von Fiasp ultra-fast-acting wurde in einer randomisierten, doppelblinden Cross-Over-Studie in älteren (≥65 Jahre) Patienten mit Typ 1 Diabetes mellitus untersucht. Die blutzuckersenkende Wirkung in älteren und jüngeren Patienten war vergleichbar (Ratio AUCGIR,0−12h 0,93 [0,73;1,17]95% CI), obwohl die Exposition für Insulin Aspart in älteren Patienten um ca. 30% erhöht war (Ratio AUCIAsp,0−12h 1,30 [1,07;1,57]95% CI).
Kinder und Jugendliche
Der postprandiale Verlauf der Plasmaglukose mit Fiasp ultra-fast-acting in Kindern und Jugendlichen war mit dem in Erwachsenen vergleichbar (Differenz im mittleren postprandialen Anstieg der Plasmaglukose über 2h: Kinder - Erwachsene 0,16 [-1,86; 2,19]95% CI bzw. Jugendliche - Erwachsene 1,54 [-0,20; 3,27]95% CI).
Klinische Wirksamkeit und Sicherheit
Fiasp ultra-fast-acting wurde bei 2'068 randomisierten erwachsenen Patienten mit Typ 1 Diabetes mellitus (1'143 Patienten) und Typ 2 Diabetes mellitus (925 Patienten) in 3 Langzeit- (18–26 Behandlungswochen) Wirksamkeits- und Sicherheitsstudien untersucht.
Patienten mit Typ 1 Diabetes mellitus
Mit Fiasp ultra-fast-acting wird eine wirksame Blutzuckerkontrolle bei prandialer oder postprandialer Verabreichung erreicht. Bei prandialer Verabreichung von Fiasp ultra-fast-acting war die Senkung des HbA1c statistisch signifikant stärker im Vergleich zu NovoRapid (Abb. 1, Tabelle 2). Mit Fiasp ultra-fast-acting wurde bei Patienten mit Typ 1 Diabetes im Vergleich zu NovoRapid eine bessere gesamte Blutzuckerkontrolle erreicht.
Tabelle 2: Ergebnisse aus einer 26-wöchigen klinischen Basal-Bolus-Studie bei Patienten mit Typ 1 Diabetes
|
|
Fiasp ultra-fast-acting prandial + Insulin detemir
|
Fiasp ultra-fast-acting postprandial + Insulin detemir
|
NovoRapid prandial + Insulin detemir
| |
N
|
381
|
382
|
380
| |
HbA1c (%)
| |
Baseline → Ende der Studie
|
7,6 → 7,3
|
7,6 → 7,5
|
7,6 → 7,4
| |
Angepasste Veränderung seit Baseline
|
-0,32
|
-0.13
|
-0,17
| |
Geschätzte Behandlungsdifferenz
|
-0,15 [-0,23;-0,07]CE
|
0,04 [-0,04;0,12]D
|
| |
Patienten (%), die ein HbA1c <7% erreichten
| |
Alle Patienten
|
33,3
|
23,3
|
28,2
| |
Geschätzte Odds Ratio
|
1,47 [1,02;2,13]CE
|
0,73 [0,49;1,07]D
|
| |
Blutzuckeranstieg (mmol/l) 2 Stunden postprandialB
| |
Baseline → Ende der Studie
|
6,1 → 5,9
|
6,1 → 6,7
|
6,2 → 6,6
| |
Angepasste Veränderung seit Baseline
|
-0,29
|
0,67
|
0,38
| |
Geschätzte Behandlungsdifferenz
|
-0,67 [-1,29;-0,04]CE
|
0,30 [-0,34;0,93]D
|
| |
Beobachtete Rate schwerer oder durch Blutzuckermessung bestätigter HypoglykämieB pro Patientenjahr der Exposition (prozentualer Anteil der Patienten)
|
59,0 (92,7)
|
54,4 (95,0)
|
58,7 (97,4)
| |
Geschätzte Rate Ratio
|
1,01 [0,88;1,15]C
|
0,92 [0,81;1,06]D
|
| |
Beobachtete Rate schwerer Hypoglykämien oder durch Blutzuckermessung bestätigter HypoglykämieB pro Patientenjahr der Exposition (prozentualer Anteil der Patienten)
|
0.25 (6.7)
|
0.26 (8.0)
|
0.27 (8.4)
| |
Geschätzte Rate Ratio
|
0.87 [0.47; 1.62]C
|
0.93 [0.50;1.73]D
|
|
Ausgangs- und Studienende-Werte basieren auf der letzten, verfügbaren, beobachteten Werte. Angabe des 95% Konfidenzintervall i in ‹[ ]›
A Mahlzeitentest
B Schwere Hypoglykämie (Episode, die die Hilfe einer anderen Person erforderlich gemacht hat) oder mittels Blutzuckermessung bestätigte Hypoglykämie definiert als Episode mit Blutzucker <3,1 mmol/l, unabhängig von Symptomen
C Die Differenz bezieht sich auf prandial verabreichtes Fiasp ultra-fast-acting – prandial verabreichtes NovoRapid
D Die Differenz bezieht sich auf postprandial verabreichtes Fiasp ultra-fast-acting – prandial verabreichtes NovoRapid
E Statistisch signifikant zugunsten von präprandial verabreichtem Fiasp ultra-fast-acting
Bei Patienten mit Diabetes Typ 1 waren die beobachteten Raten schwerer oder per BZ (Blutzucker)-Messung bestätigter Hypoglykämie-Episoden in den Behandlungsgruppen vergleichbar (prandiales Fiasp ultra-fast-acting, postprandiales Fiasp ultra-fast-acting und NovoRapid, Tabelle 2).
Insgesamt 6,7%, 8,0% und 8,4% der Patienten in den Behandlungsgruppen mit prandialem Fiasp ultra-fast-acting, postprandialem Fiasp ultra-fast-acting und NovoRapid, erlitten mindestens 1 Episode einer schweren Hypoglykämie. Die entsprechenden Raten in den drei Behandlungsgruppen betrugen 0,25, 0,26 und 0,27 Episoden pro Patientenjahr der Exposition. Es gab keine statistisch signifikanten Behandlungsunterschiede in der Gruppe mit prandialem oder postprandialem Fiasp ultra-fast-acting im Vergleich zu NovoRapid (geschätzte Behandlungs-verhältnisse; prandiales Fiasp ultra-fast-acting: NovoRapid: 0,87 [0,47; 1,62]95-%-KI; postprandiales Fiasp ultra-fast-acting : NovoRapid®: 0,93 [0,50; 1,73]95-%-KI).
Innerhalb von 2 Stunden nach Beginn einer Mahlzeit war die beobachtete Rate schwerer oder per BZ-Messung bestätigter Hypoglykämie höher, aber nicht statistisch signifikant unterschiedlich: 7,46 Episoden pro Patientenjahr der Exposition (66,8% der Patienten) bei prandialem Fiasp ultra-fastacting im Vergleich zu 5,87 Episoden pro Patientenjahr der Exposition (66,1% der Patienten) bei NovoRapid, was den früheren und schnelleren Wirkeintritt und den niedrigeren postprandialen Blutzuckeranstieg, die mit Fiasp ultra-fast-acting beobachtet wurden, widerspiegelt.
Patienten mit Typ 2 Diabetes mellitus
Patienten mit Typ 2 Diabetes mellitus zeigten unter Behandlung mit Fiasp ultra-fast-acting eine zu NovoRapid vergleichbare Wirksamkeit hinsichtlich der Blutzuckerkontrolle (Behandlungsdifferenz für Änderung im HbA1c: -0,02[-0,15;0,10] 95% CI).
Bolus-Injektionen von Fiasp ultra-fast-acting zu den Hauptmahlzeiten zusätzlich zur Behandlung mit Basalinsulin und Metformin, bewirkte eine ausgeprägte Reduktion des HbA1c (Behandlungsdifferenz: -0,94 [-1,17;-0,72] 95% CI).
Ältere Patienten
In den drei kontrollierten klinischen Studien waren 192 von 1'219 (16%) mit Fiasp ultra-fast-acting behandelten Patienten mit Typ 1 Diabetes mellitus oder Typ 2 Diabetes mellitus ≥65 Jahre alt und 24 von 1'219 (2%) waren ≥75 Jahre alt. Dabei wurden keine Unterschiede zwischen älteren und jüngeren Patienten in Bezug auf Sicherheit und Wirksamkeit beobachtet.
PharmakokinetikAbsorption
Fiasp ultra-fast-acting zeichnet sich durch einen im Vergleich zu NovoRapid schnellere und höhere Exposition innerhalb der ersten 2 Stunden nach Injektion/Infusion aus.
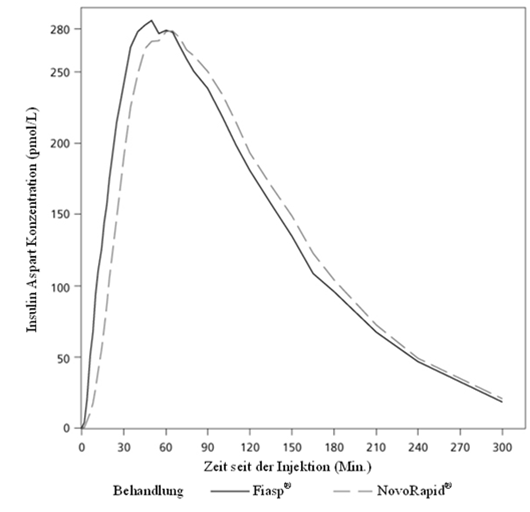
Bei subkutaner Injektion von Fiasp ultra-fast-acting wurde Insulin Aspart circa 4 Minuten nach Verabreichung im Blutkreislauf beobachtet, d.h. ca. 5 Minuten früher als nach subkutaner Injektion von NovoRapid. Die Zeit bis zum Erreichen von 50% der maximalen Konzentration war 9 Minuten kürzer. Die gesamte Insulinexposition (Insulin Aspart, 0–12 Stunden) und die maximale Insulinkonzentration (Cmax) von Fiasp ultra-fast-acting und NovoRapid waren vergleichbar (Tabelle 3). Die gesamte und maximale Konzentration steigt innerhalb des therapeutischen Dosisbereichs proportional mit zunehmender subkutaner Dosis von Fiasp ultra-fast-acting an.
Tabelle 3: Behandlungsratio (Fiasp ultra-fast-acting/NovoRapid) der Insulinexposition nach Injektion
|
Frühe Insulinexposition*
| |
AUCInsulin Aspart, 0–15 min
|
3,83 [3,41; 4,29]
| |
AUCInsulin Aspart, 0–30 min
|
2,01 [1,87; 2,17]
| |
AUCInsulin Aspart, 0–1 h
|
1,32 [1,26; 1,39]
| |
AUCInsulin Aspart, 0–1,5 h
|
1,16 [1,12; 1,21]
| |
AUCInsulin Aspart, 0–2 h
|
1,10 [1,06; 1,14]
| |
Gesamte Insulinexposition*
| |
AUCInsulin Aspart, 0–12 h
|
1,01 [0,98; 1,04]
| |
Cmax, Insulin Aspart
|
1,04 [1,00; 1,08]
|
Das 95% Konfidenzintervall ist in ‹[]› angegeben
* Basierend auf freiem Insulin Aspart im Serum; AUC = Fläche unter der Kurve; Cmax = maximale beobachtete Konzentration.
Distribution
Insulin Aspart hat eine geringe Bindungsaffinität zu Plasmaproteinen (<10%), ähnlich zu humanem Normalinsulin.
Biotransformation
Die Degradierung von Insulin Aspart ist vergleichbar mit dem von Humaninsulin; alle entstehenden Metaboliten sind inaktiv.
Elimination
Die Halbwertszeit nach subkutaner Verabreichung von Fiasp ultra-fast-acting beträgt 57 Minuten und ist mit der von NovoRapid vergleichbar.
Besondere Populationen
Ältere Patienten
Bei älteren Patienten mit Typ 1 Diabetes zeigte Fiasp ultra-fast-acting im Vergleich zu NovoRapid einen früheren Expositionsbeginn und eine stärkere frühe Insulinexposition bei vergleichbarer Gesamtexposition und maximaler Konzentration.
Die Bedeutung des Alters für die gesamte Insulinexposition von Fiasp ultra-fast-acting basiert auf Ergebnissen pharmakokinetischer Analysen bei verschiedenen Populationen von Patienten mit Typ 1 Diabetes. Es wurde kein Zusammenhang zwischen der gesamten Insulinexposition und dem Alter beobachtet (Altersspanne von 18 bis 83).
Leberinsuffizienz
Eine Einzeldosis-Studie zur Pharmakokinetik mit Insulin Aspart wurde bei 24 Patienten mit einer normalen bis stark eingeschränkten Leberfunktion durchgeführt. Bei Patienten mit Leberinsuffizienz war die Absorptionsrate verringert und variierte stärker.
Niereninsuffizienz
Die Bedeutung der Niereninsuffizienz für die Gesamtinsulinexposition von Fiasp ultra-fast-acting beruht auf Ergebnissen pharmakokinetischer Analysen bei verschiedenen Patientenpopulationen mit Typ 1 Diabetes. Die Nierenfunktion wurde mittels Kreatinin-Clearance (CLcr) folgendermassen definiert: ≥90 ml/min (normal) (N=546), 60–89 ml/min (leicht) (N=115), 30–59 ml/min (mässig) (N=21). Unter Fiasp ultra-fast-acting wurde mit abnehmender Nierenfunktion eine höhere Gesamtexposition festgestellt. Jedoch wurde auch eine gewisse Variabilität zwischen den Probanden mit Typ 1 Diabetes und leichter oder mässiger Niereninsuffizienz festgestellt. So sollte bei Patienten mit Niereninsuffizienz, wie bei allen Insulin-Präparaten, die Kontrolle des Blutzuckers intensiviert und die Dosierung von Fiasp ultra-fast-acting individuell angepasst werden.
Kinder und Jugendliche
Beginn und frühe Insulinexposition von Fiasp ultra-fast-acting (0.2 E/kg Körpergewicht) war bei Kindern (6–11 Jahre) und Jugendlichen (12–18 Jahre) vergleichbar mit derjenigen von Erwachsenen. Die Gesamtexposition von Fiasp ultra-fast-acting war bei Kindern und Jugendlichen im Vergleich zu Erwachsenen niedriger, während die maximale Insulin Aspart Serumkonzentration innerhalb der Altersgruppen vergleichbar war.
Präklinische DatenPräklinische Daten, die auf konventionellen Studien zur Sicherheitspharmakologie, chronischen Toxizität, Genotoxizität und zur Reproduktionstoxizität nach der Exposition mit Insulin Aspart basieren, lassen keine besonderen Gefahren für den Menschen erkennen. In-vitro-Studien zur Rezeptorbindungskinetik an Insulin- und IGF-1-Rezeptoren und zu Auswirkungen auf das Zellwachstum zeigten, dass Insulin Aspart diesbezüglich keine relevanten Unterschiede zu nativem Humaninsulin aufweist. Studien haben ebenfalls aufgezeigt, dass die Dissoziation der Bindung vom Insulinrezeptor von Insulin Aspart derjenigen von Humaninsulin entspricht.
Fortpflanzungsstudien beim Tier zeigten keine Unterschiede zwischen Insulin Aspart und Humaninsulin hinsichtlich Embryotoxizität und Teratogenität.
Sonstige HinweiseInkompatibilitäten
Zu Fiasp ultra-fast-acting hinzugefügte Substanzen können zur Degradierung von Insulin Aspart führen.
Fiasp ultra-fast-acting darf nicht verdünnt und mit keinen anderen Präparaten ausser den Infusionslösungen wie im Abschnitt «Dosierung» beschrieben gemischt werden.
Haltbarkeit
Vor dem ersten Öffnen: 30 Monate. Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Daum verwendet werden.
Besondere Lagerungshinweise
Fiasp ultra-fast-acting, FlexTouch 100 Einheiten/ml Injektionslösung im Fertigpen
Vor dem ersten Öffnen: Im Kühlschrank lagern (2–8 °C). Nicht einfrieren.
Nach Anbruch oder als Ersatz mitgeführt: Nicht über 30 °C lagern. Kann im Kühlschrank (2–8 °C) gelagert werden. Nicht einfrieren. Innerhalb von 4 Wochen verbrauchen. Verschlusskappe auf dem Pen lassen, um den Pen vor Licht zu schützen.
Fiasp ultra-fast-acting, Penfill 100 Einheiten/ml Injektionslösung in einer Patrone
Vor dem ersten Öffnen: Im Kühlschrank lagern (2–8 °C). Nicht einfrieren.
Nach Anbruch oder als Ersatz mitgeführt: Nicht über 30 °C lagern. Nicht einfrieren. Innerhalb von 4 Wochen verbrauchen. Patrone im Umkarton aufbewahren, um diese vor Licht zu schützen.
Fiasp ultra-fast-acting 100 Einheiten/ml Injektionslösung in einer Durchstechflasche
Vor dem ersten Öffnen: Im Kühlschrank lagern (2–8 °C). Nicht einfrieren.
Nach Anbruch oder als Ersatz mitgeführt: Nicht über 30 °C lagern. Kann im Kühlschrank (2–8 °C) gelagert werden. Nicht einfrieren. Innerhalb von 4 Wochen verbrauchen. Durchstechflasche im Umkarton aufbewahren, um diese vor Licht zu schützen.
Fiasp ultra-fast-acting darf nicht verwendet werden, wenn die Lösung nicht klar und farblos aussieht. Wurde Fiasp ultra-fast-acting versehentlich eingefroren, darf es nicht mehr verwendet werden.
Hinweise zur Handhabung
Fiasp ultra-fast-acting, FlexTouch 100 Einheiten/ml Injektionslösung im Fertigpen
Nadeln und Fiasp ultra-fast-acting, FlexTouch dürfen jeweils nur von einer einzigen Person verwendet werden. Der Fertigpen darf nicht wieder aufgefüllt werden.
Fiasp ultra-fast-acting, Penfill 100 Einheiten/ml Injektionslösung in einer Patrone
Nadeln und Fiasp ultra-fast-acting, Penfill dürfen jeweils nur von einer einzigen Person verwendet werden. Die Patrone darf nicht wieder aufgefüllt werden.
Fiasp ultra-fast-acting 100 Einheiten/ml Injektionslösung in einer Durchstechflasche
Nadeln und Spritzen dürfen jeweils nur von einer einzigen Person verwendet werden.
Fiasp ultra-fast-acting kann, wie unter «Dosierung/Anwendung» beschrieben, während einem Zeitraum von 9 Tagen in einem Infusionspumpensystem (CSII) verwendet werden. Schläuche, bei denen die inneren Oberflächen aus Polyethylen oder Polyolefin bestehen, erwiesen sich im Rahmen der Evaluierung als kompatibel.
Der Patient muss die Nadel nach jeder Injektion entsorgen.
Fiasp ultra-fast-acting, FlexTouch 100 Einheiten/ml Injektionslösung im Fertigpen
Im Notfall kann bei einem aktuellen Fiasp ultra-fast-acting Anwender (Hospitalisierung oder Fehlfunktion des Insulinpens) Fiasp ultra-fast-acting mit einer U100-Insulinspritze aus einem Fertigpen entnommen werden.
Fiasp ultra-fast-acting, Penfill 100 Einheiten/ml Injektionslösung in einer Patrone
Im Notfall kann bei einem aktuellen Fiasp ultra-fast-acting Anwender (Hospitalisierung oder Fehlfunktion des Insulinpens) Fiasp ultra-fast-acting mit einer U100-Insulinspritze aus einer Patrone entnommen werden.
Abfallmaterial muss gemäss lokalen Anforderungen entsorgt werden.
Zulassungsnummer66200, 66201, 66202 (Swissmedic).
PackungenFiasp ultra-fast-acting
Einzelpackungen mit Durchstechflaschen zu 10 ml (100 E/ml): 1 [B]
Fiasp ultra-fast-acting, Penfill
Patronen zu 3 ml (100 E/ml; 300 E pro Penfill) zur Anwendung in Novo Nordisk Injektionsgeräten: 5 (B)
Fiasp ultra-fast-acting, FlexTouch
Fertigpen zu 3 ml (100 E/ml; 300 E pro FlexTouch): 5 [B]
ZulassungsinhaberinNovo Nordisk Pharma AG, Küsnacht/ZH.
Stand der InformationNovember 2016.
|

