ZusammensetzungWirkstoffe
·Insulinum glarginum (Humanum insulinum analogum) (21A-Gly-30Ba-L-Arg-30Bb-L-Arg-humanum insulinum), hergestellt durch rekombinante DNA-Technologie unter Verwendung von K12-Stämmen von Escherichia coli.
·Lixisenatid
Hilfsstoffe
Glycerolum, Methioninum, Conserv.: Metacresolum 2,7 mg, Zinci chloridum, Acidum hydrochloridum (zur Einstellung des pH-Werts), Natrii hydroxidum (zur Einstellung des pH-Werts), Aqua ad iniectabilia q.s. ad solutionem pro 1 ml.
Indikationen/AnwendungsmöglichkeitenSuliqua wird in Kombination mit Metformin zur Behandlung des Diabetes mellitus Typ 2 bei Erwachsenen angewendet, wenn Metformin allein oder eine Kombinationstherapie mit Metformin und Sulfonylharnstoff, Metformin und einem GLP-1-Rezeptoragonisten oder Metformin und Basalinsulin keine ausreichende Blutzuckereinstellung gewährleistet.
Dosierung/AnwendungDosierung
Suliqua ist in zwei Stärken erhältlich, die unterschiedliche Dosierungen ermöglichen. Der Unterschied zwischen den beiden Stärken/Fertigpens liegt in den Dosisbereichen, die sich damit verabreichen lassen.
Suliqua 100/50 (gelber SoloStar-Fertigpen, 10–40)
Suliqua 100/50 ermöglicht die Verabreichung von Tagesdosen in Höhe von 10 bis 40 Dosisschritten (10–40 Einheiten Insulin glargin und 5–20 µg Lixisenatid).
Suliqua 100/33 (grüner SoloStar-Fertigpen, 30–60)
Suliqua 100/33 ermöglicht die Verabreichung von Tagesdosen in Höhe von 30 bis 60 Dosisschritten (30–60 Einheiten Insulin glargin und 10–20 µg Lixisenatid).
Um Medikationsfehler zu vermeiden, muss der Arzt/die Ärztin sicherstellen, dass auf dem Rezept die Dosisstärke, der Fertigpen-Typ und die anzuwendende Dosis eindeutig vermerkt sind.
Die zulässige Tageshöchstdosis Suliqua beträgt 60 Dosisschritte (60 Einheiten Insulin glargin und 20 µg Lixisenatid).
Suliqua wird einmal täglich innerhalb einer Stunde vor einer beliebigen Mahlzeit subkutan injiziert.
Die prandiale Injektion von Suliqua sollte vorzugsweise jeden Tag zur gleichen Zeit erfolgen; hierzu soll der Patient die Mahlzeit auswählen, die für ihn am praktischsten ist, vorzugsweise das Frühstück. Wenn der Patient eine Injektion vergisst, kann er sie innerhalb der Stunde vor der nächsten Mahlzeit nachholen.
Die Dosierung von Suliqua erfolgt individuell auf Basis des klinischen Ansprechens des Patienten. Sie richtet sich nach dem individuellen Insulinbedarf des Patienten. Die Lixisenatid-Dosis steigt oder sinkt mit der Insulin-glargin-Dosis und hängt auch vom Fertigpen-Typ ab.
Eine Dosisanpassung oder eine Verlegung des Injektionszeitpunkts durch den Patienten darf nur unter ärztlicher Aufsicht und angemessener Überwachung des Blutzuckerspiegels erfolgen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Anfangsdosis Suliqua
Die Anfangsdosis von Suliqua wird auf der Grundlage der bisherigen Diabetestherapie festgelegt. Dabei darf die empfohlene Anfangsdosis von 10 µg Lixisenatid nicht überschritten werden.
Eine bisherige Therapie mit Insulin, GLP-1-Agonisten oder anderen oralen Antidiabetika als Metformin ist vor Beginn der Behandlung mit Suliqua zu beenden.
·Nach bisheriger Behandlung mit oralen Antidiabetika, allein oder in Kombination mit einem GLP-1-Rezeptoragonisten, beträgt die empfohlene Anfangsdosis 10 Dosisschritte Suliqua 100/50 täglich.
·Nach bisheriger Behandlung mit einem 1× täglich anzuwendenden Basalinsulin (ausser Toujeo) ist die empfohlene tägliche Anfangsdosis Suliqua der nachstehenden Tabelle zu entnehmen.
·Nach bisheriger Behandlung mit einem 2× täglich anzuwendenden Basalinsulin oder mit Toujeo (Insulin glargin 300 Einheiten/ml) ist die bisher angewendete Tagesdosis um 20 % zu reduzieren; danach ist die entsprechende Anfangsdosis Suliqua der nachstehenden Tabelle zu entnehmen.
|
Bisherige Therapie: Basalinsulin
| |
Insulin-Tagesdosis*
|
≥10 bis < 20 Einheiten
|
≥20 bis < 30 Einheiten
|
≥30 bis ≤60 Einheiten
| |
Anfangsdosis und Pen
|
Suliqua
100/50
|
10 Dosisschritte/Tag
(10 Einheiten/5 µg)**
|
20 Dosisschritte/Tag
(20 Einheiten/10 µg)**
|
| |
Suliqua
100/33
|
|
30 Dosisschritte/Tag
(30 Einheiten/10 µg)**
|
* Dosis zuvor um 20 % heruntergerechnet, wenn der Patient bisher mit Toujeo (Insulin glargin 300 Einheiten/ml) oder mit einem 2× täglich anzuwendenden Basalinsulin behandelt wurde.
** Einheiten Insulin glargin (100 Einheiten/ml) / Mikrogramm Lixisenatid
Die zulässige Tageshöchstdosis Suliqua beträgt 60 Einheiten Insulin glargin und 20 µg Lixisenatid, entsprechend 60 Dosisschritten.
Titration der Suliqua-Dosis
Suliqua wird je nach individuellem Insulinbedarf des Patienten dosiert. Für eine optimierte Blutzuckereinstellung wird eine Anpassung der Dosis auf Basis des Nüchternblutzuckerspiegels im Plasma empfohlen (siehe «Eigenschaften/Wirkungen – Pharmakodynamik»). Während der Umstellung auf Suliqua und in den darauf folgenden Wochen wird eine engmaschige Überwachung des Blutzuckerspiegels empfohlen.
·Wenn der Patient mit Suliqua 100/50 beginnt, kann die Dosis bis auf 40 Dosisschritte gesteigert werden.
·Für Dosen von > 40 Dosisschritten/Tag ist Suliqua 100/33 zu verwenden.
·Wenn der Patient mit Suliqua 100/33 beginnt, kann die Dosis bis auf 60 Dosisschritte gesteigert werden.
·60 Dosisschritte entsprechen der zulässigen Tageshöchstdosis. Suliqua-Dosen über 60 Dosisschritte/Tag dürfen nicht angewendet werden.
Art der Anwendung
Suliqua wird subkutan in die Bauchdecke, den Deltamuskel oder den Oberschenkel injiziert.
Der vorgefüllte Fertigpen Suliqua Solostar ist ausschliesslich für subkutane Injektionen geeignet.
Wie schnell das Arzneimittel resorbiert wird und wie schnell und wie lange es dementsprechend wirkt, kann je nach körperlicher Belastung und anderen Faktoren wie Stress, interkurrente Erkrankungen, Umstellungen bei gleichzeitig angewendeten Arzneimitteln oder Mahlzeiten unterschiedlich sein.
Es wird empfohlen, die Injektionsstelle innerhalb des gleichen Bereichs (Bauchdecke, Deltamuskel oder Oberschenkel) von Injektion zu Injektion zu wechseln, um die Risiken der Lipodystrophie und der kutanen Amyloidose zu reduzieren oder zu vermeiden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»). Um Dosierungsfehler und eventuelle Überdosierungen zu vermeiden, darf Suliqua niemals mit einer Spritze aus der Patrone des Solostar-Fertigpens entnommen werden.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Besondere Patientengruppen
Ältere Patienten
Suliqua kann bei älteren Patienten angewendet werden. Die Dosis ist auf Basis von Blutzuckermessungen individuell anzupassen.
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit eingeschränkter Nierenfunktion kann der Insulinbedarf infolge des verminderten Insulinabbaus verringert sein. Bei Patienten mit eingeschränkter Nierenfunktion, die Suliqua anwenden, können häufige Blutzuckerkontrollen und Dosisanpassungen erforderlich sein. Zur Anwendung von Lixisenatid bei Patienten mit schwerer Niereninsuffizienz (Kreatininclearance < 30 ml/min) oder terminaler Niereninsuffizienz liegen keine therapeutischen Erfahrungen vor; die Anwendung von Suliqua bei dieser Patientenpopulation wird daher nicht empfohlen.
Patienten mit Leberfunktionsstörungen
Lixisenatid wird vorwiegend über die Nieren abgebaut. Von einer Leberfunktionsstörung ist daher kein Einfluss auf die Pharmakokinetik von Lixisenatid zu erwarten. Bei Patienten mit Einschränkung der Leberfunktion kann der Insulinbedarf aufgrund der reduzierten Kapazität zur Glykoneogenese und des verminderten Insulinabbaus verringert sein. Bei Patienten mit eingeschränkter Leberfunktion, die Suliqua anwenden, können häufige Blutzuckerkontrollen und Dosisanpassungen erforderlich sein.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Suliqua bei Kindern und Jugendlichen unter 18 Jahren ist bisher nicht nachgewiesen.
KontraindikationenÜberempfindlichkeit gegenüber einem der Wirkstoffe oder beiden Wirkstoffen oder einem der Hilfsstoffe.
Warnhinweise und VorsichtsmassnahmenSuliqua darf nicht zur Behandlung von Diabetes mellitus Typ 1 oder diabetischer Ketoazidose eingesetzt werden.
Die Insulintherapie erfordert grundsätzlich die Fähigkeit des Patienten zum selbständigen Umgang mit der Diabeteserkrankung, wie Überwachung des Blutzuckerspiegels, Erlernen der richtigen Injektionstechnik und angemessenes Verhalten bei hypo- und hyperglykämischen Stoffwechselsituationen. Die Patienten müssen in diesen selbständig durchzuführenden Massnahmen geschult werden. Sie müssen ausserdem über das richtige Verhalten in Ausnahmesituationen aufgeklärt werden, wie sie durch unzureichende oder ausgelassene Insulingaben oder durch versehentlich zu hohe Insulindosen, unzureichende Nahrungsaufnahme oder ausgelassene Mahlzeiten entstehen können.
Vor der Anwendung des Fertigpens muss die Bedienungsanleitung in der Packungsbeilage des Pens sorgfältig durchgelesen werden. Bei der Handhabung des Fertigpens müssen die dort aufgeführten Anweisungen befolgt werden. Zur Vermeidung einer möglichen Übertragung von Krankheiten darf jeder Fertigpen nur von einer einzigen Person benutzt werden.
Die Behandlung mit Insulin erfordert ständige Aufmerksamkeit für mögliche Hyper- oder Hypoglykämien. Patienten und ihre Angehörigen müssen wissen, welche korrigierenden Massnahmen ergriffen werden müssen, wenn eine Hyper- oder Hypoglykämie auftritt oder vermutet wird, und wann ein Arzt/eine Ärztin zu informieren ist.
Bei ungenügender Stoffwechseleinstellung oder Neigung zu Hyper- oder Hypoglykämien müssen die Einhaltung des Therapieschemas durch den Patienten, die gewählten Injektionsstellen und die Injektionstechnik, die Handhabung des Pens sowie alle anderen relevanten Faktoren, die eine Neigung zu Hyper- oder Hypoglykämien verstärken können, überprüft werden, bevor eine Dosisanpassung in Erwägung gezogen wird.
Die Umstellung auf ein anderes Insulinpräparat darf nur unter strenger ärztlicher Aufsicht und Einhaltung genauer Anweisungen erfolgen. Desgleichen darf das Behandlungsschema nur nach Rücksprache mit dem Arzt/der Ärztin bzw. entsprechend dessen/deren Angaben verändert werden.
Die Patienten sollten angewiesen werden, die Injektionsstelle bei jeder Verabreichung konsequent zu wechseln, um das Risiko der Entwicklung einer Lipodystrophie und einer kutanen Amyloidose zu verringern. Es besteht ein potenzielles Risiko einer verzögerten Aufnahme von Insulin sowie einer Verschlechterung der Blutzuckerkontrolle nach Insulininjektionen an Stellen mit diesen Reaktionen. Es wurde berichtet, dass ein plötzlicher Wechsel der Injektionsstelle zu einem nicht betroffenen Bereich eine Hypoglykämie nach sich ziehen kann. Es wird empfohlen, den Blutzuckerspiegel nach dem Wechsel der Injektionsstelle zu überwachen und eine Anpassung der Dosis antidiabetischer Arzneimittel zu erwägen.
Hypoglykämie
Hypoglykämie ist die Nebenwirkung, die während der Behandlung mit Suliqua am häufigsten beobachtet wurde. Eine Hypoglykämie kann auftreten, wenn eine höhere Dosis Suliqua injiziert wurde als erforderlich war. Beim insulinbehandelten Diabetiker besteht grundsätzlich das Risiko leichter oder schwerer Hypoglykämien. Diese können seine Aufmerksamkeit und damit insbesondere die Sicherheit beim Autofahren oder Bedienen von Maschinen beeinträchtigen. Dies gilt besonders zu Beginn der Behandlung, bei Präparatewechsel, unregelmässigen Insulininjektionen oder unregelmässiger Nahrungsaufnahme, sowie allgemein bei nicht optimaler Einstellung, die mit starken Blutzuckerschwankungen einhergehen kann. Der Patient muss über dieses erhöhte Risiko der Hypoglykämie informiert werden.
Als Ursachen einer Hypoglykämie kommen in Frage: Auslassen einer Mahlzeit, Erbrechen, Diarrhö, aussergewöhnliche körperliche Anstrengung, Insulinüberdosierung, endokrine Krankheiten wie Nebennierenrindeninsuffizienz, Hypothyreose, gleichzeitige Anwendung bestimmter anderer Arzneimittel, Wechsel des Injektionsbereichs, Verbesserung der Insulinempfindlichkeit (zum Beispiel nach Ausschaltung von Stressfaktoren).
Ebenso ist bei bereits vorausgegangenen schweren Hypoglykämien das Risiko grösser, dass sich diese wiederholen.
Um einer Hypoglykämie frühzeitig begegnen zu können, ist der Patient zu instruieren, immer Traubenzucker, Würfelzucker o.ä. mit sich zu führen. Er soll auch seinen Diabetikerausweis mit sich führen.
Der Zeitpunkt des Auftretens einer Hypoglykämie hängt vom Wirkprofil der verwendeten Insuline ab und kann sich daher bei Umstellung des Behandlungsschemas ändern.
Besondere Vorsicht sowie eine verstärkte Überwachung des Blutzuckers ist bei Patienten geboten, bei denen hypoglykämische Episoden besonders schwere klinische Folgen haben können, wie z.B. bei Patienten mit signifikanten Stenosen der Koronararterien oder der hirnversorgenden Blutgefässe (Risiko kardialer oder zerebraler Komplikationen bei Hypoglykämie) sowie bei Patienten mit proliferativer Retinopathie, insbesondere wenn diese nicht laserbehandelt ist (Gefahr der vorübergehenden Erblindung infolge Hypoglykämie).
Wenn normale oder erniedrigte Werte für glykosyliertes Hämoglobin vorliegen, muss auch die Möglichkeit wiederholter unerkannter (insbesondere nächtlicher) Hypoglykämien in Betracht gezogen werden.
Die Symptome einer Hypoglykämie sind:
Neurovegetative Zeichen: Schwitzen, Hungergefühl, Zittern (sogenannte neurovegetative Warnsymptome), Blässe, Palpitationen, Kopfschmerzen.
Neuroglykopenische Zeichen: Konzentrationsstörungen, Verhaltensauffälligkeiten (Agitiertheit, Nervosität, Aggressivität, Verwirrtheit u.a.), Bewusstseinsstörungen, Koordinations-, Seh- und Sprachstörungen. Diese können über Benommenheit und Somnolenz bis zum Bewusstseinsverlust fortschreiten. Die Hypoglykämie kann auch zu epileptischen Anfällen führen oder sich wie ein zerebraler Insult, z.B. mit (meist vorübergehender) Hemiparese, Aphasie oder positivem Babinski-Reflex, manifestieren.
Abgeschwächte/veränderte Warnsymptome: Besonders bei Einstellung auf tiefe Blutzuckerwerte (z.B. bei Mehrfachinjektionen nach dem Basis-Bolus-Prinzip), aber auch bei lang bestehendem Diabetes (u.U. mit Polyneuritis), bei älteren Patienten oder bei Präparatewechsel können die Warnsymptome der Hypoglykämie verändert sein und die begleitenden neurovegetativen Symptome abgeschwächt oder verzögert auftreten.
Betablocker können die üblichen Hypoglykämie-Warnsymptome abschwächen bzw. maskieren.
Der insulinbehandelte Diabetiker und sein Umfeld sind darüber zu informieren, dass sich eine Hypoglykämie auch überraschend und als erstes durch neuroglykopenische Zeichen wie Konzentrationsstörungen, Agitiertheit, Verhaltensstörungen und Bewusstseinsstörungen ankündigen kann, weshalb er eventuell nicht früh genug mit der Einnahme von Zucker reagiert.
Alkoholkonsum kann die Hypoglykämie-Gefahr erhöhen (Hemmung der hepatischen Glukoneogenese). Zu berücksichtigen ist jedoch, dass der Kohlenhydratgehalt alkoholischer Getränke auch einen Anstieg des Blutzuckerspiegels verursachen könnte.
Therapie der Hypoglykämie (siehe «Überdosierung»):
Nach jeder schweren Hypoglykämie ist die Diabeteseinstellung zu überprüfen. Der Patient ist anzuweisen, den Arzt/die Ärztin über jede erlebte schwere Hypoglykämie zu informieren.
Faktoren, die zu einer Verstärkung der Hypoglykämieneigung führen, müssen besonders engmaschig überwacht werden und können eine Dosisanpassung erfordern. Dazu zählen:
·ein Wechsel des Injektionsbereichs
·eine Verbesserung der Insulinempfindlichkeit (z.B. wenn Stressfaktoren entfallen)
·eine ungewohnte, stärkere oder längere körperliche Anstrengung
·interkurrente Erkrankungen (z.B. Erbrechen, Diarrhö)
·unzureichende Nahrungsaufnahme
·versäumte Mahlzeiten
·Alkoholkonsum
·bestimmte unkompensierte Störungen des endokrinen Systems (z.B. Hypothyreose, Unterfunktion des Hypophysenvorderlappens oder Nebennierenrindeninsuffizienz)
·gleichzeitige Anwendung bestimmter anderer Arzneimittel (siehe «Interaktionen»)
·Anwendung in Kombination mit einem Sulfonylharnstoff; die Kombination mit Lixisenatid und/oder Insulin kann das Risiko einer Hypoglykämie erhöhen
Die Dosierung von Suliqua erfolgt individuell auf Basis des klinischen Ansprechens. Sie richtet sich nach dem individuellen Insulinbedarf des Patienten (siehe «Dosierung/Anwendung»).
In einer klinischen Studie zu Lixisenatid bei älteren Patienten (≥70 Jahre) wurden bei Patienten, die positiv auf Antikörper gegen Lixisenatid getestet wurden, mehr Fälle symptomatischer Hypoglykämie beobachtet als bei antikörpernegativen Patienten.
Hyperglykämie
Ein Anstieg des Blutzuckerspiegels (Hyperglykämie), Ketoazidose und Hyperosmolarität können auftreten, wenn z.B. die Insulindosis im Verhältnis zur Kohlenhydratzufuhr zu niedrig ist, wenn die Wirkung des Insulins nachgelassen hat (z.B. infolge falscher Lagerung), wenn die körperliche Aktivität reduziert wurde, wenn die Insulinempfindlichkeit infolge von emotionalem oder körperlichem Stress (z.B. nach einer Verletzung, einem operativen Eingriff, einer fiebrigen Infektion oder anderen Erkrankung) verringert ist oder wenn gleichzeitig Arzneimittel mit blutzuckersteigernder Wirkung angewendet werden (siehe «Interaktionen»).
Anzeichen und Symptome einer hyperglykämischen Stoffwechselentgleisung sind: Durst, Polyurie, Glycosurie, Acetonurie, Müdigkeit, Hauttrockenheit, Gesichtsrötung, Appetitlosigkeit, Hypotonie und Tachykardie. Insbesondere bei Symptomen wie Erbrechen, Bauchschmerzen, schneller tiefer Atmung, Somnolenz oder Koma muss immer auch an eine begleitende Ketoazidose gedacht werden. Eine schwere Hyperglykämie oder eine Ketoazidose kann lebensbedrohlich werden. Eine Ketoazidose kann sich in Abhängigkeit von der Insulinverfügbarkeit innerhalb weniger Stunden bis Tage entwickeln. Sobald mögliche Anzeichen und Symptome einer Hyperglykämie oder Ketoazidose bemerkt werden, müssen Blutzucker und Keton im Urin bestimmt und gegebenenfalls unverzüglich Gegenmassnahmen eingeleitet werden.
Marihuana-Konsum kann möglicherweise eine Verschlechterung der Glukosetoleranz bewirken. (Andere illegale Substanzen wurden nicht getestet; andere Interaktionen siehe «Interaktionen».)
Akute Gallenblasenbeschwerden
Bei der Anwendung von GLP-1-Rezeptor-Agonisten wurden akute Gallenblasenstörungen beobachtet. Bei mit Lixisenatid behandelten Patienten wurde über akute Gallenblasenereignisse wie Cholelithiasis oder Cholezystitis berichtet, wenngleich ein kausaler Zusammenhang nicht nachgewiesen wurde. Die Patienten müssen über die charakteristischen Symptome einer akuten Gallenblasenstörung aufgeklärt werden: Oberbauchschmerzen, Fieber, Übelkeit, Erbrechen und Ikterus. Bei Verdacht auf Cholelithiasis werden Untersuchungen der Gallenblase und eine Nachsorge veranlasst.
Anaphylaxie und schwere Überempfindlichkeitsreaktionen
In klinischen Studien zu Lixisenatid (einem der Wirkstoffe von Suliqua) wurden Fälle von Anaphylaxie (Häufigkeit: 0,1 % oder 10 Fälle pro 10'000 Patienten-Jahre) sowie von anderen schweren Überempfindlichkeitsreaktionen einschliesslich Angioödem beobachtet. Insulin glargin, der andere Wirkstoff von Suliqua, kann schwere bis lebensbedrohliche generalisierte allergische Reaktionen hervorrufen, u.a. Anaphylaxie, generalisierte Hautreaktionen, Angioödem, Bronchospasmus, Hypotonie und Schock (siehe «Unerwünschte Wirkungen»).
Patienten mit Anaphylaxie oder Angioödem nach Anwendung eines anderen GLP-1-Rezeptoragonisten in der Vorgeschichte sind entsprechend zu informieren und engmaschig auf allergische Reaktionen zu überwachen, da nicht bekannt ist, ob sie eventuell für eine anaphylaktische Reaktion auf Lixisenatid prädisponiert sind. Bei Patienten mit bekannter Überempfindlichkeit gegenüber Lixisenatid oder Insulin glargin ist Suliqua kontraindiziert (siehe «Kontraindikationen»). Bei Auftreten einer Überempfindlichkeitsreaktion muss der Patient die Behandlung mit Suliqua sofort aussetzen und unverzüglich einen Arzt/eine Ärztin konsultieren.
Akute Pankreatitis
Die Anwendung von GLP-1-Rezeptoragonisten (GLP-1: Glucagon-like peptide 1) ist mit einem Risiko für die Entwicklung einer akuten Pankreatitis assoziiert. Die Patienten sind über die charakteristischen Symptome einer akuten Pankreatitis (anhaltende starke Bauchschmerzen) aufzuklären. Bei Verdacht auf Pankreatitis ist die Behandlung mit Suliqua abzusetzen. Falls sich die Diagnose einer akuten Pankreatitis bestätigt, darf Suliqua nicht wieder angesetzt werden. Bei Patienten mit Pankreatitis in der Vorgeschichte ist Suliqua nur unter besonderer Vorsicht anzuwenden.
Schwere Erkrankungen des Gastrointestinaltrakts
Die Anwendung von GLP-1-Rezeptoragonisten kann mit gastrointestinalen Nebenwirkungen einhergehen. Bei Patienten mit schweren Erkrankungen des Gastrointestinaltrakts, insbesondere schwerer Gastroparese, wurde Suliqua nicht untersucht, daher wird die Anwendung von Suliqua bei diesen Patienten nicht empfohlen.
Aspiration in Verbindung mit Vollnarkose oder tiefer Sedierung
Bei Patienten, die GLP-1-Rezeptor-Agonisten erhielten und sich einer Vollnarkose oder einer tiefen Sedierung unterzogen, wurden Fälle von Aspirationspneumonie berichtet. Daher sollte das erhöhte Risiko von verbliebenen Resten von Mageninhalt aufgrund einer verzögerten Magenentleerung (siehe Rubrik «Unerwünschte Wirkungen») bedacht werden vor der Durchführung von Eingriffen mit Vollnarkose oder tiefer Sedierung.
Patienten mit Niereninsuffizienz
Zur Anwendung bei Patienten mit schwerer Niereninsuffizienz (Kreatininclearance < 30 ml/min) oder terminaler Niereninsuffizienz liegen keine therapeutischen Erfahrungen vor; die Anwendung von Suliqua bei Patienten mit schwerer oder terminaler Niereninsuffizienz wird daher nicht empfohlen (siehe «Dosierung/Anwendung» und «Pharmakokinetik»).
Gleichzeitig angewendete Arzneimittel
Die durch Lixisenatid verzögerte Magenentleerung kann die Resorptionsrate oral angewendeter Arzneimittel senken. Bei Patienten, die Arzneimittel oral einnehmen, die eine schnelle gastrointestinale Resorption oder eine engmaschige klinische Überwachung erfordern oder eine enge therapeutische Breite haben, ist Suliqua nur mit besonderer Vorsicht anzuwenden. Konkrete Empfehlungen zur Anwendung solcher Arzneimittel sind unter «Interaktionen» aufgeführt.
Interkurrente Erkrankungen
Interkurrente Erkrankungen erfordern eine verstärkte Stoffwechselüberwachung. In vielen Fällen sind Ketonbestimmungen im Urin angezeigt und häufig ist eine Anpassung der Insulindosis erforderlich. Oft ist der Insulinbedarf erhöht.
Dehydratation
Patienten, die mit Suliqua behandelt werden, sind über das potenzielle Dehydratationsrisiko im Zusammenhang mit gastrointestinalen Nebenwirkungen aufzuklären und anzuweisen, Vorkehrungen gegen einen Flüssigkeitsverlust zu treffen.
Bildung von Antikörpern
Die Anwendung von Suliqua kann zur Bildung von Antikörpern gegen Insulin glargin und/oder Lixisenatid führen. In seltenen Fällen kann das Vorhandensein solcher Antikörper eine Anpassung der Suliqua-Dosis erforderlich machen, um eine Neigung zu Hyper- oder Hypoglykämien auszugleichen.
Bei Patienten mit Antikörpern gegen Lixisenatid zeigte sich eine höhere Inzidenz von Reaktionen an der Injektionsstelle (5,9 % bei den antikörperpositiven Patienten gegenüber 2,9 % bei den antikörpernegativen Patienten über den gesamten Behandlungszeitraum).
Hypokaliämie
Wie jedes Insulinpräparat führt auch Suliqua zur Verlagerung von Kalium aus dem extrazellulären in den intrazellulären Raum, was letztlich zur Hypokaliämie führen kann. Unbehandelt kann die Hypokaliämie zu einer Atemlähmung, einer ventrikulären Arrhythmie und zum Tode führen. Bei Patienten mit erhöhtem Risiko für Hypokaliämie (z.B. unter Behandlung mit Arzneimitteln, die den Kaliumspiegel im Blut senken oder die empfindlich auf die Serumkaliumkonzentration reagieren) ist der Kaliumspiegel gegebenenfalls zu überwachen.
Makrovaskuläre Befunde
Ein Rückgang des makrovaskulären Risikos unter Suliqua oder einem anderen Antidiabetikum ist bisher durch keine klinischen Studien nachgewiesen (siehe «Eigenschaften/Wirkungen»).
Medikationsfehler
Jeder Patient muss angewiesen werden, vor jeder Injektion systematisch das Pen-Etikett zu überprüfen, um Verwechslungen zwischen den beiden Suliqua-Pens mit unterschiedlichen Dosierungsbereichen sowie Verwechslungen mit anderen injizierbaren Antidiabetika zu vermeiden.
Um Dosierungsfehler und eventuelle Überdosierungen zu vermeiden, dürfen die Patienten das Arzneimittel niemals mit einer Spritze aus der Patrone des Fertigpens entnehmen.
Nicht untersuchte Populationen
·Eine Umstellung von GLP-1-Rezeptoragonisten auf Suliqua wurde bisher nicht untersucht.
·Suliqua wurde nicht in Kombination mit DPP-4-Inhibitoren, Sulfonylharnstoffen, Gliniden, Piogiltazon oder SGLT-2-Inhibitoren untersucht.
·Ein Umstieg von einem Basalinsulin auf Suliqua in einer Dosierung von < 10 Einheiten oder > 60 Einheiten wurde bisher nicht untersucht.
Hilfsstoffe
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis; d.h. es ist nahezu «natriumfrei».
Dieses Arzneimittel enthält Metacresol (als Konservierungsmittel), das allergische Reaktionen hervorrufen kann.
InteraktionenEs wurden keine Interaktionsstudien zu Suliqua durchgeführt.
Eine Reihe von Substanzen beeinflusst den Glukosestoffwechsel und kann eine Dosisanpassung von Suliqua erforderlich machen.
Pharmakodynamische Interaktionen
Zu den Substanzen, die die Blutzuckersenkung verstärken und die Anfälligkeit für Hypoglykämie erhöhen können, zählen u.a. blutzuckersenkende Arzneimittel, Angiotensin-Converting-Enzym- (ACE)-Hemmer, Disopyramid, Fibrate, Fluoxetin, Monoaminoxidase- (MAO-)Hemmer, Pentoxifyllin, Propoxyphen, Salicylate und Sulfonamid-Antibiotika.
Zu den Substanzen, die die blutzuckersenkende Wirkung abschwächen können, zählen u.a. Kortikosteroide, Danazol, Diazoxid, Diuretika, Glukagon, Isoniazid, Östrogene und Gestagene, Phenothiazin-Derivate, Somatropin, Sympathomimetika (z.B. Epinephrin [Adrenalin], Salbutamol, Terbutalin), Schilddrüsenhormone, atypische Antipsychotika (z.B. Clozapin und Olanzapin) und Proteaseinhibitoren.
Betablocker, Clonidin, Lithiumsalze und Alkohol können sowohl zu einer Verstärkung als auch zu einer Abschwächung der blutzuckersenkenden Wirkung von Insulin führen. Pentamidin kann eine Hypoglykämie verursachen, gelegentlich mit nachfolgender Hyperglykämie.
Zusätzlich können unter der Wirkung von Sympatholytika wie Betablockern, Clonidin, Guanethidin oder Reserpin die Zeichen der adrenergen Gegenregulation abgeschwächt sein oder fehlen.
Pharmakokinetische Interaktionen
Lixisenatid ist ein Peptid und wird nicht durch Cytochrom P450 verstoffwechselt. In in-vitro-Studien zeigte Lixisenatid keine Auswirkungen auf die Aktivität der getesteten Cytochrom-P450-Isoenzyme und humanen Transportproteine.
Auswirkungen der Magenentleerung auf oral einzunehmende Arzneimittel
Lixisenatid verzögert die Magenentleerung; dies kann die Resorptionsrate oral einzunehmender Arzneimittel senken. Die gleichzeitige Anwendung oral einzunehmender Arzneimittel mit enger therapeutischer Breite oder mit der Erfordernis einer sorgfältigen klinischen Überwachung ist sorgfältig abzuwägen. Wenn diese Arzneimittel zum Essen eingenommen werden sollen, ist der Patient anzuweisen, sie zu einer anderen Mahlzeit oder sonstigen Gelegenheit einzunehmen als der Mahlzeit, in Verbindung mit der Lixisenatid angewendet wird.
Bei oralen Arzneimitteln, deren Wirksamkeit in besonderem Masse von einer Mindestkonzentration abhängt, wie z.B. Antibiotika, sind die Patienten anzuweisen, diese Arzneimittel mindestens 1 Stunde vor oder 11 Stunden nach der Lixisenatid-Injektion einzunehmen.
Patienten, die Statine wie z.B. Atorvastatin anwenden, sind anzuweisen, diese Arzneimittel vorzugsweise mindestens 1 Stunde vor oder 11 Stunden nach der Suliqua-Injektion einzunehmen.
Paracetamol
Paracetamol wurde als Modellarzneimittel verwendet, um die Wirkung von Lixisenatid auf die Magenentleerung zu bestimmen. Nach Einnahme einer Einzeldosis Paracetamol 1000 mg waren AUC (Fläche unter der Kurve) und t1/2 (Halbwertszeit) von Paracetamol unverändert, unabhängig vom Zeitpunkt der Einnahme (vor oder nach der Lixisenatid-Injektion). Wenn Paracetamol 1 bzw. 4 Stunden nach Injektion von 10 μg Lixisenatid verabreicht wurde, verringerte sich die Cmax von Paracetamol um 29 % bzw. 31 %, und die mediane Tmax verzögerte sich um 2,0 bzw. 1,75 Stunden. Unter einer Erhaltungsdosis von 20 µg sind normalerweise eine weitere Verzögerung der tmax sowie eine reduzierte Cmax von Paracetamol zu erwarten.
Wurde Paracetamol 1 Stunde vor Lixisenatid verabreicht, waren keine Auswirkungen auf die Cmax sowie tmax von Paracetamol zu beobachten.
Basierend auf diesen Ergebnissen ist keine Dosisanpassung von Paracetamol erforderlich. Allerdings ist die bei Einnahme von Paracetamol 1 bis 4 Stunden nach Gabe von Lixisenatid beobachtete verzögerte tmax zu berücksichtigen, wenn ein schneller Wirkungseintritt des Paracetamols angestrebt wird.
Orale Kontrazeptiva
Nach Einnahme einer Einzeldosis eines oralen Kontrazeptivums (Ethinylestradiol 0,03 mg/Levonorgestrel 0,15 mg) 1 Stunde vor bzw. 11 Stunden nach Injektion von 10 µg Lixisenatid waren Cmax, AUC, t1/2 und tmax von Ethinylestradiol und Levonorgestrel allesamt unverändert.
Bei Einnahme des oralen Kontrazeptivums 1 Stunde bzw. 4 Stunden nach der Lixisenatid-Injektion waren AUC und t1/2 von Ethinylestradiol und Levonorgestrel ebenfalls unverändert, die Cmax von Ethinylestradiol war jedoch um 52 % bzw. 39 % herabgesetzt und die von Levonorgestrel um 46 % bzw. 20 %, und die mediane tmax wurde um 1 bis 3 Stunden verzögert.
Die Verringerung der Cmax ist nur von begrenzter klinischer Relevanz, und eine Dosisanpassung von oralen Kontrazeptiva ist nicht erforderlich.
Patientinnen, die orale Kontrazeptiva anwenden, sind darauf hinzuweisen, dass sie diese Mittel mindestens 1 Stunde vor oder 11 Stunden nach einer Suliqua-Injektion einnehmen müssen.
Atorvastatin
Bei gleichzeitiger morgendlicher Gabe von Lixisenatid 20 µg und Atorvastatin 40 mg über 6 Tage wurde die Atorvastatin-Exposition nicht beeinflusst, allerdings wurde die Cmax um 31 % verringert und die tmax um 3,25 Stunden verzögert.
Eine solche Verzögerung der tmax war nicht zu beobachten, wenn Atorvastatin abends und Lixisenatid morgens angewendet wurde, jedoch waren hier AUC und Cmax von Atorvastatin um 27 % bzw. 66 % erhöht.
Diese Veränderungen sind nicht klinisch relevant, daher ist keine Dosisanpassung von Atorvastatin bei gleichzeitiger Gabe mit Lixisenatid erforderlich.
Warfarin und andere Kumarinderivate
Die gleichzeitige Einnahme von Warfarin 25 mg bei wiederholter Gabe von Lixisenatid 20 µg zeigte keine Auswirkungen auf AUC oder INR (International Normalised Ratio), während die Cmax um 19 % verringert und die tmax um 7 Stunden verzögert wurde.
Aufgrund dieser Ergebnisse ist keine Dosisanpassung von Warfarin bei gleichzeitiger Gabe mit Lixisenatid erforderlich. Allerdings empfiehlt es sich, bei Patienten, die mit Warfarin und/oder anderen Kumarinderivaten behandelt werden, zu Beginn und bei Beendigung der Behandlung mit Lixisenatid den INR-Wert engmaschig zu überwachen.
Digoxin
Nach gleichzeitiger Gabe von Lixisenatid 20 μg und Digoxin 0,25 mg war die AUC von Digoxin im Gleichgewichtszustand nicht beeinflusst. Die Tmax von Digoxin verzögerte sich um 1,5 Stunden, und die Cmax verringerte sich um 26 %.
Basierend auf diesen Ergebnissen ist keine Dosisanpassung von Digoxin bei gleichzeitiger Gabe mit Lixisenatid erforderlich.
Ramipril
Nach gleichzeitiger Gabe von Lixisenatid 20 µg und Ramipril 5 mg über 6 Tage nahm die AUC von Ramipril um 21 % zu, während sich die Cmax um 63 % verringerte. AUC und Cmax des aktiven Metaboliten (Ramiprilat) wurden nicht beeinflusst. Die tmax von Ramipril und Ramiprilat war um ca. 2,5 Stunden verzögert.
Basierend auf diesen Ergebnissen ist keine Dosisanpassung von Ramipril bei gleichzeitiger Gabe mit Lixisenatid erforderlich.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter
Die Anwendung von Suliqua bei gebärfähigen Frauen, die nicht verhüten, wird nicht empfohlen.
Schwangerschaft
Es liegen keine klinischen Daten zur Anwendung von Suliqua, Insulin glargin oder Lixisenatid bei Schwangeren vor.
Suliqua darf während der Schwangerschaft nicht angewendet werden. Stattdessen wird die Anwendung von Insulin empfohlen. Möchte eine Patientin schwanger werden oder tritt eine Schwangerschaft ein, muss die Behandlung mit Suliqua abgebrochen werden.
Weitreichende Erfahrungen mit schwangeren Frauen (mehr als 1000 Schwangerschaften) deuten weder auf substanzspezifische unerwünschte Wirkungen von Insulin glargin auf die Schwangerschaft noch auf ein substanzspezifisches Fehlbildungsrisiko oder eine fetale/neonatale Toxizität von Insulin glargin hin. Tierexperimentelle Daten zu Insulin glargin ergaben keine Hinweise auf eine Reproduktionstoxizität.
Tierexperimentelle Studien zu Lixisenatid haben eine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»). Das potenzielle Risiko für den Menschen ist nicht bekannt.
Stillzeit
Da keine Daten zum Übergang von Insulin glargin oder Lixisenatid in die Muttermilch vorliegen, darf Suliqua in der Stillzeit nicht angewendet werden.
Wenn ein Neugeborenes / ein Säugling Insulin glargin mit der Muttermilch aufnimmt, dürfte normalerweise keine metabolische Wirkung zu erwarten sein, da Insulin glargin als Peptid im Gastrointestinaltrakt verdaut und in Aminosäuren aufgespalten wird.
Fertilität
Tierexperimentelle Studien zu Lixisenatid oder Insulin glargin ergaben keine Hinweise auf direkte schädliche Wirkungen in Bezug auf die Fertilität.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDie Konzentrations- und Reaktionsfähigkeit des Patienten kann aufgrund einer Hypo- oder Hyperglykämie oder z.B. aufgrund von Sehstörungen beeinträchtigt sein. Dies kann in Situationen, in denen diese Fähigkeiten von besonderer Bedeutung sind (z.B. beim Autofahren oder beim Bedienen von Maschinen), ein Risiko darstellen.
Die Patienten sind anzuweisen, Vorsichtsmassnahmen zu treffen, um Hypoglykämien beim Führen von Kraftfahrzeugen oder beim Bedienen von Maschinen zu vermeiden. Dies ist besonders wichtig bei Patienten mit verringerter oder fehlender Wahrnehmung von Hypoglykämie-Warnsymptomen oder häufigen Hypoglykämie-Episoden. In diesen Fällen ist zu prüfen, ob das Führen eines Kraftfahrzeuges oder das Bedienen von Maschinen ratsam sind.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
In den klinischen Studien der Phase III erhielten 834 Teilnehmer Suliqua.
Die während der Behandlung mit Suliqua am häufigsten berichteten Nebenwirkungen waren Hypoglykämie und gastrointestinale unerwünschte Wirkungen (siehe «Beschreibung ausgewählter unerwünschter Wirkungen» weiter unten).
Liste der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet: «sehr häufig» (≥1/10), «häufig» (≥1/100, < 1/10), «gelegentlich» (≥1/1000, < 1/100), «selten» (≥1/10'000, < 1/1000), «sehr selten» (< 1/10'000), «nicht bekannt» (kann aus den verfügbaren Daten nicht abgeschätzt werden).
|
Systemorganklasse
|
Häufigkeit
| |
|
Sehr häufig
|
Häufig
|
Gelegentlich
|
Selten
|
Nicht bekannt
| |
Infektionen und parasitäre Erkrankungen
|
|
|
Rhinopharyngitis
Infektionen der
oberen Atemwege
|
|
| |
Erkrankungen des Immunsystems
|
|
|
Urtikaria (Quaddeln)
|
|
| |
Stoffwechsel- und Ernährungsstörungen
|
Hypoglykämie
|
|
|
|
| |
Erkrankungen des Nervensystems
|
|
Schwindel
|
Kopfschmerzen
|
|
| |
Erkrankungen des Gastrointestinaltrakts
|
|
Übelkeit
Diarrhö
Erbrechen
|
Dyspepsie
Bauchschmerzen
|
Verzögerte Magenentleerung
|
| |
Leber- und Gallenerkrankungen
|
|
|
Cholelithiasis und Cholezystitis
|
|
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
|
|
Müdigkeit
Reaktionen an der Injektionsstelle
Lipodystrophie
|
|
Kutane Amyloidose
|
Beschreibung ausgewählter unerwünschter Wirkungen
Hypoglykämie
Schwere Hypoglykämie-Episoden können, vor allem wenn sie wiederholt auftreten, zu neurologischen Beeinträchtigungen führen. Lang anhaltende oder schwere Hypoglykämien können lebensbedrohlich werden.
Bei vielen Patienten gehen den neuroglykopenischen Anzeichen und Symptomen die Anzeichen einer adrenergen Gegenregulation voraus. Je schneller und tiefer der Blutzuckerspiegel abfällt, desto ausgeprägter sind im Allgemeinen das Phänomen der Gegenregulation und die dazugehörigen Symptome (siehe «Warnhinweise und Vorsichtsmassnahmen»).
In klinischen Studien der Phase III betrug bei den mit Suliqua behandelten Patienten die Inzidenz symptomatischer Hypoglykämien (mit Plasmaglukosekonzentrationen ≤3,9 mmol/l) 25,6 % bei denjenigen, die nicht mit Insulin vorbehandelt waren (469 Patienten), und 40,0 % bei denen, die zuvor ein Basalinsulin erhalten hatten (365 Patienten).
Schwere Hypoglykämien (gekennzeichnet dadurch, dass eine andere Person dem Patienten aktiv Kohlenhydrate oder Glukagon zuführen oder eine Wiederbelebungsmassnahme durchführen musste) traten bei keinem der insulinnaiven Patienten und bei 0,02 % der mit Basalinsulin vorbehandelten Patienten auf.
Erkrankungen des Gastrointestinaltrakts
Gastrointestinale unerwünschte Wirkungen (Übelkeit, Erbrechen und Diarrhö) zählten zu den am häufigsten beobachteten unerwünschten Wirkungen während des Behandlungszeitraums. Übelkeit, Diarrhö und Erbrechen traten bei mit Suliqua behandelten Patienten mit einer Häufigkeit von 8,4 %, 2,2 % bzw. 2,2 % auf. Gastrointestinale unerwünschte Wirkungen waren überwiegend leicht und von vorübergehender Dauer. Bei mit Lixisenatid behandelten Patienten traten Übelkeit, Diarrhö und Erbrechen mit einer Häufigkeit von 22,3 %, 3 % bzw. 3,9 % auf.
Erkrankungen des Immunsystems
Allergische Reaktionen (Urtikaria), die möglicherweise mit Suliqua im Zusammenhang stehen, wurden bei 0,3 % der Patienten beobachtet. Für Insulin glargin und Lixisenatid wurden nach der Markteinführung Fälle von generalisierten allergischen Reaktionen einschliesslich anaphylaktischer Reaktion und Angioödem berichtet.
Überempfindlichkeitsreaktionen vom Soforttyp auf Insulin sind selten. Allergische Reaktionen auf Insulinpräparate (einschliesslich Insulin glargin) oder auf deren Bestandteile können sich unter anderem in Form von generalisiertem Hautausschlag, Angioödem, Bronchospasmus, Hypotonie oder Schockzustand äussern und können lebensbedrohliche Ausmasse annehmen.
Die Anwendung von Insulin kann zur Bildung von Antikörpern gegen Insulin führen. Antigen-Antikörper-Reaktionen auf Humaninsulin und auf Insulin glargin sind in klinischen Studien bei Patienten, die mit NPH-Humaninsulin bzw. Insulin glargin behandelt wurden, mit vergleichbarer Häufigkeit aufgetreten. In seltenen Fällen kann das Vorhandensein von Insulin-Antikörpern die Anpassung der Insulindosis erforderlich machen, um eine Neigung zu Hyper- bzw. Hypoglykämien auszugleichen.
Bei Patienten mit Antikörpern gegen Lixisenatid zeigte sich eine höhere Inzidenz von Reaktionen an der Injektionsstelle (5,9 % bei den antikörperpositiven Patienten gegenüber 2,9 % bei den antikörpernegativen Patienten über den gesamten Behandlungszeitraum).
Bei zuvor insulinnaiven Patienten war unter Suliqua eine höhere Inzidenz von Antikörpern gegen Insulin glargin zu verzeichnen als unter Lantus. Dieses Phänomen könnte allerdings auf die genetische Variabilität der untersuchten Population zurückzuführen sein und wurde bei mit Insulin vorbehandelten Patienten nicht beobachtet.
Lipodystrophie und kutane Amyloidose
Die subkutane Applikation insulinhaltiger Injektionspräparate kann eine Lipoatrophie (Schwund des Hautgewebes), eine Lipohypertrophie (Verstärkung oder Verdickung des Gewebes) oder eine kutane Amyloidose an der Injektionsstelle hervorrufen. Der regelmässige Wechsel der Injektionsstelle innerhalb des gleichen Bereichs (Bauchdecke, Oberschenkel oder Oberarm) von Injektion zu Injektion wird empfohlen, um dazu beizutragen, diese Reaktionen zu reduzieren oder zu vermeiden (siehe «Dosierung/Anwendung» und «Unerwünschte Wirkungen»).
Reaktionen an der Injektionsstelle
Bei einigen Patienten, die insulinhaltige Therapien einschliesslich Suliqua erhielten, traten Erytheme, lokale Ödeme und Pruritus an der Injektionsstelle auf. Diese Beschwerden klangen im Allgemeinen spontan wieder ab.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch
ÜberdosierungZur Überdosierung von Suliqua liegen nur begrenzte klinische Daten vor.
Hypoglykämie und gastrointestinale unerwünschte Wirkungen können auftreten, wenn eine höhere Dosis Suliqua injiziert wurde als erforderlich war.
Leichte Episoden von Hypoglykämie können normalerweise durch Kohlenhydrate behandelt werden. Anpassungen der Suliqua-Dosis, der Essgewohnheiten oder der körperlichen Aktivität können erforderlich sein.
Schwerere Episoden von Hypoglykämie mit Koma, epileptischen Anfällen oder neurologischen Beeinträchtigungen können mit intramuskulär/subkutan verabreichtem Glukagon oder intravenöser Gabe von konzentrierter Glukose behandelt werden. Anhaltende Kohlenhydrataufnahme und Beobachtung des Patienten können erforderlich sein, da nach einer scheinbaren klinischen Erholung erneut eine Hypoglykämie auftreten kann.
Im Falle gastrointestinaler unerwünschter Wirkungen ist eine angemessene symptomatische Behandlung entsprechend den klinischen Zeichen und Symptomen des Patienten einzuleiten und die Suliqua-Dosis auf die verordnete Dosis zu senken.
Eigenschaften/WirkungenATC-Code
A10AE
Wirkungsmechanismus
Suliqua
Suliqua kombiniert zwei blutzuckersenkende Wirkstoffe mit einander ergänzenden Wirkmechanismen: Insulin glargin, ein Basalinsulinanalogon (wirkt insbesondere auf den Nüchternplasmaglukose- [NPG-]Wert), und Lixisenatid, ein GLP-1-Rezeptoragonist (wirkt insbesondere auf die postprandialen Plasmaglukosewerte [PPG]). So wird bei Patienten mit Diabetes mellitus Typ 2 gleichzeitig die Verbesserung der Blutzuckerkontrolle und die Minimierung der Gewichtszunahme und des Hypoglykämierisikos angestrebt.
Insulin glargin
Die Hauptwirkung von Insulin, einschliesslich Insulin glargin, ist die Regulierung des Glukosestoffwechsels. Insulin und seine Analoga senken den Blutzuckerspiegel durch eine Stimulierung der peripheren Glukoseaufnahme, insbesondere durch die Skelettmuskulatur und das Fettgewebe, sowie durch eine Hemmung der Glukoneogenese in der Leber. Insulin hemmt die Lipolyse und die Proteolyse und fördert die Proteinsynthese.
Lixisenatid
Lixisenatid ist ein selektiver GLP-1-Rezeptor-Agonist. Der GLP-1-Rezeptor ist der Zielrezeptor für natives GLP-1, ein endogenes Inkretinhormon, das glukoseabhängig die Insulinsekretion von pankreatischen Betazellen steigert.
Die Wirkung von Lixisenatid wird durch eine spezifische Interaktion mit GLP-1-Rezeptoren vermittelt, was zu einer Zunahme der Bildung von intrazellulärem zyklischem Adenosinmonophosphat (cAMP) führt. Lixisenatid stimuliert die Insulinsekretion bei hohem Blutzuckerspiegel, jedoch nicht bei Normoglykämie. Auf diese Weise wird das Hypoglykämierisiko begrenzt. Gleichzeitig wird die Sekretion von Glukagon unterdrückt. Im Falle einer Hypoglykämie bleibt der Mechanismus der Gegenregulation, die Glukagonsekretion, erhalten.
Lixisenatid verzögert die Entleerung des Magens, sodass die mit der Nahrung aufgenommene Glukose langsamer in den Blutkreislauf gelangt. Diese Wirkung auf die Magenentleerung könnte auch zu einem Gewichtsverlust beitragen.
Pharmakodynamik
Suliqua
Die Kombination von Insulin glargin und Lixisenatid hat keinen Einfluss auf die pharmakodynamische Wirkung von Insulin glargin. Der Einfluss der Kombination von Insulin glargin und Lixisenatid auf die Pharmakodynamik von Lixisenatid wurde nicht in Phase-I-Studien untersucht.
Übereinstimmend mit einem relativ konstanten Konzentrations-Zeit-Profil über 24 Stunden ohne ausgeprägten Peak bei Gabe von Insulin glargin allein war das Glukoseutilisations-Zeit-Profil bei Gabe der Kombination von Insulin glargin und Lixisenatid ähnlich, ohne ausgeprägten Peak.
Die Resorptionsgeschwindigkeit von Insulinen, einschliesslich Suliqua, kann inter- und auch intraindividuell variieren.
Insulin glargin
In klinischen Studien zu Insulin glargin (100 Einheiten/ml) zeigte intravenös appliziertes Insulin glargin einen mit Humaninsulin vergleichbaren blutzuckersenkenden Effekt auf molarer Basis, d.h. wenn beide Insuline in gleicher Dosis gegeben wurden.
Lixisenatid
In einer 28-tägigen placebokontrollierten Studie bei Patienten mit Typ-2-Diabetes wurde die Wirkung von 5–20 µg Lixisenatid ein- oder zweimal täglich auf den Glykämieverlauf nach einer standardisierten Testmahlzeit zur Frühstückszeit untersucht. Lixisenatid in einer Dosierung von 10 oder 20 µg ein- oder zweimal täglich bewirkte eine bessere Blutzuckereinstellung mit sowohl postprandial als auch nüchtern niedrigerem Blutzuckerspiegel. In dieser Studie bewirkte Lixisenatid in der morgendlichen Dosierung von 20 µg einmal täglich eine Aufrechterhaltung der statistisch signifikanten Reduktion des postprandialen Blutzuckerspiegels nach dem Frühstück, Mittagessen und Abendessen.
Postprandiale Glukose
In einer Studie bei Typ-2-Diabetikern zur Beurteilung von Lixisenatid in Kombination mit Metformin über 4 Wochen und in Kombination mit Insulin glargin und zum Teil zusätzlich noch mit Metformin über 8 Wochen bewirkte eine Dosis von 20 µg Lixisenatid einmal täglich vor einer Testmahlzeit zum Frühstück eine Senkung der postprandialen Plasmaglukose (AUC 0:30–4:30 h). Der Anteil der Patienten mit einem postprandialen Blutzuckerspiegel unterhalb von 7,77 mmol/l betrug nach 28 Tagen 69,3 % und nach 56 Tagen 76,1 %.
Insulinsekretion
Eine Studie zu Lixisenatid als Monotherapie belegt, dass das Arzneimittel allein im Vergleich zu Placebo laut Messung der AUC bei Typ-2-Diabetikern die erste Phase der Insulinsekretion in glukoseabhängiger Weise um den Faktor 2,8 erhöht (90 %-KI: 2,5–3,1) und die Insulinsekretion der zweiten Phase um den Faktor 1,6 (90 %-KI: 1,4–1,7).
Magenentleerung
Nach einer standardisierten Testmahlzeit verzögert Lixisenatid die Magenentleerung und reduziert dadurch die postprandiale Glukoseresorption. Die verzögernde Wirkung auf die Magenentleerung wird über die gesamte Dauer einer 28-tägigen Lixisenatid-Monotherapie bei Typ-2-Diabetikern aufrechterhalten.
Glukagonsekretion
Für Lixisenatid allein wurde nach Verabreichung von 20 µg einmal täglich ein Rückgang des postprandialen Glukagonwerts bei Typ-2-Diabetikern nach einer Testmahlzeit im Vergleich zum Behandlungsbeginn nachgewiesen. Bei gesunden Probanden wurde mit einem hypoglykämischen Clamp-Test die Wirkung einer einmaligen Injektion von 20 µg Lixisenatid auf die Glukagonreaktion im Vergleich zu Placebo untersucht und festgestellt, dass die Gegenregulation mit Glukagon unter hypoglykämischen Bedingungen bei Vorliegen einer wirksamen Lixisenatid-Plasmakonzentration erhalten blieb.
Kardiale Elektrophysiologie (QTc)
Die Auswirkung von Lixisenatid auf die Repolarisation des Herzens wurde in einer QTc-Studie untersucht (mit dem 1,5-fachen der zugelassenen Erhaltungsdosis); die Studie ergab keine Hinweise auf relevante Auswirkungen von Lixisenatid auf die ventrikuläre Repolarisation.
Herzfrequenz
In den placebokontrollierten Phase-III-Studien zu Suliqua wurde keine Steigerung der durchschnittlichen Herzfrequenz festgestellt.
Klinische Wirksamkeit
Die Sicherheit und Wirksamkeit von Suliqua zur Blutzuckerkontrolle wurde in zwei randomisierten klinischen Studien bei Patienten mit Typ-2-Diabetes untersucht:
·Add-on-Therapie zu oralen Antidiabetika (OAD) [insulinnaive Patienten]
·Patienten, die zuvor mit Basalinsulin behandelt wurden
In jeder der wirkstoffkontrollierten Studien erzielte die Behandlung mit Suliqua klinisch und statistisch signifikante Verbesserungen des Hämoglobin-A1c- (HbA1c-)Werts.
Bei Erreichen niedrigerer HbA1c-Spiegel und einer stärkeren HbA1c-Senkung führte die Behandlung mit dem Kombinationsprodukt im Vergleich zu Insulin glargin allein nicht zu verstärkten Hypoglykämien (siehe «Unerwünschte Wirkungen»).
In der klinischen Studie zur Add-on-Therapie zu Metformin wurde die Behandlung mit 10 Dosisschritten begonnen. In der klinischen Studie zur Umstellung von einem Basalinsulin betrug die Anfangsdosis 20 oder 30 Dosisschritte, je nach vorheriger Insulindosis. In beiden Studien wurde die Dosis einmal wöchentlich auf Basis selbst gemessener Nüchternplasmaglukosewerte titriert.
·Add-on-Therapie zu oralen Antidiabetika (OAD) [insulinnaive Patienten]
Klinische Studie bei Patienten mit Typ-2-Diabetes, die mit OAD nicht ausreichend kontrolliert waren
Insgesamt 1170 Patienten mit Typ-2-Diabetes wurden in einer nicht-verblindeten, 30-wöchigen, aktiv kontrollierten Studie randomisiert, um die Wirksamkeit und Sicherheit von Suliqua im Vergleich zu den Einzelkomponenten, Insulin glargin (100 Einheiten/ml) und Lixisenatid, zu untersuchen.
Patienten mit Typ-2-Diabetes, die mit Metformin allein oder mit Metformin und einem zweiten OAD (Sulfonylharnstoff, Glinid, Natrium-Glukose-Cotransporter-2- (SGLT-2-)Inhibitor oder Dipeptidyl-Peptidase-4- (DPP-4-)Inhibitor) behandelt wurden und die mit dieser Behandlung nicht ausreichend kontrolliert waren (HbA1c-Werte zwischen 7,5 % und 10 % bei Patienten, die bisher mit Metformin allein behandelt wurden, und zwischen 7 % und 9 % bei Patienten, die bisher mit Metformin und einem weiteren oralen Antidiabetikum behandelt wurden), durchliefen eine 4-wöchige Run-in-Phase. Während dieser Run-in-Phase wurde die Metformin-Behandlung optimiert und alle anderen OAD abgesetzt. Am Ende der Run-in-Phase wurden Patienten, die noch immer nicht ausreichend kontrolliert waren (HbA1c zwischen 7 % und 10 %) entweder auf Suliqua oder Insulin glargin oder Lixisenatid randomisiert. Insgesamt 58 % der Patienten erhielten zum Zeitpunkt des Screenings ein zweites OAD.
Die Typ-2-Diabetes-Population wies die folgenden Charakteristika auf: Das Durchschnittsalter betrug 58,4 Jahre, 50,6 % der Patienten waren männlich, der durchschnittliche BMI-Ausgangswert betrug 31,7 kg/m2, und die durchschnittliche Diabetesdauer lag bei ca. 9 Jahren.
Nach 30 Wochen zeigte Suliqua eine statistisch signifikante Verbesserung des HbA1c-Werts (p-Wert < 0,0001) im Vergleich zu den Einzelkomponenten. In einer vorab spezifizierten Analyse dieses primären Endpunkts waren die beobachteten Unterschiede im Hinblick auf den HbA1c-Ausgangswert (< 8 % oder ≥8 %) oder die Anwendung von OAD bei Studienbeginn (Metformin allein oder Metformin mit einem zweiten OAD) konsistent.
Zu den weiteren Studienendpunkten siehe nachstehende Tabelle und Abbildung.
Ergebnisse nach 30 Wochen – Klinische Studie zur Add-on-Therapie zu Metformin (mITT-Population)
|
|
Suliqua
|
Insulin glargin
|
Lixisenatid
| |
Anzahl Teilnehmer (mITT)
|
468
|
466
|
233
| |
HbA1c (%)
| |
Ausgangswert (Mittelwert; nach der Run-in-Phase)
|
8,1
|
8,1
|
8,1
| |
Ende der Studie (Mittelwert)
|
6,5
|
6,8
|
7,3
| |
Veränderung zum Ausgangswert (Kleinste-Quadrate-Mittelwert)
|
-1,6
|
-1,3
|
-0,9
| |
Unterschied vs. Insulin glargin
|
-0,3
|
| |
[95 %-Konfidenzintervall]
|
[-0,4; -0,2]
|
| |
(p-Wert)
|
(< 0,0001)
|
| |
Unterschied vs. Lixisenatid
|
|
|
-0,8
| |
[95 %-Konfidenzintervall]
|
|
|
[-0,9; -0,7]
| |
(p-Wert)
|
|
|
(< 0,0001)
| |
Anzahl Patienten (%), die in Woche 30 einen HbA1c-Wert < 7 % erreichten
|
345 (74 %)
|
277 (59 %)
|
77 (33 %)
| |
Nüchternplasmaglukose (mmol/l)
| |
Ausgangswert (Mittelwert)
|
9,88
|
9,75
|
9,79
| |
Ende der Studie (Mittelwert)
|
6,32
|
6,53
|
8,27
| |
Veränderung zum Ausgangswert (Kleinste-Quadrate-Mittelwert)
|
-3,46
|
-3,27
|
-1,50
| |
Veränderung vs. Insulin glargin (Kleinste-Quadrate-Mittelwert)
|
-0,19
|
|
| |
[95 %-Kl]
|
[-0,420 bis
0,038]
|
|
| |
(p-Wert)
|
(0,1017)
|
|
| |
Veränderung vs. Lixisenatid (Kleinste-Quadrate-Mittelwert)
|
-1,96
|
|
| |
[95 %-Kl]
|
[-2,246 bis
-1,682]
|
|
| |
(p-Wert)
|
(< 0,0001)
|
|
|
|
|
Suliqua
|
Insulin glargin
|
Lixisenatid
| |
Anzahl Teilnehmer (mITT)
|
468
|
466
|
233
| |
PPG nach 2 Stunden (mmol/l)
| |
[Glykämieschwankung nach 2 Stunden* (mmol/l)]
| |
Veränderung zum Ausgangswert in Woche 30
|
-5,68
|
-3,31
|
-4,58
| |
(Kleinste-Quadrate-Mittelwert)
|
[-2,31]
|
[-0,18]
|
[-3,23]
| |
Durchschnittliches Körpergewicht (kg)
| |
Ausgangswert (Mittelwert)
|
89,4
|
89,8
|
90,8
| |
Veränderung zum Ausgangswert (Kleinste-Quadrate-Mittelwert)
|
-0,3
|
1,1
|
-2,3
| |
Unterschied vs. Insulin glargin
|
|
-1,4
|
| |
[95 %-Konfidenzintervall]
|
|
[-1,9 bis
-0,9]
|
| |
(p-Wert)
|
|
(< 0,0001)
|
| |
Unterschied vs Lixisenatid
[95 %-Konfidenzintervall]
|
|
|
2,01
[1,4 bis
2,6]
| |
Anzahl an Patienten (%), die in Woche 30 einen HbA1c-Wert < 7,0 % ohne Gewichtszunahme erreichten
|
202
(43,2 %)
|
117
(25,1 %)
|
65
(27,9 %)
| |
Prozentualer Unterschied vs. Insulin glargin
|
|
18,1
|
| |
[95 %-Konfidenzintervall]
|
|
[12,2 bis
24,0]
|
| |
(p-Wert)
|
|
(< 0,0001)
|
| |
Prozentualer Unterschied vs. Lixisenatid
|
|
|
15,2
| |
[95 %-Konfidenzintervall]
|
|
|
[8,1 bis
22,4]
| |
Tagesdosis Insulin glargin
| |
Veränderung der Insulindosis in Woche 30 (Kleinste-Quadrate-Mittelwert)
|
39,8
|
40,5
|
n.z.
|
* PPG (postprandiale Glukose) nach 2 Stunden abzüglich des Glukosewerts vor der Mahlzeit
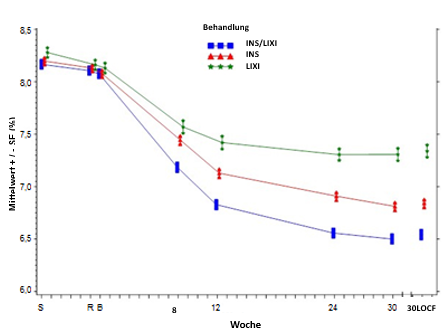
Mittlerer HbA1c-Wert (%) zu Beginn des Screenings, zum Zeitpunkt der Randomisierung und zu allen weiteren festgelegten Zeitpunkten (Teilnehmer, die die Studie abgeschlossen haben) und in Woche 30 (LOCF*) – mITT-Population
* LOCF = Last Observation Carried Forward (Fortschreibung des letzten gemessenen Werts)
Patienten in der Suliqua-Gruppe zeigten einen statistisch signifikanten Rückgang
in dem durch Plasmaglukoseselbstkontrolle ermittelten durchschnittlichen 7-Punkte-Profil von Studienbeginn bis Woche 30 (-3,35 mmol/l) im Vergleich zu Patienten in der Insulin-glargin-Gruppe
(-2,66 mmol/l; Unterschied -0,69 mmol/l) und Patienten in der Lixisenatid-Gruppe
(-1,95 mmol/l; Unterschied -1,40 mmol/l) (p < 0,0001 für beide Vergleiche).
Zu allen Zeitpunkten waren die durchschnittlichen 30-Wochen-Plasmaglukosewerte in der Suliqua-Gruppe niedriger als in der Insulin-glargin-Gruppe und der Lixisenatid-Gruppe, mit Ausnahme des Werts vor dem Frühstück, der in der Suliqua-Gruppe und der Insulin-glargin-Gruppe vergleichbar war.
·Patienten, die zuvor mit Basalinsulin behandelt wurden
Klinische Studie bei Patienten mit Typ-2-Diabetes, die durch ein Basalinsulin nicht ausreichend kontrolliert waren
Insgesamt 736 Patienten mit Typ-2-Diabetes nahmen an einer randomisierten, 30-wöchigen, aktiv kontrollierten, nicht-verblindeten, zweiarmigen multizentrischen Studie mit Parallelgruppendesign teil, in der die Wirksamkeit und Sicherheit von Suliqua im Vergleich zu Insulin glargin (100 Einheiten/ml) untersucht wurden.
Die gescreenten Patienten hatten Typ-2-Diabetes und wurden seit mindestens 6 Monaten mit einem Basalinsulin behandelt. Die Patienten erhielten eine stabile Tagesdosis zwischen 15 und 40 Einheiten allein oder in Kombination mit einem oder zwei OAD (Metformin oder ein Sulfonylharnstoff oder ein Glinid oder ein SGLT-2-Inhibitor oder ein DPP-4-Inhibitor). Sie hatten einen HbA1c-Wert zwischen 7,5 % und 10 % und einen Nüchternblutzuckerwert kleiner oder gleich 10,0 mmol/l bzw. 11,1 mmol/l, je nach vorhergehender Diabetesbehandlung.
Nach dem Screening traten die geeigneten Patienten (n = 1018) in eine 6-wöchige Run-in-Phase ein, in der sie entweder mit Insulin glargin weiterbehandelt oder, falls sie zuvor ein anderes Basalinsulin angewendet hatten, auf Insulin glargin umgestellt wurden. Die Insulindosis wurde unter weiterer Einnahme von Metformin (falls dies bisher eingenommen wurde) titriert/stabilisiert. Alle anderen OAD wurden abgesetzt.
Am Ende der Run-in-Phase wurden Patienten mit einem HbA1c-Wert zwischen 7 % und 10 %, einem Nüchternblutzuckerwert ≤7,77 mmol/l und einer Insulin-glargin-Tagesdosis zwischen 20 und 50 Einheiten auf entweder Suliqua (n = 367) oder Insulin glargin (n = 369) randomisiert.
Diese Typ-2-Diabetes-Population wies die folgenden Charakteristika auf: Das Durchschnittsalter betrug 60 Jahre, 46,7 % der Patienten waren männlich, der durchschnittliche BMI-Ausgangswert betrug rund 31 kg/m2 und die durchschnittliche Diabetesdauer betrug ca. 12 Jahre.
In Woche 30 zeigte sich unter Suliqua eine statistisch signifikante Verbesserung des HbA1c-Werts (p-Wert < 0,0001) im Vergleich zu Insulin glargin.
Zu den weiteren Studienendpunkten siehe nachstehende Tabelle und Abbildung.
Ergebnisse nach 30 Wochen – Klinische Studie zu Typ-2-Diabetes, unkontrolliert mit einem Basalinsulin (mITT-Population)
|
|
Suliqua
|
Insulin glargin
| |
Anzahl Teilnehmer (mITT)
|
366
|
365
| |
HbA1c (%)
| |
Beim Screening (Mittelwert)
|
8,5
|
8,5
| |
Ausgangswert (Mittelwert; nach der Run-in-Phase)
|
8,1
|
8,1
| |
Ende der Behandlung (Mittelwert)
|
6,9
|
7,5
| |
Veränderung zum Ausgangswert (Kleinste-Quadrate-Mittelwert)
|
-1,1
|
-0,6
| |
Unterschied vs. Insulin glargin
|
-0,5
| |
[95 %-Konfidenzintervall]
|
[-0,6; -0,4]
| |
(p-Wert)
|
(< 0,0001)
| |
Patienten [n (%)], die in Woche 30 einen HbA1c-Wert < 7 % erreichten
|
201 (54,9 %)
|
108 (29,6 %)
| |
Nüchternplasmaglukose (mmol/l)
| |
Ausgangswert (Mittelwert)
|
7,33
|
7,32
| |
Ende der Studie (Mittelwert)
|
6,78
|
6,69
| |
Veränderung zum Ausgangswert (Kleinste-Quadrate-Mittelwert)
|
-0,35
|
-0,46
| |
PPG nach 2 Stunden (mmol/l) [Glykämieschwankung nach 2 Stunden* (mmol/l)]
| |
Veränderung zum Ausgangswert in Woche 30 (Kleinste-Quadrate-Mittelwert)
|
-4,72
[-3,90]
|
-1,39
[-0,47]
| |
Durchschnittliches Körpergewicht (kg)
| |
Ausgangswert (Mittelwert)
|
87,8
|
87,1
| |
Veränderung zum Ausgangswert (Kleinste-Quadrate-Mittelwert)
|
-0,7
|
0,7
| |
Unterschied vs. Insulin glargin
|
-1,4
| |
[95 %-Konfidenzintervall]
|
[-1,8 bis -0,9]
| |
(p-Wert)
|
(< 0,0001)
|
|
|
Suliqua
|
Insulin glargin
| |
Anzahl Teilnehmer (mITT)
|
366
|
365
| |
Anzahl Patienten (%), die in Woche 30 einen HbA1c-Wert < 7,0 % ohne Gewichtszunahme erreichten
|
125
(34,2 %)
|
49
(13,4 %)
| |
Prozentualer Unterschied vs. Insulin glargin
|
20,8
| |
[95 %-Konfidenzintervall]
|
[15,0 bis 26,7]
| |
(p-Wert)
|
(< 0,0001)
| |
Tagesdosis Insulin glargin
| |
Ausgangswert (Mittelwert)
|
35,0
|
35,2
| |
Endpunkt (Mittelwert)
|
46,7
|
46,7
| |
Veränderung der Insulindosis in Woche 30 (Kleinste-Quadrate-Mittelwert)
|
10,6
|
10,9
|
* PPG (postprandiale Glukose) nach 2 Stunden abzüglich des Glukosewerts vor der Mahlzeit
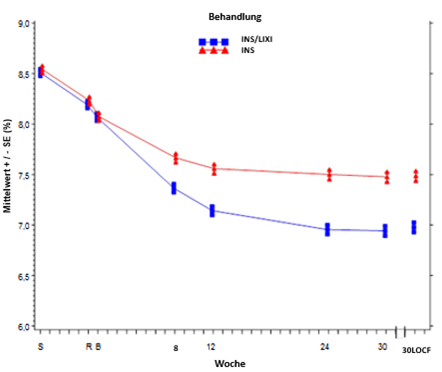
Mittlerer HbA1c-Wert (%) zu Beginn des Screenings, bei der Randomisierung und zu allen weiteren festgelegten Zeitpunkten (Teilnehmer, die die Studie abgeschlossen haben) und in Woche 30 (LOCF*) – mITT-Population
* LOCF = Last Observation Carried Forward (Fortschreibung des letzten gemessenen Werts)
Studien zu kardiovaskulären Endpunkten
Die kardiovaskuläre Sicherheit von Insulin glargin und Lixisenatid wurde in den klinischen Studien ORIGIN bzw. ELIXA nachgewiesen. Zu Suliqua wurde keine gesonderte Studie zu kardiovaskulären Endpunkten durchgeführt.
Insulin glargin
Die ORIGIN-Studie (Outcome Reduction with Initial Glargine Intervention) war eine nicht-verblindete, randomisierte Studie mit 12'537 Patienten mit erhöhtem kardiovaskulärem (KV) Risiko und Anomalie des Nüchternblutzuckers (NBZ), Glukoseintoleranz oder Diabetes mellitus Typ 2 in einem frühen Stadium. Ziel der Studie war der Vergleich von LANTUS mit der Standardtherapie im Hinblick auf den Zeitpunkt des ersten Auftretens eines schwerwiegenden kardiovaskulären Ereignisses (MACE; major adverse cardiovascular event). MACE war definiert als zusammengesetzte Grösse aus Tod kardiovaskulärer Ursache, nicht-tödlichem Myokardinfarkt und nicht-tödlichem Schlaganfall. Die mediane Nachbeobachtungsdauer betrug 6,2 Jahre. Die Häufigkeit von MACE war in der ORIGIN-Studie unter LANTUS vergleichbar wie unter Standardtherapie (Hazard Ratio [95 %-KI] für MACE: 1,02 [0,94; 1,11]).
Lixisenatid
Die ELIXA-Studie war eine randomisierte, doppelblinde, placebokontrollierte, multinationale Studie, in der kardiovaskuläre (KV) Endpunkte unter der Behandlung mit Lixisenatid bei Patienten mit Typ-2-Diabetes (n = 6068) und kurz zurückliegendem akuten Koronarsyndrom untersucht wurden. Der zusammengesetzte primäre Wirksamkeitsendpunkt war die Zeit bis zum ersten Auftreten eines der folgenden Ereignisse, validiert durch den Beurteilungsausschuss für kardiovaskuläre Ereignisse: Kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt, nicht-tödlicher Schlaganfall oder stationäre Behandlung wegen instabiler Angina pectoris. Einer der sekundären kardiovaskulären Endpunkte war eins der Ereignisse des primären Endpunkts oder stationäre Behandlung wegen Herzinsuffizienz oder koronarer Revaskularisierung. Die mediane Nachbeobachtungsdauer der Studie betrug 25,8 Monate in der Lixisenatid-Gruppe und 25,7 Monate in der Placebogruppe.
Die Inzidenz des primären Endpunkts war in der Lixisenatid-Gruppe und der Placebogruppe vergleichbar: Die Hazard Ratio (HR) für Lixisenatid vs. Placebo betrug 1,017 bei einem zweiseitigen 95 %-Konfidenzintervall (KI) von 0,886 bis 1,168. Vergleichbare Prozentwerte für die beiden Gruppen wurden auch bei den sekundären Endpunkten und für jede der einzelnen Komponenten der zusammengesetzten Endpunkte ermittelt. So betrug der Anteil der Patienten, die wegen Herzinsuffizienz stationär behandelt wurden, 4,0 % in der Lixisenatid-Gruppe und 4,2 % in der Placebogruppe (HR [95 %-Kl] = 0,96 [0,75; 1,23]).
PharmakokinetikDas Verhältnis von Insulin glargin zu Lixisenatid hat keinen relevanten Einfluss auf die Pharmakokinetik von Insulin glargin und Lixisenatid in Suliqua.
Verglichen mit Lixisenatid allein ist die Cmax niedriger, die AUC (Fläche unter der Kurve) jedoch im Allgemeinen vergleichbar, wenn Lixisenatid in Form von Suliqua verabreicht wird. Die beobachteten pharmakokinetischen Unterschiede je nachdem, ob Lixisenatid allein oder in Form von Suliqua verabreicht wird, werden nicht als klinisch signifikant erachtet.
Absorption
Nach subkutaner Injektion von Insulin-glargin/Lixisenatid-Kombinationen bei Patienten mit Typ-1-Diabetes zeigte Insulin glargin keinen ausgeprägten Peak. Die Insulin-glargin-Exposition nach Gabe der Insulin-glargin/Lixisenatid-Kombination betrug 86–101 %, verglichen mit der Verabreichung von Insulin glargin allein.
Nach subkutaner Injektion von Insulin-glargin/Lixisenatid-Kombinationen bei Patienten mit Typ-1-Diabetes lag die mediane tmax von Lixisenatid im Bereich von 2,5 bis 3,0 Stunden. Die Cmax von Lixisenatid nahm verglichen mit gleichzeitig verabreichten separaten Injektionen von Insulin glargin und Lixisenatid leicht um 22–34 % ab, was wahrscheinlich klinisch nicht relevant ist. Bei subkutaner Gabe von Lixisenatid in Bauchdecke, Oberschenkel oder Deltoid zeigen sich keine klinisch relevanten Unterschiede in der Resorptionsgeschwindigkeit.
Distribution
Lixisenatid weist eine mässige Bindung (55 %) an Humanproteine auf.
Metabolismus
Eine Metabolismusstudie beim Menschen zur alleinigen Gabe von Insulin glargin zeigte, dass Insulin glargin partiell am Carboxy-Ende der Beta-Kette im subkutanen Depot abgebaut wird, wodurch zwei aktive Metaboliten gebildet werden (M1 [21A-Gly-Insulin] und M2 [21A-Gly-des-30B-Thr-Insulin]), deren Aktivität in vitro mit der von Humaninsulin vergleichbar ist. Sowohl der unveränderte Wirkstoff als auch die beiden Abbauprodukte zirkulieren im Plasma.
Elimination
Als Peptid wird Lixisenatid über glomeruläre Filtration, gefolgt von tubulärer Rückresorption und anschliessender Proteolyse, eliminiert. Die dadurch entstandenen kleineren Peptide und Aminosäuren werden wieder dem Proteinstoffwechsel zugeführt.
Kinetik spezieller Patientengruppen
Nierenfunktionsstörungen
In einer nicht-verblindeten Studie wurde die Pharmakokinetik einer Einzeldosis Lixisenatid 5 µg bei Patienten mit Niereninsuffizienz unterschiedlicher Schwere mit der bei Gesunden verglichen (Beurteilung der Schwere anhand der laut Cockcroft-Gault-Formel geschätzten Kreatininclearance [CrCl]).
Zwischen Personen mit normaler Nierenfunktion und solchen mit leichter Niereninsuffizienz (CrCl 60–90 ml/min) waren keine relevanten Unterschiede der mittleren Cmax und der AUC von Lixisenatid zu verzeichnen. Bei Patienten mit einer mittelschweren Niereninsuffizienz (CrCl 30–60 ml/min) war die AUC von Lixisenatid um rund 51 % erhöht, bei denen mit einer schweren Niereninsuffizienz (CrCl 15–30 ml/min) um rund 87 %.
Leberfunktionsstörungen
Da Lixisenatid primär über die Nieren ausgeschieden wird, wurde keine pharmakokinetische Studie bei Patienten mit akuter oder chronischer Leberinsuffizienz durchgeführt. Es ist nicht zu erwarten, dass eine Leberfunktionsstörung die Pharmakokinetik von Lixisenatid beeinflusst.
Alter, ethnische Zugehörigkeit, Geschlecht und Körpergewicht
Insulin glargin
Der Einfluss von Alter, ethnischer Zugehörigkeit und Geschlecht auf die Pharmakokinetik von Insulin glargin wurde nicht untersucht. In kontrollierten klinischen Studien zu Insulin glargin (100 Einheiten/ml) bei Erwachsenen zeigten Subgruppenanalysen nach Alter, ethnischer Zugehörigkeit und Geschlecht keine Unterschiede bei der Sicherheit und Wirksamkeit.
Lixisenatid
In einer populationspharmakokinetischen Analyse zeigten Alter, Körpergewicht, Geschlecht und ethnische Zugehörigkeit keine klinisch signifikante Auswirkung auf die Pharmakokinetik von Lixisenatid.
Kinder und Jugendliche
Es wurden keine Studien zu Suliqua bei Kindern und Jugendlichen unter 18 Jahren durchgeführt.
Präklinische DatenEs wurden keine tierexperimentellen Studien mit der Kombination aus Insulin glargin und Lixisenatid zur Untersuchung der Toxizität bei wiederholter Verabreichung, Kanzerogenität, Genotoxizität oder Reproduktionstoxizität durchgeführt.
Insulin glargin
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Verabreichung, Genotoxizität, Kanzerogenität und Reproduktionstoxizität lassen die präklinischen Daten für Insulin glargin keine besonderen Gefahren für den Menschen erkennen.
Lixisenatid
Basierend auf konventionellen Studien zur Sicherheitspharmakologie und Genotoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
In zweijährigen subkutanen Kanzerogenitätsstudien wurden C-Zell-Karzinome an der Schilddrüse bei Ratten beobachtet, nicht jedoch bei Mäusen. Die Dosis ohne beobachtbare schädliche Wirkung (NOAEL) im Hinblick auf C-Zell-Karzinome betrug 40 µg/kg zweimal täglich (BID) bei Ratten, was einer systemischen Exposition (AUC) entspricht, die 913-fach über der Exposition bei der humantherapeutischen Dosis von 20 µg (QD) liegt. Bei extrem hohen wiederholten Gaben (das ≥913-Fache bzw. ≥272-Fache der Exposition bei der humantherapeutischen Dosis) zeigten sich bei Ratten und Mäusen Proliferationswirkungen auf die C-Zellen der Schilddrüse (Hyperplasien und Adenome). Wahrscheinlich sind diese Ergebnisse auf einen nicht genotoxischen GLP-1-Rezeptor-vermittelten Mechanismus zurückzuführen, auf den Nager besonders empfindlich reagieren. Die zweijährige subkutane Kanzerogenitätsstudie bei Mäusen ergab zudem eine höhere Inzidenz von Adenokarzinomen des Endometriums bei einer Dosis, die das 97-fache der klinischen Exposition bei der therapeutischen Dosis überstieg.
Tierexperimentelle Studien zeigten bei Ratten keine direkte schädigende Wirkung hinsichtlich der männlichen und weiblichen Fertilität. Bei mit Lixisenatid behandelten Hunden wurden reversible Läsionen in Hoden und Nebenhoden beobachtet. Die Dosis ohne beobachtbare toxische Wirkung (NOAEL) betrug 2 µg/kg zweimal täglich (BID), was einer Exposition entspricht, die nur das 17-Fache der humantherapeutischen Dosis beträgt. In einer Toxizitätsstudie an jungen Hunden wurden ähnliche Wirkungen bei allen getesteten Dosen (NOAEL < 5 µg/kg BID) beobachtet.
In embryofetalen Entwicklungsstudien wurden bei allen Dosierungen ab 2,5 µg/kg BID (Ratten: 0,5-Faches der systemischen Exposition bei der humantherapeutischen Dosis, Kaninchen: 3,8-fach höhere Exposition) Fehlbildungen, verzögertes Wachstum, verzögerte Ossifikation und Auswirkungen auf das Skelett beobachtet. In beiden Spezies zeigten die Muttertiere Anzeichen von Toxizität wie geringe Nahrungsaufnahme und reduziertes Körpergewicht. Lixisenatid im letzten Abschnitt der Tragzeit und während der Stillzeit reduzierte bei Ratten das neonatale Wachstum, wobei eine leicht erhöhte Sterblichkeit der Jungtiere beobachtet wurde.
Sonstige HinweiseInkompatibilitäten
Dieses Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Nach der ersten Anwendung des Pens
Nach der ersten Anwendung des Pens ist dieser innerhalb von 28 Tagen aufzubrauchen.
Besondere Lagerungshinweise
SoloStar-Fertigpen bis zur ersten Anwendung
Im Kühlschrank (2–8 °C) lagern.
Nicht einfrieren oder in der Nähe des Gefrierfachs oder eines Kühlelements aufbewahren. Den Fertigpen in der Umverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Ausser Reichweite von Kindern aufbewahren.
Angebrochener SoloStar-Fertigpen
Nicht über 25 °C lagern, innerhalb von höchstens 28 Tagen aufbrauchen. Nicht im Kühlschrank lagern. Nicht einfrieren.
Fertigpen nicht mit aufgesteckter Nadel aufbewahren.
Den Fertigpen vor direkter Hitzeeinwirkung und Licht geschützt aufbewahren. Die Penkappe muss nach jeder Injektion wieder auf den Pen gesetzt werden, um ihn vor Licht zu schützen. Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Vor der ersten Anwendung muss der Pen unbedingt 1–2 Stunden bei Raumtemperatur liegen.
Die Patrone muss vor Gebrauch sichtgeprüft werden. Sie darf nur verwendet werden, wenn die Lösung klar und farblos ist, keine sichtbaren Partikel enthält und von wasserähnlicher Konsistenz ist. Suliqua ist eine Lösung und muss somit vor der Injektion nicht zusätzlich gelöst werden.
Die Suliqua-Lösung darf nicht mit einem anderen Insulin gemischt oder verdünnt werden. Mischen oder Verdünnen kann das Zeit-/Wirk-Profil verändern. Mischen kann zu Ausfällungen führen.
Für jede Anwendung muss eine neue Nadel aufgesteckt werden. Nadeln dürfen nicht wiederverwendet werden. Der Patient muss die Nadel nach jeder Injektion entsorgen.
Wenn die Nadel verstopft ist, sind die Anweisungen zu befolgen, die in der Bedienungsanleitung des Pens, die Bestandteil der Packungsbeilage ist, beschrieben sind.
Leere Pens dürfen nicht wiederverwendet werden und müssen vorschriftsgemäss entsorgt werden.
Zur Vermeidung einer möglichen Übertragung von Krankheiten darf jeder Pen immer nur von ein- und demselben Patienten verwendet werden.
Das Etikett des Pens muss vor jeder Injektion überprüft werden, um Medikationsfehler und Verwechslungen zwischen den beiden Dosisstärken/Fertipen-Typen von Suliqua und/oder zwischen Suliqua und anderen injizierbaren Antidiabetika zu vermeiden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Vor der Injektion von Suliqua muss die Bedienungsanleitung des Pens sorgfältig durchgelesen werden.
Zulassungsnummer66283 (Swissmedic).
PackungenFertigpen SoloStar® mit 3 ml Injektionslösung.
Suliqua 100/50 (gelber SoloStar®-Fertigpen für 10–40 Dosisschritte): Packung mit 3 Pens (B).
Suliqua 100/33 (grüner SoloStar® -Fertigpen für 30–60 Dosisschritte): Packung mit 3 Pens (B).
Zulassungsinhaberinsanofi-aventis (schweiz) ag, 1214 Vernier/GE.
Stand der InformationMai 2025
|


