Eigenschaften/WirkungenATC-Code
N05AX16
Wirkungsmechanismus
REXULTI ist ein neuartiger, atypischer antipsychotischer Wirkstoff, dessen pharmakologische Aktivität auf der Modulation der Serotonin-Dopamin Aktivität beruht. Obwohl der genaue Wirkmechanismus von Brexpiprazol in der Behandlung der Schizophrenie oder der Agitiertheit bei Alzheimer-Demenz nicht vollständig geklärt ist, beruht die Pharmakologie von Brexpiprazol vermutlich auf einer Kombination von hoher Bindungsaffinität und funktioneller Aktivität an multiplen monoaminergen Rezeptoren. Seine modulatorische Wirkung auf die serotonergen und dopaminergen Systeme beruht auf einer Kombination von partiell agonistischer Aktivität an den serotonergen 5-HT1A und den dopaminergen D2 Rezeptoren und einer antagonistischen Aktivität an den serotonergen 5-HT2A Rezeptoren, wobei die Affinitäten zu all diesen Rezeptoren ähnlich hoch sind (Ki: 0,1–0,5 nM).
Brexpiprazol zeigt ausserdem eine antagonistische Aktivität an den noradrenergen α1B/2C Rezeptoren im gleichen sub-nanomolaren Ki-Bereich (Ki: 0,2–0,6 nM). Die partiell agonistische Aktivität am 5HT1A/D2 Rezeptor in Kombination mit der antagonistischen Aktivität an den 5-HT2A und α1B/2C Rezeptoren trägt möglicherweise zur antipsychotischen Wirkung von Brexpiprazol bei.
Pharmakodynamik
Brexpiprazol hat eine hohe Affinität (Ki <5 nM) zu multiplen monoaminergen Rezeptoren, darunter Serotonin 5-HT1A, 5-HT2A, 5-HT2B und 5-HT7, Dopamin D2 und D3 sowie noradrenerge α1A, α1B, α1D und α2C Rezeptoren. Brexpiprazol wirkt als Partialagonist an den 5-HT1A, D2 und D3 Rezeptoren und als Antagonist an den 5-HT2A, 5-HT2B, 5-HT7, α1A, α1B, α1D und α2C Rezeptoren.
An den dopaminergen D2 Rezeptoren besitzt Brexpiprazol eine schwache intrinsiche Aktivität. Brexpiprazol hat eine mässige Affinität zu Histamin H1 Rezeptoren (19 nM) und eine sehr schwache Affinität zu muscarinischen M1 Rezeptoren (67% Inhibition bei 10 µM). Die Dosis-Wirkungs-Okkupanz sowie das Verhältnis der Gehirn/Plasma Exposition wurden in präklinischen Studien invivo oder exvivo für die D2/D3, 5-HT2A, 5-HT1A, 5-HT6 und 5-HT7 Rezeptoren sowie für den 5-HT-Transporter bestimmt. Die Resultate stimmen mit den relativen invitro Bindungsaffinitäten überein und zeigen die Aktivität von Brexpiprazol an mehreren Angriffspunkten im zentralen Nervensystem bei relevanter Plasma Exposition.
In einer umfassenden QTc-Studie bei Patienten mit Schizophrenie oder schizoaffektiver Störung, bewirkte REXULTI nach 12 Tagen therapeutischer (4 mg/Tag) oder supra-therapeutischer (12 mg/Tag) Dosierung keine QTcF Verlängerung. Es wurde keine Korrelation zwischen den Brexpiprazol Konzentrationen und QTcF Verlängerung beobachtet.
Klinische Wirksamkeit
Schizophrenie
Die Wirksamkeit von REXULTI bei der Behandlung von erwachsenen Patienten mit Schizophrenie gemäss DSM-IV-TR Kriterien, wurde in zwei randomisierten, doppel-blinden, Placebo-kontrollierten 6-Wochen Studien mit fixer Dosierung (Studien 331-10-231 und 331-10-230) und einer Langzeitstudie zur Erhaltungstherapie (Studie 331-10-232) gezeigt.
Für in Frage kommende Patienten wurde eine Spitalaufnahme oder eine Verlängerung des Spitalaufenthalts zur Behandlung eines akuten Rückfalls von Schizophrenie als vorteilhaft befunden. Sie mussten im Voraus eine angemessene ambulante Behandlung mit Antipsychotika erhalten und innerhalb der letzten 12 Monate vor Studienbeginn gut auf diese Behandlung (ausser Clozapin) angesprochen haben.
In den Studien 331-10-231 und 331-10-230 wurden die Patienten auf Tagesdosen von REXULTI 2 mg oder 4 mg oder Placebo randomisiert. Patienten in den REXULTI Gruppen begannen die Behandlung mit 1 mg einmal täglich am Tag 1. Am Tag 5 wurde die REXULTI Dosis auf 2 mg einmal täglich erhöht. Am Tag 8 wurde die Dosis, abhängig vom Behandlungsarm, für die restlichen 5 Studienwochen entweder bei 2 mg belassen oder auf 4 mg einmal täglich erhöht.
Die Studien 331-10-231 und 331-10-230 umfassten auch zwei Behandlungsarme mit tiefer REXULTI Dosierung von 0.25 mg/Tag und 1 mg/Tag. Diese wurden jedoch nicht in die primäre Analyse aufgenommen.
Der primäre Wirksamkeits-Endpunkt für beide Studien war die Veränderung des Gesamtscores der Positive and Negative Syndrome Scale (PANSS) vom Ausgangswert bis Woche 6. Die PANSS umfasst 30 Items und misst die positiven (7 Items) und negativen (7 Items) Symptome der Schizophrenie sowie die allgemeine Psychopathologie (16 Items). Jedes Item wird auf einer Skala von 1 (nicht vorhanden) bis 7 (extrem) bewertet. Der PANSS Gesamt-score reicht von 30 (bestes Ergebnis) bis 210 (schlechtestes Ergebnis). Der wichtigste sekundäre Endpunkt der Studien war die Veränderung auf der Clinical Global Impression – Severity of Illness Scale (CGI S) vom Ausgangswert bis Woche 6. Die CGI S ist eine validierte, vom Arzt bewertete Skala, die den aktuellen klinischen Zustand des Patienten in Bezug auf die Symptom-schwere bewertet. Weitere sekundäre Endpunkte waren unter anderen die Personal and Social Performance Scale (PSP), eine validierte, vom Arzt bewertete Skala, welche die persönliche und soziale Funktionsfähigkeit misst.
In Studie 331-10-231 war REXULTI in beiden Dosierungen, 2 mg/Tag und 4 mg/Tag, bezüglich des PANSS-Gesamtscores gegenüber Placebo überlegen (Tabelle 3). In Studie 331-10-232 war REXULTI in einer Dosis von 4 mg/Tag im Hinblick auf den PANSS-Gesamtscore gegenüber Placebo überlegen (Tabelle 3). Für die Dosis 2 mg/Tag wurde nur in Studie 331-10-231 eine statistisch signifikante Wirksamkeit gezeigt. Aus der Untersuchung der Populationsuntergruppen auf Basis von Alter, Geschlecht und ethnischer Zugehörigkeit ergaben sich keine Hinweise auf Unterschiede bei der Ansprechempfindlichkeit.
Tabelle 3 zeigt die Ergebnisse für den primären Wirksamkeitsendpunkt für die Studien 331-10-231 und 331-10-230.
Tabelle 3: Primäre Wirksamkeitsresultate für die 6-Wochen Studien in Schizophrenie (Studien 331-10-231 und 331-10-230)
|
|
Primärer Wirksamkeitsparameter: PANSS
| |
Studie
|
Behandlungs-gruppe
|
N
|
Mittlerer Ausgangswert (SD)
|
LS mittlere Abweichung vom Ausgangswert (SE)
|
LS mittlere Differenza (95% KI)
|
p-Wert
| |
331-10-231
|
REXULTI (2 mg/Tag)*
|
180
|
95,85 (13,75)
|
-20,73 (1,55)
|
-8,7
(-13,1; -4,4)
|
<0,0001
| |
REXULTI (4 mg/Tag)*
|
178
|
94,70 (12,06)
|
-19,65 (1,54)
|
-7,6
(-12,0; -3,1)
|
0,0006
| |
Placebo
|
178
|
95,69 (11,46)
|
-12,01 (1,60)
|
--
|
-
| |
331-10-230
|
REXULTI
(2 mg/Tag)
|
179
|
96,30 (12,91)
|
-16,61 (1,49)
|
-3,1
(-7,2; 1,1)
|
0,1448
| |
REXULTI (4 mg/Tag)*
|
181
|
94,99 (12,38)
|
-20,00 (1,48)
|
-6,5
(-10,6; -2,4)
|
0,0022
| |
Placebo
|
180
|
94,63 (12,84)
|
-13,53 (1,52)
|
--
|
-
|
SD: standard deviation (Standardabweichung); SE: standard error (Standardfehler); LS: Least-Square, KI: unadjusted confidence interval (unbereinigtes Konfidenzintervall).
* REXULTI dem Placebo statistisch signifikant überlegen
a Differenz (REXULTI minus Placebo) der Least-Square mittleren Veränderung vom Ausgangswert bis Woche 6
REXULTI war in den Dosierungen 2 mg/Tag und 4 mg/Tag in den sekundären Endpunkten, CGI-S-Score und PSP-Gesamtscore, Placebo überlegen. Somit bestätigen die Ergebnisse für den CGI-S- und den PSP-Score sekundäre Endpunkte die Überlegenheit und klinisch relevante Wirkung von REXULTI im Vergleich zu Placebo.
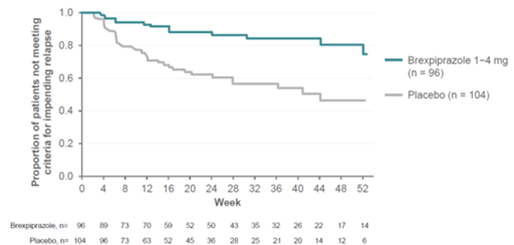
Ein vorher festgelegte Interimsanalyse zeigte bei den in die REXULTI Gruppe (1–4 mg/Tag) randomisierten Patienten eine statistisch signifikant längere Zeit bis zum drohenden Rückfall als bei den in die Placebo Gruppe randomisierten Patienten (p = 0,0008, Log-Rank Test). Die Schlussanalyse bestätigte die statistisch signifikant längere Zeit bis zum drohenden Rückfall für Patienten in der REXULTI Gruppe gegenüber der Placebo Gruppe (p < 0,0001, Log-Rank Test). Die Kaplan-Meier Kurven des kumulativen Anteils der Patienten im finalen Analyse Set, die während der doppel-blinden Behandlungsphase in den REXULTI und Placebo Gruppen einen Rückfall erlitten, sind in Abbildung 1 dargestellt. Bei der Schlussanalyse betrug die Hazard-Ratio aus dem Cox Proportional Hazard Model für den Vergleich von Placebo und REXULTI 3,42 (95% KI: 1,82; 6,41, Rückfallrate 13,54% vs. 38,46%). Somit hatten Patienten in der Placebo Gruppe ein 3,42-fach erhöhtes Risiko für einen drohenden Rückfall als Patienten in der REXULTI Gruppe.
Abbildung 1: Kaplan-Meier Kurven für die Zeit bis zum drohenden Rückfall (doppel-blinde Erhaltungsphase, Wirksamkeits-Stichprobe) – Schlussanalyse, Studie 3
Agitiertheit bei Alzheimer-Demenz
Die Wirksamkeit von REXULTI bei der Behandlung der Agitiertheit bei Alzheimer-Demenz (AAD) wurde in zwei 12-wöchigen randomisierten, doppelblinden, placebokontrollierten Studien mit fixer Dosis (Studie 331-12-283 und 331-14-213) gezeigt. Die Studienpatienten mussten eine Diagnose einer wahrscheinlichen Alzheimer-Krankheit nach den Kriterien des National Institute of Neurological and Communicative Diseases and Stroke/Alzheimer's Disease and Related Disorders Association (NINCDS-ADRDA) und einen Mini-Mental-Examination (MMSE)-Score von ≥5 bis ≤22 erfüllen.
Bei der Aufnahme in die Studie mussten die Patienten einen Gesamtscore ≥4 für das Item Agitation/Aggression des NPI/NPI-NH (Neuropsychiatric Inventory-Nursing Home Version) aufweisen. Die Patienten mussten bei der Aufnahme in die Studie so starke agitierte Verhaltensweisen aufweisen, dass nach Ausschluss anderer Ursachen eine Pharmakotherapie gerechtfertigt war.
AAD-Patienten, die in der Vergangenheit auf zwei oder mehr Antipsychotika nicht angesprochen hatten, waren vom klinischen Entwicklungsprogramm REXULTI ausgeschlossen.
An Studie 331-12-283 nahmen 433 Patienten mit einem Durchschnittsalter von 74 Jahren (Bereich: 51 bis 90 Jahre) teil. An Studie 331-14-213 nahmen 345 Patienten mit einem Durchschnittsalter von 74 Jahren (Bereich: 56 bis 90 Jahre) teil.
In Studie 331-12-283 bestanden bei 78 (18%) der mit REXULTI behandelten Patienten und 36 (8%) der mit Placebo behandelten Patienten vor Studienbeginn psychotische Symptome. In Studie 331-14-213 berichteten 44 (19%) der mit REXULTI behandelten Patienten und 21 (18%) der mit Placebo behandelten Patienten psychotische Symptome in der Vorgeschichte.
Der primäre Wirksamkeitsendpunkt in allen Studien war die Änderung der Cohen-Mansfield Agitation Inventory (CMAI)-Scores zwischen der Ausgangsuntersuchung und Woche 12. Der CMAI ist ein von Ärzten bewerteter Fragebogen, der aus 29 Elementen besteht und die Häufigkeit der Manifestationen von Agitiertheit bei älteren Patienten auf der Grundlage der Eingaben des Pflegepersonals bewertet.
Patienten in Studie 331-14-213 mussten zusätzlich zu den allgemeinen Einschlusskriterien zu Studienbeginn die Kriterien für CMAI-Faktor 1 (aggressives Verhalten) erfüllen. Dafür muss eines der folgenden Merkmale vorliegen: ≥1 aggressive Verhaltensweise, die mehrmals pro Woche auftritt, oder ≥2 aggressive Verhaltensweisen, die ein- oder zweimal pro Woche auftreten, oder ≥3 aggressive Verhaltensweisen, die weniger als einmal pro Woche auftreten. Aggressives Verhalten bezieht sich auf Schlagen (einschließlich sich selbst), Treten, Kratzen, Greifen, Stoßen, Verletzen von sich selbst oder anderen, Werfen von Gegenständen, Fluchen oder verbale Aggression, Spucken, Zerreißen von Gegenständen oder Zerstörung von Eigentum, Schreien und Beißen. Zudem mussten die Patienten in Studie 331-14-213 das Kriterium Agitiertheit bei Patienten mit kognitiven Störungen nach der vorläufigen Konsensusdefinition der International Psychogeriatric Association (IPA) (2014) erfüllen.
Die Patienten in Studie 331-12-283 erhielten randomisiert eine feste Dosis von REXULTI 1 mg einmal täglich, 2 mg einmal täglich oder Placebo. In dieser Studie zeigten Patienten, die REXULTI 2 mg einmal täglich erhielten, in Woche 12 eine Verbesserung der CMAI-Scores gegenüber den Patienten, die Placebo erhielten. Die Patienten in Studie 331-14-213 erhielten randomisiert eine feste Dosis von REXULTI 2 mg oder 3 mg einmal täglich (kombinierter Behandlungsarm) oder Placebo. In dieser Studie zeigten Patienten, die REXULTI 2 mg oder 3 mg einmal täglich erhielten, in Woche 12 eine Verbesserung der CMAI-Scores gegenüber den Patienten, die Placebo erhielten.
Wie in Tabelle 4 gezeigt, war die mittlere Veränderung des CMAI-Scores in Woche 12 bei den Patienten, die mit 2 mg/Tag oder 3 mg/Tag REXULTI behandelt worden waren, signifikant grösser als unter Placebo. Unter der Dosis von 1 mg einmal täglich zeigte sich in dieser Patientenpopulation keine signifikant größere Veränderung des CMAI-Scores gegenüber dem Ausgangswert.
Tabelle 4: Änderung des CMAI-Gesamtscores Ausgangswert bis Woche 12 bei Patienten mit Agitiertheit bei Alzheimer-Demenz in Studie 331-12-283 und Studie 331-14-213
|
Studie
|
Behandlungsgruppe
|
N
|
Mittlerer Ausgangswert
(SD)
|
Veränderung des LS Mean
(SE)
|
Unterschied zwischen Behandlungen†
(95%-KI)
| |
331-12-283
|
REXULTI 1 mg/Tag
|
134
|
70,5 (16,0)
|
-17,6 (1,3)
|
0,2 (-3,4, 3,9)
| |
REXULTI 2 mg/Tag‡
|
138
|
71,0 (16,6)
|
-21.6 (1.3)
|
-3,8 (-7,4, -0,2)
| |
Placebo
|
131
|
72,2 (17,9)
|
-17,8 (1,3)
|
—
| |
331-14-213*
|
REXULTI 2 mg/Tag oder 3 mg/Tag‡
|
225
|
80,6 (16,6)
|
-22,6 (1,1)
|
-5.3 (-8,8, -1,9)
| |
Placebo
|
116
|
79,2 (17,5)
|
-17,3 (1,4)
|
—
|
SD: Standardabweichung, SE: Standardfehler, LS Mean: angepasster Mittelwert (least-square mean), KI: nicht adjustiertes Konfidenzintervall
† Differenz (Arzneimittel minus Placebo) zwischen den Veränderungen der angepassten Mittelwerte seit dem Ausgangswert
‡ Dosierungen statistisch signifikant überlegen gegenüber Placebo
* Angereicherte Wirksamkeitsprobe (AAD-Probanden mit einem Minimum an aggressivem Verhalten, definiert als CMAI-Faktor-1-Kriterium).
Die Untersuchung des primären Endpunkts in Populationsuntergruppen (nach Alter, ethnischer Abstammung oder Geschlecht) ergab keine Unterschiede bezüglich des Ansprechens zwischen diesen Gruppen.
Für die Studie 331-14-213 wurde eine Post-hoc-Reaktionsanalyse durchgeführt, bei der eine klinisch bedeutsame Veränderung (Meaningful Within Patient Change (MWPC)) auf Brexpiprazol als eine Änderung des CMAI-Gesamtscores um mindestens 20 Punkte vom Ausgangswert bis Woche 12 definiert wurde. Der Anteil der Patienten mit einem MWPC betrug 57 % bei den mit REXULTI behandelten Patienten und 37 % bei den mit Placebo behandelten Patienten.
Langzeitdaten
Schizophrenie
Die Langzeitstudie (Studie 331-10-232) war eine randomisierte Placebo-kontrollierte doppelblinde Studie zur Messung der Wirksamkeit, Sicherheit und Verträglichkeit von REXULTI 1–4 mg/Tag als Erhaltungstherapie bei Erwachsenen mit Schizophrenie. Die Brexpiprazol-Dosierung konnte in dieser Studie nach Ermessen des Prüfers angepasst werden. Die häufigste Modaldosis für stabilisierte Patienten, die randomisiert Brexpiprazol zugeordnet waren, betrug 4 mg/Tag (64 Patienten, 66%), gefolgt von 3 mg/Tag (25 Patienten, 25,8%), 2 mg/Tag (7 Patienten, 7,2%) und 1 Patient (1%) erhielt eine Modaldosis von 1 mg/Tag.
Agitierheit bei Alzheimer Demenz
Eine 12-wöchige offene Verlängerungsstudie (Studie 331-201-00182) zur Bewertung der Sicherheit und Verträglichkeit von Brexpiprazol bei Patienten mit Unruhe im Zusammenhang mit Demenz vom Alzheimer-Typ zeigte nach 12-wöchiger Behandlung ähnliche mittlere CMAI-Gesamtwerte bei Patienten, die zuvor in der vorausgegangenen kontrollierten Studie mit Brexpiprazol oder Placebo behandelt worden waren. Bei unterschiedlichen mittleren CMAI-Ausgangswerten (vorherige Brexpiprazol Gruppe 57,3 [SD 17,2] gegenüber vorherige Placebo-Gruppe 62,9 [18,1] war die mittlere (SD) Veränderung gegenüber dem Ausgangswert bei den 86 Probanden in der vorherigen Placebogruppe wie zu erwarten größer (-12,5 [SD 16,6]) als bei den 140 Probanden in der vorherigen Brexpiprazol-Gruppe (−7,1 [SD 12,3]).
|

