Eigenschaften/WirkungenATC-Code
A05AA04
Pharmakotherapeutische Gruppe: Gallensäuren und Derivate
Wirkungsmechanismus
Obeticholsäure ist ein selektiver und potenter Agonist für den Farnesoid X-Rezeptor (FXR), ein Kernrezeptor, der in hohen Konzentrationen in Leber und Darm exprimiert wird. Man nimmt an, dass FXR ein wichtiger Regulator für Gallensäure-, Entzündungs-, Fibrose- und Stoffwechsel-Wege ist. Die FXR-Aktivierung senkt die intrazelluläre Gallensäurekonzentration in den Hepatozyten durch Unterdrückung der de-novo-Synthese aus Cholesterin sowie durch Erhöhen des Transports von Gallensäuren aus den Hepatozyten. Diese Mechanismen begrenzen die Gesamtgrösse des zirkulierenden Gallensäure-Pools und fördern gleichzeitig die Cholerese, wodurch die Leberexposition gegenüber Gallensäuren reduziert wird.
Pharmakodynamik
Dosistitration
In der randomisierten, doppelblinden, placebokontrollierten, 12-monatigen Parallelgruppen-Studie der Phase III (POISE) pendelte sich bei den meisten mit OCALIVA 5 mg einmal täglich behandelten Patienten die ALP-Reduktion nach ungefähr 3 Monaten ein. Eine abhängig von der Verträglichkeit und dem Ansprechen vorgenommene Erhöhung der OCALIVA-Dosis auf 10 mg einmal täglich führte bei der Mehrzahl der Patienten zu einer weiteren Reduktion von ALP (siehe «Dosierung/Anwendung»).
Pharmakodynamische Marker
In der POISE-Studie war von Therapiebeginn bis Monat 12 die Anwendung von OCALIVA 10 mg einmal täglich mit einer 173%igen Erhöhung der Konzentrationen von FGF-19 verbunden, einem durch FXR induzierten Enterokin, das an der Homöostase der Gallensäure beteiligt ist. Von Therapiebeginn bis Monat 12 waren die Konzentrationen der Cholsäure und der Chenodesoxycholsäure reduziert (1,4 μM bzw. 2,7 μM). Die klinische Bedeutung dieser Befunde ist unklar.
Kardiale Elektrophysiologie
Bei einer Dosis, die das 10-fache der empfohlenen Höchstdosis betrug, verlängerte OCALIVA das QT-Intervall in keinem klinisch relevanten Ausmass.
Klinische Wirksamkeit
Eine randomisierte, doppelblinde, placebokontrollierte, 12-monatige Parallelgruppen-Studie der Phase III (POISE) beurteilte die Sicherheit und Wirksamkeit von OCALIVA bei 216 Patienten mit PBC, die mindestens 12 Monate lang UDCA einnahmen (stabile Dosis über ≥3 Monate vor Studieneinschluss) bzw. die UDCA nicht tolerieren konnten und UDCA in ≥3 Monaten vor Studieneinschluss nicht erhielten. Die Patienten wurden in die Studie aufgenommen, wenn die Konzentration an alkalischer Phosphatase (ALP) ≥1,67× Obergrenze des Normalbereichs (ULN) betrug und/oder wenn der Gesamtbilirubin-Wert >1× ULN, jedoch <2× ULN betrug.
Die Patienten erhielten nach Randomisierung (1:1:1) einmal täglich ein Placebo, 10 mg OCALIVA oder eine OCALIVA-Titrierung (5 mg, titriert auf 10 mg nach 6 Monaten, je nach dem Ansprechen/der Verträglichkeit der Behandlung). Die Mehrheit (93%) der Patienten erhielt eine mit UDCA kombinierte Behandlung, und eine kleine Anzahl von Patienten (7%), die UDCA nicht tolerieren konnten, erhielt ein Placebo, OCALIVA (10 mg) oder eine OCALIVA-Titrierung (5 mg auf 10 mg) als Monotherapie.
Die ALP- und Gesamtbilirubin-Werte wurden als kategorische Variablen zum primären kombinierten Endpunkt sowie als fortlaufende Variablen im Verlauf der Zeit beurteilt.
Die Studienpopulation war überwiegend weiblich (91%) und weiss (94%). Das mittlere Alter betrug 56 Jahre, und die Mehrheit der Patienten war weniger als 65 Jahre alt. Die mittleren Baseline-ALP-Werte reichten von 316 U/l bis 327 U/l. Die mittleren Baseline-Gesamtbilirubin-Werte reichten über die Behandlungsarme hinweg von 10 μmol/l bis 12 μmol/l, wobei 92% der Patienten innerhalb des Normalbereichs lagen.
Die Behandlung mit 10 mg OCALIVA oder einer OCALIVA-Titrierung (5 mg auf 10 mg) resultierte in klinisch und statistisch signifikanten Zunahmen (p <0,0001) im Vergleich zum Placebo bei der Anzahl der Patienten, die den primären kombinierten Endpunkt zu allen Studienzeitpunkten erreichten (siehe Tabelle 2). Das Ansprechen erfolgte teilweise bereits nach 2 Wochen und war dosisabhängig (5 mg OCALIVA im Vergleich zu 10 mg nach 6 Monaten, p = 0,0358).
Tabelle 2. Prozentsatz der PBC-Patienten, die den primären kombinierten Endpunkta zum 6-Monate- und zum 12-Monate-Zeitpunkt erreichten (mit oder ohne UDCA)b
|
|
OCALIVA
10 mgc
(N = 73)
|
OCALIVA
Titrierungc
(N = 70)
|
Placebo
(N = 73)
| |
Monat 6
|
|
|
| |
Responder, n (%)
Entsprechendes 95%-KI
|
37 (51)
39%, 63%
|
24 (34)
23%, 47%
|
5 (7)
2%, 15%
| |
p-Wertd
|
<0,0001
|
<0,0001
|
NA
| |
Monat 12
|
|
|
| |
Responder, n (%)
Entsprechendes 95%-KI
|
35 (48)
36%, 60%
|
32 (46)
34%, 58%
|
7 (10)
4%, 19%
| |
p-Wert d
|
<0,0001
|
<0,0001
|
NA
| |
Komponenten des primären Endpunktse
| |
ALP-Wert von weniger als dem 1,67-fachen des ULN, n (%)
|
40 (55)
|
33 (47)
|
12 (16)
| |
Reduzierung des ALP-Werts um mindestens 15%, n (%)
|
57 (78)
|
54 (77)
|
21 (29)
| |
Gesamtbilirubin von ≤1× ULNf, n (%)
|
60 (82)
|
62 (89)
|
57 (78)
|
a Prozentsatz der Patienten, bei denen ein Ansprechen erfolgte, definiert als ALP-Wert von weniger als dem 1,67-fachen des ULN, Gesamtbilirubin-Wert im Normalbereich und Reduzierung des ALP-Werts um mindestens 15%. Fehlende Werte galten als Nichtansprechen. Die Berechnung der 95%-Konfidenzintervalle (KI) erfolgte anhand des exakten Tests nach Fisher.
b Bei dieser Studie hatten 16 Patienten (7%) eine Unverträglichkeit und erhielten kein UDCA als Begleitmedikament: 6 Patienten (8%) im OCALIVA 10 mg-Arm, 5 Patienten (7%) im OCALIVA-Titrationsarm und 5 Patienten (7%) im Placebo-Arm.
c Die Patienten erhielten nach Randomisierung (1:1:1) einmal täglich 10 mg OCALIVA über die gesamten 12 Monate der Studie hinweg oder eine OCALIVA-Titrierung (einmal täglich 5 mg während den ersten 6 Monaten, mit der Möglichkeit einer Steigerung auf einmal täglich 10 mg während den letzten 6 Monaten, wenn der Patient OCALIVA tolerierte, aber ALP-Werte von mindestens dem 1,67-fachen der ULN und/oder Gesamtbilirubin-Werte über der ULN oder eine ALP-Reduzierung von weniger als 15% hatte) oder Placebo.
d OCALIVA-Titrierung und OCALIVA 10 mg im Vergleich zu Placebo. P-Werte werden anhand des Cochran-Mantel-Haenszel General Association-Tests mit Stratifizierung nach UDCA-Intoleranz und ALP-Werten vor der Behandlung von mehr als dem 3-fachen der ULN und/oder AST-Werten von mehr als dem 2-fachen der ULN und/oder Gesamtbilirubin von mehr als der ULN erhalten.
e Die Berechnung der Ansprechraten erfolgte auf der Grundlage der Fallbeobachtungsanalyse (d. h., [n = beobachteter Responder]/[N = Intention to Treat [ITT]-Kollektiv]); Prozentsätze der Patienten mit Monat-12-Werten betragen 86%, 91% bzw. 96% für die Arme OCALIVA 10 mg, OCALIVA-Titrierung bzw. Placebo.
f Die mittleren Baseline-Gesamtbilirubin-Werte reichten über die Behandlungsarme hinweg von 10 μmol/l bis 12 μmol/l, wobei 92% der eingeschlossenen Patienten innerhalb des Normalbereichs lagen (d. h. ≤ ULN).
Mittlere ALP-Reduktion
Abbildung 1 zeigt die durchschnittliche Reduktion der ALP bei den mit OCALIVA behandelten Patienten im Vergleich zu Placebo. Eine Reduktion wurde bereits in Woche 2 beobachtet. Bis zum Monat 3 pendelte sie sich ein und blieb bei den Patienten, die über die gesamten 12 Monate die gleiche Dosierung erhalten hatten, bis zum Monat 12 erhalten. Obwohl in der POISE-Studie eine Titration nach 6 Monaten beurteilt worden ist, unterstützt die Datenlage eine Titration von OCALIVA bereits nach 3 Monaten. Bei den Patienten des OCALIVA -Titrationsarms, deren OCALIVA -Dosis von 5 mg einmal täglich auf 10 mg einmal täglich erhöht worden war, wurde im Monat 12 mehrheitlich eine weitere Reduktion der ALP beobachtet (siehe «Pharmakokinetik»).
Abbildung 1: Mittlerer ALP-Wert über 12 Monate in der POISE-Studie, nach Therapiearm, mit oder ohne UDCAa
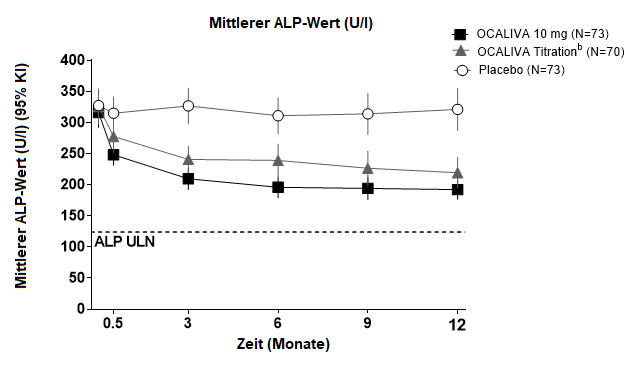
a In der Studie gab es 16 Patienten (7%), die wegen Unverträglichkeit keine begleitende UDCA-Gabe erhielten: 6 Patienten (8%) im OCALIVA 10 mg-Arm, 5 Patienten (7%) im OCALIVA-Titrationsarm und 5 Patienten (7%) im Placebo-Arm.
b Die dem OCALIVA-Titrationsarm randomisiert zugewiesenen Patienten erhielten während den ersten 6 Monaten OCALIVA 5 mg einmal täglich. Ab Monat 6 kamen diejenigen Patienten, die OCALIVA vertrugen, deren ALP jedoch beim 1,67-fachen der Normobergrenze (ULN) oder höher lag und/oder deren Gesamtbilirubin über ULN lag, oder die eine ALP-Reduktion von weniger als 15% aufwiesen, für eine Titration von 5 mg einmal täglich auf 10 mg einmal täglich in den letzten 6 Monaten der Studie in Frage.
Mittlere GGT-Reduktion
Die mittlere (95% KI) Reduktion der Gamma-Glutamyltransferase (GGT) betrug 178 (137, 219) U/l im Arm mit OCALIVA 10 mg, 138 (102, 174) U/l im OCALIVA-Titrationsarm und 8 (-32, 48) U/l im Placebo-Arm.
OCALIVA als Monotherapie
Einundfünfzig PBC-Patienten mit Baseline-ALP-Werten von ≥1,67× ULN und/oder Gesamtbilirubin-Werten über der ULN wurden im Hinblick auf biochemisches Ansprechen auf die OCALIVA-Monotherapie beurteilt (24 Patienten erhielten einmal täglich 10 mg OCALIVA und 27 Patienten erhielten Placebo); dies erfolgte im Rahmen einer gepoolten Analyse der Daten der randomisierten, doppelblinden, placebokontrollierten 12-monatigen Phase-III-Studie (POISE) und einer randomisierten, doppelblinden, placebokontrollierten 3monatigen klinischen Studie. Zum Monat 3-Zeitpunkt war bei 9 (38%) der mit OCALIVA behandelten Patienten ein Ansprechen auf den kombinierten Endpunkt erreicht, im Vergleich zu 1 (4%) mit Placebo behandelten Patienten. Die mittlere (95%-KI) Reduzierung des ALP-Werts bei den mit OCALIVA behandelten Patienten betrug 246 (165, 327) U/l im Vergleich zu einem Anstieg von 17 (-7, 42) U/l bei den mit Placebo behandelten Patienten.
|

