Eigenschaften/WirkungenATC-Code
A10BD24
Wirkungsmechanismus
Steglujan
Steglujan kombiniert zwei Antidiabetika mit ergänzenden Wirkungsmechanismen, um die Blutzuckerkontrolle bei Patienten mit Diabetes mellitus Typ 2 zu verbessern: Ertugliflozin, ein SGLT2-Inhibitor, und Sitagliptinphosphat, ein DPP-4-Inhibitor.
Ertugliflozin
SGLT2 ist als wichtigster Transporter für die Rückresorption der Glukose aus dem glomerulären Filtrat in den Blutkreislauf verantwortlich. Ertugliflozin ist ein SGLT2-Inhibitor. Über die SGLT2-Inhibition reduziert Ertugliflozin die renale Rückresorption von gefilterter Glukose und senkt den Schwellenwert der Niere für Glukose, wodurch die urinäre Glukoseausscheidung erhöht wird.
Sitagliptinphosphat
Sitagliptinphosphat ist ein oral aktiver, potenter und stark selektiver Inhibitor des Enzyms Dipeptidyl-Peptidase 4 (DPP-4) zur Behandlung des Diabetes mellitus Typ 2. Die DPP-4-Hemmer sind eine Wirkstoffklasse, die als Inkretinverstärker wirken. Durch Hemmung des Enzyms DPP-4 erhöht Sitagliptin die Konzentrationen der beiden bekannten aktiven Inkretin-Hormone GLP-1 (Glucagon-like Peptide-1) und GIP (Glucose-dependent insulinotropic Polypeptide). Die Inkretine sind Teil eines endogenen Systems, das bei der physiologischen Regulierung der Glukosehomöostase beteiligt ist. Wenn der Blutzucker normal oder erhöht ist, fördern GLP-1 und GIP die Insulinsynthese und die Insulinfreisetzung aus den Betazellen im Pankreas. Zusätzlich erniedrigt GLP-1 die Glukagonsekretion aus den Alphazellen im Pankreas, was zu einer verminderten Glukoseproduktion in der Leber führt. Dieser Mechanismus unterscheidet sich von dem bei Sulfonylharnstoffen bekannten Mechanismus; Sulfonylharnstoffe rufen auch bei niedrigen Glukosewerten eine Insulinfreisetzung hervor, was bei Typ-2-Diabetikern und Gesunden zu durch Sulfonylharnstoff induzierten Hypoglykämien führen kann. Sitagliptin ist ein potenter und stark selektiver Inhibitor des Enzyms DPP-4 und hemmt die nahe verwandten Enzyme DPP-8 und DPP-9 in therapeutischen Konzentrationen nicht. Sitagliptin unterscheidet sich in der chemischen Struktur und der pharmakologischen Wirkung von GLP-1-Analoga, Insulin, Sulfonylharnstoffen oder Meglitiniden, Biguaniden, PPARγ-Agonisten (peroxisome proliferator-activated receptor-gamma agonists), Alpha-Glucosidase-Hemmern und Amylin-Analoga.
Pharmakodynamik
Ertugliflozin
Urinäre Glukoseausscheidung und Harnvolumen
Nach Gabe von Einzel- und multiplen Dosen von Ertugliflozin wurden bei gesunden Probanden und Patienten mit Diabetes mellitus Typ 2 dosisabhängige Anstiege der im Urin ausgeschiedenen Glukosemenge beobachtet. Eine Dosis-Wirkungs-Modellierung deutet darauf hin, dass Ertugliflozin 5 mg und 15 mg zu einer nahezu maximalen urinären Glukoseausscheidung (UGE) führen, wobei die Dosis von 15 mg gegenüber der Dosis von 5 mg eine inkrementell verstärkte UGE erbringt. Die verstärkte UGE bleibt nach Gabe multipler Dosen erhalten. Die mit Ertugliflozin erzielte UGE führt auch zu einer Erhöhung des Harnvolumens.
Kardiale Elektrophysiologie
In einer randomisierten, placebokontrollierten Crossover-Studie mit aktivem Vergleichspräparat erhielten 42 gesunde Probanden eine supratherapeutische orale Einzeldosis von 100 mg Ertugliflozin (entspricht dem 6,7-Fachen der empfohlenen Höchstdosis), Moxifloxacin und Placebo. Unter einer Dosis von 100 mg Ertugliflozin wurde keine Verlängerung des QTc-Intervalls beobachtet.
Sitagliptin
Allgemeines
Bei Patienten mit Diabetes mellitus Typ 2 bewirkt die Verabreichung einer oralen Einzeldosis Sitagliptin eine 24-stündige Hemmung der DPP-4-Enzymaktivität, was zu einer Steigerung der Blutspiegel von aktivem GLP-1 und GIP um das 2- bis 3-Fache, zu erhöhten Insulin- und C-Peptid-Konzentrationen im Plasma, zu verringerten Glucagonkonzentrationen, zu verringerter Nüchternglukose und zu einer reduzierten Glukoseexkursion nach einer oralen Glukosegabe oder einer Mahlzeit führt.
In einer Studie an Patienten mit Diabetes mellitus Typ 2, die unter Metformin-Monotherapie nicht ausreichend eingestellt waren, waren die über den Tag beobachteten Blutzuckerwerte bei Patienten, die Sitagliptin 100 mg täglich (50 mg zweimal täglich) in Kombination mit Metformin erhielten, signifikant niedriger im Vergleich zu Patienten, die Placebo mit Metformin bekamen (siehe Abb. 1).
Abbildung 1: 24-Stunden-Plasmaglukoseprofil nach 4wöchiger Behandlung mit Sitagliptin 50 mg BID mit Metformin oder Placebo mit Metformin
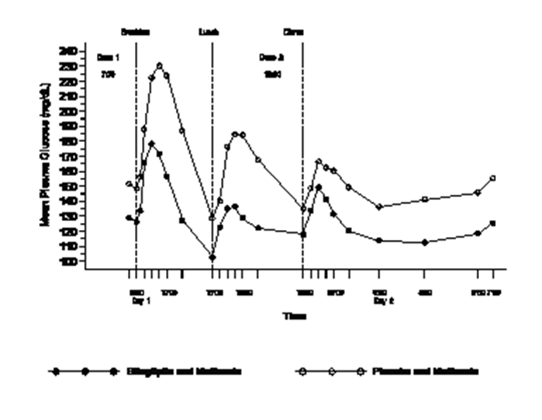
In klinischen Phase-III-Studien mit einer Dauer von 18 und 24 Wochen verbesserte die Behandlung mit Sitagliptin 100 mg täglich bei Patienten mit Diabetes mellitus Typ 2 die Betazellfunktion erheblich, was durch mehrere Marker, einschliesslich HOMA-β (Homeostasis Model Assessment-β) und Proinsulin/Insulin-Quotient, und Messungen der Empfindlichkeit der Betazellen aus dem Mahlzeittoleranztest, mit häufiger Probenahme, bewertet wurde.
In Phase-II-Studien wurde mit Sitagliptin 50 mg zweimal täglich keine zusätzliche glykämische Wirkung im Vergleich zu Sitagliptin 100 mg einmal täglich erzielt.
In einer randomisierten, placebokontrollierten, doppelblinden Double-Dummy, 4-Zeiträume Crossover-Studie bei gesunden erwachsenen Probanden wurden die Auswirkungen auf die Plasmakonzentrationen von aktivem und Gesamt-GLP-1 sowie Glukose nach den Mahlzeiten nach gleichzeitiger Verabreichung von Sitagliptin mit Metformin mit denen nach jeweils zweitägiger Verabreichung von Sitagliptin allein, Metformin allein oder Placebo verglichen. Die inkrementellen gewichteten mittleren Konzentrationen von aktivem GLP-1 vier Stunden nach der Mahlzeit waren nach Verabreichung von Sitagliptin allein oder Metformin allein im Vergleich zu Placebo um etwa das 2-Fache erhöht. Der Effekt auf die aktiven GLP-1-Konzentrationen nach gleichzeitiger Verabreichung von Sitagliptin mit Metformin war additiv, wobei die Konzentrationen von aktivem GLP-1 im Vergleich zu Placebo ungefähr um das 4-Fache anstiegen. Sitagliptin allein erhöhte nur die Konzentrationen von aktivem GLP-1, was die Hemmung von DPP-4 reflektiert, während Metformin allein die Konzentrationen von aktivem und Gesamt-GLP-1 in ähnlichem Umfang erhöhte. Diese Daten stimmen mit verschiedenen Mechanismen für die Erhöhung der Konzentrationen von aktivem GLP-1 überein. Die Ergebnisse der Studie haben ausserdem gezeigt, dass Sitagliptin, jedoch nicht Metformin, die Konzentrationen von aktivem GIP erhöht.
In Studien mit gesunden Probanden führte Sitagliptin nicht zu einer Senkung der Blutzuckerwerte oder zu Hypoglykämie; dies deutet darauf hin, dass die insulinotropen und Glucagon-suppressiven Wirkungen des Medikaments glukoseabhängig sind.
Effekte auf den Blutdruck
In einer randomisierten, placebokontrollierten Crossover-Studie bei Patienten mit Hypertonie unter einem oder mehreren Antihypertensiva (einschliesslich Angiotensin-konvertierende Enzymhemmer, Angiotensin-II-Antagonisten, Calciumkanalblocker, Betablocker und Diuretika) wurde die gleichzeitige Verabreichung mit Sitagliptin im Allgemeinen gut vertragen. Bei diesen Patienten hatte Sitagliptin eine moderate blutdrucksenkende Wirkung; 100 mg Sitagliptin täglich senkte den 24-stündigen mittleren ambulanten systolischen Blutdruck im Vergleich zu Placebo um ca. 2 mmHG. Bei Probanden mit normalem Blutdruck wurden keine Blutdrucksenkungen beobachtet.
Kardiale Elektrophysiologie
In einer randomisierten, placebokontrollierten Crossover-Studie wurde 79 gesunden Probanden eine orale Einzeldosis von Sitagliptin 100 mg, Sitagliptin 800 mg (entspricht dem 8-Fachen der empfohlenen Dosis) oder Placebo verabreicht. Bei der empfohlenen Dosis von 100 mg gab es bei der maximalen Plasmakonzentration oder zu jedem anderen Zeitpunkt während der Studie keinen Effekt auf das QTc-Intervall. Nach der 800-mg-Dosis betrug die maximale Steigerung der durch Placebo korrigierten mittleren Veränderung des QTc-Intervalls gegenüber dem Ausgangswert 3 Stunden nach der Dosisgabe 8,0 ms. Diese geringe Steigerung wurde als klinisch nicht signifikant betrachtet. Bei der 800-mg-Dosis waren die maximalen Sitagliptin-Konzentrationen im Plasma ca. 11-mal höher als die maximalen Konzentrationen nach einer 100-mg-Dosis.
Bei Patienten mit Diabetes mellitus Typ 2, die Sitagliptin 100 mg (N=81) oder Sitagliptin 200 mg (N=63) täglich erhielten, wurden basierend auf den EKG-Daten, die zum Zeitpunkt der erwarteten maximalen Plasmakonzentration erzielt wurden, keine bedeutenden Änderungen des QTc-Intervalls festgestellt.
Klinische Wirksamkeit
Glykämische Kontrollstudien in Patienten mit Diabetes Typ 2
Die Wirksamkeit und Sicherheit von Ertugliflozin in Kombination mit Sitagliptin wurden in 3 multizentrischen, randomisierten, doppelblinden, placebo- und mittels aktivem Vergleichspräparat kontrollierten klinischen Phase-3-Studien bei 1'985 Patienten mit Diabetes mellitus Typ 2 beurteilt. Diese Studien umfassten verschiedene Untergruppen bezüglich Rasse (Weisse, Schwarze, Asiaten und andere) oder Ethnie (Hispanier und Personen anderer ethnischer Zugehörigkeit); die Patienten waren 21 bis 85 Jahre alt.
Die Behandlung mit Ertugliflozin in Kombination mit Sitagliptin führte bei Patienten mit Diabetes mellitus Typ 2 zu einer klinisch und statistisch signifikanten Verbesserung von HbA1c und Nüchternplasmaglukose (FPG) gegenüber Placebo oder einem aktiven Vergleichspräparat.
Bei Patienten mit Diabetes mellitus Typ 2, die mit Ertugliflozin in Kombination mit Sitagliptin behandelt wurden, fiel die Verbesserung des HbA1c in den nach Alter, Geschlecht und ethnischer Zugehörigkeit definierten Teilgruppen allgemein ähnlich aus.
Faktorielle Studie mit Ertugliflozin und Sitagliptin als Add-on-Kombinationstherapie mit Metformin
Insgesamt 1233 Patienten mit Diabetes mellitus Typ 2 nahmen an einer randomisierten, doppelblinden, multizentrischen, 26wöchigen, aktivkontrollierten Studie zur Beurteilung der Wirksamkeit und Sicherheit von Ertugliflozin 5 mg oder 15 mg in Kombination mit Sitagliptin 100 mg im Vergleich zu den jeweiligen Einzelwirkstoffen teil. Patienten mit Diabetes mellitus Typ 2 und unzureichender Einstellung unter einer Metformin-Monotherapie (≥1500 mg/Tag) wurden per Randomisierung einem von fünf aktiven Behandlungsarmen zugewiesen: Ertugliflozin 5 mg oder 15 mg, Sitagliptin 100 mg oder Sitagliptin 100 mg in Kombination mit 5 mg oder 15 mg Ertugliflozin einmal täglich zusätzlich zur fortgeführten Hintergrundtherapie mit Metformin.
In Woche 26 zeigte sich unter Ertugliflozin in Kombination mit Sitagliptin 100 mg eine statistisch signifikante Verbesserung von HbA1c und FPG gegenüber den jeweiligen Einzelwirkstoffen (siehe Tabelle 5). Unter Ertugliflozin in Kombination mit Sitagliptin 100 mg erreichten mehr Patienten ein HbA1c <7% als unter den jeweiligen Einzelwirkstoffen. Die Behandlung mit Ertugliflozin in Kombination mit Sitagliptin 100 mg führte im Vergleich zu Sitagliptin 100 mg zudem zu einer statistisch signifikanten Reduktion des Körpergewichts und systolischen Blutdrucks.
Tabelle 5: Ergebnisse einer faktoriellen Studie mit Ertugliflozin und Sitagliptin als Addon-Kombinationstherapie mit Metformin im Vergleich zu den jeweiligen Einzelwirkstoffen in Woche 26*
|
|
Ertugliflozin 5 mg
|
Sitagliptin 100 mg
|
Ertugliflozin 5 mg + Sitagliptin 100 mg
| |
HbA1c (%)
|
N = 250
|
N = 247
|
N = 243
| |
Wert zu Studienbeginn (Mittel)
|
8,6
|
8,5
|
8,6
| |
Veränderung gegenüber Studienbeginn (LS-Mittel†)
|
-1,0
|
-1,1
|
-1,5
| |
Unterschied gegenüber
Sitagliptin
Ertugliflozin 5 mg
|
|
|
-0,4‡ (-0,6; -0,3)
-0,5‡ (-0,6; -0,3)
| |
(LS-Mittel†, 95%-KI)
|
|
|
| |
Patienten [N (%)] mit HbA1c <7%
|
66 (26,4)
|
81 (32,8)
|
127 (52,3) §
| |
FPG (mg/dl)
|
N = 250
|
N = 247
|
N = 243
| |
Wert zu Studienbeginn (Mittel)
|
184,1
|
177,4
|
183,8
| |
Veränderung gegenüber Studienbeginn (LS-Mittel†)
|
-35,7
|
-25,6
|
-44,0
| |
Unterschied gegenüber
Sitagliptin
Ertugliflozin 5 mg
(LS-Mittel†, 95%-KI)
|
|
|
-18,4‡ (-24,0; -12,8)
-8,2¶ (-13,8; -2,7)
| |
Körpergewicht (kg)
|
N = 250
|
N = 247
|
N = 243
| |
Wert zu Studienbeginn (Mittel)
|
88,6
|
89,8
|
89,5
| |
Veränderung gegenüber Studienbeginn (LS-Mittel†)
|
-2,7
|
-0,7
|
-2,5
| |
Unterschied gegenüber Sitagliptin
(LS-Mittel†, 95%-KI)
|
|
|
-1,8‡ (-2,5; -1,2)
| |
Systolischer Blutdruck (mmHg)
|
N = 250
|
N = 247
|
N = 243
| |
Wert zu Studienbeginn (Mittel)
|
129,7
|
128,3
|
130,2
| |
Veränderung gegenüber Studienbeginn (LS-Mittel†)
|
-3,9
|
-0,7
|
-3,4
| |
Unterschied gegenüber Sitagliptin
(LS-Mittel†, 95%-KI)
|
|
|
-2,8¶ (-4,7; -0,8)
|
* N umfasst alle randomisierten, behandelten Patienten mit mindestens einer Messung der Outcome-Variablen.
† Mittelwerte der kleinsten Quadrate, adjustiert für Zeit, eGFR zu Studienbeginn und Zeit/Behandlung-Interaktion.
‡ p<0,001 im Vergleich zur Kontrollgruppe.
§ p<0,001 im Vergleich zur Kontrollgruppe (basierend auf adjustierten Odds-Ratio-Vergleichen aus einem logistischen Regressionsmodell mit multipler Imputation fehlender Datenwerte).
¶ p≤0,005 im Vergleich zur Kontrollgruppe.
Ertugliflozin als Add-on-Kombinationstherapie mit Metformin und Sitagliptin
Insgesamt 463 Patienten mit Diabetes mellitus Typ 2, der unter Metformin (≥1'500 mg/Tag) und 100 mg Sitagliptin einmal täglich nicht ausreichend eingestellt war, nahmen an einer randomisierten, doppelblinden, multizentrischen, 26wöchigen, placebokontrollierten Studie zur Beurteilung der Wirksamkeit und Sicherheit von Ertugliflozin teil. Die Patienten wurden per Randomisierung einer Behandlung mit Ertugliflozin 5 mg, Ertugliflozin 15 mg oder Placebo einmal täglich zusätzlich zur weitergeführten Hintergrundtherapie mit Metformin und Sitagliptin zugeteilt.
In Woche 26 zeigte sich unter Ertugliflozin eine statistisch signifikante Verbesserung von HbA1c, FPG, Körpergewicht und systolischem Blutdruck gegenüber Placebo. Unter Ertugliflozin erreichte zudem ein grösserer Anteil an Patienten ein HbA1c <7% im Vergleich zu Placebo (siehe Tabelle 6).
Tabelle 6: Ergebnisse einer Add-on-Studie mit Ertugliflozin in Kombination mit Metformin und Sitagliptin in Woche 26*
|
|
Ertugliflozin 5 mg
|
Placebo
| |
HbA1c (%)
|
N = 156
|
N = 153
| |
Wert zu Studienbeginn (Mittel)
|
8,1
|
8,0
| |
Veränderung gegenüber Studienbeginn (LS-Mittel†)
|
-0,8
|
-0,1
| |
Unterschied gegenüber Placebo (LS-Mittel†, 95%-KI)
|
-0,7‡ (-0,9; -0,5)
|
| |
Patienten [N (%)] mit HbA1c <7%
|
50 (32,1)§
|
26 (17,0)
| |
FPG (mg/dl)
|
N = 156
|
N = 153
| |
Wert zu Studienbeginn (Mittel)
|
167,7
|
169,6
| |
Veränderung gegenüber Studienbeginn (LS-Mittel†)
|
-26,9
|
-1,8
| |
Unterschied gegenüber Placebo (LS-Mittel†, 95%-KI)
|
-25,2‡ (-32,8; -17,5)
|
| |
Körpergewicht (kg)
|
N = 156
|
N = 153
| |
Wert zu Studienbeginn (Mittel)
|
87,6
|
86,5
| |
Veränderung gegenüber Studienbeginn (LS-Mittel†)
|
-3,3
|
-1,3
| |
Unterschied gegenüber Placebo (LS-Mittel†, 95%-KI)
|
-2,0‡ (-2,6; -1,4)
|
| |
Systolischer Blutdruck (mmHg)
|
N = 156
|
N = 153
| |
Wert zu Studienbeginn (Mittel)
|
132,1
|
130,2
| |
Veränderung gegenüber Studienbeginn (LS-Mittel†)
|
-3,8
|
-0,9
| |
Unterschied gegenüber Placebo (LS-Mittel†, 95%-KI)
|
-2,9¶ (-5,4; -0,5)
|
|
* N umfasst alle randomisierten, behandelten Patienten mit mindestens einer Messung der Outcome-Variablen.
† Mittelwerte der kleinsten Quadrate, adjustiert für Zeit, vorherige antihyperglykämische Medikation, eGFR zu Studienbeginn und Zeit/Behandlung-Interaktion.
‡ p≤0,001 im Vergleich zu Placebo.
§p<0,001 im Vergleich zu Placebo (basierend auf adjustierten Odds-Ratio-Vergleichen aus einem logistischen Regressionsmodell mit multipler Imputation fehlender Datenwerte).
¶ p<0,05 im Vergleich zu Placebo.
Kardiovaskuläre Ergebnisse bei Patienten mit Diabetes Typ 2 und etablierter kardiovaskulärer Erkrankung (VERTIS-CV Studie)
Ertugliflozin
Die Wirkung von Ertugliflozin auf das kardiovaskuläre Risiko bei erwachsenen Patienten mit Diabetes Typ 2 und etablierten, stabilen, atherosklerotischen kardiovaskulären Erkrankungen wurde in der VERTIS-CV Studie untersucht, einer multizentrischen, multinationalen, randomisierten, doppelblinden, placebokontrollierten, ereignisgesteuerten Studie. In der Studie wurde das Risiko schwerwiegender unerwünschter kardiovaskulärer Ereignisses (MACE) zwischen Ertugliflozin und Placebo verglichen. Beide Gruppen wurden unter der Studie gemäss der aktuellen Therapierichtlinien behandelt.
Insgesamt wurden 8246 Patienten randomisiert (Ertugliflozin 5 mg N=2752, Ertugliflozin 15 mg N=2747 oder Placebo N=2747) und über einen Median von 3 Jahren beobachtet. Etwa 88% der Studienpopulation war kaukasisch, 6% asiatisch und 3% schwarz. Das Durchschnittsalter lag bei 64 Jahren und etwa 70% waren männlich.
Alle Patienten in der Studie hatten zu Studienbeginn einen ungenügend kontrollierten Diabetes mellitus Typ 2 (HbA1c ≥7%). Die mittlere Dauer des Diabetes mellitus Typ 2 betrug 13 Jahre, das mittlere HbA1c zu Studienbeginn betrug 8,2% und die mittlere eGFR 76 ml/min/1,73 m2. Zu Studienbeginn wurden die Patienten mit einem (32%) oder mehreren (67%) Antidiabetika behandelt, darunter Metformin (76%), Insulin (47%), Sulfonylharnstoffe (41%), DPP-4-Inhibitoren (11%) und GLP-1-Rezeptoragonisten (3%).
Fast alle Patienten (99%) hatten zu Studienbeginn eine etablierte atherosklerotische kardiovaskuläre Erkrankung, darunter: eine dokumentierte Vorgeschichte mit koronarer Herzkrankheit (76%), zerebrovaskulärer Erkrankung (23%) oder peripherer Arterienerkrankung (19%). Ungefähr 24% der Patienten hatten eine Vorgeschichte von Herzinsuffizienz (HF). Zu Studienbeginn lag der mittlere systolische Blutdruck bei 133 mmHg, der mittlere diastolische Blutdruck bei 77 mmHg, der mittlere LDL-Wert bei 89 mg/dl und der mittlere HDL-Wert bei 44 mg/dl. Zu Studienbeginn wurden etwa 81% der Patienten mit Inhibitoren des Renin-Angiotensin-Systems, 69% mit Betablockern, 43% mit Diuretika, 82% mit Statinen, 4% mit Ezetimib und 89% mit Thrombozytenaggregationshemmern behandelt.
Primärer Endpunkt der VERTIS-CV Studie war die Zeit bis zum ersten Auftreten eines schwerwiegenden unerwünschten kardiovaskulären Ereignisses (Major Adverse Cardiac Event, MACE). Ein schwerwiegendes unerwünschtes kardiovaskuläres Ereignis wurde definiert als das Auftreten entweder eines kardiovaskulären Todes oder eines nicht-tödlichen Myokardinfarkts (MI) oder eines nicht-tödlichen Schlaganfalls.
Die Inzidenzrate von MACE war zwischen den Ertugliflozin-behandelten und den mit Placebo behandelten Patienten ähnlich. Die geschätzte Hazard Ratio von MACE in Verbindung mit Ertugliflozin im Vergleich zu Placebo betrug 0,97 bei einem Konfidenzintervall von 95,6% (0,85, 1,11). Die obere Grenze dieses Konfidenzintervalls schloss ein Risiko grösser als 1,3 aus. (Tabelle 7). Die Ergebnisse für die einzelnen 5 mg und 15 mg Dosen stimmten mit den Ergebnissen für die kombinierte Dosisgruppe überein.
Tabelle 7: Analyse von MACE und seinen Komponenten und Hospitalisierung bei Herzinsuffizienz aus der VERTIS-CV Studie*
|
|
Placebo (N=2747)
|
Ertugliflozin (N=5499)
|
| |
Endpunkt†
|
N (%)
|
Ereignisrate (pro 100 Personenjahre)
|
N (%)
|
Ereignisrate (pro 100 Personenjahre)
|
Hazard Ratio vs Placebo
(CI) ‡
| |
MACE (KV Tod, nicht-tödlicher MI, od. nicht-tödlicher Schlaganfall)
|
327 (11,9)
|
4,0
|
653 (11,9)
|
3,9
|
0,97
(0,85; 1,11)
| |
Nicht-tödlicher MI
|
148 (5,4)
|
1,6
|
310 (5,6)
|
1,7
|
1,04
(0,86; 1,27)
| |
Nicht-tödlicher Schlaganfall
|
78 (2,8)
|
0,8
|
157 (2,9)
|
0,8
|
1,00
(0,76; 1,32)
| |
KV Tod
|
184 (6,7)
|
1,9
|
341 (6,2)
|
1,8
|
0,92
(0,77; 1,11)
|
N=Anzahl Patienten, CI=Konfidenzintervall, KV=Kardiovaskulär, MI=Myokardinfarkt.
* Intent-to-treat Analysesatz.
† MACE wurde bei Probanden ausgewertet, die mindestens eine Dosis der Studienmedikation einnahmen, und bei Probanden, die die Studienmedikation vor dem Ende der Studie absetzten, zensierte Ereignisse, die mehr als 365 Tage nach der letzten Dosis der Studienmedikation auftraten. Andere Endpunkte wurden unter Verwendung aller randomisierten Probanden und Ereignisse ausgewertet, die zu irgendeinem Zeitpunkt nach der ersten Dosis der Studienmedikation bis zum letzten Kontaktdatum auftraten. Die Gesamtzahl der ersten Ereignisse wurde für jeden Endpunkt analysiert.
‡ Für MACE wird ein CI von 95.6%, für andere Endpunkte ein CI von 95% dargestellt.
Sitagliptin
TECOS Studie
Die TECOS Studie (Trial Evaluating Cardiovascular Outcomes with Sitagliptin) war randomisiert und umfasste 14'671 Patienten in der Intention-to-treat Population mit HbA1c-Werten von ≥6,5 bis 8,0% und nachgewiesener kardiovaskulärer Erkrankung. Die Patienten erhielten entweder Sitagliptin 100 mg täglich (7332) (oder 50 mg täglich, falls der eGFR-Ausgangswert ≥30 und <50 ml/min/1,73 m2 war) oder Placebo (7339), gegeben zusätzlich zur üblichen Therapie mit Zielwerten gemäss regionalen Standards für HbA1c und kardiovaskuläre Risikofaktoren. Patienten mit einer eGFR <30 ml/min/1,73 m2 wurden nicht in die Studie aufgenommen. Die Studie umfasste 2004 Patienten, die ≥75 Jahre alt waren, und 3324 Patienten, die Niereninsuffizienz (eGFR <60 ml/min/1,73 m2) hatten.
Die Patienten in der Sitagliptin-Gruppe erhielten weniger antihyperglykämische Arzneimittel als jene in der Placebo-Gruppe (Hazard Ratio 0,72; 95% KI, 0,68-0,77; p ≤0,001). Zudem war bei Patienten, die bei Studieneintritt nicht unter Insulin waren, das Starten einer chronischen Insulintherapie weniger wahrscheinlich (Hazard-Ratio 0,70; 95% KI, 0,63-0,79; p <0,001).
Der primäre kardiovaskuläre Endpunkt war eine Zusammensetzung des ersten Auftretens von kardiovaskulärem Tod, nicht-tödlichem Myokardinfarkt, nicht-tödlichem Schlaganfall oder Hospitalisierung wegen instabiler Angina pectoris. Sekundäre kardiovaskuläre Endpunkte waren erstes Auftreten von kardiovaskulärem Tod, nicht-tödlichem Myokardinfarkt oder nichttödlichem Schlaganfall; erstes Auftreten der einzelnen Komponenten der primären Zusammensetzung; Gesamtmortalität; und Hospitalisierungen aufgrund von Herzinsuffizienz.
Nach einer medianen Beobachtungszeit von drei Jahren erhöhte sich das Risiko für schwere unerwünschte kardiovaskuläre Ereignisse oder einer Hospitalisierung wegen Herzinsuffizienz nicht, wenn Sitagliptin bei Patienten mit Diabetes mellitus Typ 2 zusätzlich zur üblichen Therapie verabreicht wurde (Tabelle 8).
Tabelle 8: Ergebnisraten für kardiovaskuläre Ereignisse und wichtige sekundäre Ereignisse
|
|
Sitagliptin 100 mg
|
Placebo
|
Hazard Ratio
(95% KI)
|
p-Wert†
| |
N (%)
|
Inzidenz-Rate pro 100 Patientenjahre*
|
N (%)
|
Inzidenz-Rate pro 100 Patientenjahre*
| |
Analyse der Intention-to-Treat Population
| |
Anzahl Patienten
|
7332
|
7339
|
0,98 (0,89–1,08)
|
<0,001
| |
Zusammengesetzter primärer Endpunkt
(Kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt, nicht-tödlicher Schlaganfall oder Hospitalisierung wegen instabiler Angina pectoris)
|
839 (11,4)
|
4,1
|
851 (11,6)
|
4,2
| |
Zusammengesetzter sekundärer Endpunkt
(Kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt oder nicht-tödlicher Schlaganfall)
|
745 (10,2)
|
3,6
|
746 (10,2)
|
3,6
|
0,99 (0,89-1,10)
|
<0,001
| |
Sekundäre Ereignisse
| |
Kardiovaskulärer Tod
|
380 (5,2)
|
1,7
|
366 (5,0)
|
1,7
|
1,03 (0,89-1,19)
|
0,711
| |
Alle Myokardinfarkte (tödlich und nicht-tödlich)
|
300 (4,1)
|
1,4
|
316 (4,3)
|
1,5
|
0,95 (0,81-1,11)
|
0,487
| |
Alle Schlaganfälle (tödlich und nicht-tödlich)
|
178 (2,4)
|
0,8
|
183 (2,5)
|
0,9
|
0,97 (0,79-1,19)
|
0,760
| |
Hospitalisierung wegen instabiler Angina pectoris
|
116 (1,6)
|
0,5
|
129 (1,8)
|
0,6
|
0,90 (0,70-1,16)
|
0,419
| |
Tod jeglicher Ursache
|
547 (7,5)
|
2,5
|
537 (7,3)
|
2,5
|
1,01 (0,90-1,14)
|
0,875
| |
Hospitalisierung wegen Herzinsuffizienz‡
|
228 (3,1)
|
1,1
|
229 (3,1)
|
1,1
|
1,00 (0,83-1,20)
|
0,983
|
* Inzidenz-Rate pro 100 Patientenjahre wurde berechnet als 100 × (totale Anzahl Patienten mit ≥1 Ereignis während der entscheidenden Expositionsperiode pro Total der Patientenjahre der Beobachtung).
† Basierend auf dem Cox-Modell stratifiziert nach Region. Für zusammengesetzte Endpunkte entsprechen die p-Werte einem Nicht-Unterlegenheits-Test, mit dem Ziel zu zeigen, dass die Hazard Ratio kleiner ist als 1,3. Für alle anderen Endpunkte entsprechen die p-Werte einem Test der Differenzen der Hazard Rates.
‡ Die Analyse der Hospitalisierung wegen Herzinsuffizienz wurde angepasst für Vorgeschichte von Herzinsuffizienz bei Studieneintritt.
|

