Eigenschaften/WirkungenATC-Code: J05AX18
Prevymis ist ein antivirales Arzneimittel gegen CMV.
Wirkungsmechanismus
Letermovir ist ein antivirales Arzneimittel gegen CMV.
Letermovir hemmt den Terminase-Komplex der CMV-DNA, der für die virale Replikation erforderlich ist. Biochemische Charakterisierung und Elektronenmikroskopie haben gezeigt, dass Letermovir die Bildung von Genomen mit geeigneter Einheitslänge beeinflusst und die Virion-Reifung beeinträchtigt.
Antivirale Aktivität
Der mittlere EC50-Wert von Letermovir gegen eine Reihe von klinischen CMV-Isolaten in einem Zellkultur-Infektionsmodell betrug 2,1 nM (Spanne 0,7 nM bis 6,1 nM n=74).
Virale Resistenz
In Zellkulturen
Die CMV-Gene UL56 und UL89 kodieren Untereinheiten der CMV-DNA-Terminase. CMV-Mutanten mit reduzierter Empfindlichkeit gegenüber Letermovir sind in Zellkultur selektiert worden. Die Mutationen korrespondieren mit UL56 und treten in Aminosäureresten zwischen 231 und 369 auf (V231A, V231L, V236L, V236M, E237D, L241P, T244K, T244R, L257I, F261C, F261L, F261S, Y321C, C325F, C325R, C325Y, M329T, R369G, R369M, R369S). Die EC50-Werte für diese Mutationen sind um das 13- bis 5'870-Fache höher als beim Wildtyp-Referenzvirus. Es korrespondieren keine bekannten Letermovir-Resistenzmutationen mit UL89.
In klinischen Studien
In einer Phase-2b-Studie zur Beurteilung von Letermovir-Dosen von 60, 120 oder 240 mg/Tag oder Placebo über einen Zeitraum von bis zu 84 Tagen bei 131 HSZT-Empfängern wurde eine DNA-Sequenzanalyse einer ausgewählten UL56-Region (Aminosäuren 231 bis 369) an Proben von 12 mit Letermovir behandelten Studienteilnehmern durchgeführt, bei denen es zu Prophylaxeversagen kam und von denen Proben zur Analyse verfügbar waren. Bei einem Studienteilnehmer (der 60 mg/Tag erhielt) lag eine Letermovir-resistente Genotyp-Variante (GV) (V236M) vor.
In einer Phase-3-Studie (P001) wurde eine DNA-Sequenzanalyse der gesamten kodierenden Regionen von UL56 und UL89 an Proben von 22 mit Letermovir behandelten Patienten der FAS-Population durchgeführt, bei denen es zu Prophylaxeversagen kam und von denen Proben zur Analyse verfügbar waren. Bei einem Patienten lag eine Letermovir-resistente GV (V236M) vor.
Kreuzresistenz
Eine Kreuzresistenz mit Arzneimitteln ausserhalb dieser Klasse ist nicht wahrscheinlich. Letermovir ist voll wirksam gegen Viruspopulationen mit Substitutionen, die Resistenz gegen CMV-DNA-Polymerase-Hemmer (Ganciclovir, Cidofovir und Foscarnet) verleihen. Diese DNA-Polymerase-Hemmer sind voll wirksam gegen Viruspopulationen mit Substitutionen, die Resistenz gegen Letermovir verleihen.
Pharmakogenomik
Die Auswirkung genetischer Varianten im OATP1B1-Gen SLCO1B1 (rs4149056, rs2306283, rs4149032) und UGT1A1 (rs4148323 und Promoter-TA-Repeat-Varianten) auf die Pharmakokinetik von Letermovir wurde bei 299 Studienteilnehmern beurteilt. Klinisch relevante Auswirkungen dieser Varianten auf die Letermovir-Expositionen lagen nicht vor.
Kardiale Elektrophysiologie
Die Auswirkung von Letermovir-Dosen bis zu 960 mg i.v. auf das QTc-Intervall wurde in einer randomisierten, sowohl Placebo- als auch aktiv (Moxifloxacin 400 mg oral) kontrollierten, vierphasigen Einzeldosis-Crossover-Studie zur QT-Zeit an 38 gesunden Probanden untersucht. Letermovir verlängert das QTc-Intervall nicht in klinisch relevantem Umfang nach der i.v.-Dosis von 960 mg mit Plasmakonzentrationen, die etwa doppelt so hoch sind wie bei der i.v.-Dosis von 480 mg.
Klinische Wirksamkeit und Sicherheit
Erwachsene CMV-seropositive Empfänger [R+] eines allogenen hämatopoetischen Stammzelltransplantats
Zur Beurteilung der Letermovir-Prophylaxe als Präventionsstrategie gegen eine CMV-Infektion oder -Erkrankung wurde die Wirksamkeit von Letermovir in einer multizentrischen, doppelblinden, placebokontrollierten Phase-3-Studie (P001) mit erwachsenen CMV-seropositiven Empfängern [R+] eines allogenen HSZT untersucht. Die Patienten erhielten per Randomisierung (2:1) oder Placebo. Die Randomisierung war nach Studienzentrum und Risiko einer CMV-Reaktivierung (hoch gegenüber niedrig) bei Eintritt in die Studie stratifiziert. Die Letermovir-Therapie wurde nach HSZT (Tag 0-28 nach der Transplantation) eingeleitet und bis Woche 14 nach der Transplantation fortgesetzt. Letermovir wurde entweder oral oder i.v. verabreicht. Bis Woche 24 nach der Transplantation wurden die Patienten im Hinblick auf den primären Wirksamkeitsendpunkt überwacht; bis Woche 48 nach der Transplantation wurde eine kontinuierliche Nachbeobachtung durchgeführt.
Von den 565 behandelten Patienten erhielten 373 Letermovir (einschliesslich 99 Patienten, die mindestens eine i.v.-Dosis erhielten) und 192 Placebo (einschliesslich 48 Patienten, die mindestens eine i.v.-Dosis erhielten). Die mediane Zeit bis zum Beginn der Letermovir-Behandlung betrug 9 Tage nach der Transplantation. Bei 37% der Patienten war das Einwachsen der Stammzellen (Engraftment) zu Studienbeginn erfolgt. Das mediane Alter betrug 54 Jahre (Spanne 18 bis 78 Jahre). Zu Studienbeginn erhielten 50% der Patienten eine myeloablative Therapie, 52% bekamen Cyclosporin und 42% Tacrolimus. Die häufigsten primären Gründe für die Transplantation waren akute myeloische Leukämie (38%), myeloblastisches Syndrom (15%) und Lymphom (13%). Zwölf Prozent (12%) der Patienten waren zu Studienbeginn positiv auf CMV-DNA getestet.
Zu Studienbeginn bestand bei 31% der Patienten ein hohes Risiko einer Reaktivierung, definiert durch mindestens eines der folgenden Kriterien: Humanes-Leukozytenantigen-(HLA-)verwandter Spender (Bruder oder Schwester) mit mindestens einem Mismatch an einem der folgenden drei HLA-Genloci: HLA-A, -B oder -DR, haploidentischer Spender; nicht verwandter Spender mit mindestens einem Mismatch an einem der folgenden vier HLA-Genloci: HLA-A, -B, -C und -DRB1; Verwendung von Nabelschnurblut als Stammzellquelle; Verwendung von Ex-vivo-T-Zellerschöpften Transplantaten; Graft-versus-Host-Krankheit (GVHD) Grad 2 oder höher, die systemische Kortikosteroide erforderlich machte.
Wirksamkeit
Klinisch signifikante CMV-Infektion
Der primäre Wirksamkeitsendpunkt von P001 war das Auftreten einer klinisch signifikanten CMV-Infektion bis Woche 24 nach der Transplantation. Als klinisch signifikante CMV-Infektion wurde entweder das Auftreten einer CMV-Endorgan-Erkrankung oder die Einleitung einer präemptiven Therapie (PET) gegen CMV aufgrund einer dokumentierten CMV-Virämie (unter Verwendung des Roche COBAS AmpliPrep/COBAS TaqMan Assay,.
Letermovir zeigte in der Analyse des primären Endpunkts eine überlegene Wirksamkeit gegenüber Placebo, wie in Tabelle 3 dargestellt. Der geschätzte Behandlungsunterschied von -23,5% war statistisch signifikant (einseitiger p-Wert <0,0001).
Tabelle 3: P001: Wirksamkeitsergebnisse bei HSZT-Empfängern (NC=F-Ansatz, FAS-Population)
|
|
Letermovir
|
Placebo
| |
|
(N=325)
|
(N=170)
| |
Parameter
|
n (%)
|
n (%)
| |
Primärer Endpunkt
(Anteil der Patienten mit Prophylaxeversagen)
|
122 (37,5)
|
103 (60,6)
| |
Gründe für Versagen†
|
|
| |
Klinisch signifikante CMV-Infektion bis Woche 24‡
|
57 (17,5)
|
71 (41,8)
| |
Einleitung der präemptiven Therapie auf Basis der dokumentierten CMV-Virämie
|
52 (16,0)
|
68 (40,0)
| |
CMV-Endorganerkrankung
|
5 (1,5)
|
3 (1,8)
| |
Vor Woche 24 aus Studie ausgeschieden
|
56 (17,2)
|
27 (15,9)
| |
Fehlendes Outcome in Besuchsfenster Woche 24
|
9 (2,8)
|
5 (2,9)
| |
Stratum-adjustierter Behandlungsunterschied (Letermovir-Placebo)§
|
|
| |
Unterschied (95%-KI)
|
-23,5 (-32,5; -14,6)
|
| |
p-Wert
|
<0,0001
|
| |
† Die Kategorien für das Versagen schliessen sich gegenseitig aus und beruhen auf der Hierarchie der Kategorien in der aufgeführten Reihenfolge.
‡ Eine klinisch signifikante CMV-Infektion wurde definiert als CMV-Endorganerkrankung oder Einleitung einer präemptiven Therapie auf Basis einer dokumentierten CMV-Virämie und des klinischen Zustands des Patienten.
§ 95%-KIs und p-Wert für die Behandlungsunterschiede im prozentualen Ansprechen wurden unter Verwendung der Stratum-adjustierten Mantel-Haenszel-Methode berechnet, wobei der Unterschied nach dem harmonischen Mittelwert der Stichprobengrösse je Arm für jede Schicht (hohes oder niedriges Risiko) gewichtet wurde. Zur Erklärung der statistischen Signifikanz wurde ein einseitiger p-Wert von ≤0,0249 verwendet.
Hinweis: FAS= komplettes Analyse-Set; FAS umfasst die randomisierten Patienten, die mindestens eine Dosis des Studienmedikaments erhalten haben; ausgeschlossen sind Patienten mit nachweisbarer CMV-DNA zu Studienbeginn. Ansatz für die Behandlung fehlender Werte: Ansatz Abbruch=Versagen (Non-Completer=Failure - NC=F). Bei dem NC=F-Ansatz wurde Versagen definiert als alle Patienten, die eine klinisch signifikante CMV-Infektion entwickelten oder vorzeitig aus der Studie ausschieden oder bei denen bis zum Besuchsfenster in Woche 24 nach der Transplantation kein Outcome vorlag.
N = Anzahl der Patienten in jeder Behandlungsgruppe.
n (%) = Anzahl (Prozent) der Patienten in jeder Unterkategorie.
|
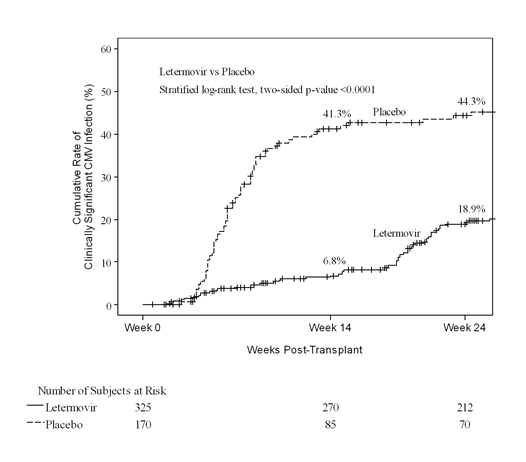
In Woche 24 nach der Transplantation betrug die Kaplan-Meier-(KM)-Ereignisrate für klinisch signifikante CMV-Infektion 18,9% in der Letermovir-Gruppe im Vergleich zu 44,3% in der Placebo-Gruppe (nomineller zweiseitiger stratifizierter Log-Rank-p-Wert <0,0001) (siehe Abb. 1). Die folgenden Faktoren standen bei den mit Letermovir behandelten Patienten mit einer klinisch signifikanten CMV-Infektion zwischen Woche 14 und Woche 24 nach der Transplantation in Zusammenhang:
·hohes Risiko einer CMV-Reaktivierung zu Studienbeginn,
·bestehende GVHD, und
·Anwendung eines Steroids zu irgendeinem Zeitpunkt nach der Randomisierung.
Abb. 1: P001: Kaplan-Meier-Plot der Zeit bis zum Beginn einer klinisch signifikanten CMV-Infektion bis Woche 24 nach der Transplantation bei HSZT-Empfängern (FAS-Population)
Im Hinblick auf die Wirksamkeit war Letermovir in allen Untergruppen, einschliesslich der folgenden, deutlich vorteilhafter:
·geringes oder hohes Risiko einer CMV-Reaktivierung,
·Konditionierungstherapien, und
·Begleittherapien mit Immunsuppressiva.
Mortalität
Die KM-Ereignisrate für die Gesamtmortalität in der Letermovir- gegenüber der Placebo-Gruppe betrug 12,1% gegenüber 17,2% in Woche 24 nach der Transplantation (nomineller zweiseitiger stratifizierter Log-Rank-p-Wert = 0,0401) bzw. 23,8% gegenüber 27,6% in Woche 48 nach der Transplantation (nomineller zweiseitiger stratifizierter Log-Rank-p-Wert = 0,2117). Die K-M-Ereignisrate für die Gesamtmortalität nach Geschlecht (Männer vs. Frauen) in der Woche 24 nach der Transplantation betrug 16,4% und 6,6% in der Letermovir-Gruppe und lag bei 14,2% und 25,4% in der Placebo-Gruppe; diese nach Geschlecht aufgeschlüsselten Ereignisraten sind mit Vorsicht zu interpretieren, da die Randomisierung nicht nach Geschlecht stratifiziert wurde, was bei Baseline zu Ungleichgewichten beim geschlechtsspezifischen Mortalitätsrisiko zwischen den Behandlungsgruppen führte.
|

