Eigenschaften/WirkungenATC-Code
N06AX27
Wirkungsmechanismus
Esketamin, das S-Enantiomer von racemischem Ketamin, ist ein Antidepressivum mit neuem Wirkungsmechanismus. Es ist ein nicht-selektiver, nicht-kompetitiver Antagonist des Rezeptors für N-Methyl-D-aspartat (NMDA), eines ionotropen Glutamat-Rezeptors.
Von den vermuteten ätiologisch beitragenden Faktoren der Depression einschliesslich Stress und anderen Bedingungen weiss man, dass sie eine strukturelle und funktionelle Beeinträchtigung von Synapsen in Hirnregionen verursachen, die an der Regulierung von Stimmung und emotionalem Verhalten beteiligt sind. Gemäss Hinweisen in der Literatur bewirkt Esketamin durch Antagonismus zum NMDA-Rezeptor einen vorübergehenden Anstieg der Freisetzung von Glutamat, was zu vermehrter Stimulation des α-Amino-3-Hydroxy-5-Methyl-4-Isoxazolpropionsäure (AMPAR)-Rezeptors führt und nachfolgend zur vermehrten Produktion neurotropher Signale, welche die synaptische Funktion in diesen Hirnarealen wiederherstellen. Im Unterschied zu anderen antidepressiven Therapien kommen Monoamin-, GABA- oder Opioid-Rezeptoren bei der primären antidepressiven Wirkung von Esketamin nicht direkt ins Spiel.
Pharmakodynamik
Siehe unter Wirkungsmechanismus.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit von Spravato Nasenspray beurteilte man anfänglich in fünf klinischen Phase-3-Studien (TRD3001, TRD3002, TRD3003, TRD3004 und TRD3005) an erwachsenen Patienten (18-86 Jahre) mit TRD, welche die Kriterien einer MDD nach DSM-5 erfüllten und die in der gegenwärtigen depressiven Episode auf mindestens zwei orale Antidepressiva adäquater Dosierung und Dauer nicht angesprochen hatten (Non-Responder). 1833 erwachsene Patienten wurden in die Studien aufgenommen, davon erhielten 1601 Spravato. Darüber hinaus wurden 202 Patienten in die Phase-2-Studie TRD2005 in Japan randomisiert (von denen 122 Patienten Spravato erhielten), 252 Patienten wurden in die Phase-3-Studie TRD3006 hauptsächlich in China randomisiert (von denen 126 Patienten Spravato erhielten), und 676 Patienten wurden in die Phase-3-Studie TRD3013 randomisiert (von denen 334 Patienten Spravato erhielten).
Therapieresistente Depression (TRD) – kurzdauernde Studien
Spravato wurde in drei randomisierten, doppelblinden, multizentrischen, kurzdauernden (4 Wochen) Phase-3-Studien mit aktiver Kontrolle bei Patienten mit TRD beurteilt. Die Studien TRANSFORM-1 (TRD3001) und TRANSFORM-2 (TRD3002) wurden bei Erwachsenen (18 bis <65 Jahre) und die Studie TRANSFORM-3 (TRD3005) bei Erwachsenen ≥65 Jahren durchgeführt. Die Patienten in den Studien TRD3001 und TRD3002 begannen an Tag 1 der Behandlung mit Spravato 56 mg in Kombination mit einem neu initiierten, täglich einzunehmendem oralen AD oder einem Placebo-Nasenspray in Kombination mit einem neu initiierten, täglich einzunehmendem oralen AD. Im Verlauf der 4-wöchigen doppelblinden Induktionsphase erhielten die Patienten zweimal wöchentlich entweder unverändert Spravato 56 mg oder die Dosis wurde auf 84 mg Spravato oder entsprechendes Placebo-Nasenspray hochtitriert. Spravato Dosen von 56 mg oder 84 mg wurden in Studie TRD30001 mit fixer Dosierung und in Studie TRD3002 mit flexibler Dosierung gegeben. In der Studie TRD3005 begannen Patienten ≥65 Jahre an Tag 1 der Behandlung mit Spravato 28 mg in Kombination mit einem neu initiierten, täglich einzunehmendem oralen AD oder Placebo-Nasenspray in Kombination mit einem neu initiierten, täglich einzunehmendem oralen AD. Im Verlauf der vierwöchigen doppelblinden Induktionsphase wurde die Dosis von Spravato oder Placebo-Nasenspray auf 56 mg oder 84 mg zweimal wöchentlich hochtitriert. In den Studien mit flexibler Dosierung (TRD3002 und TRD3005) wurde die Dosis Spravato basierend auf der klinischen Beurteilung hochtitriert, konnte basierend auf der Verträglichkeit jedoch auch heruntertitriert werden. In allen Studien wurde an Tag 1 eine unverblindete Therapie mit einem oralen AD (SNRI: Duloxetin, Venlafaxin retard; SSRI: Escitalopram, Sertralin) neu initiiert. Die Wahl der neu initiierten oralen AD-Therapie wurde vom Studienarzt in Abhängigkeit von der individuellen Behandlungshistorie des Patienten getroffen. In allen Kurzzeitstudien war der primäre Wirksamkeitsendpunkt die Veränderung des MADRS-Gesamtscores vom Beginn der Studie (Baseline) bis Tag 28.
Die demografischen und die krankheitsbezogenen Baseline-Merkmale für Patienten in TRD3002, TRD3001 und TRD3005 sind in Tabelle 3 aufgeführt.
Tabelle 3: Demografische Baseline-Merkmale für TRD3002, TRD3001 und TRD3005 (komplette Analyse-Sets)
|
|
Studie TRD3002
(n = 223)
|
Studie TRD3001
(n = 342)
|
Studie TRD3005
(n = 137)
| |
Alter, Jahre
| |
Median (Spannweite)
|
47,0 (19; 64)
|
47,0 (18; 64)
|
69,0 (65; 86)
| |
Geschlecht, n (%)
| |
Männlich
|
85 (38,1%)
|
101 (29,5%)
|
52 (38,0%)
| |
Weiblich
|
138 (61,9%)
|
241 (70,5%)
|
85 (62,0%)
| |
Ethnische Zugehörigkeit, n (%)
| |
Weiss
|
208 (93,3%)
|
262 (76,6%)
|
130 (94,9%)
| |
Schwarz oder afroamerikanisch
|
11 (4,9%)
|
19 (5,6%)
|
--
| |
Vorangegangene orale AD-Therapie ohne Therapieansprechen (d.h. Therapieversagen)
| |
Anzahl vorangegangener AD-Therapien, n (%)
| |
2
|
136 (61,0%)
|
167 (48,8%)
|
68 (49,6%)
| |
3 oder mehr
|
82 (36,8%)
|
167 (48,8%)
|
58 (42,3%)
| |
Am Tag der Randomisierung neu initiiertes orales AD, n (%)
| |
SNRI
|
152 (68,2%)
|
196 (57,3%)
|
61 (44,5%)
| |
SSRI
|
71 (31,8%)
|
146 (42,7%)
|
76 (55,5%)
| |
Aus der Studie ausgeschieden (aus beliebigen Gründen), n/N (%)
|
30/227 (13,2%)
|
31/346 (9,0%)
|
16/138 (11,6%)
|
In Studie TRD3002 mit flexibler Dosierung erhielten 67% der auf Spravato randomisierten Patienten an Tag 28 eine Dosis von 84 mg. In Studie TRD3002 zeigte Spravato in Kombination mit einem neu initiierten oralen AD eine statistische Überlegenheit gegenüber Placebo-Nasenspray in Kombination mit einem neu initiierten oralen AD (SNRI: Duloxetin, Venlafaxin retard; SSRI: Escitalopram, Sertralin) (Tabelle 4); weiterhin wurde bereits 24 Stunden nach der Anwendung eine Symptomreduktion beobachtet.
In Studie TRD3001 zeigte die therapeutische Wirkung (definiert als Veränderung des MADRS-Gesamtscores gegenüber Baseline am Ende der 4-wöchigen Induktionsphase) für Spravato 84 mg in Kombination mit einem neu initiierten oralen AD keine statistische Signifikanz versus Placebo-Nasenspray in Kombination mit dem oralen AD (SNRI: Duloxetin, Venlafaxin retard; SSRI: Escitalopram, Sertralin) beobachtet (Tabelle 4).
In Studie TRD3005 erhielten 64% der auf Spravato randomisierten Patienten an Tag 28 eine Dosis von 84 mg, 25% eine Dosis von 56 mg und 10% eine Dosis von 28 mg. In Studie TRD3005 zeigte der therapeutische Effekt (definiert als Veränderung des MADRS-Gesamtscores gegenüber Baseline am Ende der 4-wöchigen Induktionsphase) für Spravato in Kombination mit einem neu initiierten AD keine statistische Signifikanz versus Placebo-Nasenspray in Kombination mit dem oralen AD (SNRI: Duloxetin, Venlafaxin retard; SSRI: Escitalopram, Sertralin) (Tabelle 4). Subgruppenanalysen deuten auf eine verminderte Wirksamkeit in der Patientengruppe über 75 Jahre hin.
Tabelle 4: Ergebnisse nach Woche 4 der klinischen Studien bezogen auf den primären Wirksamkeitsendpunkt Veränderung des MADRS-Gesamtscores (ANCOVA LOCF)
|
Nr. der Studie
|
Behandlungsgruppe§
|
Patientenzahl
|
Mittlerer Baselinewert (SD)
|
LSM Veränderung am Ende von Woche 4 versus Baseline (SE)
|
LSM Differenz (95% KI)†
|
2-seitiger p-Wert
| |
TRD3001
|
Spravato 56 mg + orales AD
|
115
|
37,4 (4,8)
|
-18,7 (1,3)
|
-4,1
(-7,5, -0,6)#
|
N/Aδ
| |
Spravato 84 mg + orales AD
|
114
|
37,8 (5,6)
|
-17,3 (1,3)
|
-2,0
(-5,5, 1,4)#
|
0,250
| |
Placebo-Nasenspray + orales AD
|
113
|
37,5 (6,2)
|
-14,8 (1,3)
|
|
| |
TRD3002
|
Spravato (56 mg oder 84 mg) + orales AD
|
114
|
37,0 (5,7)
|
-18,0 (1,3)
|
-3,5
(-6,7, -0,3)‡
|
0,034‡
| |
Placebo-Nasenspray + orales AD
|
109
|
37,3 (5,7)
|
-14,5 (1,3)
|
|
| |
TRD3005 (≥65 Jahre)
|
Spravato (28 mg, 56 mg oder 84 mg) + orales AD
|
72
|
35,5 (5,9)
|
-10,9 (1,7)
|
-3,6
(-7,2, -0,03)#
|
0,052
| |
Placebo-Nasenspray + orales AD
|
65
|
34,8 (6,4)
|
-6,9 (1,7)
|
|
| |
SD = Standardabweichung (Standard Deviation), SE = Standardfehler (Standard Error), LSM = geschätzter Randmittelwert (Least Square Means), KI = Konfidenzintervall, AD = Antidepressivum
§ Nasal angewendetes Esketamin oder Placebo; orales AD = Standard (ein neu initiiertes AD)
† Differenz (Spravato + orales AD minus Placebo-Nasenspray + orales AD) der LSM-Veränderung versus Baseline
‡ Behandlungsgruppe, die der Behandlung mit Placebo-Nasenspray + orales AD statistisch signifikant überlegen war
# Medianer erwartungstreuer Schätzer (d. h. gewichtete Kombination der LSM-Differenz von Placebo-Nasenspray + orales AD) und flexibles 95 % Konfidenzintervall
δ Da 84 mg statistisch nicht signifikant war, ist der p-Wert für den Vergleich von Spravato 56 mg + orales AD versus Placebo + orales AD aufgrund der Testhierarchie nicht dargestellt.
|
Zeitlicher Verlauf des Ansprechens auf die Behandlung
In der Studie TRD3002 beobachtete man eine antidepressive Wirkung von Spravato mit Verringerung der depressiven Symptomatik bereits 24 Stunden nach Verabreichung der ersten Dosis. Es kam zu einer zunehmenden Besserung in den nachfolgenden Wochen mit Erreichen der vollen antidepressiven Wirkung von Spravato am Tag 28. Die mittlere Änderung des MADRS-Gesamtscores für flexibel dosiertes Spravato (56 mg oder 84 mg) plus orales AD war zu allen Zeitpunkten (Wochen 1, 2, 3 und 4) konsistent grösser als für orales AD plus nasal verabreichtes Placebo. Am Tag 28 erhielten 67% der randomisierten Patienten, die mit Spravato behandelt wurden, 84 mg. Ein einheitlicher Behandlungseffekt wurde in den Studien TRD3001 und TRD3005 beobachtet.
Therapeutisches Ansprechen und Remissionsraten
Therapeutisches Ansprechen war definiert als Abnahme des MADRS-Gesamtscores um ≥50% gegenüber dem Ausgangswert (Basislinie) in der Induktionsphase. Auf der Grundlage der Abnahme des MADRS-Gesamtscores gegenüber der Basislinie war während der gesamten 4-wöchigen doppelblinden Induktionsphase der Anteil Patienten in den Studien TRD3001, TRD3002 und TRD3005, die auf die Behandlung mit Spravato plus orales AD ansprachen, grösser als mit oralem AD plus Placebo-Nasenspray (Tabelle 5).
Remission war definiert als MADRS-Gesamtscore ≤12. In allen drei Studien war am Ende der 4-wöchigen doppelblinden Induktionsphase ein grösserer Anteil der mit Spravato plus orales AD behandelten Patienten in Remission als mit oralem AD plus Placebo-Nasenspray (Tabelle 5).
Tabelle 5: Ansprech- und Remissionsraten in 4-wöchigen klinischen Studien aufgrund der LOCF-Daten
|
Studie Nr.
|
Behandlungsgruppe§
|
Zahl der Patienten (%)
| |
Ansprechrate†
|
Remissions-rate‡
| |
24
Stunden
|
Woche 1
|
Woche 2
|
Woche 3
|
Woche 4
|
Woche 4
| |
TRD3001
|
Spravato 56 mg +
orales AD
|
20
(19,0%)
|
21
(18,3%)
|
30
(26,1%)
|
52
(45,2%)
|
61
(53,0%)
|
40
(34,8%)
| |
Spravato 84 mg +
orales AD
|
17
(16,3%)#
|
16
(14,3%)
|
26
(23,2%)
|
35
(31,0%)
|
54
(47,8%)
|
40
(35,4%)
| |
Orales AD + Placebo-Nasenspray
|
8
(7,9%)
|
5
(4,4%)
|
15
(13,3%)
|
27
(23,9%)
|
42
(37,2%)
|
33
(29,2%)
| |
TRD3002
|
Spravato 56 mg oder 84 mg + orales AD
|
18
(16,5%)
|
15
(13,4%)
|
29
(25,9%)
|
54
(48,2%)
|
71
(63,4%)
|
54
(48,2%)
| |
Orales AD + Placebo-Nasenspray
|
11
(10,8%)
|
13
(11,9%)
|
23
(21,1%)
|
36
(33,0%)
|
54
(49,5%)
|
33
(30,3%)
| |
TRD3005
(≥65 Jahre)
|
Spravato 28 mg, 56 mg oder 84 mg + orales AD
|
NA
|
4
(6,1%)
|
4
(5,6%)
|
9
(12,7%)
|
17
(23,9%)
|
11
(15,5%)
| |
Orales AD + Placebo-Nasenspray
|
NA
|
3
(4,8%)
|
8
(12,5%)
|
10
(15,6%)
|
8
(12,5%)
|
4
(6,3%)
| |
AD = Antidepressivum; NA = keine Daten (not available)
§ Nasal verabreichtes Spravato oder Placebo; orales AD = Behandlungsstandard (neu initiiertes AD)
† Ansprechen war definiert als Abnahme des MADRS-Gesamtscores um ≥50% ab Basislinie
‡ Remission war definiert als MADRS-Gesamtscore ≤12
# Die erste Dosis war Spravato 56 mg + orales AD
|
Langzeitdaten
Therapieresistente Depression (TRD) - Langzeitstudien
Studie TRD3003 (SUSTAIN-1) - Studie zur Rezidivprophylaxe
SUSTAIN-1 (TRD3003) war eine randomisierte, doppelblinde, multizentrische Langzeitstudie zur Rezidivprophylaxe in parallelen Gruppen mit aktiver Kontrolle. Insgesamt wurden 705 Patienten in die Studie aufgenommen, wobei 437 Patienten direkt rekrutiert wurden und 150 Patienten aus der Studie TRD3001 und 118 Patienten aus der Studie TRD3002 aufgenommen wurden. Die direkt in die Studie aufgenommenen Patienten wurden mit Spravato (56 mg oder 84 mg zweimal wöchentlich) plus einem oralen AD in einer 4-wöchigen offenen (nicht verblindeten) Induktionsphase behandelt. Patienten, die auf die Behandlung ansprachen [Abnahme des MADRS-Gesamtscores um ≥50% gegenüber dem Ausgangswert (Basislinie)] setzten die Behandlung mit Spravato plus einem oralen AD in einer 12-wöchigen Optimierungsphase fort. Am Ende der offenen Induktionsphase waren 52% der Patienten in Remission (MADRS-Gesamtscore ≤12) und 66% der Patienten waren Responder (≥50% Verbesserung des MADRS-Gesamtscores). Insgesamt begannen 455 mit Esketamin behandelte Patienten die nachfolgende Optimierungsphase; Patienten in stabiler Remission oder mit stabilem Ansprechen wurden randomisiert eingeteilt, die Behandlung mit Spravato fortzusetzen oder Spravato abzusetzen und zu Placebo-Nasenspray zu wechseln. Nach den ersten 16 Behandlungswochen mit Spravato plus orales AD waren 176 Patienten (39%) in stabiler Remission und 121 Patienten (27%) in stabilem Ansprechen (aber nicht in stabiler Remission). Stabile Remission war definiert als MADRS-Gesamtscore ≤12 in mindestens 3 der letzten 4 Wochen der Optimierungsphase, und stabiles Ansprechen war definiert als Abnahme des MADRS-Gesamtscores um ≥50% seit der Basislinie in den letzten 2 Wochen der Optimierungsphase, aber nicht in stabiler Remission.
Die Ausgangswerte (Basisline) der demographischen Daten und Krankheitsmerkmale der randomisiert in die doppelblinde Erhaltungsphase aufgenommenen Patienten waren in beiden Gruppen vergleichbar; das mediane Alter der Patienten betrug 48 (19-64) Jahre, 66% waren weiblich und 90% kaukasischer Abstammung.
Stabile Remission
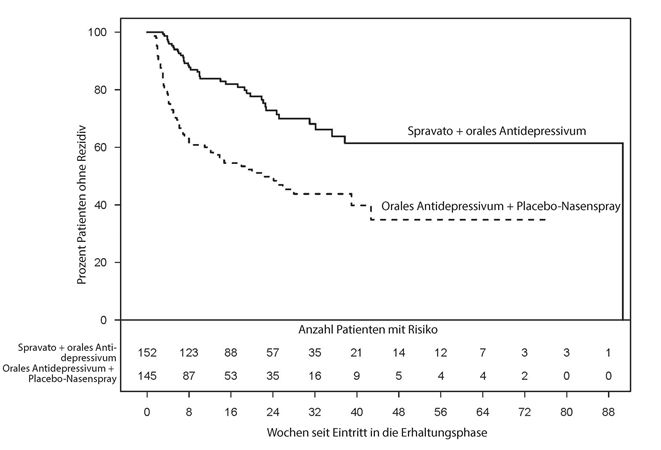
Bei den Patienten in stabiler Remission, welche die Behandlung mit Spravato plus orales AD fortsetzten, war die Zeit bis zum Rezidiv der depressiven Symptome statistisch signifikant länger als bei Patienten in der Kontrollgruppe (orales AD plus Placebo-Nasenspray). Rezidiv wurde definiert als ein MADRS-Gesamtscore ≥22 während zwei aufeinanderfolgenden Wochen oder Hospitalisierung wegen sich verschlechternder Depression oder ein sonstiges klinisch relevantes Ereignis als Hinweis auf ein Rezidiv. Die mediane Zeit bis zum Rezidiv betrug in der Kontrollgruppe (orales AD plus Placebo-Nasenspray) 273 Tage, wohingegen der Median für Spravato plus orales AD nicht schätzbar war, da diese Gruppe zu keinem Zeitpunkt während der Studie eine 50%ige Rezidivrate erreichte.
Für Patienten in stabiler Remission betrug die geschätzte Hazard Ratio [Risikoquotient] (95%-Vertrauensintervall) von Spravato in Kombination mit oralem AD relativ zur Kontrollgruppe (orales AD plus Placebo-Nasenspray) auf der Grundlage gewichteter Schätzungen 0,49 (95%-Vertrauensintervall 0,29, 0,84), p=0.003. Dies bedeutet, dass Patienten in stabiler Remission, welche die Behandlung in der Gruppe Spravato plus orales AD fortsetzten, eine durchschnittlich 51%ige geringere Wahrscheinlichkeit für ein Rezidiv hatten als Patienten, die zur Kontrollgruppe (orales AD plus Placebo-Nasenspray) wechselten.
Stabiles Ansprechen
Die Wirksamkeitsresultate waren auch übereinstimmend bei Patienten mit stabilem Ansprechen, welche die Behandlung mit Spravato plus orales AD fortsetzten; bei ihnen war die Zeit bis zum Rezidiv der depressiven Symptomatik statistisch signifikant länger als bei Patienten in der Kontrollgruppe (orales AD plus Placebo-Nasenspray). Die mediane Zeit bis zum Rezidiv betrug 88 Tage in der Kontrollgruppe und 635 Tage in der mit Spravato behandelten Gruppe.
Bei Patienten mit stabilem Ansprechen betrug die geschätzte Hazard Ratio [Risikoquotient] (95%-Vertrauensintervall) von Spravato in Kombination mit oralem AD relativ zur Kontrollgruppe (orales AD plus Placebo-Nasenspray) auf der Grundlage des Cox-Proportional-Hazards-Modells 0,3 (95%-Vertrauensintervall 0,16, 0,55). Dies bedeutet, dass Patienten, die stabile Responder waren und die Behandlung in der Gruppe Spravato in Kombination mit oralem AD fortsetzten, eine durchschnittlich 70%ige geringere Wahrscheinlichkeit für einen Rezidiv hatten als Patienten, die zur Kontrollgruppe (orales AD plus Placebo-Nasenspray) wechselten.
In Abbildung 1 ist der kumulative Anteil der Patienten unter denjenigen mit stabiler Remission und denjenigen mit stabilem Ansprechen (kombiniert aus Studie TRD3003) gezeigt, die Rezidiv-frei blieben.
Abbildung 1: Dauer des Zeitraums bis zum Eintreten eines Rezidivs bei Patienten mit stabilem Ansprechen und in stabiler Remission in Studie TRD3003
Häufigkeit der Dosierung
Von den Patienten in stabiler Remission oder mit stabilem Ansprechen erhielten 23% bzw. 55% während der Erhaltungsphase eine wöchentliche Dosierung und 69% bzw. 34% eine Dosierung alle zwei Wochen. Einige Patienten erhielten auch beides - eine wöchentliche Dosierung oder eine Dosierung alle zwei Wochen (8% bzw. 11%). Von den Patienten, die randomisiert Spravato erhielten, bekamen 60% die Dosis 84 mg und 40% die Dosis 56 mg.
Studie TRD3013 (ESCAPE-TRD)
Die Wirksamkeit von Spravato wurde in einer randomisierten, offenen, auswerterverblindeten, aktiv kontrollierten Langzeitstudie (TRD3013) untersucht, in der Spravato mit Quetiapin mit verlängerter Wirkstofffreisetzung (XR) bei 676 erwachsenen Patienten mit TRD (18-74 Jahre) verglichen wurde, die weiterhin ihr derzeitiges orales AD (ein SSRI oder SNRI) einnahmen. Die Patienten erhielten eine Behandlung mit flexibel dosiertem Spravato (28, 56 oder 84 mg) oder Quetiapin XR, entsprechend den Dosierungsempfehlungen in den zum Zeitpunkt des Studienbeginns gültigen Fachinformationen.
Der primäre Wirksamkeitsendpunkt war die Remission (MADRS-Gesamtscore ≤10) in Woche 8 und der wichtigste sekundäre Endpunkt war das Verbleiben ohne Rezidiv bis Woche 32 nach der Remission in Woche 8. Rezidiv wurde definiert als ein MADRS-Gesamtscore ≥22 in 2 aufeinanderfolgenden Wochen oder ein Krankenhausaufenthalt wegen einer Verschlechterung der Depression oder ein anderes klinisch relevantes Ereignis, das auf ein Rezidiv hindeutet.
Die demografischen und krankheitsbezogenen Ausgangswerte der Patienten waren in den Gruppen Spravato plus oralem AD und Quetiapin XR plus oralem AD ähnlich. Der mittlere (SD) MADRS-Gesamtscore bei Studienbeginn betrug 31,4 (6,06) für die Gruppe mit Spravato plus oralem AD und 31,0 (5,83) für die Gruppe mit Quetiapin XR plus oralem AD.
Spravato plus oralem AD zeigte eine klinisch bedeutsame und statistische Überlegenheit gegenüber Quetiapin XR plus oralem AD sowohl beim primären (Tabelle 6) als auch beim entscheidenden sekundären (Tabelle 7) Wirksamkeitsmass.
Tabelle 6: Primäre Wirksamkeitsergebnisse für die Studie TRD3013a
|
Behandlungsgruppe
|
Spravato + Orales AD
|
Quetiapin XR + Orales AD
| |
Anzahl der Patienten in Remission in Woche 8
|
91/336 (27,1%)
|
60/340 (17,6%)
| |
Abweichung in Prozent (95% KI)
|
9,44 (3,19; 15,68)
|
–
| |
Bereinigte Odds-Ratio (95% KI)
|
1,74 (1,20; 2,52)
P = 0,003b
|
–
| |
KI = Konfidenzintervall; AD = Antidepressivum; XR = verlängerte Wirkstofffreisetzung.
a Ein Patient, der die Studienintervention vor Woche 8 abbrach, wurde als negatives Ergebnis betrachtet (d.h. Nicht-Remission). Bei Patienten, für die in Woche 8 kein MADRS-Ergebnis vorlag, die aber die Studienintervention nicht abbrachen und nicht vor Woche 8 aus der Studie ausschieden, wurde LOCF der MADRS angewandt.
b P-Wert für den CMH-Test (Cochran-Mantel-Haenszel), bereinigt um die Altersgruppen (18–64; ≥65) und die Gesamtzahl der Behandlungsabbrüche.
|
Tabelle 7: Wichtige sekundäre Wirksamkeitsergebnisse der TRD3013-Studiea
|
Behandlungsgruppe
|
Spravato + Orales AD
|
Quetiapin XR + Orales AD
| |
Anzahl der Patienten, die in Woche 8 in Remission und in Woche 32 Rezidiv-frei waren
|
73/336 (21,7%)
|
48/340 (14,1%)
| |
Abweichung in Prozent (95% KI)
|
7,61 (1,85; 13,37)
|
–
| |
Bereinigte Odds-Ratio (95% KI)
|
1,72 (1,15; 2,57)
P = 0,008b
|
–
| |
KI = Konfidenzintervall; AD = Antidepressivum; XR = verlängerte Wirkstofffreisetzung.
a Ein Patient, der die Studienintervention abbrach, wurde als negatives Ergebnis betrachtet. Bei Patienten, für die zum Zeitpunkt der Woche 8 kein MADRS-Ergebnis vorlag, die aber die Studienintervention nicht abbrachen und nicht vor Woche 8 aus der Studie ausschieden, wurde LOCF der MADRS angewandt.
b P-Wert für den CMH-Test, bereinigt um die Altersgruppen (18–64; ≥65) und die Gesamtzahl der Behandlungsabbrüche.
|
Remissions- und Ansprechraten
Die Remissionsrate in Woche 32 betrug 55,0% bei Patienten in der Gruppe Spravato plus oralem AD und 37,0% in der Gruppe Quetiapin XR plus oralem AD, mit einem Odds Ratio (95% KI) von 2,09 (1,53, 2,85). Die Ansprechrate (definiert als Verringerung des MADRS-Gesamtscores um ≥50% gegenüber dem Ausgangswert oder ein MADRS-Gesamtscore von ≤10) lag in Woche 32 bei 75,5% der Patienten in der Gruppe Spravato mit oralem AD und bei 55,5% in der Gruppe Quetiapin XR mit oralem AD, mit einem Odds Ratio (95% KI) von 2,48 (1,78, 3,46).
Die Behandlungsabbruchsraten während des 32-wöchigen Behandlungszeitraums aufgrund von unerwünschten Ereignissen, mangelnder Wirksamkeit bzw. insgesamt betrugen 4,2%, 8,3% bzw. 23,2% für die Patienten in der Gruppe Spravato plus orales AD und 11,5%, 15,0% bzw. 40,3% für die Patienten in der Gruppe Quetiapin XR plus orales AD.
Studie zum Zusammenhang zwischen Dosis und therapeutischem Ansprechen bei TRD
Eine doppelt randomisierte, doppelblinde, Placebo-kontrollierte Phase-2-Studie zur Ermittlung des Dosierungsbereichs rekrutierte 108 erwachsene Patienten mit TRD. Zusätzlich zur weiter geführten oralen antidepressiven Therapie erhielten die Patienten 14 mg, 28 mg, 56 mg oder 84 mg Esketamin oder Placebo nasal verabreicht zweimal wöchentlich während 2 Wochen. Die Behandlung mit den Dosierungen 28 mg, 56 mg und 84 mg Spravato verbesserte signifikant die depressiven Symptome bei Patienten mit TRD, was sich als Änderung des MADRS-Gesamtscores nach 1 Woche zeigte. Zwar waren die Spravato-Dosierungen 28 mg, 56 mg und 84 mg wirksam zur Behandlung der TRD, doch war die Wirkdauer der 28-mg-Dosis kürzer.
Therapieresistente Depression – Kurzzeitstudie in japanischen Patienten
Die Wirksamkeit von Spravato wurde ebenfalls in einer randomisierten, doppelblinden, aktiv kontrollierten Kurzzeitstudie (TRD2005) (über 4 Wochen) bei 202 erwachsenen japanischen Patienten mit TRD untersucht. Die Patienten erhielten unter Fortsetzung des aktuellen oralen ADs eine 4-wöchige Induktionstherapie mit Spravato Nasenspray in einer Fixdosierung von 28 mg, 56 mg, 84 mg oder Placebo. Der primäre Wirksamkeitsendpunkt war die Veränderung des MADRS-Gesamtscores vom Beginn der Studie (Baseline) bis Tag 28. Die demografischen und krankheitsbezogenen Merkmale der Patienten zu Baseline waren in den Gruppen Spravato plus AD und Placebo-Nasenspray plus AD vergleichbar.
In der Studie TRD2005 wurde am Ende der 4-wöchigen Induktionsphase für keine der 3 untersuchten Dosierungen von Spravato (plus orale AD) ein statistisch signifikanter Unterschied im Vergleich zu Placebo (plus oralem AD) in Bezug auf die Veränderung des MADRS-Gesamtscores im Vergleich zur Baseline beobachtet.
Therapieresistente Depression – Kurzzeitstudie in chinesischen Patienten
Die Wirksamkeit von Spravato wurde zudem in einer randomisierten, doppelblinden, aktiv kontrollierten Kurzzeitstudie (TRD3006) (über 4 Wochen) bei 252 erwachsenen Patienten (224 chinesische Patienten, 28 nicht-chinesische Patienten) mit TRD untersucht. Die Patienten erhielten eine 4-wöchige Induktionstherapie mit flexibel dosiertem Spravato (56 mg oder 84 mg) oder Placebo, zusätzlich zu einem neu initiiertem oralen AD. Der primäre Wirksamkeitsendpunkt war die Veränderung des MADRS-Gesamtscores vom Beginn der Studie (Baseline) bis Tag 28. Die demografischen und krankheitsbezogenen Merkmale der Patienten waren in den Gruppen Spravato plus AD und Placebo-Nasenspray plus AD vergleichbar.
In der Studie TRD3006 wurde am Ende der 4-wöchigen Induktionsphase kein statistisch signifikanter Unterschied zwischen Spravato (plus oralem AD) und Placebo (plus oralem AD) in Bezug auf die Veränderung des MADRS-Gesamtscores gegenüber der Baseline festgestellt.
Akute Kurzzeitbehandlung eines psychiatrischen Notfalls im Rahmen einer Major Depression
Spravato wurde in zwei identischen randomisierten, doppelblinden, multizentrischen, placebokontrollierten Phase-3-Kurzzeitstudien (4 Wochen), Aspire I (SUI3001; NCT03039192) und Aspire II (SUI3002; NCT03097133) bei erwachsenen Patienten mit mittelschwerer bis schwerer MDD (MADRS-Gesamtscore >28) und aktiven Suizidgedanken mit Suizidabsicht untersucht. In diesen Studien erhielten die Patienten über 4 Wochen zweimal wöchentlich eine Behandlung mit 84 mg Spravato oder Placebo-Nasenspray. Alle Patienten erhielten eine umfassende Standardbehandlung (SOC), die einen anfänglichen stationären Krankenhausaufenthalt und eine neu eingeleitete oder optimierte Therapie mit einem oralen AD (AD-Monotherapie oder AD plus Augmentation) nach Festlegung durch den Prüfarzt einschloss. Nach der ersten Dosis war bei Patienten, welche die 84-mg-Dosis nicht vertrugen, eine einmalige Dosisreduktion auf 56 mg Spravato zulässig.
Die demografischen Merkmale und Krankheitsmerkmale der Patienten in SUI3001 und SUI3002 zur Baseline waren in der Behandlungsgruppe mit Spravato + SOC und in der Behandlungsgruppe mit dem Placebo-Nasenspray + SOC ähnlich. Das mediane Patientenalter betrug 40 Jahre (Bereich 18 bis 64 Jahre), 61% waren weiblich; 73% Kaukasier und 6% Schwarze, und 63% der Patienten hatten bereits mindestens einen Suizidversuch unternommen. Vor der Aufnahme in die Studie hatten 92% der Patienten eine Therapie mit einem AD erhalten. Während der Studie erhielten 40% der Patienten im Rahmen der Standardbehandlung eine AD-Monotherapie, 54% der Patienten erhielten ein AD plus Augmentation und 6% erhielten beides, sowohl eine AD-Monotherapie als auch ein AD plus Augmentation.
Der primäre Indikator für die Wirksamkeit war die Reduzierung der MDD-Symptome, gemessen anhand der Veränderung des MADRS-Gesamtscores 24 Stunden nach der ersten Dosis (Tag 2) gegenüber dem Ausgangswert.
In SUI3001 und SUI3002 erwies sich die Behandlung mit Spravato + SOC hinsichtlich des primären Indikators für die Wirksamkeit im Vergleich zu Placebo-Nasenspray + SOC statistisch überlegen (siehe Tabelle 8).
Tabelle 8: Primäre Wirksamkeitsergebnisse bezüglich der Veränderung des MADRS-Gesamtscores 24 Stunden nach der ersten Dosis gegenüber dem Ausgangswert (in den Studien SUI3001 und SUI3002) (ANCOVA*)
|
Nr. der Studie
|
Behandlungsgruppe§
|
Patientenzahl
|
Mittlerer Baseline-Score
(SD)
|
LSM-Veränderung zwischen Baseline und 24 Std. nach der ersten Dosis (SE)
|
LSM Differenz
(95% KI)†
p-Wert
| |
SUI3001
|
84 mg Spravato + SOC
|
111
|
41,3 (5,87)
|
-15,9 (1,04)
|
-3,8
(-6,56; -1,09)‡
P=0,006
| |
Placebo-Nasenspray + SOC
|
112
|
41,0 (6,29)
|
-12,0 (1,02)
|
-
| |
SUI3002
|
84 mg Spravato + SOC
|
113
|
39,4 (5,21)
|
-16,0 (1,02)
|
-3,9
(-6,60; -1,11)‡
P=0,006
| |
Placebo-Nasenspray + SOC
|
113
|
39,9 (5,76)
|
-12,2 (1,05)
|
-
| |
Kombinierte Studien (SUI3001 und SUI3002)
|
84 mg Spravato + SOC
|
224
|
40,3 (5,61)
|
-16,0 (0,72)
|
-3,8
(-5,75; -1,89)‡
| |
Placebo-Nasenspray + SOC
|
225
|
40,4 (6,04)
|
-12,1 (0,72)
|
-
| |
SD = Standardabweichung (Standard Deviation), SE = Standardfehler (Standard Error), LSM = geschätzter Randmittelwert (Least Square Means), KI = Konfidenzintervall; SOC=Standardbehandlung.
* ANCOVA LOCF: In der Studie SUI3001 lag für 1 Teilnehmer (in der Behandlungsgruppe Placebo + SOC) kein MADRS-Gesamtscore an Tag 2 (24 Stunden nach der ersten Dosis) vor, und der MADRS-Gesamtscore wurde durch den 4 Stunden nach der ersten Dosis erhaltenen Wert ersetzt («carried forward»). In der Studie SUI3002 konnte bei 5 der 6 Teilnehmer, für die kein MADRS-Gesamtscore an Tag 2 (24 Stunden nach der ersten Dosis) vorlag, der MADRS-Gesamtscore durch den 4 Stunden nach der ersten Dosis erhaltenen Wert ersetzt werden.
§ Nasal gegebenes Esketamin oder Placebo.
† Differenz (Spravato + SOC minus Placebo-Nasenspray + SOC) bezüglich der Veränderung der geschätzten Randmittelwerte gegenüber Baseline.
‡ Behandlungsgruppen, die gegenüber Placebo-Nasenspray + SOC statistisch signifikant überlegen waren.
|
Die Unterschiede (95% KI) bezüglich der Veränderung des MADRS-Gesamtscores an Tag 2 (24 Stunden nach der ersten Dosis) gegenüber dem Ausgangswert zwischen der Behandlung mit Spravato + SOC und Placebo + SOC betrugen -4,81 (-7,26; -2,36) in der Teilgruppe mit vorgängigem Suizidversuch (N=282) und -2,32 (-5,54; 0,91) in der Teilgruppe ohne vorgängigen Suizidversuch (N=166).
Bei den 18% der Patienten mit mittelschwerer depressiver Episode (MADRS-Gesamtscore bei Baseline <35) zeigte SPRAVATO plus Standardbehandlung in einer post-hoc-Analyse der gepoolten Daten von SUI3001 und SUI3002 keine Überlegenheit gegenüber Placebo plus Standardbehandlung an Tag 2 (24 Stunden nach der ersten Dosis).
Zeitlicher Verlauf des Ansprechens auf die Behandlung
Sowohl in der SUI3001 als auch in der SUI3002 wurde ab dem Zeitpunkt nach 4 Stunden ein Unterschied zwischen der Behandlung mit Spravato und der Placebogabe beobachtet. Zwischen dem Zeitpunkt nach 4 Stunden und Tag 25 stellten sich sowohl in der Spravato- als auch in der Placebo-Gruppe weitere Besserungen ein. Der Unterschied zwischen den Gruppen blieb im Allgemeinen bestehen, schien sich jedoch bis Tag 25 im Lauf der Zeit nicht zu verstärken. Abb. 3 zeigt den zeitlichen Verlauf der Veränderung des MADRS-Gesamtscores als primärem Indikator für die Wirksamkeit unter Verwendung kombinierter Daten aus den Studien SUI3001 und SUI3002.
Abbildung 3: Veränderung der Kleinstquadrat-Mittelwerte gegenüber Baseline des MADRS-Gesamtscores im zeitlichen Verlauf in den Studien SUI3001 und SUI3002* (kombinierte analysierte Gesamtgruppe) - MMRM
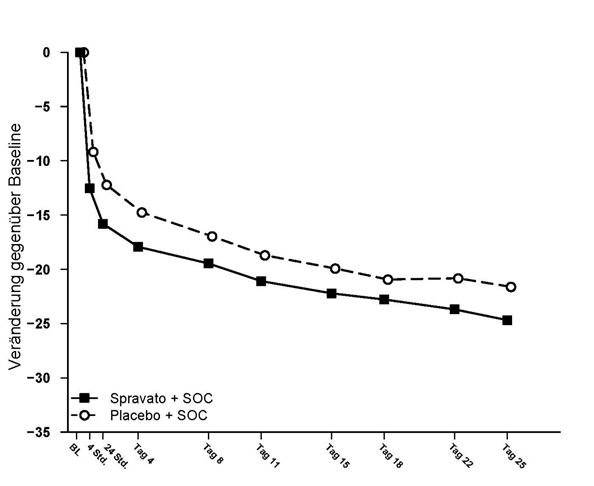
* Hinweis: In diesen Studien war bei Patienten, welche die 84-mg-Dosis nicht vertrugen, nach der ersten Dosis eine einmalige Dosisreduktion auf 56 mg Spravato zulässig. Bei etwa 16% der Patienten wurde die Dosierung von Spravato von 84 mg auf 56 mg zweimal wöchentlich reduziert.
Remissionsraten
In den Phase-3-Studien war der Prozentanteil der Patienten, die eine Remission erreichten (MADRS-Gesamtscore ≤12 zu einem beliebigen Zeitpunkt während der Studie), in der Behandlungsgruppe mit Spravato + SOC zu allen Zeitpunkten während der doppelblinden Behandlungsphase höher als in der Behandlungsgruppe mit Placebo + SOC (Tabelle 9).
Tabelle 9: Patienten, die eine Remission der MDD erreichten; doppelblinde Behandlungsphase; bzgl. der Wirksamkeit analysierte Gesamtgruppe
|
|
SUI3001
|
SUI3002
|
Kombinierte Studien
(SUI3001 und SUI3002)
| |
|
Placebo +
SOC
|
Spravato +
SOC
|
Placebo +
SOC
|
Spravato +
SOC
|
Placebo +
SOC
|
Spravato +
SOC
| |
|
112
|
112
|
113
|
114
|
225
|
226
| |
Tag 1, 4 Std. nach der ersten Dosis
| |
Patienten mit Remission der MDD
|
9 (8,0%)
|
12 (10,7%)
|
4 (3,5%)
|
12 (10,5%)
|
13 (5,8%)
|
24 (10,6%)
| |
Tag 2, 24 Std. nach der ersten Dosis
| |
Patienten mit Remission der MDD
|
10 (8,9%)
|
21 (18,8%)
|
12 (10,6%)
|
25 (21,9%)
|
22 (9,8%)
|
46 (20,4%)
| |
Tag 25
| |
Patienten mit Remission der MDD
|
38 (33,9%)
|
46 (41,1%)
|
31 (27,4%)
|
49 (43,0%)
|
69 (30,7%)
|
95 (42,0%)
| |
SOC=Standardbehandlung
Hinweis: Remission beruht auf einem MADRS-Gesamtscore von ≤12. Teilnehmer, die dieses Kriterium nicht erfüllten oder bei denen die Behandlung aus irgendeinem Grund vor dem Zeitpunkt abgesetzt wurde, gelten nicht als in Remission.
|
Auswirkungen auf die Suizidalität
Die sekundäre Wirksamkeitsmessung war die Veränderung anhand der Skala «Clinical Global Impression of Suicidal Severity – revised» (CGI-SS-r) 24 Stunden nach der ersten Dosis (Tag 2). CGI-SS-r ist eine von einem Arzt bewertete Einzeleinschätzung, die dazu dient, den aktuellen Schweregrad der Suizidgedanken und des suizidalen Verhaltens eines Patienten zu bewerten. Die CGI-SS-r-Werte reichen von 0 bis 6, wobei höhere Werte schwerere Suizidgedanken und suizidales Verhalten anzeigen. In den Studien SUI3001 und SUI3002 zeigte Spravato plus Standardbehandlung keine Überlegenheit gegenüber Placebo-Nasenspray plus Standardbehandlung bei der Verbesserung des CGI-SS-r.
Die langfristige Wirksamkeit von Spravato zur Suizidprävention wurde nicht untersucht.
Weitere Informationen
Auswirkung auf die Fahrtüchtigkeit
In zwei Studien – eine an Erwachsenen mit MDD und die andere Studie an gesunden Probanden – untersuchte man die Auswirkungen von Spravato auf die Fähigkeit zum Führen von Kraftfahrzeugen. Das Fahrvermögen auf der Strasse wurde mit der mittleren Standardabweichung der lateralen Position (SDLP, standard deviation of the lateral position) beurteilt, einem Mass für die Beeinträchtigung beim Fahren.
In einer einfach verblindeten Placebo-kontrollierten Studie an 25 erwachsenen Patienten mit MDD beurteilte man die Wirkungen einer Einzeldosis von 84 mg Esketamin-Nasenspray auf die Fahrweise am nächsten Tag sowie die Wirkung der wiederholten Gabe von 84 mg Spravato intranasal auf die Fahrweise am gleichen Tag. Als positive Kontrolle für die Einzeldosis-Behandlungsphase diente ein alkoholhaltiges Getränk. Die SDLP war 18 Stunden nach Verabreichung einer Einzeldosis von 84 mg Esketamin-Nasenspray ähnlich wie nach Placebo-Gabe. In der Behandlungsphase mit Mehrfachdosierung war die SDLP nach mehrmaliger Anwendung von 84 mg Spravato intranasal 6 Stunden nach der letzten Dosisgabe an den Tagen 11, 18 und 25 ähnlich wie nach Placebo. Die obere Grenze des zweiseitigen 95%-Vertrauensintervalls der mittleren Differenz zwischen einer Einzeldosis Esketamin und Placebo war 0,58 cm, das ist weniger als die vordefinierte Nichtunterlegenheit-Grenze von 2,4 cm. Die untere Grenze des 95%-Vertrauensintervalls der mittleren Differenz zwischen Ethanol und Placebo war 1,03 cm (p <0,001), was die Sensitivität der Studie bestätigt.
In einer randomisierten, doppelblinden, cross-over (Überkreuzung-Design), Placebo-kontrollierten Studie an 23 gesunden Probanden wurden die Wirkungen einer Einzeldosis von 84 mg Esketamin-Nasenspray auf die Fahrweise beurteilt. Als positive Kontrolle diente Mirtazapin. 8 Stunden nach Verabreichung von Esketamin oder Mirtazapin beurteilte man das Fahrvermögen. Die SDLP war nach Verabreichung von Esketamin-Nasenspray ähnlich wie nach Placebo. Die obere Grenze des zweiseitigen 95%-Vertrauensintervalls der mittleren Differenz zwischen Esketamin und Placebo betrug 0,86 cm, das ist weniger als die vordefinierte Nichtunterlegenheit-Grenze von 2,4 cm. Die untere Grenze des 95%-Vertrauensintervalls der mittleren Differenz zwischen Mirtazapin und Placebo war 1,12 cm (p = 0,001), was die Sensitivität der Studie belegt. Von den 23 ausgewerteten Probanden schlossen 21 den Test mit Erfolg ab. Zwei Probanden brachen den Fahrtest nach Verabreichung von Esketamin ab, weil sie den Eindruck hatten, nicht fahrtüchtig zu sein.
Wirkung auf das QT/QTc-Intervall und die kardiale Elektrophysiologie
Die Behandlung mit Spravato verlängerte das QTc-Intervall nicht. In einer randomisierten, doppelblinden, Placebo-kontrollierten Cross-over-Studie mit positiver Kontrolle (Moxifloxacin 400 mg) in 4 Phasen an 60 gesunden Probanden beurteilte man die Wirkung von Spravato (84 mg Nasenspray und 0,8 mg/kg Esketamin als intravenöse Infusion während 40 Minuten) auf das QTc-Intervall. Die maximalen Konzentrationen von Esketamin im Plasma waren nach der intravenösen Infusion ungefähr 3-mal so hoch wie diejenigen nach der intranasalen Dosis von 84 mg. Die obere Grenze des 90%-Vertrauensintervalls für das grösste Placebo-adjustierte und für den Ausgangswert (Basislinie) korrigierte QTc-Intervall, berechnet mit der Fridericia-Korrekturformel (QTcF) für beide Behandlungsgruppen, blieb an allen untersuchten Zeitpunkten unter 10 msec.
|


