Eigenschaften/WirkungenATC-Code
Pharmakotherapeutische Gruppe: Immunsuppressiva, selektive Immunsuppressiva, ATC-Code: L04AA43
Wirkungsmechanismus
Ravulizumab ist ein monoklonaler IgG2/4K-Antikörper, der spezifisch an das Komplementprotein C5 bindet und dadurch dessen Spaltung in C5a (das proinflammatorische Anaphylatoxin) und C5b (die initiierende Untereinheit des Membranangriffskomplexes [MAC oder C5b-9]) hemmt und die Bildung des C5b-9 verhindert. Ravulizumab erhält die frühen Komponenten der Komplementaktivierung, die von wesentlicher Bedeutung für die Opsonisierung von Mikroorganismen und die Elimination (Clearance) von Immunkomplexen sind.
Pharmakodynamik
Nach der Ravulizumab-Behandlung wurde sowohl bei zuvor nicht mit Komplementinhibitoren behandelten erwachsenen und pädiatrischen Patienten mit PNH als auch bei mit Eculizumab vorbehandelten Patienten mit PNH in Phase-3-Studien eine sofortige, vollständige und anhaltende Hemmung von freiem Serum-C5 (Konzentration von < 0,5 µg/ml) am Ende der ersten Infusion beobachtet und über den gesamten 26-wöchigen Behandlungszeitraum aufrechterhalten, und zwar bei allen Patienten. Eine sofortige und vollständige Hemmung von freiem C5 im Serum wurde auch bei erwachsenen und pädiatrischen Patienten mit aHUS, bei erwachsenen Patienten mit gMG und bei erwachsenen Patienten mit NMOSD am Ende der ersten Infusion und während des 26wöchigen Behandlungszeitraums beobachtet.
Umfang und Dauer des pharmakodynamischen Ansprechens bei Patienten mit PNH, aHUS, gMG oder NMOSD waren bei Ravulizumab expositionsabhängig. Konzentrationen von freiem C5 von weniger als 0,5 µg/ml korrelierten mit einer maximalen intravasalen Hämolysekontrolle und einer vollständigen Hemmung des terminalen Komplements. Bei gMG führt die Aktivierung des terminalen Komplements zu MAC-Ablagerungen an den neuromuskulären Verbindungsstellen und zu einer Beeinträchtigung der neuromuskulären Übertragung. Bei NMOSD führt eine durch Autoantikörper gegen AQP4 verursachte unkontrollierte Aktivierung des terminalen Komplements zur Entstehung der MAC- und C5a-abhängigen Entzündung, die Astrozytennekrose und eine erhöhte Durchlässigkeit der Blut-Hirn-Schranke sowie die Schädigung der umgebenden Gliazellen und Neuronen zur Folge hat.
Klinische Wirksamkeit
Paroxysmale nächtliche Hämoglobinurie (PNH)
Die Sicherheit und Wirksamkeit von Ravulizumab bei erwachsenen Patienten mit PNH wurden in zwei offenen, randomisierten, aktiv kontrollierten Phase-3-Studien untersucht:
einer Studie mit erwachsenen Patienten mit PNH, die zuvor nicht mit Komplementinhibitoren behandelt worden waren,
einer Studie mit erwachsenen Patienten mit PNH, die klinisch stabil waren, nachdem sie mindestens in den 6 Monaten zuvor mit Eculizumab behandelt worden waren.
Ravulizumab wurde gemäss dem empfohlenen, in Abschnitt «Dosierung/Anwendung» beschriebenen Dosierungsschema (4 Infusionen von Ravulizumab über 26 Wochen) angewendet, während Eculizumab gemäss dem zugelassenen Dosierungsschema von Eculizumab 600 mg wöchentlich in den ersten 4 Wochen und 900 mg alle 2 Wochen (15 Infusionen über 26 Wochen) verabreicht wurde.
Die Patienten wurden vor bzw. zu Beginn der Behandlung mit Ravulizumab bzw. Eculizumab gegen Meningokokkeninfektion geimpft oder erhielten bis 2 Wochen nach der Impfung eine prophylaktische Behandlung mit entsprechenden Antibiotika.
Zwischen der Ravulizumab- und der Eculizumab-Behandlungsgruppe bestanden in keiner der beiden Phase-3-Studien nennenswerte Unterschiede bei den demografischen bzw. bei Studienbeginn vorliegenden Merkmalen. Die 12-monatige Transfusionshistorie war in beiden Phase-3-Studien in der Ravulizumab- und der Eculizumab-Behandlungsgruppe ähnlich.
Studie mit erwachsenen PNH-Patienten, die zuvor nicht mit Komplementinhibitoren behandelt worden waren (ALXN1210-PNH-301)
Die Studie mit zuvor nicht mit Komplementinhibitoren behandelten Patienten war eine 26-wöchige, multizentrische, offene, randomisierte, aktiv kontrollierte Phase-3-Studie, die mit 246 Patienten durchgeführt wurde, die vor Studieneintritt nicht mit Komplementinhibitoren behandelt worden waren, gefolgt von einer Langzeit-Verlängerungsphase, in der alle Patienten Ravulizumab erhielten. Geeignete Patienten für diese Studie mussten eine hohe Krankheitsaktivität, definiert als LDH-Wert ≥ 1,5 × ULN (Upper Limit of Normal/oberer Grenzwert) beim Screening sowie das Vorhandensein von einem oder mehreren der folgenden PNH-bedingten Anzeichen oder Symptome innerhalb von 3 Monaten vor dem Screening aufweisen: Ermüdung/Fatigue, Hämoglobinurie, Abdominalschmerz, Kurzatmigkeit (Dyspnoe), Anämie (Hämoglobin < 10 g/dl), ein zurückliegendes schwerwiegendes unerwünschtes vaskuläres Ereignis (einschliesslich Thrombose), Dysphagie oder Erektionsstörung; oder eine zurückliegende PNH-bedingte Transfusion von Erythrozytenkonzentraten.
Mehr als 80 % der Patienten in beiden Behandlungsgruppen hatten innerhalb von 12 Monaten vor Studieneintritt eine Transfusion erhalten. Die Mehrheit der Studienpopulation aus der Studie mit zuvor nicht mit Komplementinhibitoren behandelten Patienten war zu Studienbeginn stark hämolytisch; 86,2 % der eingeschlossenen Patienten wiesen im Zusammenhang mit PNH einen erhöhten LDH-Wert ≥ 3 × ULN auf, was ein direktes Mass für die intravaskuläre Hämolyse darstellt.
Die Tabelle 9 zeigt die Merkmale der PNH-Patienten, die in die Studie mit zuvor nicht mit Komplementinhibitoren behandelten Patienten aufgenommen wurden, bei Studienbeginn; zwischen den Behandlungsarmen wurden keine offensichtlichen, klinisch bedeutsamen Unterschiede beobachtet.
Tabelle 9: Merkmale bei Studienbeginn in der Studie bei zuvor nicht mit Komplementinhibitoren behandelten Patienten
|
Parameter
|
Statistik
|
Ravulizumab
(N = 125)
|
Eculizumab
(N = 121)
| |
Alter (in Jahren) bei PNH-Diagnose
|
Mittelwert (SD)
Median
Min.; Max.
|
37,9 (14,90)
34,0
15; 81
|
39,6 (16,65)
36,5
13; 82
| |
Alter (in Jahren) bei der ersten Infusion in der Studie
|
Mittelwert (SD)
Median
Min.; Max.
|
44,8 (15,16)
43,0
18; 83
|
46,2 (16,24)
45,0
18; 86
| |
Geschlecht (n, %)
|
männlich
weiblich
|
65 (52,0)
60 (48,0)
|
69 (57,0)
52 (43,0)
| |
LDH-Werte vor der Behandlung
|
Mittelwert (SD)
|
1633,5 (778,75)
|
1578,3 (727,06)
| |
Median
|
1513,5
|
1445,0
| |
Anzahl Patienten mit Transfusionen von Erythrozytenkonzentraten in den 12 Monaten vor der ersten Dosis
|
n (%)
|
103 (82,4)
|
100 (82,6)
| |
Einheiten von in den 12 Monaten vor der ersten Dosis transfundierten Erythrozytenkonzentraten
|
Gesamtwert
|
925
|
861
| |
Mittelwert (SD)
|
9,0 (7,74)
|
8,6 (7,90)
| |
Median
|
6,0
|
6,0
| |
Gesamt-PNH-Erythrozyten-Klongrösse
|
Median
|
33,6
|
34,2
| |
Gesamt-PNH-Granulozyten-Klongrösse
|
Median
|
93,8
|
92,4
| |
Patienten mit PNH-bedingten Symptomen und Erkrankungena vor Studienbeginn
|
n (%)
|
121 (96,8)
|
120 (99,2)
| |
Anämie
|
|
103 (82,4)
|
105 (86,8)
| |
Hämaturie oder Hämoglobinurie
|
|
81 (64,8)
|
75 (62,0)
| |
Aplastische Anämie
|
|
41 (32,8)
|
38 (31,4)
| |
Niereninsuffizienz
|
|
19 (15,2)
|
11 (9,1)
| |
Myelodysplastisches Syndrom
|
|
7 (5,6)
|
6 (5,0)
| |
Schwangerschaftskomplikation
|
|
3 (2,4)
|
4 (3,3)
| |
Sonstigeb
|
|
27 (21,6)
|
13 (10,7)
|
a Basierend auf Krankengeschichte.
b „Sonstige“ wie auf dem Prüfbogen angegeben beinhaltete Thrombozytopenie, chronische Nierenerkrankung und Panzytopenie sowie eine Reihe weiterer Symptome und Erkrankungen.
Die koprimären Endpunkte waren Transfusionsvermeidung und Hämolyse, direkt gemessen an der Normalisierung der LDH-Werte (LDH-Werte ≤ 1 × ULN; der ULN für LDH ist 246 U/l). Die wichtigen sekundären Endpunkte umfassten die prozentuale Veränderung der LDH-Werte von der Baseline, die Veränderung der Lebensqualität (FACIT-Fatigue-Score), den Anteil an Patienten mit Durchbruchhämolyse und den Anteil an Patienten mit stabilisiertem Hämoglobinspiegel.
Bei beiden koprimären Endpunkten, Vermeidung der Transfusion von Erythrozytenkonzentraten gemäss den im Prüfplan spezifizierten Richtlinien und LDH-Normalisierung von Tag 29 bis Tag 183, und bei allen vier wichtigen sekundären Endpunkten war Ravulizumab im Vergleich zu Eculizumab nicht unterlegen (Abbildung 1).
Abbildung 1: Analyse der koprimären und sekundären Endpunkte – Full Analysis Set (Studie mit zuvor nicht mit Komplementinhibitoren behandelten Patienten)
|
|
|
Ravulizumab
(N = 125)
|
Eculizumab
(N = 121)
|
Differenz (95 %-KI)
| |
Transfusionsvermeidung (%)
|
|

|
73,6
|
66,1
|
6,8 (-4,7; 18,1)
| |
|
|
|
| |
LDH-Normalisierung
|
|
|
Odds Ratio (95 %-KI)
| |
(Odds Ratio)
|
53,6
|
49,4
|
1,19 (0,80; 1,77)
| |
|
|
|
| |
|
|
|
Differenz (95 %-KI)
| |
LDH-Veränderung gegenüber Baseline (%)
|
-76,8
|
-76,0
|
0,8 (-3,6; 5,2)
| |
Veränderung des FACIT-Fatigue-Scores
|
7,1
|
6,4
|
0,7 (-1,2; 2,6)
| |
Durchbruchhämolyse (%)
|
4,0
|
10,7
|
6,7 (-0,2; 14,2)
| |
Hämoglobin-Stabilisierung (%)
|
68,0
|
64,5
|
2,9 (-8,8; 14,6)
| |
|
|
|
| |
|
Zugunsten von Eculizumab
|
Zugunsten von Ravulizumab
|
|
|
|
Hinweis: Schwarze Dreiecke zeigen die Nichtunterlegenheitsgrenzen an, graue Punkte zeigen Punktschätzungen an.
Hinweis: LDH = Lactat-Dehydrogenase; KI = Konfidenzintervall; FACIT = Functional Assessment of Chronic Illness Therapy.
Die abschliessende Wirksamkeitsanalyse der Studie bezog alle Patienten ein, die jemals mit Ravulizumab (n = 244) behandelt worden waren und die mediane Behandlungsdauer betrug 1423 Tage. Die abschliessende Analyse bestätigte, dass das im primären Auswertungszeitraum beobachtete Ansprechen auf die Ravulizumab-Behandlung über die gesamte Studiendauer hinweg anhielt.
Studie mit erwachsenen PNH-Patienten, die zuvor mit Eculizumab behandelt wurden (ALXN1210-PNH-302)
Die Studie bei zuvor mit Eculizumab behandelten Patienten war eine 26-wöchige, multizentrische, offene, randomisierte, aktiv kontrollierte Phase-3-Studie, die mit 195 PNH-Patienten, die klinisch stabil waren (LDH ≤ 1,5 x ULN), nachdem sie mindestens in den 6 Monaten zuvor mit Eculizumab behandelt worden waren, durchgeführt wurde, gefolgt von einer Langzeit-Verlängerungsphase, in der alle Patienten Ravulizumab erhielten.
Die Krankengeschichte in Bezug auf PNH war in der Ravulizumab- und der Eculizumab-Behandlungsgruppe ähnlich. Die 12-monatige Transfusionshistorie war in der Ravulizumab- und der Eculizumab-Behandlungsgruppe ähnlich, und mehr als 87 % der Patienten in beiden Behandlungsgruppen hatten innerhalb von 12 Monaten vor Studieneintritt keine Transfusion erhalten. Die mittlere Gesamt-PNH-Erythrozyten-Klongrösse betrug 60,05 %, die mittlere Gesamt-PNH-Granulozyten-Klongrösse betrug 83,30 % und die mittlere Gesamt-PNH-Monozyten-Klongrösse betrug 85,86 %.
Die Tabelle 10 zeigt die Merkmale bei Studienbeginn der PNH-Patienten, die in die Studie bei zuvor mit Eculizumab behandelten Patienten aufgenommen wurden; zwischen den Behandlungsarmen wurden keine offensichtlichen, klinisch bedeutsamen Unterschiede beobachtet.
Tabelle 10: Merkmale bei Studienbeginn in der Studie bei zuvor mit Eculizumab behandelten Patienten
|
Parameter
|
Statistik
|
Ravulizumab
(N = 97)
|
Eculizumab
(N = 98)
| |
Alter (in Jahren) bei PNH-Diagnose
|
Mittelwert (SD)
Median
Min., Max.
|
34,1 (14,41)
32,0
6, 73
|
36,8 (14,14)
35,0
11, 74
| |
Alter (in Jahren) bei der ersten Infusion in der Studie
|
Mittelwert (SD)
Median
Min., Max.
|
46,6 (14,41)
45,0
18, 79
|
48,8 (13,97)
49,0
23, 77
| |
Geschlecht (n, %)
|
männlich
weiblich
|
50 (51,5)
47 (48,5)
|
48 (49,0)
50 (51,0)
| |
LDH-Werte vor der Behandlung
|
Mittelwert (SD)
|
228,0 (48,71)
|
235,2 (49,71)
| |
Median
|
224,0
|
234,0
| |
Anzahl Patienten mit Transfusionen von Erythrozytenkonzentraten/Vollblut in den 12 Monaten vor der ersten Dosis
|
n (%)
|
13 (13,4)
|
12 (12,2)
| |
Einheiten von in den 12 Monaten vor der ersten Dosis transfundiertem Erythrozytenkonzentrat/Vollblut
|
Gesamtwert
|
103
|
50
| |
Mittelwert (SD)
|
7,9 (8,78)
|
4,2 (3,83)
| |
Median
|
4,0
|
2,5
| |
Patienten mit PNH-bedingten Symptomen und Erkrankungena vor Studienbeginn
|
n (%)
|
90 (92,8)
|
96 (98,0)
| |
Anämie
|
|
64 (66,0)
|
67 (68,4)
| |
Hämaturie oder Hämoglobinurie
|
|
47 (48,5)
|
48 (49,0)
| |
Aplastische Anämie
|
|
34 (35,1)
|
39 (39,8)
| |
Niereninsuffizienz
|
|
11 (11,3)
|
7 (7,1)
| |
Myelodysplastisches Syndrom
|
|
3 (3,1)
|
6 (6,1)
| |
Schwangerschaftskomplikation
|
|
4 (4,1)
|
9 (9,2)
| |
Sonstigeb
|
|
14 (14,4)
|
14 (14,3)
|
a Basierend auf Krankengeschichte.
b Die Kategorie „Sonstige“ umfasste Neutropenie, Nierenfunktionsbeeinträchtigung und Thrombopenie sowie eine Reihe weiterer Symptome und Erkrankungen.
Der primäre Endpunkt war Hämolyse, gemessen an der prozentualen Veränderung der LDH-Werte gegenüber Baseline. Die sekundären Endpunkte umfassten den Anteil an Patienten mit Durchbruchhämolyse, die Lebensqualität (FACIT-Fatigue-Score), die Transfusionsvermeidung und den Anteil an Patienten mit stabilisiertem Hämoglobinspiegel.
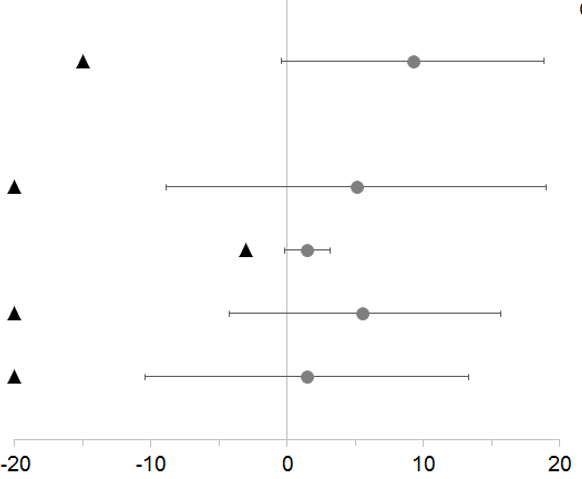
In Hinblick auf den primären Endpunkt, die prozentuale Veränderung der LDH-Konzentration von Baseline bis Tag 183, und bei allen vier wichtigen sekundären Endpunkten war Ravulizumab im Vergleich zu Eculizumab nicht unterlegen (Abbildung 2).
Abbildung 2: Analyse des primären und der sekundären Endpunkte – Full Analysis Set (Studie bei zuvor mit Eculizumab behandelten Patienten)
|
|
|
Ravulizumab
(N=97)
|
Eculizumab
(N = 98)
|
Differenz (95 %-KI)
| |
|
|
|
|
|
| |
LDH-Veränderung gegenüber Baseline (%)
|
-0,8
|
8,4
|
9,2 (-0,4; 18,8)
| |
|
|
|
| |
Durchbruchhämolyse (%)
|
0
|
5,1
|
5,1 (-8,9; 19,0)
| |
Veränderung des FACIT-Fatigue-Scores
|
2,0
|
0,5
|
1,5 (-0,2; 3,2)
| |
|
|
|
| |
Transfusionsvermeidung (%)
|
87,6
|
82,7
|
5,5 (-4,3; 15,7)
| |
Hämoglobin-Stabilisierung (%)
|
76,3
|
75,5
|
1,4 (-10,4; 13,3)
| |
|
|
|
| |
|
|
|
| |
|
Zugunsten von Eculizumab
|
Zugunsten von Ravulizumab
|
|
|
|
Hinweis: Schwarze Dreiecke zeigen die Nichtunterlegenheitsgrenzen an, graue Punkte zeigen Punktschätzungen an.
Hinweis: LDH = Lactat-Dehydrogenase; KI = Konfidenzintervall.
Die abschliessende Wirksamkeitsanalyse der Studie bezog alle Patienten ein, die jemals mit Ravulizumab behandelt worden waren (n = 192) und eine mittlere Behandlungsdauer von 968 Tagen hatten. Die abschliessende Analyse bestätigte, dass das im primären Auswertungszeitraum beobachtete Ansprechen auf die Ravulizumab-Behandlung über die gesamte Studiendauer hinweg anhielt.
Atypisches hämolytisch-urämischen Syndrom (aHUS)
Studie an erwachsenen Patienten mit aHUS (ALXN1210-aHUS-311)
Die Studie an Erwachsenen war eine multizentrische, einarmige klinische Phase-3-Studie bei Patienten mit dokumentiertem aHUS, die vor dem Eintritt in diese Studie noch keine Behandlung mit einem Komplement-Inhibitor erhalten hatten und Anzeichen einer thrombotischen Mikroangiopathie (TMA) aufwiesen. Die Studie bestand aus einem 26wöchigen Zeitraum für die Erstbeurteilung und die Patienten hatten die Möglichkeit, an einem Verlängerungszeitraum von bis zu 4,5 Jahren teilzunehmen.
Es wurden insgesamt 58 Patienten mit dokumentiertem aHUS aufgenommen. Die Einschlusskriterien schlossen Patienten aus, die mit TMA infolge thrombotischer thrombozytopenischer Purpura (TTP) bzw. hämolytisch-urämischem Syndrom in Zusammenhang mit dem Shiga-Toxin von Escherichia coli (STEC HUS) vorstellig wurden. Zwei Patienten wurden aufgrund der bestätigten Diagnose eines STEC HUS aus dem vollständigen Analyseset ausgeschlossen. Zu Studienbeginn zeigten 93 % der Patienten extrarenale (kardiovaskuläre, pulmonale, zentralnervöse, gastrointestinale, die Haut oder Skelettmuskulatur betreffende) Anzeichen oder Symptome eines aHUS.
Tabelle 11 zeigt die demographischen Merkmale und Ausgangsmerkmale von 56 erwachsenen Patienten, die in Studie ALXN1210aHUS-311 aufgenommen wurden und das vollständige Analyseset bildeten.
Tabelle 11: Ausgangsmerkmale in der Studie an Erwachsenen
|
Parameter
|
Statistik
|
Ravulizumab
(N = 56)
| |
Alter bei Erstinfusion (Jahre)
|
Mittel (SD)
Min., Max.
|
42,2 (14,98)
19,5; 76,6
| |
Geschlecht
Männlich
|
n (%)
|
19 (33,9)
| |
Ethnie a
Asiatisch
Weißhäutig
Sonstige
|
n (%)
|
15 (26,8)
29 (51,8)
12 (21,4)
| |
Transplantation in der Vorgeschichte
|
n (%)
|
8 (14,3)
| |
Thrombozyten (109/l) im Blut
|
n
Median (Min., Max.)
|
56
95,25 (18; 473)
| |
Hämoglobin (g/l) im Blut
|
n
Median (Min., Max.)
|
56
85,00 (60,5; 140)
| |
LDH (U/l) im Serum
|
n
Median (Min., Max.)
|
56
508,00 (229,5; 3249)
| |
eGFR (ml/min/1,73 m2)
|
n (%)
Median (Min., Max.)
|
55
10,00 (4; 80)
| |
Dialyse-Patienten
|
N (%)
|
29 (51,8)
| |
Patientinnen post partum
|
N (%)
|
8 (14,3)
|
Hinweis: Die Prozentangaben basieren auf der Gesamtzahl von Patienten.
Abkürzungen: eGFR = geschätzte glomeruläre Filtrationsrate; LDH = Laktatdehydrogenase; Max. = Maximum; Min. = Minimum.
Der primäre Endpunkt war das vollständige Ansprechen der TMA während des 26wöchigen Zeitraums für die Erstbeurteilung, belegt durch eine Normalisierung der hämatologischen Parameter (Thrombozytenzahl ≥ 150 x 109/l und LDH ≤ 246 U/l) und eine Verbesserung des Serumkreatinins um ≥ 25 % gegenüber dem Ausgangswert. Die Patienten mussten jedes Kriterium für ein vollständiges Ansprechen der TMA bei 2 verschiedenen Beurteilungen im Abstand von mindestens 4 Wochen (28 Tagen) und bei jeder zwischenzeitlichen Messung erfüllen.
Ein vollständiges Ansprechen der TMA wurde bei 30 der 56 Patienten (53,6 %) während des 26wöchigen Zeitraums für die Erstbeurteilung beobachtet, wie es in Tabelle 12 gezeigt ist.
Tabelle 12: Analyse des vollständigen Ansprechens der TMA und der Komponenten des vollständigen Ansprechens der TMA während des 26wöchigen Zeitraums für die Erstbeurteilung (ALXN1210aHUS-311)
|
|
Summe
|
Responder
| |
n
|
Anteil (95 %-KI)a
| |
Vollständiges Ansprechen der TMA
|
56
|
30
|
0,536 (0,396; 0,675)
| |
Komponenten des vollständigen Ansprechens der TMA
|
|
|
| |
Normalisierung der Thrombozytenzahl
|
56
|
47
|
0,839 (0,734; 0,944)
| |
Normalisierung der LDH
|
56
|
43
|
0,768 (0,648; 0,887)
| |
≥25 %ige Verbesserung des Serumkreatinins gegenüber dem Ausgangswert
|
56
|
33
|
0,589 (0,452; 0,727)
| |
Normalisierung der Blutwerte
|
56
|
41
|
0,732 (0,607; 0,857)
|
a Die 95 %-KI für den Anteil basierten auf der asymptotischen Gaußschen Approximationsmethode mit Kontinuitätskorrektur.
Abkürzungen: KI = Konfidenzintervall; LDH = Laktatdehydrogenase; TMA = thrombotische Mikroangiopathie.
Vier weitere Patienten zeigten ein vollständiges Ansprechen der TMA, das nach dem 26wöchigen Zeitraum für die Erstbeurteilung bestätigt wurde (das vollständige Ansprechen der TMA wurde an Tag 169, 302, 401 und 407 festgestellt). Somit zeigten insgesamt 34 von 56 Patienten ein vollständiges Ansprechen der TMA (60,7 %; 95 %-KI: 47,0 %, 74,4 %). Die Zahl des Ansprechens einzelner Komponenten erhöhte sich auf 48 Patienten (85,7 %; 95 %-KI: 75,7 %, 95,8 %) bei der Normalisierung der Thrombozytenzahl, auf 47 Patienten (83,9 %; 95 %-KI: 73,4 %, 94,4%) bei der Normalisierung der LDH und auf 35 Patienten (62,5 %; 95 %-KI: 48,9 %, 76,1 %) bei der Besserung der Nierenfunktion.
Ein vollständiges Ansprechen der TMA wurde innerhalb eines medianen Zeitraums von 86 Tagen (7 bis 169 Tage) erzielt. Eine Zunahme der durchschnittlichen Thrombozytenzahl wurde bald nach Behandlungsbeginn mit Ravulizumab beobachtet, wobei ein Anstieg von 118,52 × 109/l zu Studienbeginn auf 240,34 × 109/l an Tag 8 festgestellt wurde. Der Wert blieb bei allen anschliessenden Besuchsterminen während des Zeitraums für die Erstbeurteilung (26 Wochen) über 227 × 109/l. Ebenso sank der mittlere LDH-Wert während der ersten 2 Behandlungsmonate gegenüber dem Ausgangswert und blieb für die Dauer des Erstbeurteilungszeitraums (26 Wochen) erhalten.
Von den Patienten, die mit einer chronischen Nierenerkrankung in Stadium 5 vorstellig wurden, zeigten 67,6 % (23/34) eine Besserung der chronischen Nierenerkrankung um 1 oder mehrere Stadien. Das Stadium der chronischen Nierenerkrankung besserte sich weiterhin bei vielen Patienten (19/30), nachdem während des 26wöchigen Zeitraums für die Erstbeurteilung ein vollständiges Ansprechen der TMA erreicht wurde. Von den 29 dialysepflichtigen Patienten bei Eintritt in die Studie konnten 17 die Dialysebehandlung bis zum Ende des verfügbaren Nachbeobachtungszeitraums absetzen, während 6 von 27 Patienten, die zu Studienbeginn keine Dialysebehandlung erhielten, bei der letzten verfügbaren Nachuntersuchung eine Dialysebehandlung bekamen. Tabelle 13 fasst die sekundären Wirksamkeitsergebnisse von Studie ALXN1210aHUS-311 zusammen.
Tabelle 13: Sekundäres Wirksamkeitsergebnis für Studie ALXN1210aHUS-311
|
Parameter
|
Studie ALXN1210aHUS-311
(N = 56)
| |
Hämatologische Parameter bei TMA, Tag 183
Thrombozyten (109/L) im Blut
Mittelwert (SD)
Median
LDH (U/l) im Serum
Mittelwert (SD)
Median
|
Beobachteter Wert (n = 48)
237,96 (73,528)
232,00
194,46 (58,099)
176,50
|
Veränderung gegenüber dem Ausgangswert (n = 48)
114,79 (105,568)
125,00
-519,83 (572,467)
-310,75
| |
Anstieg des Hämoglobins um ≥ 20 g/l gegenüber dem Ausgangswert mit einem bestätigenden Ergebnis bis zum Ende des Zeitraums für die Erstbeurteilung
m/n
Anteil (95 %-KI)**
|
40/56
0,714 (0,587; 0,842)
| |
Veränderung des CKD-Stadiums gegenüber dem Ausgangswert, Tag 183
Verbesserunga
m/n
Anteil (95 %-KI)*
Verschlechterungb
m/n
Anteil (95 %-KI)*
|
32/47
0,681 (0,529; 0,809)
2/13
0,154 (0,019; 0,454)
| |
eGFR (ml/min/1,73 m2), Tag 183
Mittelwert (SD)
Median
|
Beobachteter Wert (n = 48)
51,83 (39,162)
40,00
|
Veränderung gegenüber dem Ausgangswert (n = 47)
34,80 (35,454)
29,00
|
Hinweis: n: Anzahl von Patienten mit verfügbaren Daten für eine bestimmte Untersuchung bei dem Besuchstermin an Tag 183. m: Anzahl von Patienten, die ein bestimmtes Kriterium erfüllen. Das Stadium der chronischen Nierenerkrankung (CKD) wird anhand der Klassifikation der National Kidney Foundation für Stadien der chronischen Nierenerkrankung (Chronic Kidney Disease Stage) bestimmt. Stadium 5 gilt als schlechteste Kategorie, während Stadium 1 die beste Kategorie ist. Der Ausgangswert wird anhand der letzten verfügbaren eGFR vor Behandlungsbeginn ermittelt. Verbesserung/Verschlechterung: im Vergleich zum CKD-Stadium zu Studienbeginn. *Die 95 %-Konfidenzintervalle (95 %-KI) basieren auf dem exakten Clopper-Pearson-Konfidenzintervall. aSchließt Patienten mit CKD- Stadium 1 zu Studienbeginn aus, weil bei ihnen keine Besserung möglich ist. bSchließt Patienten mit Stadium 5 zu Studienbeginn aus, da bei ihnen keine Verschlechterung möglich ist.
Abkürzungen: eGFR = geschätzte glomeruläre Filtrationsrate;; LDH = Laktatdehydrogenase; TMA = thrombotische Mikroangiopathie.
Generalisierte Myasthenia gravis (gMG)
Studie an erwachsenen Patienten mit gMG
Die Wirksamkeit und Sicherheit von Ravulizumab bei erwachsenen Patienten mit gMG wurden in einer randomisierten, doppelblinden, placebokontrollierten Multizenterstudie der Phase III (ALXN1210-MG-306) untersucht. Die an dieser Studie teilnehmenden Patienten konnten anschliessend in eine nicht verblindete-Verlängerungsphase überführt werden, in der alle Patienten Ravulizumab erhielten.
Patienten mit gMG (Diagnosestellung vor mindestens 6 Monaten) und positivem Serumtest auf Azetylcholinrezeptor (AchR)-Antikörper, klinischer Klassifikationsklasse II bis IV gemäss MGFA (Myasthenia Gravis Foundation of America) und einer Restsymptomatik, die durch einen Myasthenia Gravis Activities of Daily Living (MG-ADL) Gesamtscore ≥ 6 belegt wurde, wurden zu einer Behandlung mit entweder Ravulizumab (N = 86) oder Placebo (N = 89) randomisiert. Patienten mit immunsupprimierenden Therapien (Kortikosteroide, Azathioprin, Cyclophosphamid, Cyclosporin, Methotrexat, Mycophenolatmofetil oder Tacrolimus) konnten diese vorbestehende Therapie während der gesamten Dauer der Studie fortsetzen. Zusätzlich war eine Notfalltherapie (einschliesslich hochdosierter Kortikosteroide, PE/PP oder IVIg) erlaubt, falls ein Patient eine klinische Verschlechterung gemäss Definition im Studienprotokoll zeigte.
Insgesamt 162 Patienten (92,6 %) beendeten den 26-wöchigen, randomisierten, kontrollierten Zeitraum der Studie ALXN1210-MG-306. Die Merkmale der Patienten zu Studienbeginn sind in Tabelle 14 zusammengestellt. Die überwiegende Mehrheit der in die Studie aufgenommenen Patienten (97 %) waren in den letzten zwei Jahren vor Eintritt in die Studie mit mindestens einer immunmodulatorischen Therapie, einschliesslich Immunsuppressiva, PE/PP oder IVIg behandelt worden.
Tabelle 14: Merkmale zu Studieneginn von Studie ALXN1210-MG-306
|
Parameter
|
Statistik
|
Placebo
(N = 89)
|
Ravulizumab
(N = 86)
| |
Geschlecht
Männlich
Weiblich
|
n (%)
|
44 (49,4)
45 (50,6)
|
42 (48,8)
44 (51,2)
| |
Alter bei Erstinfusion des Studienmedikaments (Jahre)
|
Mittel (SD)
(Min., Max.)
|
53,3 (16,05)
(20, 82)
|
58,0 (13,82)
(19, 79)
| |
Ältere Patienten (≥ 65 Jahre) bei Eintritt in die Studie
|
n (%)
|
24 (27,0)
|
30 (34,9)
| |
Dauer der MG seit Diagnosestellung (Jahre)
|
Mittel (SD)
(Min., Max.)
Median
|
10,0 (8,90)
(0,5; 36,1)
7,6
|
9,8 (9,68)
(0,5; 39,5)
5,7
| |
MG-ADL-Ausgangsscore
|
Mittel (SD)
(Min., Max.)
Median
|
8,9 (2,30)
(6,0; 15,0)
9,0
|
9,1 (2,62)
(6,0; 24,0)
9,0
| |
QMG-Ausgangsscore
|
Mittel (SD)
(Min., Max.)
Median
|
14,5 (5,26)
(2,0; 27,0)
14,0
|
14,8 (5,21)
(6,0; 39,0)
15,0
| |
MGFA-Klassifikation zu Studienbeginn
Klasse II (leichte Schwäche)
Klasse III (moderate Schwäche)
Klasse IV (stark ausgeprägte Schwäche)
|
n (%)
|
39 (44)
45 (51)
5 (6)
|
39 (45)
41 (48)
6 (7)
| |
Etwaige frühere Intubationen seit Diagnosestellung (MGFA-Klasse V)
|
n (%)
|
9 (10,1)
|
8 (9,3)
| |
Anzahl Patienten mit früherer MG-Krise seit Diagnosestellunga
|
n (%)
|
17 (19,1)
|
21 (24,4)
| |
Anzahl stabiler immunsupprimierender Therapienb bei Studieneintritt
0
1
≥ 2
|
n (%)
|
8 (9,0)
34 (38,2)
47 (52,8)
|
10 (11,6)
40 (46,5)
36 (41,9)
|
a Angaben zu früheren MG-Krisen wurden bei Aufnahme der Anamnese erfasst und nicht nach der Definition im klinischen Prüfplan bewertet.
b Immunsuppressive Therapien umfassen Kortikosteroide, Azathioprin, Cyclophosphamid, Cyclosporin, Methotrexat, Mycophenolatmofetil oder Tacrolimus.
Abkürzungen: Max. = Maximum; Min. = Minimum; MG = Myasthenia gravis; MG-ADL = Myasthenia Gravis Activities of Daily Living; MGFA = Myasthenia Gravis Foundation of America; QMG = Quantitative Myasthenia Gravis; SD = Standardabweichung
Der primäre Endpunkt war die Veränderung des MG-ADL-Gesamtscores gegenüber Studienbeginn bis Woche 26.
Die sekundären Endpunkte, die ebenfalls die Veränderungen gegenüber Studienbeginn bis Woche 26 bewerteten, umfassten die Veränderung des Quantitative-Myasthenia-Gravis-(QMG-)Gesamtscores, den Anteil von Patienten mit Verbesserungen von mindestens 5 bzw. 3 Punkten bei den QMG- und MG-ADL-Gesamtscores sowie Veränderungen bei den Bewertungen der Lebensqualität.
Ravulizumab zeigte einen statistisch signifikanten Unterschied des MG-ADL-Gesamtscores im Vergleich zu Placebo. Der primäre und die sekundären Endpunkte sind in Tabelle 15 zusammengestellt.
Tabelle 15: Analyse des primären und der sekundären Wirksamkeitsendpunkte
|
Wirksamkeits-endpunkte in Woche 26
|
Placebo
(N = 89)
LS- Mittelwert (SEM)
|
Ravulizumab
(N = 86)
LS-Mittelwert (SEM)
|
Statistik für den Vergleich
|
Behandlungs-effekt
(95 %-KI)
|
p-Wert
(mit Mixed Effect Repeated Measures)
| |
MG-ADL
|
-1,4 (0,37)
|
-3,1 (0,38)
|
Unterschied der Veränderung zur Baseline
|
-1,6 (-2,6; -0,7)
|
0,0009
| |
QMG
|
-0,8 (0,45)
|
-2,8 (0,46)
|
Unterschied der Veränderung zur Baseline
|
-2,0 (-3,2; -0,8)
|
0,0009
| |
MG-QoL15r
|
-1,6 (0,70)
|
-3,3 (0,71)
|
Unterschied der Veränderung zur Baseline
|
-1,7 (-3,4; 0,1)
|
0,0636
| |
Neuro-QoL-Fatigue
|
-4,8 (1,87)
|
-7,0 (1,92)
|
Unterschied der Veränderung zur Baseline
|
-2,2 (-6,9; 2,6)
|
0,3734a
|
a Der Endpunkt wurde nicht formal auf statistische Signifikanz getestet; ein nominaler p-Wert wurde ermittelt.
Abkürzungen: KI = Konfidenzintervall; LS = kleinste Quadrate; MG-ADL = Myasthenia Gravis Activities of Daily Living; MG-QoL15r = überarbeitete Lebensqualitätsskala für Myasthenia Gravis mit 15 Items; Neuro-QoL-fatigue = Neurologische Lebensqualität, Fatigue; QMG = Quantitative Myasthenia Gravis; SEM = Standardfehler des Mittelwerts.
In der Studie ALXN1210-MG-306 war ein klinischer Responder nach dem MG-ADL-Gesamtscore definiert als ein Patient mit einer Verbesserung um mindestens 3 Punkte. Der Anteil der klinischen Responder in Woche 26 betrug 56,7 % unter Ravulizumab gegenüber 34,1 % unter Placebo (nominal p=0,0049). Ein klinischer Responder war nach dem QMG-Gesamtscore definiert als ein Patient mit einer Verbesserung um mindestens 5 Punkte. Der Anteil der klinischen Responder in Woche 26 lag bei 30,0 % unter Ravulizumab gegenüber 11,3 % unter Placebo (p=0,0052).
Tabelle 16 zeigt eine Übersicht über die Patienten mit klinischer Verschlechterung und die Patienten, die im Verlauf des 26-wöchigen randomisierten kontrollierten Zeitraums eine Notfallbehandlung benötigten.
Tabelle 16: Klinische Verschlechterung und Notfalltherapie
|
Parameter
|
Statistik
|
Placebo
(N = 89)
|
Ravulizumab
(N = 86)
| |
Gesamtzahl von Patienten mit klinischer Verschlechterung
|
n (%)
|
15 (16,9)
|
8 (9,3)
| |
Gesamtzahl von Patienten mit Bedarf für eine Notfalltherapiea
|
n (%)
|
14 (15,7)
|
8 (9,3)
|
a Die Notfalltherapie umfasste ein hochdosiertes Kortikosteroid, Plasmaaustausch/Plasmapherese oder intravenöses Immunglobulin.
Zum Zeitpunkt der Analyse waren 150 der 158 Patienten, die in die offene Verlängerungsphase aufgenommen wurden, noch an der Studie beteiligt.
Bei Patienten, die während des randomisierten kontrollierten Behandlungszeitraums anfangs ULTOMIRIS erhielten und auch während der ersten 34 Wochen der offenen Verlängerungsphase weiterhin mit ULTOMIRIS behandelt wurden, hielt die Behandlungswirkung an (Abbildung 3). Bei Patienten, die während des 26-wöchigen randomisierten kontrollierten Behandlungszeitraums zunächst Placebo erhielten und während der offenen Verlängerungsphase eine Behandlung mit ULTOMIRIS begannen, war ein rasches und andauerndes Ansprechen auf die Behandlung zu beobachten (Abbildung 3).
Abbildung 3: Veränderung des MG-ADL-Gesamtscores (A) und des QMG-Gesamtscores (B) gegenüber Baseline im randomisierten kontrollierten Behandlungszeitraum bis einschliesslich Woche 60 (Mittelwert und 95 %-KI)
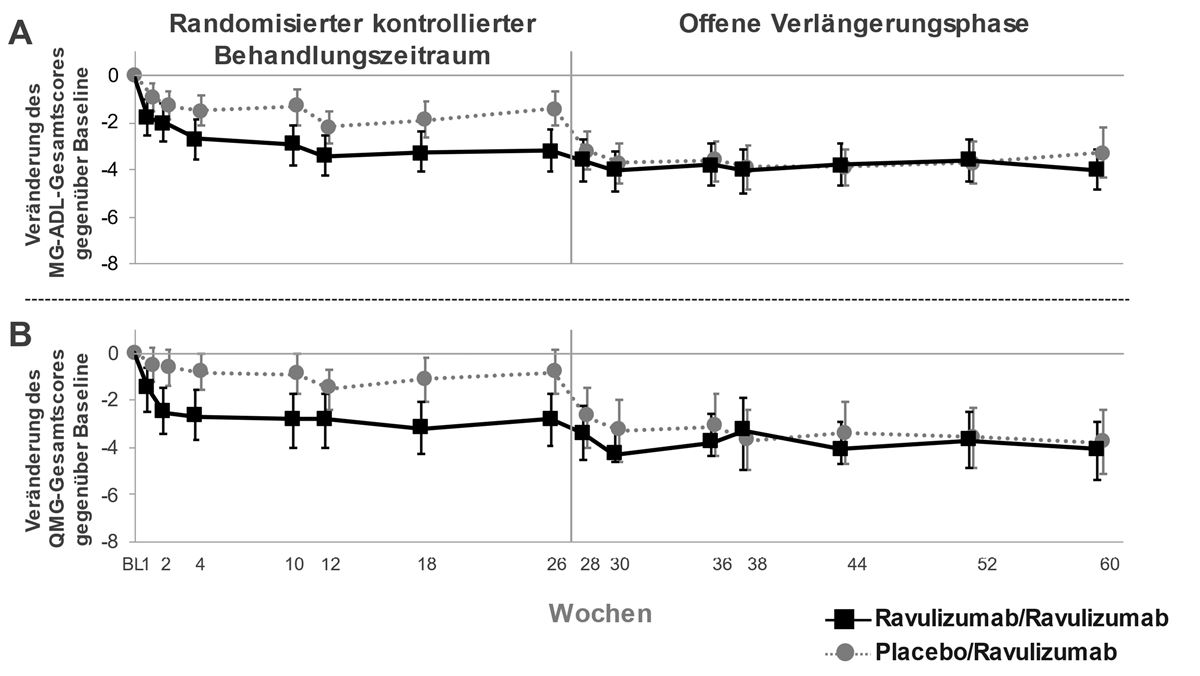
Abkürzungen: KI = Konfidenzintervall; MG-ADL = Myasthenia Gravis Activities of Daily Living; QMG = Quantitative Myasthenia Gravis
In der offenen Verlängerungsphase der Studie hatten die behandelnden Ärzte die Möglichkeit, die immunsuppressiven Therapien anzupassen. Von den Patienten, die in der offenen Verlängerungsphase über eine Dauer von 34 Wochen beobachtet wurden, reduzierten 28,0 % der Patienten ihre tägliche Kortikosteroiddosis und 6,2 % der Patienten beendeten die Kortikosteroidtherapie. Der häufigste Grund für die Anpassung der Kortikosteroidtherapie war eine Besserung der MG-Symptome während der Behandlung mit Ravulizumab.
Neuromyelitis-optica-Spektrum-Erkrankungen (NMOSD)
Studie an erwachsenen Patienten mit NMOSD
Die Wirksamkeit von Ravulizumab bei erwachsenen NMOSD-Patienten mit positiven Anti-AQP4-Antikörpern wurde in einer globalen offenen Studie ALXN1210-NMO-307 untersucht.
In Studie ALXN1210-NMO-307 wurden 58 erwachsene NMOSD-Patienten mit positivem Serumtest auf Anti-AQP4-Antikörper, mindestens 1 Schub in den letzten 12 Monaten vor dem Screeningszeitraum sowie einem Expanded Disability Status Scale (EDSS) Score von ≤ 7 eingeschlossen. Eine vorherige Behandlung mit immunsuppressiven Therapien (IST) war für die Aufnahme in die Studie nicht erforderlich und 51,7 % der Patienten erhielten eine Monotherapie mit Ravulizumab. Patienten, die eine etablierte IST (d. h. Kortikosteroide, Azathioprin, Mycophenolat-Mofetil, Tacrolimus) erhielten, durften mit der Anforderung einer gleichbleibenden Dosierung bis zum Erreichen von Woche 106 der Studie, die Therapie in Kombination mit Ravulizumab fortsetzen. Darüber hinaus war eine Soforttherapie zur Rückfallbehandlung (einschliesslich hochdosierter Kortikosteroide, PE/PP und IVIg) erlaubt, falls ein Patient während der Studie einen Schub zeigte.
Eingeschlossene Patienten waren im Median 47.4 (18-74) Jahre alt und vorwiegend weiblich (90%). Das mediane Alter bei der ersten klinischen Manifestation der NMOSD war 42.5 Jahre, zwischen 16 bis 73 Jahre. Die Merkmale zu Studienbeginn sind in Tabelle 17 dargestellt.
Table 17: Krankheitsanamnese und Ausgangscharakteristika in Studie ALXN1210-NMO-307
|
Variable
|
Statistik
|
ALXN1210-NMO-307 Ravulizumab
(N = 58)
| |
Zeitraum von der ersten klinischen Manifestation der NMOSD bis zur Anwendung der ersten Dosis des Studienmedikaments (Jahre)
|
Mittelwert (SD)
|
5,2 (6,38)
| |
Median
|
2,0
| |
Min., Max.
|
0,19; 24,49
| |
Anamnestische annualisierte Schubrate (ARR) innerhalb von 24 Monaten vor dem Screening
|
Mittelwert (SD)
|
1,87 (1,59)
| |
Median
|
1,44
| |
Min., Max.
|
0,5; 6,9
| |
HAI-Ausgangsscore
|
Mittelwert (SD)
|
1,2 (1,42)
| |
Median
|
1,0
| |
Min., Max.
|
0; 7
| |
EDSS-Ausgangsscore
|
Mittelwert (SD)
|
3,30 (1,58)
| |
Median
|
3,25
| |
Min., Max.
|
0,0; 7,0
| |
Jegliche frühere Anwendung von Rituximab
|
n (%)
|
21 (36,2)
| |
Anzahl der Patienten, die bei Studienbeginn ausschliesslich stabile Kortikosteroide erhielten
|
n (%)
|
12 (20,7)
| |
Anzahl der Patienten, die bei Studienbeginn keine IST erhalten
|
n (%)
|
30 (51,7)
|
Abkürzungen: ARR = annualized relapse rate; EDSS = Expanded Disability Status Scale; HAI = Hauser Ambulation Index; IST = immunsuppressive Therapie; Max. = maximum; Min. = minimum; NMOSD = Neuromyelitis-optica-Spektrum-Erkrankungen; SD = Standardabweichung (standard deviation).
Der primäre Endpunkt der Studie ALXN1210-NMO-307 war die Zeit bis zum ersten in der Studie aufgetretenen Schub, der von einem unabhängigen Entscheidungsgremium bestätigt wurde. Bei den mit Ravulizumab behandelten Patienten wurde während des primären Behandlungszeitraums kein festgestellter Schub in der Studie beobachtet. Alle mit Ravulizumab behandelten Patienten waren während der medianen Nachbeobachtungszeit von 90,93 Wochen schubfrei. Die mit Ravulizumab behandelten Patienten zeigten konsistentes schubfreies Ergebnis hinsichtlich des primären Endpunkts mit oder ohne begleitender IST-Behandlung.
Ravulizumab wurde nicht für die Akutbehandlung von Schüben bei NMOSD-Patienten untersucht.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten
Paroxysmale nächtliche Hämoglobinurie (PNH)
Studie an pädiatrischen Patienten mit PNH (ALXN1210-PNH-304)
Die pädiatrische Studie (ALXN1210-PNH-304) ist eine multizentrische, offene Phase-3-Studie, welche an Kindern und Jugendlichen mit PNH durchgeführt wurde, die entweder zuvor mit Eculizumab behandelt worden waren, oder die zuvor nicht mit einem Komplementinhibitor vorbehandelt waren.
Gemäß den Zwischenergebnissen schlossen insgesamt 13 pädiatrische PNH-Patienten die Behandlung mit Ravulizumab während des primären Auswertungszeitraums (26 Wochen) von Studie ALXN1210-PNH-304 ab. Fünf der 13 Patienten waren noch nie mit einem Komplementinhibitor behandelt worden und 8 Patienten erhielten vor Studieneintritt eine Behandlung mit Eculizumab.
Die meisten Patienten waren bei der ersten Infusion zwischen 12 und 17 Jahre alt (Durchschnittsalter: 14,4 Jahre), während 2 Patienten unter 12 Jahren (11 Jahre und 9 Jahre alt) waren. Acht der 13 Patienten waren weiblich. Das Durchschnittsgewicht zu Studienbeginn betrug 56 kg, Bereich: 37 bis 72 kg. Tabelle 18 zeigt die Krankheitsvorgeschichte und die Merkmale der in Studie ALXN1210-PNH-304 aufgenommenen pädiatrischen Patienten zu Studienbeginn.
Tabelle 18: Krankheitsvorgeschichte und Merkmale zu Studienbeginn (vollständiges Analyseset)
|
Variable
|
Nicht mit Komplementinhibitor vorbehandelte Patienten
(N = 5)
|
Mit Eculizumab vorbehandelte Patienten
(N = 8)
| |
Gesamt-PNH-Erythrozyten-Klongröße (%)
|
(N = 4)
|
(N = 6)
| |
Median (Min., Max.)
|
40,05 (6,9; 68,1)
|
71,15 (21,2; 85,4)
| |
Gesamt-PNH-Granulozyten-Klongröße (%)
|
|
| |
Median (Min., Max.)
|
78,30 (36,8; 99,0)
|
91,60 (20,3; 97,6)
| |
Anzahl Patienten mit pRBC/Vollbluttransfusionen innerhalb von 12 Monaten vor der ersten Dosis, n (%)
|
2 (40,0)
|
2 (25,0)
| |
Anzahl pRBC/Vollblut-Transfusionen innerhalb von 12 Monaten vor der ersten Dosis
|
|
| |
Insgesamt
|
10
|
2
| |
Median (Min.; Max.)
|
5,0 (4; 6)
|
1,0 (1; 1)
| |
Transfundierte pRBC/Vollblut-Einheiten innerhalb von 12 Monaten vor der ersten Dosis
|
|
| |
Insgesamt
|
14
|
2
| |
Median (Min., Max.)
|
7,0 (3; 11)
|
2,0 (2; 2)
| |
Patienten mit PNH-assoziierten Erkrankungen vor Einholung der Einwilligungserklärung nach Aufklärung über die Studie, n (%)
|
5 (100)
|
8 (100)
| |
Anämie
|
2 (40,0)
|
5 (62,5)
| |
Hämaturie oder Hämoglobinurie
|
2 (40,0)
|
5 (62,5)
| |
Aplastische Anämie
|
3 (60,0)
|
1 (12,5)
| |
Niereninsuffizienz
|
2 (40,0)
|
2 (25,0)
| |
Sonstigea
|
0
|
1 (12,5)
| |
LDH-Spiegel vor der Behandlung (E/l)
|
|
| |
Median (Min., Max.)
|
588,50 (444; 2.269,7)
|
251,50 (140,5; 487)
|
a Andere mit PNH assoziierte Erkrankungen wurden als „Nieren- und Milzinfarkte“ und als „multiple Läsionen die auf einen embolischen Prozess hindeuten“ beschrieben.
Hinweis: Die prozentualen Angaben basieren auf der Gesamtzahl von Patienten in jeder Kohorte.
Abkürzungen: LDH = Laktatdehydrogenase; Max. = Maximum; Min. = Minimum; PNH = paroxysmale nächtliche Hämoglobinurie; pRBC = Erythrozytenkonzentrat (packed red blood cell); RBC = Erythrozyt.
Die Patienten erhielten an Tag 1 eine Initialdosis Ravulizumab auf der Grundlage des Körpergewichts, gefolgt von einer Erhaltungstherapie an Tag 15 und danach einmal alle 8 Wochen (q8W) für Patienten mit einem Gewicht ≥ 20 kg oder einmal alle 4 Wochen (q4W) für Patienten mit einem Körpergewicht < 20 kg. Bei Patienten, die bei Eintritt in die Studie eine Behandlung mit Eculizumab erhielten, war Tag 1 der Studienbehandlung 2 Wochen nach der letzten Dosis Eculizumab des Patienten geplant.
Das auf dem Körpergewicht basierende Dosierungsschema von Ravulizumab bewirkte eine sofortige, vollständige und anhaltende Hemmung des terminalen Komplementsystems während des gesamten 26-wöchigen Zeitraums für die Erstbeurteilung, unabhängig davon, ob sie mit Eculizumab vorbehandelt worden waren oder nicht. Nach Beginn der Ravulizumab-Behandlung wurden sofort nach der ersten Dosis therapeutische Steady-State-Serumkonzentrationen von Ravulizumab erreicht und über den gesamten 26-wöchigen Zeitraum für die Erstbeurteilung in beiden Kohorten aufrechterhalten. In der Studie traten keine Durchbruchhämolyse-Ereignisse auf und bei keinem Patienten lagen die Konzentrationen von freiem C5-Protein nach der Baseline über 0,5 µg/ml. Die mittlere prozentuale Veränderung des LDH-Wertes gegenüber Baseline betrug -47,91 % an Tag 183 in der Kohorte ohne vorherige Behandlung mit einem Komplementinhibitor und blieb in der Kohorte mit Eculizumab-Vorbehandlung während des 26wöchigen Zeitraums für die Erstbeurteilung stabil. Sechzig Prozent (3/5) der Patienten ohne vorherige Behandlung mit einem Komplementinhibitor und 75 % (6/8) der Patienten mit Eculizumab-Vorbehandlung erreichten bis Woche 26 eine Hämoglobinstabilisierung. Eine Transfusionsvermeidung wurde von 84,6 % (11/13) der Patienten während des 26-wöchigen Zeitraums für die Erstbeurteilung erreicht.
Diese Zwischenergebnisse zur Wirksamkeit sind in Tabelle 19 unten zusammengestellt.
Tabelle 19: Ergebnisse für die Wirksamkeit in der klinischen Studie an pädiatrischen Patienten mit PNH (ALXN1210-PNH-304) - 26-wöchiger Zeitraum für die Erstbeurteilung
|
Endpunkt
|
Ravulizumab
(zuvor nicht mit Komplementinhibitoren behandelt, N = 5)
|
Ravulizumab
(Umstellung, mit Komplementinhibitoren vorbehandelt, N = 8)
| |
LDH- prozentuale Veränderung gegenüber Baseline
Mittelwert (SD)
|
-47,91 (52,716)
|
4,65 (44,702)
| |
Transfusionsvermeidung
Prozentualer Anteil (95-%-KI)
|
60,0 (14,66; 94,73)
|
100,0 (63,06; 100,00)
| |
Hämoglobinstabilisierung
Prozentualer Anteil (95-%-KI)
|
60,0 (14,66; 94,73)
|
75 (34,91; 96,81)
| |
Durchbruchhämolyse (%)
|
0
|
0
|
Abkürzungen: LDH = Laktatdehydrogenase
Die Langzeitergebnisse für die Wirksamkeit bis zum Studienende über eine Behandlungsdauer von im Median 915 Tagen zeigten ein anhaltendes Ansprechen der Behandlung bei pädiatrischen Patienten mit PNH.
Ausgehend von diesen Zwischenergebnissen scheint die Wirksamkeit von Ravulizumab bei pädiatrischen PNH-Patienten ähnlich zu sein wie die bei erwachsenen PNH-Patienten beobachtete.
Atypisches hämolytisch-urämischen Syndrom (aHUS)
Die Anwendung von Ultomiris bei pädiatrischen Patienten zur Behandlung eines aHUS wird durch die Ergebnisse einer klinischen Studie an Kindern und Jugendlichen untermauert (insgesamt 31 Patienten mit dokumentiertem aHUS wurden aufgenommen. 28 Patienten im Alter von 10 Monaten bis 17 Jahren wurden in das vollständige Analyseset eingeschlossen).
Studie an pädiatrischen Patienten mit aHUS (ALXN1210-aHUS-312)
Bei dieser pädiatrischen Studie handelt es sich um eine 26wöchige, fortlaufende, multizentrische, einarmige Phase-3-Studie an Kindern und Jugendlichen.
Insgesamt wurden 21 Patienten ohne Eculizumab-Vorbehandlung mit der dokumentierten Diagnose eines aHUS und Anhaltspunkten für eine TMA in die Studie aufgenommen; davon wurden 18 in das vollständige Analyseset eingeschlossen. Die Einschlusskriterien schlossen Patienten aus, die mit einer TMA aufgrund von TTP und STEC-HUS vorstellig wurden. Zwei Patienten erhielten eine Einzeldosis und ein Patient erhielt 2 Dosen; die Patienten brachen die Behandlung aber dann ab und wurden aus dem vollständigen Analyseset ausgeschlossen, weil das aHUS nicht bestätigt war. Das mittlere Körpergewicht zu Studienbeginn betrug insgesamt 22,2 kg; die Mehrheit der Patienten befand sich zu Studienbeginn in der Gewichtskategorie ≥ 10 bis < 20 kg. Die meisten Patienten (72,2 %) wiesen vor der Behandlung extrarenale (kardiovaskuläre, pulmonale, zentralnervöse, gastrointestinale, die Haut oder Skelettmuskulatur betreffende) Zeichen oder Symptome eines aHUS zu Studienbeginn auf. Zu Studienbeginn hatten 33,3 % (n = 6) der Patienten eine CKD in Stadium 5.
Insgesamt wurden 10 Patienten, die von Eculizumab zu Ravulizumab wechselten und eine dokumentierte aHUS-Diagnose sowie Anzeichen einer TMA aufwiesen, in die Studie aufgenommen. Es musste ein klinisches Ansprechen auf Eculizumab vorliegen, bevor die Patienten in die Studie aufgenommen wurden (d. h. LDH < 1,5 x ULN und Thrombozytenzahl ≥ 150.000/µl und eGFR > 30 ml/min/l,73 m²). Demzufolge gibt es keine Daten über die Anwendung von Ravulizumab bei Patienten, die nicht auf Eculizumab ansprechen.
Tabelle 20 zeigt die Ausgangsmerkmale von pädiatrischen Patienten, die in Studie ALXN1210aHUS-312 aufgenommen wurden.
Tabelle 20: Demographische Merkmale und Ausgangsmerkmale in Studie ALXN1210aHUS-312
|
Parameter
|
Statistik
|
Ravulizumab
(ohne Vorbehandlung, N = 18)
|
Ravulizumab
(Behandlungs-wechsel, N = 10)
| |
Alterskategorie bei Erstinfusion (Jahre)
Geburt bis < 2 Jahre
2 bis < 6 Jahre
6 bis < 12 Jahre
12 bis < 18 Jahre
|
n (%)
|
2 (11,1)
9 (50,0)
5 (27,8)
2 (11,1)
|
1 (10,0)
1 (10,0)
1 (10,0)
7 (70,0)
| |
Geschlecht
Männlich
|
n (%)
|
8 (44,4)
|
9 (90,0)
| |
Ethniea
Ureinwohner Nordamerikas (Indianer) oder Alaskas
Asiatisch
Schwarz oder Afroamerikaner
Weißhäutig
Unbekannt
|
n (%)
|
1 (5,6)
5 (27,8)
3 (16,7)
9 (50,0)
1 (5,6)
|
0 (0,0)
4 (40,0)
1 (10,0)
5 (50,0)
0 (0,0)
| |
Transplantation in der Vorgeschichte
|
n (%)
|
1 (5,6)
|
1 (10,0)
| |
Thrombozyten (109/l) im Blut
|
Median (Min., Max.)
|
51,25 (14; 125)
|
281,75 (207; 415,5)
| |
Hämoglobin (g/l)
|
Median (Min., Max.)
|
74,25 (32; 106)
|
132,0 (114,5; 148)
| |
LDH (U/l)
|
Median (Min., Max.)
|
1963,0 (772; 4985)
|
206,5 (138,5; 356)
| |
eGFR (ml/min/1,73 m2)
|
Median (Min., Max.)
|
22,0 (10; 84)
|
99,75 (54; 136,5)
| |
Dialysepflichtigkeit zu Studienbeginn
|
n (%)
|
6 (33,3)
|
0 (0,0)
|
Hinweis: Die prozentualen Anteile basieren auf der Gesamtzahl der Patienten.
a Auf die Patienten können mehrere Ethnien zutreffen.
Abkürzungen: aHUS = atypisches hämolytisch-urämischen Syndrom; eGFR = geschätzte glomeruläre Filtrationsrate; LDH = Laktatdehydrogenase; Max. = Maximum; Min. = Minimum.
Der primäre Endpunkt war das vollständige Ansprechen der TMA während des 26wöchigen Zeitraums für die Erstbeurteilung, festgestellt anhand der Normalisierung der hämatologischen Parameter (Thrombozyten ≥ 150 x 109/l und LDH ≤ 246 U/l) sowie eine Besserung des Serumkreatinins von ≥ 25 % gegenüber dem Ausgangswert. Die Patienten mussten alle Kriterien für ein vollständiges Ansprechen der TMA bei 2 verschiedenen Beurteilungen im Abstand von mindestens 4 Wochen (28 Tagen) und bei jeder zwischenzeitlichen Messung erfüllen.
Ein vollständiges Ansprechen der TMA wurde bei 14 der 18 nicht vorbehandelten Patienten (77,8 %) während des 26wöchigen Zeitraums für die Erstbeurteilung festgestellt, wie es in Tabelle 21 gezeigt ist.
Tabelle 21: Vollständiges Ansprechen der TMA und Analyse der Komponenten des vollständigen Ansprechens der TMA während des 26-wöchigen Zeitraums für die Erstbeurteilung (ALXN1210aHUS-312)
|
|
Summe
|
Responder
| |
n
|
Anteil (95 %-KI)a
| |
Vollständiges Ansprechen der TMA
|
18
|
14
|
0,778 (0,524; 0,936)
| |
Komponenten des vollständigen Ansprechens der TMA
|
|
|
| |
Normalisierung der Thrombozytenzahl
|
18
|
17
|
0,944 (0,727; 0,999)
| |
Normalisierung von LDH
|
18
|
16
|
0,889 (0,653; 0,986)
| |
Verbesserung des Serumkreatinins um ≥ 25 % gegenüber dem Ausgangswert
|
18
|
15
|
0,833 (0,586; 0,964)
| |
Normalisierung der Blutwerte
|
18
|
16
|
0,889 (0,653; 0,986)
|
Hinweis: 1 Patient schied nach Behandlung mit 2 Dosen Ravulizumab aus der Studie aus.
a Die 95 %-Konfidenzintervalle (95 %-KI) für den Anteil basieren auf der asymptotischen Gaußschen Approximationsmethode mit Kontinuitätskorrektur.
Abkürzungen: KI = Konfidenzintervall; LDH = Laktatdehydrogenase; TMA = thrombotische Mikroangiopathie.
Das vollständige Ansprechen der TMA während des Zeitraums für die Erstbeurteilung wurde in einer medianen Zeitdauer von 30 Tagen (15 bis 97 Tage) erzielt. Bei allen Patienten mit vollständigem Ansprechen der TMA blieb das Ansprechen während des gesamten Zeitraums für die Erstbeurteilung erhalten, wobei kontinuierliche Verbesserungen der Nierenfunktion beobachtet wurden. Nach Beginn der Ravulizumab-Behandlung war rasch ein Anstieg der mittleren Thrombozytenzahl mit einer Zunahme von 60,50 × 109/l zu Studienbeginn auf 296,67 × 109/l an Tag 8 zu beobachten, die bei allen anschließenden Besuchsterminen im Zeitraum für die Erstbeurteilung (26 Wochen) über 296 × 109/l lag.
Drei weitere Patienten zeigten ein vollständiges Ansprechen der TMA, das nach dem 26wöchigen Zeitraum für die Erstbeurteilung bestätigt wurde (das vollständige Ansprechen der TMA wurde an Tag 291, 297 und 353 festgestellt); somit zeigten 17 der 18 pädiatrischen Patienten (94,4 %) (95 %-KI: 72,7 %; 99,9 %) ein vollständiges Ansprechen der TMA. Das Ansprechen individueller Komponenten erhöhte sich auf 17 von 18 Patienten (94,4 %; 95 %-KI: 72,7 %, 99,9 %) für die Normalisierung der Thrombozytenzahl, auf 17 von 18 Patienten (94,4 %; 95 %-KI: 72,7 %, 99,9 %) für die LDH-Normalisierung und auf 17 von 18 Patienten (94,4 %; 95 %-KI: 72,7 %, 99,9 %) für die Besserung der Nierenfunktion.
Alle 6 Patienten, die bei Eintritt in die Studie dialysepflichtig waren, konnten die Dialysebehandlung absetzen. Bei fünf dieser Patienten war dies bereits spätestens an Tag 43 möglich. Kein Patient begann während der Studie eine Dialysebehandlung. Der größte Teil der Patientenpopulation (15/17) zeigte eine Besserung der CKD um 1 oder mehrere Stadien bis Tag 183; 14 Patienten zeigten eine Besserung um 2 oder mehr Stadien. Tabelle 22 fasst die sekundären Wirksamkeitsergebnisse für Studie ALXN1210aHUS-312 zusammen.
Tabelle 22: Sekundäre Wirksamkeitsergebnisse von Studie ALXN1210aHUS-312
|
Parameter
|
Studie ALXN1210aHUS-312
(N = 18)
| |
Hämatologische Parameter bei TMA, Tag 183
Thrombozyten (109/l)im Blut
Mittelwert (SD)
Median
LDH (U/l) im Serum
Mittelwert (SD)
Median
|
Beobachteter Wert (n = 17)
304,94 (75,711)
318,00
262,41 (59,995)
247,00
|
Veränderung gegenüber dem Ausgangswert (n = 17)
245,59 (91,827)
247,00
-2044,13 (1328,059)
-1851,50
| |
Anstieg des Hämoglobins um ≥ 20 g/l gegenüber dem Ausgangswert mit bestätigtem Ergebnis während des Zeitraums für die Erstbeurteilung
m/N
Anteil (95 %-KI)*
|
16/18
0,889 (0,653; 0,986)
| |
Veränderung des CKD-Stadiums gegenüber dem Ausgangswert, Tag 183
Verbesserunga
m/n
Anteil (95 %-KI)*
Verschlechterungb
m/n
Anteil (95 %-KI)*
|
15/17
0,882 (0,636; 0,985)
0/11
0,000 (0,000; 0,285)
| |
eGFR (ml/min/1,73 m2), Tag 183
Mittelwert (SD)
Median
|
Beobachteter Wert (n = 17)
108,5 (56,87)
108,0
|
Veränderung gegenüber dem Ausgangswert (n = 17)
85,4 (54,33)
80,0
|
Hinweis: n: Anzahl von Patienten mit verfügbaren Daten für eine bestimmte Untersuchung beim Besuchstermin an Tag 183. m: Anzahl von Patienten, die ein bestimmtes Kriterium erfüllen. Das Stadium der chronischen Nierenerkrankung (CKD) wird anhand der Klassifikation der National Kidney Foundation für Stadien der chronischen Nierenerkrankung (Chronic Kidney Disease Stage) bestimmt. Stadium 1 wird als die beste Kategorie betrachtet, während Stadium 5 als schlechteste Kategorie gilt. Der Ausgangswert wird anhand der letzten verfügbaren eGFR vor Behandlungsbeginn ermittelt. Verbesserung/Verschlechterung: Im Vergleich zum CKD-Stadium zu Studienbeginn.
*Die 95 %-Konfidenzintervalle (95 %-KI) basieren auf dem exakten Clopper-Pearson-Konfidenzintervall. .
a Verbesserung schließt Patienten mit Stadium 1 zu Studienbeginn aus, da bei ihnen keine Besserung möglich ist; bVerschlechterung schließt Patienten mit Stadium 5 zu Studienbeginn aus, da bei ihnen keine Verschlechterung möglich ist.
Abkürzungen: eGFR = geschätzt glomeruläre Filtrationsrate; LDH = Laktatdehydrogenase; TMA = thrombotische Mikroangiopathie.
Bei Patienten, die mit Eculizumab vorbehandelt wurden, führte die Umstellung auf Ravulizumab zu einer Aufrechterhaltung der Krankheitskontrolle, wie an stabilen hämatologischen und renalen Parametern abzulesen ist, ohne offenbare Auswirkungen auf die Sicherheit.
Die Wirksamkeit von Ravulizumab bei der Behandlung von aHUS scheint bei pädiatrischen Patienten ähnlich zu sein wie bei erwachsenen Patienten.
|



